2. 皖南医学院生物化学与分子生物学教研室,安徽 芜湖 241002
2. Anhui Provincial Key Laboratory of Active Biological Macro-molecules, Wannan Medical College, Wuhu 241002, China
炎症是机体组织针对有害刺激(如病原体, 受损细胞或刺激物)所产生的复杂生物反应, 是一种涉及免疫细胞, 血管和分子介质的保护性反应[1]。然而, 过度的炎症反应常常导致疾病的发生, 如关节炎及脓毒症[2-4]。脂多糖(LPS), 也称脂聚糖或内毒素, 存在于革兰氏阴性菌的外膜中, 通过与位于细胞表面的脂多糖结合蛋白(LBP)和CD14形成复合物激活靶细胞, 诱导胞内多条信号通路的活化, 从而引发多种促炎细胞因子释放和炎症相关蛋白的表达[5-6]。MAPKs、NF-κB及JAK-stats等信号途径参与LPS诱导的炎症反应[7-9]。反应活性氧(ROS)作为炎症反应的重要介质, 在炎症相关疾病的发生、发展中发挥非常重要的作用[10-12]。我们已有的研究发现, LPS刺激RAW264.7细胞, 诱导胞内ROS的生成增加, ROS作为上游信号分子介导NF-κB, JAK-stats, MAPKs等信号通路的激活, 诱发炎症的发生[7, 13-14]。
越来越多的研究表明, 天然活性产物可以拮抗LPS诱导的炎症反应[15-17]。金盏花苷E又称去葡萄糖竹节参皂苷, 从竹节参中提取的五环三萜类化合物。有文献报道金盏花苷E能够保护过氧化氢诱导的心肌细胞凋亡[18-19]。但金盏花苷E其它的生物学作用尚不清楚。我们的预实验结果发现, 金盏花苷E能够抑制LPS诱导的炎症因子释放, 提示其具有一定的抗炎作用, 但其发挥抗炎作用的分子机制尚不清楚。因此, 本研究拟进一步探究金盏花苷E的抗炎作用及可能的分子机制, 为金盏花苷E用于炎症相关疾病的治疗提供实验依据。
1 材料和方法 1.1 药物、试剂及抗体金盏花苷(HPLC≥95%)(上海源叶生物), LPS(Sigma)。兔单克隆抗体iNOS, COX-2, β-actin, p-p38, p-ERK, p-JNK, p-JAK1, p-JAK2(CST), p-stat1, p-stat3 (Santa Cruz)。ROS检测试剂盒和WB细胞裂解液(碧云天生物), CCK-8试剂盒(凯基生物)。
1.2 细胞培养及传代小鼠单核巨噬细胞RAW264.7购买于中科院典型培养物保藏委员会昆明细胞库。细胞使用含10%胎牛血清(南美), 100 U/mL青霉素, 100 μg/mL链霉素的DMEM高糖培养基(美国Hyclone)常规培养, 每2 d传代1次。细胞培养条件为5% CO2, 37 ℃, 取对数生长期细胞用于实验研究。
1.3 细胞活力检测RAW264.7细胞接种于96孔细胞培养板, 细胞密度为1×104。不同浓度(2、4、6、8、10、20、25、30μg/mL)的金盏花苷E分别作用细胞24 h, 每组3个复孔。去除原培养基, PBS清洗1遍之后, 将CCK-8原液用培养基按照1:10的比例稀释, 每孔加入100 μL稀释液, 在细胞培养箱(37 ℃, 5% CO2)中继续孵育2 h。使用全波段酶标仪(美国Thermo)在450 nm波长处检测各组吸光度(A450 nm)。细胞存活率(%)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.4 促炎细胞因子检测RAW264.7细胞接种于12孔细胞培养板, 分别用不同浓度的金盏花苷E(6、8、10μg/mL)预处理RAW264.7细胞2 h, 然后LPS(100 ng/mL)刺激细胞16 h。收集细胞培养液, 12 000×g离心5 min, 取上清用于ELISA实验。TNF-α、IL-1β ELISA检测试剂盒均为R & D公司产品。具体操作按照厂家提供的说明书进行, 每组3个复孔, 450 nm波长检测各组的吸光度。
1.5 Western blottingRAW264.7细胞接种于12孔细胞培养板, 设置空白对照组、金盏花苷E组、LPS组和金盏花苷E与LPS联合作用组。不同浓度的金盏花苷E(6、8、10μg/mL)首先预处理RAW264.7细胞2 h, 然后用100 ng/mL的LPS继续刺激特定的时间。药物处理后的细胞用预冷的PBS洗涤两次, 然后加入含蛋白酶抑制剂的细胞裂解液放置在冰上裂解30 min, 4 ℃, 12 000×g离心10 min, 收集上清, 并进行蛋白定量。蛋白样品加入SDS上样缓冲液, 煮沸5~10 min, 取等量蛋白进行SDS-PAGE。电泳分离的蛋白转移至硝酸纤维素膜(PALL, USA), 然后用5%脱脂奶粉室温封闭2 h, TBST洗膜3次, 每次5 min。加入相应一抗4 ℃孵育过夜, TBST洗涤3次后, 加入相应荧光二抗(LI-COR Biosciences)室温继续孵育1 h。最后使用Odyssey双色红外激光成像系统(LI-COR)检测实验结果, Image J软件用于光密度分析。
1.6 激光共聚焦显微镜观察stat3核转位磷酸化的stat通过形成二聚体进入细胞核调控炎症相关基因的表达[20]。因此, 我们通过共聚焦实验检测金盏花苷E对LPS诱导stat3核转位的影响。RAW264.7细胞接种在共聚焦激光小皿中, 实验分为对照组, 金盏花苷E单独处理组, LPS组及金盏花苷E与LPS联合刺激组。药物处理后的细胞, 弃去细胞培养基, PBS洗涤后, 用4%多聚甲醛室温固定30 min, 然后加入含3%牛血清白蛋白的PBS封闭1 h, PBS洗涤3次之后加入stat3一抗(1:100稀释), 4 ℃孵育过夜。PBS洗涤之后加入Alexa Fluor® 555标记的二抗(1:200稀释), 室温避光孵育1 h。最后DAPI避光染色细胞核5 min。激光共聚焦显微镜(德国Leica)观察stat3的核转位(630×)。
1.7 ROS检测ROS通过激活转录因子stat在LPS诱导的炎症反应中发挥关键作用, 且ROS的生成有助于JAK-stats信号途径的激活[21]。我们通过检测不同处理条件下RAW264.7细胞中ROS的变化情况, 探究金盏花苷E对LPS诱导ROS产生的影响作用。RAW264.7细胞接种于12孔细胞培养板, 实验分组同1.5所述。金盏花苷E预处理细胞2 h, 然后LPS刺激15 min。按照1:200的比例用无血清DMEM培养基稀释CM-H2DCFDA荧光探针(碧云天), 每组加入1 mL CM-H2DCFDA探针稀释液, 37 ℃, 5% CO2条件下孵育细胞30 min, 弃除细胞培养液, 用PBS清洗3次, 充分洗涤除去未进入细胞的游离探针。在488 nm激发波长, 525 nm发射波长处使用倒置荧光显微镜(Olympus)观察细胞内ROS荧光强度并拍照。
1.8 统计分析数据以均数±标准差表示。Prism 6.0软件(GraphPad Software, Inc., La Jolla, CA, 美国)分析实验结果。单因素方差分析(ANOVA)用于实验数据统计分析, P < 0.05认为组间差异有统计学意义。
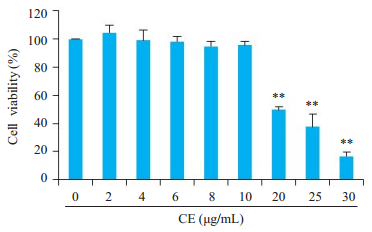
2 结果 2.1 金盏花苷E对RAW264.7细胞活力的影响金盏花苷E在小于20μg/mL时对RAW264.7细胞活力没有显著影响(图 1)。所以, 我们选择6、8、10μg/mL 3个剂量组用于后续实验研究。
|
图 1 金盏花苷E对RAW264.7细胞活力的影响 Fig.1 Effect of different concentrations of calenduloside E (CE) on RAW264.7 cell viability. **P < 0.01 vs control group |
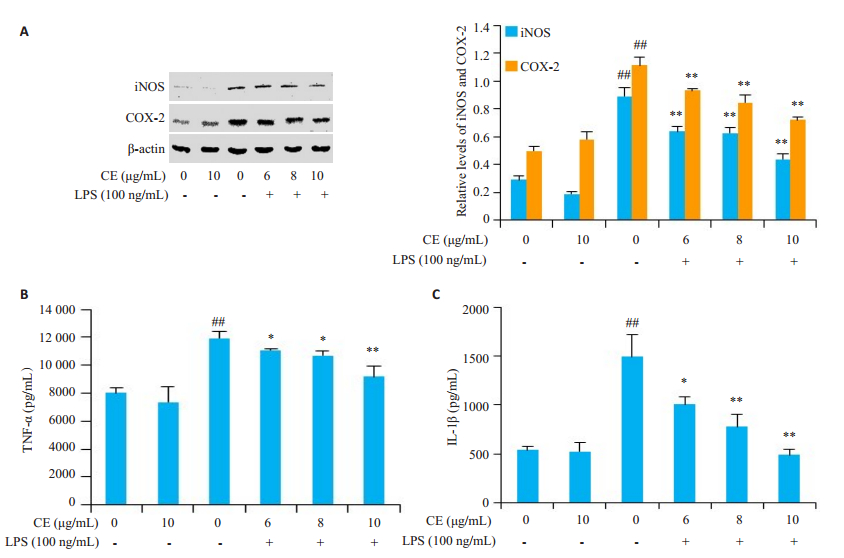
金盏花苷E明显下调LPS诱导的RAW264.7细胞中iNOS、COX-2蛋白的表达(图 2A), LPS诱导的促炎细胞因子TNF-α、IL-1β释放亦被显著抑制(图 2B-C), 且抑制作用呈现出浓度依赖性。
|
图 2 金盏花苷抑制LPS诱导炎症蛋白表达(A)及促炎因子释放(B和C) Fig.2 Inhibitory effects of CE on LPS-induced inflammatory proteins (A) and inflammatory cytokines (B, C) in RAW264.7 cells. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs LPS group. |
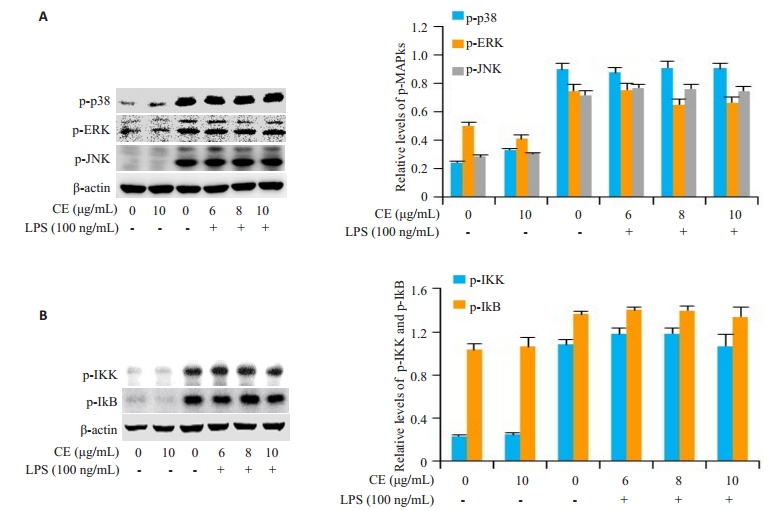
LPS刺激的RAW264.7细胞, p38 MAPK、ERK、JNK及IKK、IκB的磷酸化水平明显升高, 而且金盏花苷E对LPS诱导的上述信号途径的激活并无明显影响(图 3)。
|
图 3 金盏花苷E对LPS诱导的MAPKs及NF-κB信号途径活化的影响 Fig.3 Effects of CE on LPS-induced activation of MAPKs and NF-κB signaling pathways in RAW264.7 cells |
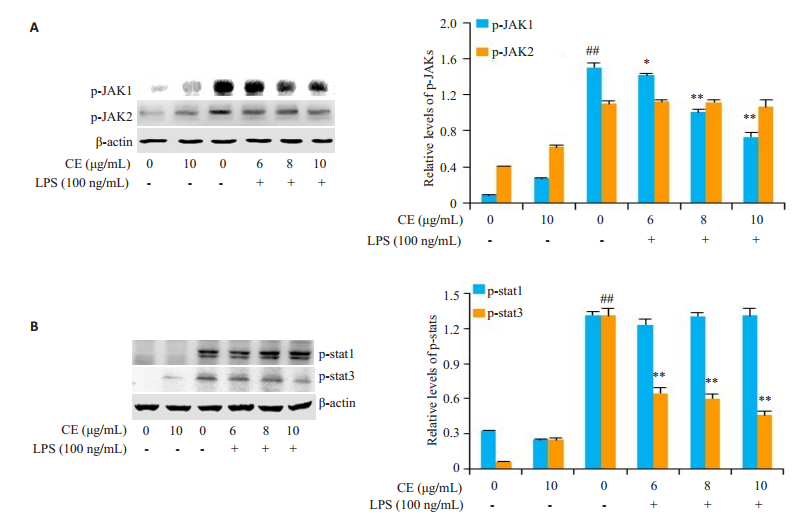
金盏花苷E明显下调了LPS诱导的JAK1磷酸化而对JAK2的磷酸化并无明显影响(图 4A), 金盏花苷E虽然对LPS诱导的stat1磷酸化并无显著影响, 却抑制了stat3的磷酸化(图 4B)。
|
图 4 金盏花苷E对LPS诱导JAK-stats信号通路活化的影响 Fig.4 Effects of CE on LPS-induced activation of JAK-stats signaling pathway in RAW264.7 cells. ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs LPS group |
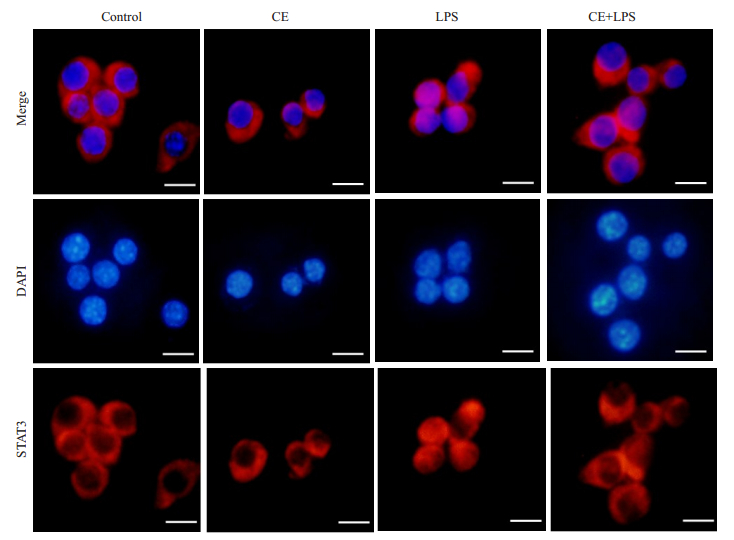
金盏花苷E预处理RAW264.7细胞2 h, 然后LPS刺激4 h, 观察细胞质和细胞核中stat3的定位情况(图 5), 与对照组相比, 在LPS的刺激下, stat3明显向胞核转移, 而金盏花苷E(10μg/mL)预处理的细胞, LPS诱导的stat3核转位现象则被显著抑制。
|
图 5 金盏花苷E抑制LPS诱导的stat3核转位 Fig.5 Inhibitory effects of CE on LPS-induced nuclear translocation of stat3 in RAW264.7 cells (Scale bar=25 μm) |
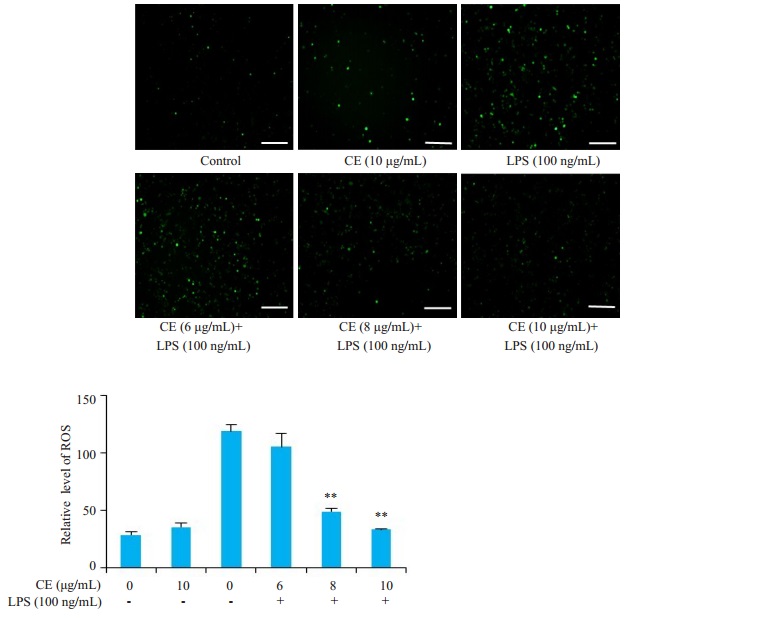
结果显示, 和对照组相比, LPS单独处理组RAW264.7细胞中ROS含量明显增多, 而金盏花苷E能够明显抑制LPS诱导的ROS生成, 尤其是8和10μg/mL组(图 6)。
|
图 6 金盏花苷E抑制LPS诱导的ROS产生 Fig.6 Inhibitory effect of CE on LPS-induced ROS production in RAW264.7 cells (Scale bar= 100μm). **P < 0.01 vs LPS group |
CCK-8结果显示, 金盏花苷E在浓度低于20 μg/mL时对细胞无明显毒性效应。因此, 我们选择6、8、10μg/mL 3个浓度用于后续研究。炎症相关蛋白iNOS、COX-2及促炎细胞因子TNF-α、IL-1β与炎症的发生密切相关[22]。本研究通过WB和ELISA实验检测金盏花苷E对LPS诱导炎症蛋白表达及促炎细胞因子释放的影响。结果表明, 金盏花苷E明显下调LPS诱导的iNOS、COX-2的表达, 抑制TNF-α和IL-1β的释放, 且抑制效应呈现一定的浓度依赖性。由于MAPKs, NF-кB及JAK-stats信号通路参与炎症的发生[7-8, 20], 为了进一步探究金盏花苷E对抗LPS诱导炎症反应的分子机制是否与上述信号通路有关, 我们通过WB检测金盏花苷E对LPS诱导上述信号通路活化的影响。结果发现, 金盏花苷E对LPS诱导的MAPKs及NF-кB通路的激活无明显影响。
已有的研究表明, LPS刺激RAW264.7细胞, JAK1、JAK2的磷酸化水平约5 min开始升高, 10~15 min左右达到最高点; stat1和stat3磷酸化水平在LPS作用细胞2 h开始升高, 约4~6 h达到最高点[23-24]。根据以上实验结果, 我们选择LPS刺激细胞15 min和4 h的条件下, 分别检测金盏花苷E对JAK及stats磷酸化的影响。结果发现, 金盏花苷E能够明显降低LPS诱导的RAW264.7细胞中JAK1及其下游信号分子stat3的磷酸化, 并进一步抑制stat3的核转位现象。总之, 以上研究结果意味着, 金盏花苷E主要通过抑制JAK1-stat3信号通路的活化及stat3的核转位, 抑制LPS诱导的炎症反应。
研究发现, LPS刺激巨噬细胞促进ROS的产生[25-26], ROS还能够作为第二信使, 介导相关信号通路的活化和转录因子的激活, 进而调控炎症反应的发生、发展[27-28]。既然金盏花苷E能够抑制JAK1-stat3信号途径的激活, 我们不禁猜测, 该抑制效应的产生是否与金盏花苷E调控ROS的生成有关呢?因此, 我们继续深入探究金盏花苷E对ROS产生的影响作用。结果发现, 金盏花苷E确实能够有效抑制LPS诱导的RAW264.7细胞中ROS的产生。我们前期研究已证明, ROS清除剂NAC(N-乙酰-L-半胱氨酸)能够显著降低JAK-stat通路的磷酸化及iNOS、COX-2的表达[29-30]。综合以上研究结果, 金盏花苷E主要通过抑制ROS的产生及其介导的JAK1- stat3信号通路抑制LPS诱发的炎症反应。
然而, 金盏花苷E如何调控LPS诱导的胞内ROS的产生及下游信号途径的活化尚不清楚, 它是否通过影响细胞表面与LPS结合的受体, 或阻止LPS与LBP及CD14分子的结合能力来发挥生物学作用呢?以上假设也是我们将来探究的重点。
| [1] |
Ferrero-Miliani L, Nielsen OH, Andersen PS, et al. Chronic inflammation: importance of NOD2 and NALP3 in interleukin-1 beta Generation[J]. Clin Exp Immunol, 2007, 147(2): 227-35. |
| [2] |
Na HS, Song YR, Kim S, et al. Aloin inhibits interleukin (IL)-1β-stimulated IL-8 production in KB cells[J]. J Periodontol, 2016, 87: e108-115. DOI:10.1902/jop.2016.150447 |
| [3] |
YU, Qian, ZENG, et al. Ginsenoside Rk1 suppresses proinflammatory responses in lipopolysaccharide-stimulated RAW264.7 cells by inhibiting the Jak2/Stat3 pathway[J]. Chin J Nat Med, 2017(10): 751-7.
|
| [4] |
Achoui M, Appleton D, Abdulla MA, et al. In vitro and in vivo antiinflammatory activity of 17-Oacetylacuminolide through the inhibition of cytokines, NF-κB translocation and IKK β activity[J]. PLoS One, 2010, 5: e15105. DOI:10.1371/journal.pone.0015105 |
| [5] |
Sweet MJ, Da HM. Endotoxin signal transduction in macrophages[J]. J Leu Biol, 1996, 60(1): 8-26. DOI:10.1002/jlb.60.1.8 |
| [6] |
Sanghera JS, Weinstein SL, Aluwalia M, et al. Activation of multiple proline-directed kinases by bacterial lipopolysaccharide in murine macrophages[J]. J Immunol, 1996, 156(11): 4457-65. |
| [7] |
Qi S, Xin Y, Guo Y, et al. Ampelopsin reduces endotoxic inflammation via repressing ROS-mediated activation of PI3K/Akt/ NF-κB signaling pathways[J]. Int Immunopharmacol, 2012, 12(1): 278-87. DOI:10.1016/j.intimp.2011.12.001 |
| [8] |
Lee SB, Lee WS, Shin JS, et al. Xanthotoxin suppresses LPSinduced expression of iNOS, COX-2, TNF-α, and IL-6 via AP-1, NF-κB, and JAK-STAT inactivation in RAW264.7 macrophages[J]. Int Immunopharmacol, 2017, 49: 21-29. DOI:10.1016/j.intimp.2017.05.021 |
| [9] |
Byung, Hy uk, H an, et al. Hwangryunhaedoktang exerts antiinflammation on LPS-induced NO production by suppressing MAPK and NF-κB activation in RAW264.7 macrophages[J]. J Integr Med, 2017, 15(4): 326-36. DOI:10.1016/S2095-4964(17)60350-9 |
| [10] |
Malhotra JD, Miao HZ, Zhang KZ, et al. Antioxidants reduce endoplasmic reticulum stress and improve protein secretion[J]. Proc Natl Acad Sci USA, 2008, 105(47): 18525-30. DOI:10.1073/pnas.0809677105 |
| [11] |
Mitochondria LG, Species RO. Which role in physiology and Pathology[J]. Adv Exp Med Biol, 2012, 942(3): 93-136. |
| [12] |
Nathan C, Cunningham-Bussel A. Beyond oxidative stress: an immunologist's guide to reactive Oxygen species[J]. Nat Rev Immunol, 2013, 13(5): 349-61. DOI:10.1038/nri3423 |
| [13] |
Qi ZL, Qi SM, Ling LF, et al. Salidroside attenuates inflammatory response via suppressing JAK2-STAT3 pathway activation and preventing STAT3 transfer into nucleus[J]. Int Immunopharmacol, 2016, 35: 265-71. DOI:10.1016/j.intimp.2016.04.004 |
| [14] |
Ren J, Li LX, Wang YE, et al. Gambogic acid induces heme oxygenase-1 through Nrf2 signaling pathway and inhibits NFkappa B and MAPK activation to reduce inflammation in LPSactivated RAW264.7 cells[J]. Biomed Pharmacother, 2019, 109: 555-62. DOI:10.1016/j.biopha.2018.10.112 |
| [15] |
Fylaktakidou KC, Hadjipavlou-Litina DJ, Litinas KE, et al. Natural and synthetic coumarin derivatives with anti-inflammatory/ antioxidant activities[J]. Curr Pharm Des, 2004, 10(30): 3813-33. DOI:10.2174/1381612043382710 |
| [16] |
Zhao C, Wang Y, Yuan X, et al. Berberine inhibits lipopolysaccharideinduced expression of inflammatory cytokines by suppressing TLR4-mediated NF-ĸB and MAPK signaling pathways in rumen epithelial cells of Holstein calves[J]. J Dairy Res, 2019, 30: 1-6. |
| [17] |
Yang QX, Luo J, Lv HJ, et al. Pulegone inhibits inflammation via suppression of NLRP3 inflammasome and reducing cytokine production in mice[J]. Immunopharmacol Immunotoxicol, 2019, 28: 1-8. |
| [18] |
Tian Y, Wang S, Shang H, et al. The clickable activity-based probe of anti-apoptotic calenduloside E[J]. Pharm Biol, 2019, 57(1): 133-9. DOI:10.1080/13880209.2018.1557699 |
| [19] |
Tian Y, Du YY, Shang H, et al. Calenduloside E analogues protecting H9c2 cardiomyocytes against H2O2-Induced apoptosis: design, synthesis and biological evaluation[J]. Front Pharmacol, 2017, 8: 862. DOI:10.3389/fphar.2017.00862 |
| [20] |
Schindler C, Levy DE, Decker T. JAK-STAT signaling: From interferons to cytokines[J]. J Biol Chem, 2007, 282(28): 20059-63. DOI:10.1074/jbc.R700016200 |
| [21] |
Pan XL, Cao X, Li N, et al. Forsythin inhibits lipopolysaccharideinduced inflammation by suppressing JAK-STAT and p38 MAPK signalings and ROS production[J]. Inflamm Res, 2014, 63(7): 597-608. DOI:10.1007/s00011-014-0731-7 |
| [22] |
Turner MD, Nedjai B, Hurst T, et al. Cytokines and chemokines: At the crossroads of cell signalling and inflammatory disease[J]. Biochim Biophys Acta, 2014, 1843(11): 2563-82. DOI:10.1016/j.bbamcr.2014.05.014 |
| [23] |
Ma Y, Tang T, Sheng L, et al. Aloin suppresses lipopolysaccharideinduced inflammation by inhibiting JAK1STAT1/3 activation and ROS production in RAW264.7 cells[J]. Int J Mol Med, 2018, 42(4): 1925-34. |
| [24] |
齐世美, 李强, 姜琦, 等. 白杨素通过JAK-STATs信号通路抑制内毒素诱导的巨噬细胞炎症反应[J]. 南方医科大学学报, 2018, 38(3): 243-50. DOI:10.3969/j.issn.1673-4254.2018.03.02 |
| [25] |
Han W, Li H, Cai J, et al. NADPH oxidase limits lipopolysaccharide- induced lung inflammation and injury in mice through reduction-oxidation regulation of NF-κB activity[J]. J Immunol, 2013, 190(9): 4786-94. DOI:10.4049/jimmunol.1201809 |
| [26] |
Moon SW, Ahn CB, Oh Y, et al. Lotus(nelumbo nucifera)seed protein isolate exerts anti-inflammatory and antioxidant effects in LPS-stimulated RAW264.7 macrophages via inhibiting NF-κB and MAPK pathways, and upregulating catalase activity[J]. Int J Biol Macromol, 18, 134: 791-7. |
| [27] |
Zhang LL, Mu GG, Ding QS, et al. PTEN represses colon Cancer progression through inhibiting paxillin transcription via PI3K/AKT/ NF-kB pathway[J]. J Biol Chem, 2015, 290(24): 15018-29. DOI:10.1074/jbc.M115.641407 |
| [28] |
Pawate S, Shen Q, Fan F, et al. Redox regulation of glial inflammatory response to lipopolysaccharide and interferongamma[J]. J Neurosci Res, 2004, 77(4): 540-51. DOI:10.1002/jnr.20180 |
| [29] |
Qi ZL, Yin F, Lu LA, et al. Baicalein reduces lipopolysaccharideinduced inflammation via suppressing JAK/STATs activation and ROS production[J]. Inflamm Res, 2013, 62(9): 845-55. DOI:10.1007/s00011-013-0639-7 |
| [30] |
Qi S, Feng Z, Li Q, et al. Myricitrin modulates NADPH Oxidase- Dependent ROS production to inhibit Endotoxin-Mediated inflammation by blocking the JAK/STAT1 and NOX2/p47phox Pathways[J]. Oxid Med Cell Longev, 2017, 9738745. |
 2019, Vol. 39
2019, Vol. 39

