肝癌的发病率在所有肿瘤中位居第6, 死亡率位居第4, 我国肝癌的发病人数占全球总数的一半, 是造成60岁以上男性死亡的第一大肿瘤杀手[1-2]。过去30年肝癌肝癌5年总生存率仅为10.1%[2], 需要寻找新的治疗方法。
热疗是恶性肿瘤放化疗外的一种辅助疗法, 它是将器官或组织加热到一定温度, 引起肿瘤细胞死亡的方法[3]。利用磁性纳米粒子(MNP)靶向肿瘤细胞, 对肿瘤细胞精准热疗成为当下研究的热点[4-6]。我们前期合成了聚合物PEG-PLL-FA修饰的共载顺铂和TFPI2质粒的磁性纳米粒子, 并将其应用于鼻咽癌靶向治疗和成像, 在体外取得了良好效果[7]。本研究是在前期工作的基础上, 合成一种具及良好生物相容性、在高频交变磁场作用下具有磁热治疗且具有良好生物相容性的磁性纳米复合物PEG-APTES-MNP。有研究已将其用于MRI成像, 显示了良好的成像效果[8], 说明其具有良好的磁性, 具有作为肝癌磁热治疗纳米药物的潜力, 目前并无相关报道。本研究将PEG-APTES-MNP纳米复合物经尾静脉脉注射至肝癌模型肿瘤部位, 在高频交变磁场作用下磁性纳米粒子发热并对肝癌进行治疗。通过激光共聚焦、MTT、动物肿瘤生长实验等检测肝癌模型肿瘤内的活性氧自由基情况及对肝癌的抑制作用效果, 为肝癌辅助治疗提供实验依据。
1 材料和方法 1.1 材料FeCl3·6H2O、FeSO4·4H2O、羧基聚乙二醇(Polyethylene glycol, PEG)相对分子质量2000、1-(3-二甲氨基丙基)- 3-乙基碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、氨丙基三乙氧基硅烷(APTES)、邻二氮菲、氨水购自上海阿拉丁生化科技股份有限公司, BALB/C裸鼠(雄性, 6~ 8周龄)购自北京维通利华实验动物有限公司, 普鲁氏蓝染色试剂盒、活性氧自由基(ROS)检测试剂盒、凋亡检测试剂盒购自上海碧云天生物技术有限公司。
1.2 方法 1.2.1 磁性纳米复合物PEG-APTES-MNP理化性质检测化学共沉淀法制备聚乙二醇(PEG)、氨丙基三乙氧基硅烷(APTES)修饰的磁性纳米粒子(MNP)PEGAPTES- MNP[7], 检测其稳定性与磁性。常温下将PEGAPTES- MNP与未修饰的磁性纳米粒子分别放置24 h, 观察其沉降情况。将PEG-APTES-MNP行T1MRI成像, 参数设置如下:TR/TE(重复时间/回声时间, Repetition time/Echo time)3000/80 ms, 视场180 mm, 层厚2.0 mm, 层距1 mm。将PEG-APTES-MNP置于高频交变磁场中, 检测其磁热效率, 设置磁场功率为1.0 kW, 时间为5 min, 红外相机进行成像。邻二氮菲分光光度法检测样品铁含量。
1.2.2 细胞普鲁氏蓝染色将磁性纳米复合物PEGAPTES- MNP与HepG2细胞共同培养6 h, 将细胞用4%多聚甲醛固定并用普鲁士蓝染色试剂盒染色, 然后通过显微镜观察细胞。
1.2.3 磁热处理后细胞活性检测取HepG2细胞, 将细胞消化计数并接种到96孔板(3000/孔), 24 h后将不同浓度磁性纳米复合物PEG-APTES-MNP和MNP分别加入细胞培养液中, 对照组加等体积PBS, 继续培养。4 h后, 吸收培养基并用新鲜培养基替换, 并置于高频交变磁场中(1.0 kW, 15 min), 24 h后行噻唑蓝(MTT)检测。将细胞接种到6孔板(105/孔)中, 然后培养24 h。将PEG-APTES-MNP和MNP(通过铁的浓度计数, 10 μg/mL)分别加入细胞中, 设置未处理细胞为对照。4 h后, 吸收培养基并用新鲜培养基替换, 并置于高频交变磁场中(1.0 kW, 10 min)。细胞继续培养4 h。细胞用胰蛋白酶消化并重悬于100 mL PBS中。细胞用试剂盒染色后, 通过流式细胞术检测细胞凋亡率。
1.2.4 细胞ROS水平检测将磁性纳米复合物PEGAPTES- MNP与HepG2细胞共同培养6 h, 将细胞用4%多聚甲醛固定并用ROS染色试剂盒及DAPI染色, 然后通过激光共聚焦显微镜观察细胞。
1.2.5 磁性纳米复合物PEG-APTES-MNP生物相容性检测依据先前文献的报道[7]。小鼠静脉采血, 4 ℃、4000 r/min离心5 min, 弃上清。相同方法将血细胞用PBS洗涤3次。将聚合物PEG-APTES-MNP以100μg/mL的终浓度加入血液悬浮液样品中。轻轻混合, 室温下孵育15 min后涂片, 通过倒置光学显微镜检测观察血细胞凝集的程度。
1.2.6 磁性纳米复合物PEG-APTES-MNP介导的磁热对肝癌肿瘤模型的影响将HepG2细胞消化接种于BALB/C裸鼠背部, 1周后肿瘤约生长至5 mm大小。此时开始治疗。分别经尾静脉给药注射PBS, PEGAPTES- MNP, 剂量为30 mg/kg, 注射结束将一磁铁固定于肿瘤部位2 h, 以使磁性纳米复合物富集于肿瘤部位。注射PEG-APTES-MNP的小鼠进一步分为2组, 一组置于高频交变磁场中(2.0 kW, 15 min)行磁热治疗, 每周给药治疗1次, 一组不进行磁热治疗。3组小鼠(每组5只), 共治疗3周, 观察记录肿瘤变化。
1.3 统计分析用Graphpad Prism 8软件进行统计分析, 数据采用均数±标准差, 组间比较采用方差分析, P < 0.05时差异有统计学意义。
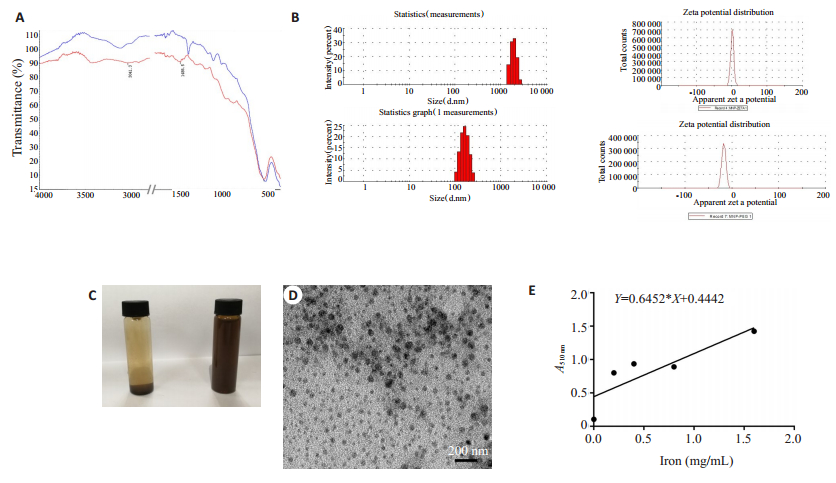
2 结果 2.1 磁性纳米复合物PEG-APTES-MNP的表征APTES修饰MNP后其红外光谱图 1486.5位置出现氨基特征峰(图 1A)。其与PEG继续反应后, 其平均水流动力学粒径大小为152.8 nm, 而未修饰的MNP其平均水流动力学粒径为1754.7 nm; Zeta电位的结果与水流动力学粒径结果一致, 修饰前后的电位值分别为0和-28.1 mV(图 1B)。其透射电镜(TEM)大小分布为39.4±6.28 nm(图 1D)。MNP修饰后较修饰前在水溶液中分散得更好(图 1C)。利用邻二氮菲分光光度法测得PEG-APTES-MNP的铁含量为0.49±0.004mg/mL(图 1E)。
|
图 1 磁性纳米复合物PEG-APTES-MNP的表征 Fig.1 Characterization of the nanocompound PEG-APTES-MNP. A: IR spectrum; B: Particle size and Zeta potential; C: Stability in water; D: Transmission electron microscopy; E: Standard curve of iron content |
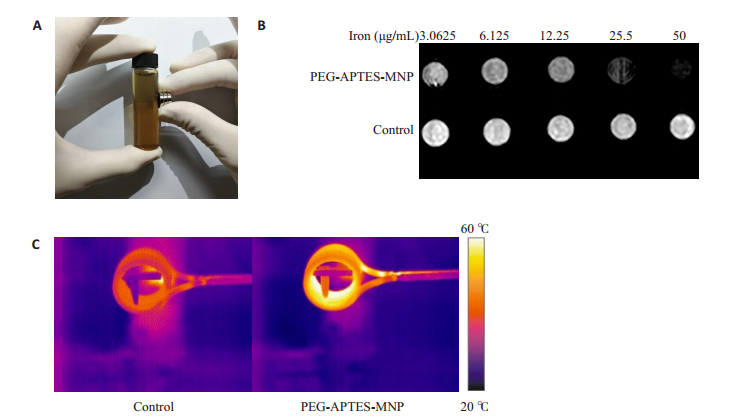
为了证明磁性纳米复合物PEG-APTES-MNP是否有足够的磁性, 我们将一强磁铁置于样品一侧, 大约10 min后水溶液中的样品(图 2A)。同时, 我们将不同浓度的样品行T1 MRI成像, 成像显示, 随着样品浓度的增加, 其信号强度也随之增加, 而对照组信号几乎无任何改变(图 2B)。将样品与对照组放置于功率为1.0 kW的高频交变磁场下, 10 min后对照组温度无明显变化(24.2 ℃), 而样品则温度迅速升至57.3 ℃(图 2C)。
|
图 2 磁性纳米复合物PEG-APTES-MNP的理化性质 Fig.2 Physiochemical property of the nanocompound PEG-APTES-MNP. A: Magnetism; B: Magnetic resonance imaging (MRI); C: Infrared thermal imaging |
大量摄取我们进一步观察磁性纳米复合PEG-APTES-MNP是否可以被肿瘤细胞摄取, 进而在肿瘤细胞内部对其进行杀伤。磁性纳米复合PEG-APTES-MNP与肝癌细胞HepG2共同孵育6 h后, 其被细胞大量摄取, 而在细胞内被普鲁氏蓝染成蓝色, 而对照组几乎没有蓝染(图 3)。

|
图 3 PEG-APTES-MNP被HepG2细胞摄取后的普鲁氏蓝染色图 Fig.3 Prussion blue staining of HepG2 cells incubated with PEG-APTES-MNP |
与对照组相比, PEG-APTES-MNP与血细胞共同孵育后并不会引起血细胞聚集, 血细胞形态完整, 没有对血细胞形态上造成任何破坏(图 4)。

|
图 4 PEG-APTES-MNP对血细胞影响的显微镜图 Fig.4 Effect of PEG-APTES-MNP on blood cells |
为了验证磁性PEG-APTES-MNP介导的磁热对肝癌细胞HepG2的抑制作用, 我们做了MTT实验及凋亡实验。磁热组和非磁热组在铁浓度为2.5 μg/mL时对HepG2的活力影响不大, 而在铁浓度为20 μg/mL则均对细胞有较强的抑制作用, 二者间没有显著差异(P > 0.05);但在铁浓度为5和10μg/mL时二组对HepG2的抑制作用能力显示出明显差异:(53.80 ± 2.58)% vs (76.72±7.64)%, (6.81±1.29)% vs(29.46±2.79)%(P < 0.05), 表明PEG-APTES-MNP对肿瘤细胞同样有抑制作用, 其介导的磁热效应对肿瘤细胞杀伤更为明显(图 5A)。凋亡实验结果与MTT结果一致。单纯PEGAPTES- MNP组与其介导的磁热组凋亡率分别为35.6%和61.3%, 高于对照组的13.8%(图 5B)。

|
图 5 PEG-APTES-MNP有效抑制肝癌细胞HepG2的活性 Fig.5 Inhibitory effects of PEG-APTES-MNP on HepG2 cells. A: MTT assay; B: Cell apoptosis detected by flow cytometry (P < 0.05) |
为了验证磁性纳米复合物对肿瘤细胞HepG2的杀伤机制, 我们运用ROS检测试剂DCFH-DA检测了其在细胞内产生ROS的能力。与磁性纳米复合物PEGAPTES- MNP共孵育的HepG2细胞内有大量绿色荧光产生(ROS), 而对照组则绿光很少。表明实验组肿瘤细胞内有大量ROS产生(图 6)。

|
图 6 PEG-APTES-MNP可在肝癌细胞HepG2内产生大量ROS的激光共聚焦显微镜图 Fig.6 ROS production in HepG2 cells incubated with PEG-APTES-MNP detected by laser scanning confocal microscopy |
最后, 我们进一步验证了磁性纳米复合物介导的磁热在动物模型水平对肝癌治疗的有效性。与对照组相比, 经PEG-APTES-MNP及其介导的磁热治疗后的裸鼠肿瘤体积明显变小, 且磁热治疗组肿瘤被抑制的更明显(抑制率分别为41.12%和92.4%); 生长曲线也显示相同的作用趋势, 与对照组相比, 经磁性纳米复合物PEGAPTES- MNP及其介导的磁热治疗后的裸鼠肿瘤生长明显被抑制(P < 0.05)。由此可见磁性纳米复合物PEGJAPTES-MNP可在动物水平有效抑制肝癌的生长(图 7)。

|
图 7 磁性纳米复合物PEG-APTES-MNP介导的磁热对肝癌的抑制作用 Fig.7 Inhibitory effects of PEG-APTES-MNP on tumor growth in nude mice. A: Size of the tumors; B: Growth curve of the tumors (*P < 0.05, **P < 0.01) |
肝癌严重威胁我国人民健康。尽管肝癌拥有众多的治疗方式, 但过去30年肝癌的治疗效果并未得到有效改善, 肝癌5年总生存率仅为10.1%[2]。肿瘤的发生发展及转移的机制十分复杂, 传统的针对某一靶分子的治疗方式并不能完全抑制肿瘤的生长, 肿瘤细胞会通过其他信号途径进行代偿, 使治疗失败。因此, 需要肿瘤治疗方法实现新型化、综合化; 开发能够有效抑制肝癌并改善肝癌患者生存质量的新型治疗药物和新的治疗方法具有重大的现实意义。
热疗常用的热烧蚀技术包括激光烧蚀、射频消融术、微波消融, 高强度聚焦超声消融[9]。但是它们的作用范围有限, 有着较高的复发和转移率, 且烧蚀范围不易控制, 容易造成周围正常组织损伤[10]。利用纳米粒子靶向肿瘤细胞, 对肿瘤细胞精准热疗成为当下研究的热点。由于肿瘤血流丰富、肿瘤存在对纳米粒子的高通透性和滞留(EPR)效应, 导致纳米颗粒易在肿瘤区域聚集。且肿瘤更易受热损伤, 肿瘤区域的热量散失的速度和效率都比正常组织差, 导致热量容易积累, 可使肿瘤区域温度比正常组织温度高5~7 ℃。目前研究的热点多集中在光热疗法, 即利用纳米粒子携载光敏材料, 再利用高能光束激发光敏材料产热, 进而对肿瘤细胞进行杀伤, 这些研究在体内外实验中取得了良好抑癌效果[11-13]。但是由于光源的穿透能力有限, 不能穿透深层组织, 无法应用于肝癌或位置较深的其他肿瘤。而磁热则可有效解决该问题。磁热是将磁性纳米粒子置于高频交变磁场中, 并在磁场作用下产热的技术[14], 磁场不受肿瘤部位限制, 可根据需要调整磁场强度, 且对患者无任何伤害, 得到了广泛研究[15-17]。
磁性纳米粒子作为一种纳米材料, 不仅具有纳米粒子的一般特性, 而且具有磁性。磁性纳米粒子表面经改性后具有良好的生物相容性, 适合于医学应用。如, 表面修饰的磁性纳米颗粒可以作为载体, 允许药物或基因在磁场作用下定向运输, 实现靶向治疗[18]。基于磁性纳米粒子的热疗在肿瘤治疗中引起越来越多的关注, 其中超顺磁性氧化铁纳米颗粒(SPIO)特别是Fe3O4/Fe2O3用于恶性肿瘤的局部热疗, 可使肿瘤局部温度达到42~ 45 ℃[19]。本研究采用的磁性纳米复合物PEG-APTESMNP具有良好的理化特性。纳米粒子表面采用后PEG进行修饰, 因此表面带有负电荷[20]。由于血清中含有大量带有负电荷的蛋白分子, 纳米粒子负电性会保持其在血清中的稳定性。有研究表明, 带正电荷的纳米粒子会很快被循环系统清除[21], 当纳米粒子表面电荷为-30~30 mV时最为稳定[22]。也正因如此, 我们合成的磁性纳米复合物在水溶液中保持了良好的稳定性, 与其他PEG修饰的纳米粒子显示出的稳定特点具有一致性[23-24]。同时, PEG良好的亲水性, 增加了纳米粒子的水溶性, 这些都可以延长它们在动物体内的循环时间[25]。有研究表明, 如肿瘤温度达到41~47 ℃后, 高温便可通过直接损伤及防止DNA修复来杀伤肿瘤细胞[26]。我们的实验表明PEG-APTES-MNP具有良好的磁性, 其在高频交变磁场中可被快速加热至55 ℃以上, 足以将肿瘤细胞杀死, 与相关研究结果一致[27]。普鲁氏蓝染色实验说明我们合成的磁性纳米复合物可有效进入肿瘤细胞内。血细胞稳定实验表明, 磁性纳米粒子不会与血细胞聚集; 如纳米粒子与血细胞相互作用则会引起聚集, 进而使颗粒粒径增大, 影响纳米粒子在细胞内的进出, 影响其生物相容性[28]。研究表明运用磁性纳米粒子作为介质, 介导磁热对肿瘤进行杀伤可起到良好的效果[29-31], 通过交变磁场的作用是肿瘤局部达到较高温度, 引起肿瘤细胞凋亡、坏死, 这在我们的结果中也得到证实, 通过磁热治疗后大量肝癌细胞凋亡。然而上述研究忽略了一个重要问题:我们的研究结果显示, 未在高频交变磁场中加热的磁性纳米粒子同样会引起肿瘤细胞凋亡, 原因是什么呢?研究表明, 由于Fe3O4具有过氧化物酶活性, 可将肿瘤细胞内大量的过氧化氢分解并产生ROS, 从而对肿瘤细胞进行杀伤[32-33], 我们利用DCFH-DA对肿瘤细胞染色的结果表明, Fe3O4可以在肝癌细胞内产生大量ROS, 其与磁热产生的协同作用, 应是磁性纳米粒子应用于磁热治疗肿瘤能够取得良好效果的重要原因之一, 我的研究为其做了良好的补充。因此, 我们合成的磁性纳米复合物在体内外均表现出对肿瘤细胞较强的抑制作用。有研究表明, 磁热可以作为辅助疗法增强肿瘤治疗效果[34]。此外, 有报道表明, 磁性纳米粒子可以使动物体内肿瘤相关巨噬细胞由M2向M1型极化, 诱发机体免疫系统对肿瘤细胞重新识别和杀伤[35], 对磁性纳米复合物在体内的杀伤产生协同作用。总之, 我们合成的磁性纳米复合物PEG-APTES-MNP具有良好的理化特性和生物相容性, 在其介导的磁热作用下, 通过不同机制在体内外对肝癌细胞均表现出较强的抑制作用, 可作为治疗肝癌的潜在纳米药物。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-32. DOI:10.3322/caac.21338 |
| [3] |
Wust P, Hildebrandt B, Sreenivasa G, et al. Hyperthermia in combined treatment of cancer[J]. Lancet Oncol, 2002, 3(8): 487-97. DOI:10.1016/S1470-2045(02)00818-5 |
| [4] |
Riaz A. Nanotechnology: next Generation war against cancer[J]. Pure Appli Bio, 2017, 6(1): 352-62. |
| [5] |
Hedayatnasab Z, Abnisa F, Daud WM. Review on magnetic nanoparticles for magnetic nanofluid hyperthermia application[J]. Mater Des, 2017, 123(123): 174-96. |
| [6] |
Quinto CA, Mohindra P, Tong S, et al. Multifunctional superparamagnetic Iron oxide nanoparticles for combined chemotherapy and hyperthermia cancer treatment[J]. Nanoscale, 2015, 7(29): 12728-36. DOI:10.1039/C5NR02718G |
| [7] |
Li HL, Fu CP, Miao XW, et al. Multifunctional magnetic codelivery system coated with polymer mPEG-PLL-FA for nasopharyngeal cancer targeted therapy and Mr imaging[J]. J Biomater Appl, 2017, 31(8): 1169-81. DOI:10.1177/0885328217692964 |
| [8] |
Feng B, Hong RY, Wang LS, et al. Synthesis of Fe3O4/APTES/PEG diacid functionalized magnetic nanoparticles for Mr imaging[J]. Colloids Surf A Physicochem Eng Asp, 2008, 328(1/3): 52-9. |
| [9] |
Overgaard J. The current and potential role of hyperthermia in radiotherapy[J]. Int J Radiat Oncol Biol Phys, 1989, 16(3): 535-49. DOI:10.1016/0360-3016(89)90470-7 |
| [10] |
Huang J, Xu JS, Xu RX. Heat-sensitive microbubbles for intraoperative assessment of cancer ablation margins[J]. Biomaterials, 2010, 31(6): 1278-86. DOI:10.1016/j.biomaterials.2009.11.008 |
| [11] |
Chen YW, Su YL, Hu SH, et al. Functionalized graphene nanocomposites for enhancing photothermal therapy in tumor treatment[J]. Adv Drug Deliv Rev, 2016, 105(Pt B): 190-204. |
| [12] |
Chen Z, Zhao PF, Luo ZY, et al. Cancer cell Membrane-Biomimetic nanoparticles for Homologous-Targeting Dual-Modal imaging and photothermal therapy[J]. ACS Nano, 2016, 10(11): 10049-57. DOI:10.1021/acsnano.6b04695 |
| [13] |
Wang WQ, Wang L, Li Y, et al. Nanoscale polymer Metal-Organic framework hybrids for effective photothermal therapy of colon cancers[J]. Advanced Materials, 2016, 28(42): 9320. DOI:10.1002/adma.201602997 |
| [14] |
Hergt R, Dutz S, Mueller R, et al. Magnetic particle hyperthermia: nanoparticle magnetism and materials development for cancer therapy[J]. J Physics-Condensed Matter, 2006, 18(38, SI): S2919-34. DOI:10.1088/0953-8984/18/38/S26 |
| [15] |
Yin PT, Shah S, Pasquale NJ, et al. Stem cell-based gene therapy activated using magnetic hyperthermia to enhance the treatment of cancer[J]. Biomaterials, 2016, 81(81): 46-57. |
| [16] |
Altanerova U, Babincova M, Babinec P, et al. Human mesenchymal stem cell-derived Iron oxide exosomes allow targeted ablation of tumor cells via magnetic hyperthermia[J]. Int J Nanomedicine, 2017, 12: 7923-36. DOI:10.2147/IJN.S145096 |
| [17] |
Blanco-Andujar C, Walter A, Cotin GA, et al. Design of Iron oxidebased nanoparticles for MRI and magnetic hyperthermia[J]. Nanomedicine, 2016, 11(14): 1889-910. DOI:10.2217/nnm-2016-5001 |
| [18] |
Guo T, Lin M, Huang JX, et al. The recent advances of magnetic nanoparticles in medicine[J]. J Nanomater, 2018, 1-8. |
| [19] |
Kandasamy G, Sudame A, Luthra T, et al. Functionalized hydrophilic superparamagnetic Iron oxide nanoparticles for magnetic fluid hyperthermia application in liver cancer treatment[J]. Acsomega, 2018, 3(4): 3991-4005. |
| [20] |
Leopold LF, Todor IS, Diaconeasa Z, et al. Assessment of PEG and BSA-PEG Gold nanoparticles cellular interaction[J]. Colloids Surf A Physicochem Eng Asp, 2017, 532(532): 70-6. |
| [21] |
Blanco E, Shen H, Ferrari M. Principles of nanoparticle design for overcoming biological barriers to drug delivery[J]. Nat Biotechnol, 2015, 33(9): 941-51. DOI:10.1038/nbt.3330 |
| [22] |
Kaaki K, Herve-Aubert K, Chiper M, et al. Magnetic nanocarriers of doxorubicin coated with poly (ethylene glycol) and folic acid: relation between coating structure, surface properties, colloidal stability, and cancer cell targeting[J]. Langmuir, 2012, 28(2): 1496-505. DOI:10.1021/la2037845 |
| [23] |
Mohammadi MR, Malkovskiy AV, Jothimuthu P, et al. PEG/dextran double layer influences Fe ion release and colloidal stability of Iron oxide nanoparticles[J]. Sci Rep, 2018, 8(1): 4286. DOI:10.1038/s41598-018-22644-8 |
| [24] |
Cao ZB, Adnan NN, Wang GY, et al. Enhanced colloidal stability and protein resistance of layered double hydroxide nanoparticles with phosphonic acid-terminated PEG coating for drug delivery[J]. J Colloid Interface Sci, 2018, 521(521): 242-51. |
| [25] |
Chen Y, Xu ZQ, Zhu DF, et al. Gold nanoparticles coated with polysarcosine brushes to enhance their colloidal stability and circulation time in vivo[J]. J Colloid Interface Sci, 2016, 483(483): 201-10. |
| [26] |
Mantso T, Goussetis G, Franco R, et al. Effects of hyperthermia as a mitigation strategy in DNA damage-based cancer therapies[J]. Semin Cancer Biol, 2016, 37-38(37): 96-105. |
| [27] |
Espinosa A, Di Corato R, Kolosnjaj-Tabi JA, et al. Duality of Iron oxide nanoparticles in cancer therapy: amplification of heating efficiency by magnetic hyperthermia and photothermal bimodal treatment[J]. ACS Nano, 2016, 10(2): 2436-46. DOI:10.1021/acsnano.5b07249 |
| [28] |
Suvarna M, Dyawanapelly S, Kansara BA, et al. Understanding the stability of Nanoparticle-Protein interactions: effect of particle size on adsorption, conformation and thermodynamic properties of serum albumin proteins[J]. Acs Applied Nano Materials, 2018, 1(10): 5524-35. DOI:10.1021/acsanm.8b01019 |
| [29] |
Boekelheide Z, Hussein ZA, Hartzell S. Electronic measurements in an alternating magnetic field for studying magnetic nanoparticle hyperthermia: minimizing eddy current heating[J]. IEEE Trans Magn, 2016, 52(7): 1-4. |
| [30] |
Yadavalli T, Jain H, Chandrasekharan G, et al. Magnetic hyperthermia heating of Cobalt ferrite nanoparticles prepared by low temperature ferrous sulfate based method[J]. AIP Adv, 2016, 6(5): 4942951. |
| [31] |
Stigliano RV, Shubitidze F, Petryk JD, et al. Mitigation of eddy current heating during magnetic nanoparticle hyperthermia therapy[J]. Int J Hyperther, 2016, 32(7): 735-48. DOI:10.1080/02656736.2016.1195018 |
| [32] |
Kojima K, Takahashi S, Saito S, et al. Combined effects of Fe3O4 nanoparticles and chemotherapeutic agents on prostate cancer cells in vitro[J]. Applied Sciences-basel, 2018, 8(1): 10. |
| [33] |
Ma P', Xiao HH, Yu C, et al. Enhanced cisplatin chemotherapy by Iron oxide Nanocarrier-Mediated Generation of highly toxic reactive Oxygen species[J]. Nano Lett, 2017, 17(2): 928-37. DOI:10.1021/acs.nanolett.6b04269 |
| [34] |
Attaluri A, Kandala SK, Wabler M, et al. Magnetic nanoparticle hyperthermia enhances radiation therapy: A study in mouse models of human prostate cancer[J]. Int J Hyperthermia, 2015, 31(4): 359-74. DOI:10.3109/02656736.2015.1005178 |
| [35] |
Zanganeh S, Hutter G, Spitler R, et al. Iron oxide nanoparticles inhibit tumour growth by inducing pro-inflammatory macrophage polarization in tumour tissues[J]. Nat Nanotechnol, 2016, 11(11): 986-94. DOI:10.1038/nnano.2016.168 |
 2019, Vol. 39
2019, Vol. 39

