2. 南方医科大学珠江医院,广东 广州 510280;
3. 南方医科大学基础医学院人体解剖学国家重 点学科,广东 广州 510515;
4. 广东医科大学基础医学院人体解剖学教研室,广东 湛江 524003;
5. 南方医科大学 顺德医院医学转化中心,广东 佛山 528300
2. Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China;
3. National Key Discipline of Human Anatomy, School of Basic Medical Sciences, Southern Medical University, Guangzhou 510515, China;
4. Department of Human Anatomy, School of Basic Medical Sciences, Guangdong Medical University, Zhanjiang 524003, China;
5. Center for Medical Transformation, Shunde Hospital, Southern Medical University, Foshan 528300, China
Tempol(TPL)是一种小分子氮氧化物自由基, 通过硝酰基团得到或失去电子发挥氧化或还原的作用[1]。在体外细胞学实验中, TPL通过促氧化作用诱导多种肿瘤细胞凋亡[2-4]。而当TPL在浓度较低及处理时间较短时表现为还原性, 多项动物体内实验显示TPL可模拟超氧化物歧化酶的活性而具有抗氧化性[5-7], 保护多种生物系统免遭氧化损伤并用于多种疾病防治的研究, 包括离子辐射防护[8]、高血压[9]、神经系统损伤[10-11]、缺血再灌注损伤[12]和糖尿病[13-14]等。顺铂为临床上常用的抗肿瘤药物, 广泛用于多种实体肿瘤的治疗[15-16]。顺铂的细胞毒性作用主要是通过与核DNA(nDNA)形成加合物造成DNA损伤, 进而抑制nDNA复制及转录, 最终导致肿瘤细胞凋亡[17]。此外, 顺铂作用于线粒体DNA(mtDNA)诱导ROS生成也是其发挥作用的机制之一, 升高的ROS会导致电子传递链的相关蛋白质合成受损[18-19]。顺铂诱导的ROS增加不仅损伤肿瘤细胞, 也是造成肾毒性、神经毒性及耳毒性的重要原因[20-21]。
有研究表明, TPL作为化疗保护剂, 可以降低顺铂对听觉细胞HEI-OC1的细胞毒性[22], 而且降低小鼠体内的线粒体损伤进而缓解顺铂引起的肾毒性[23]。但是, 升高ROS也是顺铂杀伤肿瘤细胞的机制之一[18], 而TPL在其降低顺铂引起的副作用的同时是否会减弱化疗药顺铂的药效目前还不清楚。探讨TPL是否会影响顺铂在体内的抗肿瘤作用具有重要意义。因此, 本研究主要从细胞及动物水平探讨化疗保护剂TPL对顺铂抗肿瘤效果的影响, 为TPL是否适合与化疗药物顺铂联合用于临床治疗肿瘤提供参考。
1 材料和方法 1.1 试剂TPL(Adamas试剂), 顺铂, 噻唑蓝[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide MTT]、二甲基亚砜(Sigma-Aldrich, USA); 细胞培养基RPMI 1640、胰酶(Gibco, USA), 胎牛血清(BI, UT, USA)
1.2 细胞培养人结肠癌细胞SW480、小鼠结肠癌细胞CT26 (ATCC, USA)。SW480、CT26培养于含10%小牛血清及1%青霉素和链霉素的RPMI 1640培养液, 于37 ℃、5%CO2及饱和湿度的细胞培养箱中进行培养, 每隔2~3 d进行换液。当细胞呈对数生长且状态良好时进行实验。
1.3 MTT实验当细胞呈对数生长期时胰酶消化、收集细胞, 以每孔3500个细胞接种于96孔板, 37 ℃、5% CO2孵箱中培养12 h, 使细胞充分贴壁。加入200 μL不同浓度(0、0.25、0.5、1、1.5、2、3 mmol/L)TPL分别处理细胞SW480、CT26, 每组处理3个复孔(设置空白孔), 孵育48 h。去除培养基, 用PBS洗1遍。将100μL MTT混合液加入有细胞培养孔及对照孔中, 37 ℃避光孵育2~4 h, 小心吸尽孔内液体, 每孔加入100 μL二甲基亚砜, 避光置于摇床上15~20 min, 用Bio-tek酶标仪检测A490 nm。细胞活力计算公式:细胞活力(%)=(实验组A值-空白组A值)/(对照组A值-空白孔A值)×100%。
1.4 CCK8实验胰蛋白酶消化、收集生长状态良好的细胞, 以每孔3500个细胞接种于96孔板中, 孵箱培养12 h, 使其充分贴壁, 加入200μL不同浓度(0、0.25、0.5、1、1.5、2、3 mmol/L) TPL分别处理细胞SW480、CT26, 48 h后, 将细胞用完全培养基清洗两遍, 加入100 μL培养基, 每孔加入10 μL CCK8试剂(GLPBIO, GK10001), 37 ℃避光孵育2 h, 用Bio-tek酶标仪检测A490 nm, 并计算细胞活力。
1.5 药物协同分析用不同浓度的TPL和不同浓度顺铂单独或联合处理SW480、CT26细胞, 每组3个复孔, 其余步骤同MTT及CCK8实验, 计算得到细胞抑制率后, 运用药物间相互作用生物软件Calcusyn和Chou-Talalay方法得到ED50、ED75、ED90时的联合指数(CI), 当CI < 1表示为协同作用, CI=1表示为叠加作用, CI > 1表示为拮抗作用。
1.6 动物购买SPF级的6~8周雌性的BALB/c小鼠, 每笼5只饲养于独立换气盒笼中, 使环境中的温度及湿度适宜, 并控制12 h昼夜节律变换, 整个环境严格消毒, 并提供充足的高温灭菌饮用水和辐射灭菌的饲料。所有实验操作符合科技部与南方医科大学动物实验伦理委员会的要求。
1.7 小鼠皮下肿瘤模型实验动物饲养5~7 d, 使小鼠适应环境后开始实验。选择对数生长期且状态良好的CT26细胞, 常规消化并计数, 用PBS稀释成1×106/mL的细胞悬液置于冰上待用。用注射器抽取0.2 mL(2×106细胞)皮下接种于已脱毛小鼠双侧前肢背侧。待肿瘤可见时(第4~7天)记为d0, 将荷瘤小鼠随机分成4组:对照组(生理盐水)、顺铂组(顺铂, 5 mg/kg, 1次/周)、TPL组[TPL, 0.58 mmol/(L· kg), 1次/d]和顺铂+TPL组[顺铂, 5 mg/kg, 1次/周; TPL, 0.58 mmol/(L· kg), 1次/d], 每组7只, 根据分组分别腹腔注射不同药物, 测量鼠重及肿瘤双径(长和宽), 计算肿瘤体积TV(TV=长×宽2/2)。
1.8 苏木素-伊红(HE)染色和免疫组化实验肿瘤组织准备:药物处理14 d后, 小鼠脱颈处死, 剥取小鼠肾脏及肿瘤组织, 剔除坏死及结缔组织, 将切取的动物组织快速放进4%的多聚甲醛固定24~48 h; 将组织从固定液中取出, 水洗, 并放入不同浓度乙醇中脱水并在二甲苯中透明, 然后浸蜡与包埋。
HE染色:将组织切成厚度为4 μm切片, 将切片进行脱蜡、水化后, 经过苏木素染色, 1%盐酸酒精分色, 返蓝及伊红染色后, 用梯度酒精进行脱水、透明及封固, 待中性树胶干燥后高倍显微镜下观察。
免疫组化实验:4μm的组织切片分别用Bax(稀释度为1:200, Bioss)和Bcl-2(稀释度为1:200, Proteintech) 4 ℃过夜孵育, PBS清洗后, 用连接过氧化物酶的二抗室温孵育1 h, 接着用二氨基联苯胺进行显色, 苏木素进行复染。每个组织切片随机选取5~6个视野进行观察和统计。
1.9 Western blot将剥取的肿瘤组织剔除坏死和包膜, 置于-80 ℃冰箱保存, 实验时将组织取出, 用研钵研磨组织, 边研磨边加入适量液氮, 待研磨充分后加入适当RIPA裂解液和蛋白酶抑制剂并提取蛋白。用BCA法检测蛋白浓度。取20~30 mg的蛋白用聚丙烯酰胺凝胶进行电泳, 并转膜至PVDF。分别用BAX, Bcl2及GAPDH一抗进行孵育(4 ℃, 过夜)。用连接过氧化物酶的二抗孵育, 最后通过ECL法显影, 并放入Bio-Rad高灵敏度化学发光成像系统下曝光成像并拍照。
1.10 肿瘤组织TUNEL染色为了进行肿瘤组织中细胞凋亡分析, 根据试剂说明书将肿瘤组织石蜡切片进行TUNEL染色(Yeasen, 40307ES20), 细胞核采用碘化丙啶PI染色液进行染色。并在荧光显微镜下对TUNEL染色切片进行观察及分析, 染色细胞核数量运用Image J软件进行计数。
1.11 肿瘤组织中ROS水平检测为了制备组织匀浆用于ROS检测, 将新鲜的小鼠肿瘤组织剪成1~2 mm3的体积。组织碎片用常温PBS缓冲液冲洗3次, 加入5~6倍体积的0.25%胰酶, 37 ℃消化30 min, 用尼龙网过滤悬液2次制成细胞悬液。收集的细胞用于ROS检测。用ROS检测试剂盒(碧云天公司)进行ROS检测, 简单地说, 用含有10 μm/mL DCFADA的无血清培养基将1×107/mL重悬, 37 ℃避光浮云20 min。PBS洗去未进入细胞的DCFA-DA并重悬细胞, 并立即用流式细胞仪进行检测。
1.12 统计学分析使用SPSS软件进行统计学分析。实验结果以均数±标准表示, 所有实验至少重复3次。两样本分差分析采用t检验, 小鼠体质量和肿瘤体积的组间差异运用重复测量的方差分析, 不同时间点的组间差异运用单因素方差分析进行比较。P < 0.05表示差异有统计学意义。
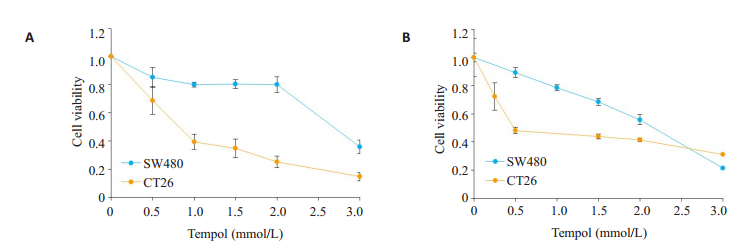
2 结果 2.1 TPL抑制肿瘤细胞活性, 与顺铂具有协同作用首先分析TPL对人大肠癌细胞SW480和小鼠结肠癌细胞CT26的生存能力的影响, MTT及CCK8的结果显示:TPL抑制两株细胞的生存能力, 其作用呈浓度依赖性(图 1A、B)。TPL作用于SW480和CT26的IC50分别为0.85、2.80 mmol/L。
|
图 1 MTT实验(A)及CCK8实验(B)显示TPL对SW480及CT26肿瘤细胞株活力的抑制效果 Fig.1 Inhibitory effects of tempol on viability of SW480 and CT26 cells measured by MTT and CCK8 assays |
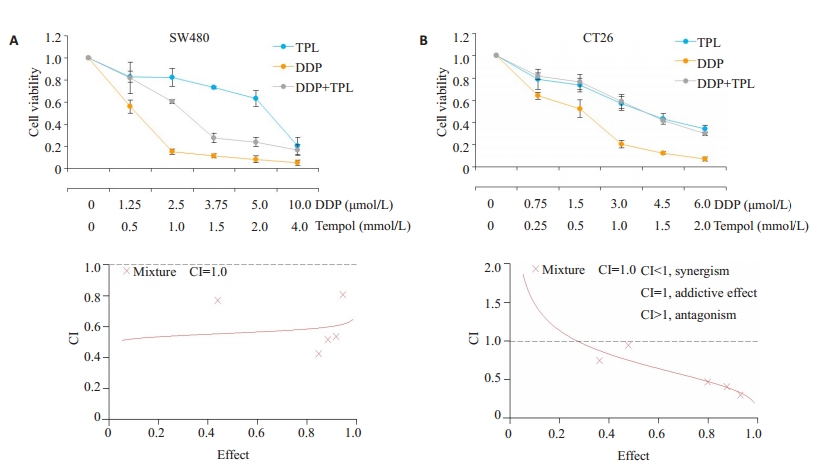
为分析TPL与顺铂是否具有协同抗肿瘤的效果, SW480及CT26细胞分别用顺铂、TPL单独及二者联合处理(两株细胞中顺铂与TPL浓度的比值分别是1/400、3/1000)48 h。相比与单独用药, 两药联合组在两株细胞中的毒性作用均增强(图 2A、B)。进一步运用CalcuSyn软件分析两药联合时毒性的增强作用是否呈现协同效果。当TPL与顺铂的浓度比率为2:2.5时, 在SW480中药物效应(对细胞活性抑制的效应)达到50%、75%及90%时的有效剂量(ED), 即ED50、ED75、ED90时的联合指数(CI)分别为0.559±0.181、0.58±0.14及0.602± 0.181;同样, 在CT26中TPL与顺铂联合的各CI值也小于1(图 2)。因此细胞学实验表明TPL与DDP具有协同抑制细胞活性的作用。
|
图 2 TPL与顺铂具有协同抗肿瘤作用 Fig.2 Tempol has a synergistic anti-tumor effect with DDP in vitro. A-B: Viability of SW480 and CT26 cells after treatment with TPL and DDP alone or in combination. The synergistic effect of TPL and DDP was analyzed using CalcuSyn software |
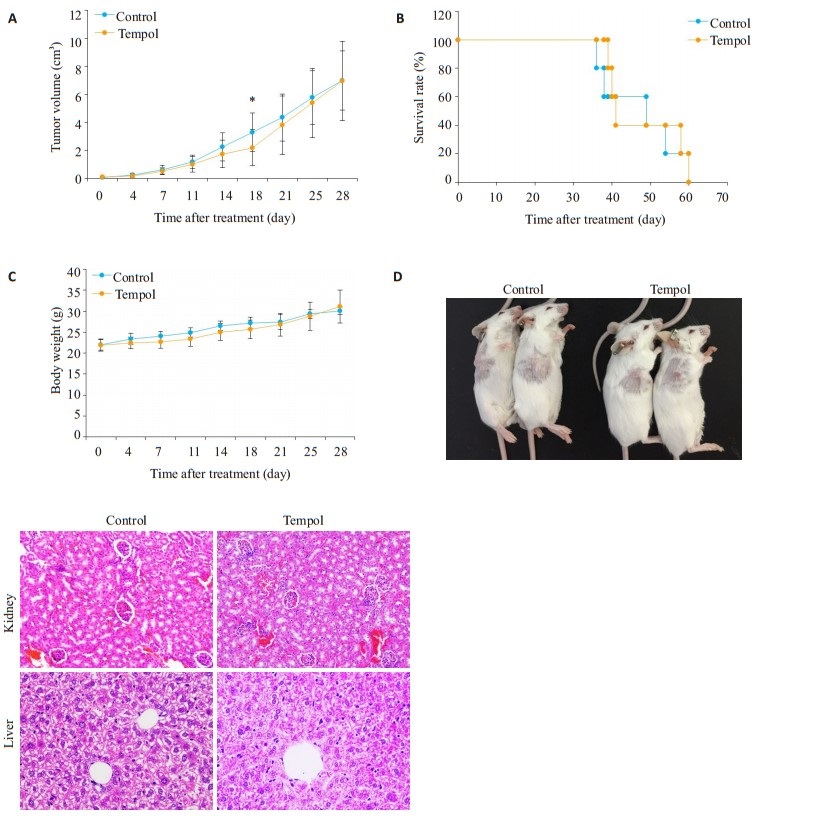
为了更全面的探讨TPL的抗肿瘤效果, 本研究在免疫功能正常的小鼠中验证TPL的抗肿瘤作用, 建立balb/c小鼠皮下结肠癌模型, 用剂量为100 mg/kg的TPL处理细胞, 结果显示, TPL组在实验早期(约第18天)可降低肿瘤体积(P < 0.05), 但到实验后期, 对肿瘤的抑制效果逐渐减弱, 使总体与对照组没有差别(图 3A); 而100 mg/kg的TPL对小鼠生存期没有明显影响(图 3B)。
|
图 3 当TPL剂量为100 mg/kg时, 对小鼠肿瘤无明显的抑制作用 Fig.3 Treatment with 100 mg/kg tempol produces no obvious anti-tumor effect in the homograft mouse model. A: CT26 tumor growth curve in the control group (0.9% NaCl) and tempol group (100 mg/kg, once daily, 7 days/week); B: Survival curves of the mice in control and tempol groups; C: Changes of body weight in the control and tempol groups; D: Anesthetized mice after 14 days of control or tempol treatment; E: HE staining of the kidneys and livers in the control and tempol groups (Original magnification: × 200). *P < 0.05 vs Control |
实验中观察不同处理组中小鼠的外表及活动情况显示, 与对照组相比, TPL组小鼠的毛色、光泽度(图 3D)以及活动状态并无明显差别。此外, TPL处理不改变小鼠体质量(图 3C)。为进一步明确TPL对小鼠内脏的毒性, 通过HE染色对小鼠肾脏及肝脏的组织形态进行观察显示, TPL不明显改变小鼠肝脏及肾脏的组织形态(图 3E)。
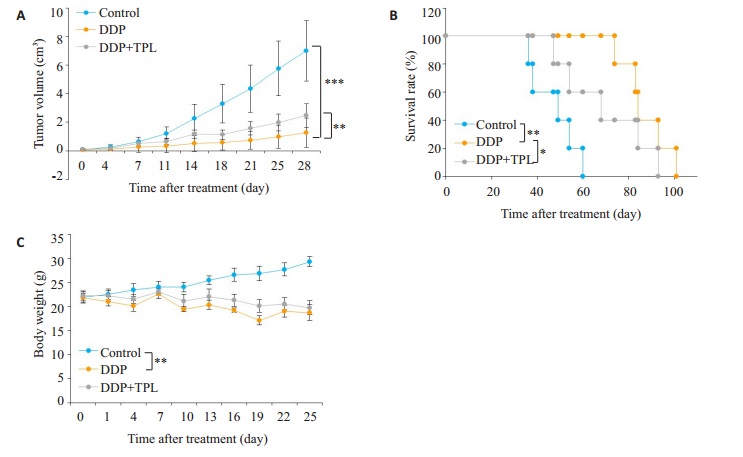
2.3 TPL在小鼠肿瘤模型中减弱顺铂的抗肿瘤作用结果显示顺铂明显抑制肿瘤生长, 但是与顺铂组相比, TPL联合顺铂组肿瘤体积明显增加(图 4A), 而且小鼠生存期显著缩短(图 4B), 对小鼠体质量无明显增加作用(图 4C)。
|
图 4 在小鼠体内实验中, TPL减弱顺铂的抗肿瘤效果 Fig.4 Tempol treatment reduces the anti-tumor effect of DDP in the homograft mouse model. A: CT26 tumor growth curve in the control group (0.9% NaCl), DDP group (5 mg/kg, i.p., once a week) and tempol +DDP group (tempol 100 mg/kg, i.p., once a day; cisplatin 5 mg/kg, i.p., once a week); B: Survival curves of the mice in control, DDP and tempol + DDP groups; C: Changes of body weight in the control, DDP and TPL+ DDP groups. *P < 0.05, **P < 0.01, ***P < 0.001. |
通过HE染色观察肿瘤组织的形态结构, 结果显示, 顺铂导致肿瘤组织明显坏死, 而TPL明显减少顺铂所致的肿瘤组织坏死面积(图 5A)。在多数肿瘤中表现为促凋亡蛋白Bax表达水平下降而抑凋亡蛋白Bcl-2表达升高, 下调Bax或上调Bcl-2能抑制多种因素诱导的肿瘤细胞凋亡。因此为探讨TPL明显减少顺铂所致的肿瘤组织坏死面积是否是通过抑制细胞凋亡, 通过免疫组化检测肿瘤组织中Bax与Bcl-2的表达, 结果显示顺铂增加Bax而减少Bcl-2的表达, 但是TPL联合顺铂处理逆转了顺铂对两种蛋白的调节作用(图 5A), Western blot结果显示, TPL联合顺铂减少肿瘤组织中Bax的表达(图 5C)。
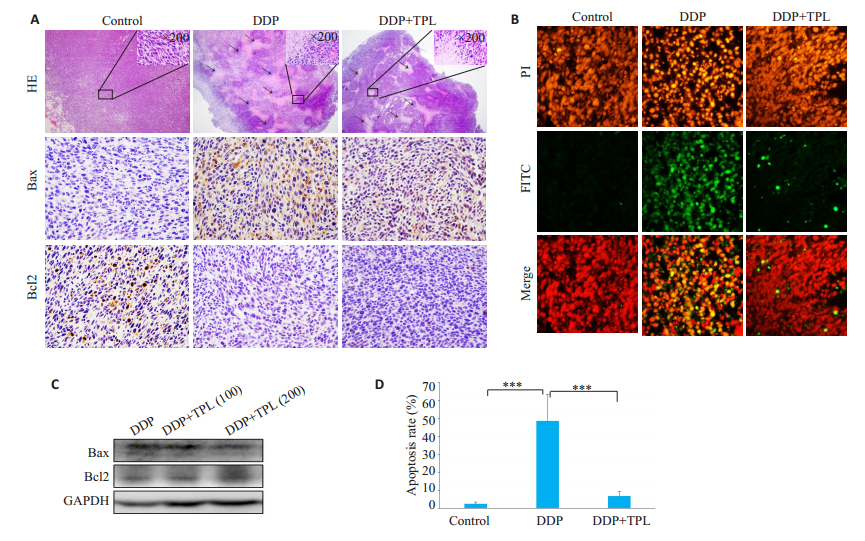
|
图 5 在小鼠体内实验中, TPL降低顺铂诱导的肿瘤细胞凋亡 Fig.5 Tempol treatment inhibits DDP-induced cell apoptosis in the tumor tissue. A: HE staining (× 40) and immunohistochemical staining for Bax and Bcl2 (×200) of the tumor tissues in the control, DDP and tempol+DDP groups; B: TUNEL staining of the tumor tissues at 14 days after the treatments. Green fluorescence indicates TUNEL-positive apoptotic cells, and red fluorescence indicates PIstained nuclei (×200); C: Bax and Bcl-2 protein expression in tumor tissues in DDP, tempol (100 mg/kg)+DDP and tempol (200 mg/kg)+ DDP groups detected by immunoblotting; D: Cell apoptotic rates cells determined by TUNEL staining in the tumor tissues (***P < 0.001) |
通过TUNEl染色进一步分析肿瘤组织中细胞凋亡情况, 显示顺铂处理的小鼠肿瘤组织中凋亡细胞明显增加, 而TPL联合顺铂处理组中细胞凋亡减少(图 5B、D)。
2.5 TPL降低顺铂诱导的ROS升高检测肿瘤组织中ROS水平结果显示, 顺铂可增加肿瘤组织中ROS水平, 而TPL联合顺铂显著减少顺铂造成的ROS水平升高作用(图 6A)。同时对小鼠肾脏进行HE染色发现, 顺铂处理导致肾脏明显纤维化, 而TPL联合顺铂显著减少肾脏的纤维化程度, 使肾脏组织形态与对照组差异不明显(图 6B)。
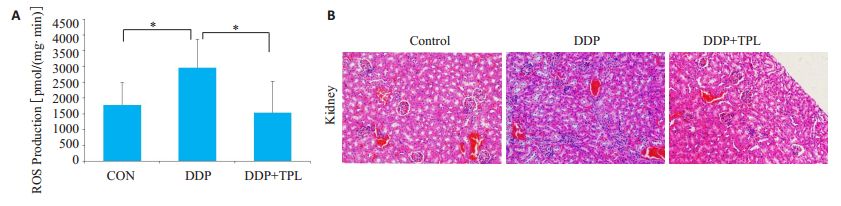
|
图 6 在小鼠体内实验中, Tempol降低顺铂诱导的肿瘤细胞凋亡 Fig.6 Tempol (TPL) attenuates DDP-induced increase of ROS production in the tumor tissue. A: Effect of the 3 treatments on ROS production in the tumor tissues for 24 h at 14 days after tumor implantation (*P < 0.05); B: HE staining of the kidneys in control, DDP and TPL+DDP groups (×200) |
本研究表明, 尽管TPL在细胞学实验中与顺铂具有协同抗肿瘤作用, 但在体内实验中TPL拮抗顺铂的抗肿瘤作用, 明显降低顺铂对肿瘤的生长抑制作用并缩短小鼠寿命, 对其机制的初步探讨发现, TPL逆转顺铂诱导的肿瘤细胞凋亡, 降低顺铂诱导的ROS水平的升高。本研究结果提示, TPL和顺铂在体内联合应用有减低顺铂治疗效果的风险。TPL是一种具有膜通透性好、低毒性的抗氧化剂, 通过其超氧阴离子的清除活性可以防止线粒体中超氧离子和H2O2的产生, 减少细胞氧化损伤[24-26]。本实验证实TPL可以缓解顺铂引起的肾脏纤维化改变。但是目前对TPL是否减弱顺铂在体内的抗肿瘤效果还鲜有研究。因此本研究在动物体内对此问题进行探讨, 并且首次发现化疗保护剂TPL明显抑制顺铂诱导的细胞凋亡, 拮抗顺铂抗肿瘤作用。美国正在开展TPL降低顺铂毒副作用的临床试验, 因此本研究的结果对该试验具有重要的参考及指导意义。
本实验证实, TPL可以抑制多株肿瘤细胞株的活性。但在体内实验中, 结合本课题组待发表的实验发现只有当TPL剂量达到200 mg/kg以上才具有明显抗肿瘤作用, 而当TPL剂量小于200 mg/kg时, 其抗肿瘤效果并不显著。这是由于在体内药物组织分布和代谢的原因, 使TPL难以达到杀伤肿瘤细胞的作用浓度和足够的作用时间。TPL的氮氧自由基在血浆中的半衰期很短, 而在肿瘤组织中停留的时间更短[27], 利用MRI检测氮氧化合物(3-CP)在小鼠体内的代谢发现, 在正常组织和肿瘤组织中, 氮氧自由基(3-CP)的药物浓度在8.5 min达到最大值, 之后药物浓度便开始减弱[28]。因此在TPL单独用药时, 需要更高的剂量的TPL才能达到较好的抗肿瘤效果。如何加大TPL的血药浓度及药物作用时间, 是使TPL发挥更好的抗癌作用需要解决的重要问题。
本实验中TPL对顺铂的肿瘤杀伤效果的影响在细胞水平和动物水平存在差异, 在细胞水平二者为协同作用, 而动物水平二者为拮抗作用, 这与TPL的氧化还原特性相关, TPL可通过硝酰基团得到或失去电子而具有氧化性和还原性[29]。当表现为氧化性时, TPL可增加细胞周期依赖性激酶抑制子p21waf1/cip1的表达, 激活caspase-3和Bax/Bcl-2通路的功能[30], 同时TPL的细胞毒性作用依赖于诱导细胞内氧化压力[31-32], 从而发挥肿瘤细胞杀伤作用。当表现为还原性时, TPL可模拟超氧化物歧化酶及过氧化氢酶的作用, 清除超氧阴离子自由基[24, 33], 减少蛋白质的损伤及缓解脂质过氧化反应对细胞膜等生物膜的损伤[1]。而TPL表现为氧化性还是还原性受到多种因素的影响, 如药物浓度、作用时间、药物作用环境及其他难以确定的因素[34]。一般而言, 当药物作用时间较短, 药物浓度较低时表现为抗氧化性, 保护细胞免受氧化损伤, 当浓度较高且持续作用时, 表现为促氧化性从而杀伤肿瘤细胞[34]。一般研究中使用的TPL剂量在体内难以达到杀伤肿瘤细胞的高浓度和持续的作用时间。因此在这些体内研究中, 即使在TPL的使用剂量到达最大耐受剂量时, TPL仍只是起到抗氧化剂的作用[8, 35]。造成肿瘤细胞内氧化压力是顺铂的抗肿瘤及产生毒副作用的机制之一, 因此, 在体内实验中TPL在减少顺铂对其他器官毒副作用的同时, 也减弱顺铂对肿瘤组织的毒性杀伤作用。而在细胞学实验中, TPL浓度恒定及作用时间较长, TPL表现为促氧化作用, 激活caspase-3和Bax/Bcl-2通路的功能[30], 与顺铂协同抑制细胞生存。
综上所述, 本研究提示将TPL作为抗氧化剂与顺铂化疗药物同时运用时, 应该衡量利弊, 评估TPL减少化疗药造成的毒副作用的好处, 同时要评估其降低化疗药物治疗效果的风险, 从而谨慎用药。本研究也为其他抗氧化剂, 与肿瘤化疗药物(尤其通过增加ROS的药物)联合运用时提供指导。
| [1] |
Pattison DI, Lam M, Shinde SS, et al. The nitroxide tempol is an efficient scavenger of protein radicals: cellular and kinetic studies[J]. Free Rad Biol Med, 2012, 53(9): 1664-74. DOI:10.1016/j.freeradbiomed.2012.08.578 |
| [2] |
Gariboldi MB, Rimoldi V, Supino R, et al. The nitroxide tempol induces oxidative stress, p21(WAF1/CIP1), and cell death in HL60 cells[J]. Free Rad Biol Med, 2000, 29(7): 633-41. DOI:10.1016/S0891-5849(00)00347-6 |
| [3] |
Lewandowski M, Gwozdzinski K. Nitroxides as antioxidants and anticancer drugs[J]. Int J Mol Sci, 2017, 18(11): 2490-503. DOI:10.3390/ijms18112490 |
| [4] |
Gariboldi MB, Lucchi S, Caserini C, et al. Antiproliferative effect of the piperidine nitroxide tempol on neoplastic and nonneoplastic mammalian cell lines[J]. Free Rad Biol Med, 1998, 24(6): 913-23. DOI:10.1016/S0891-5849(97)00372-9 |
| [5] |
de Blasio MJ, Ramalingam A, Cao AH, et al. The superoxide dismutase mimetic tempol blunts diabetes-induced upregulation of NADPH oxidase and endoplasmic reticulum stress in a rat model of diabetic nephropathy[J]. Eur J Pharmacol, 2017, 807(1): 12-20. |
| [6] |
Offer T, Russo A, Samuni A. The pro-oxidative activity of SOD and nitroxide SOD mimics[J]. Faseb J, 2000, 14(9): 1215-23. DOI:10.1096/fasebj.14.9.1215 |
| [7] |
Bernardy CC, Zarpelon AC, Pinho-Ribeiro FA, et al. Tempol, a superoxide dismutase mimetic agent, inhibits superoxide anion- Induced inflammatory pain in mice[J]. Biomed Res Int, 2017, 21(8): 9584819-31. |
| [8] |
Hahn SM, Deluca AM, Coffin D, et al. In vivo radioprotection and effects on blood pressure of the stable free radical nitroxides[J]. Int J Radiat Oncol Biol Phys, 1998, 42(4): 839-42. DOI:10.1016/S0360-3016(98)00317-4 |
| [9] |
Dornas WC, Cardoso LM, Silva MA, et al. Oxidative stress causes hypertension and activation of nuclear factor-kappa B after high-fructose and salt treatments[J]. Sci Rep, 2017, 7(3): 46051-64. |
| [10] |
Alzoubi KH, Khabour OF, Albawaana AS, et al. Tempol prevents chronic sleep-deprivation induced memory impairment[J]. Brain Res Bull, 2016, 120(2): 144-50. |
| [11] |
Sun L, Chen Y, Shen X, et al. Inhibition of NOX2-NLRP1 signaling pathway protects against chronic glucocorticoids exposure-induced hippocampal neuronal damage[J]. Int Immunopharmacol, 2019, 74(10): 105721-33. |
| [12] |
Zhang G, Wang Q, Zhou Q, et al. Protective effect of tempol on acute kidney injury through PI3K/Akt/Nrf2 signaling pathway[J]. Kidney Blood Press Res, 2016, 41(2): 129-38. DOI:10.1159/000443414 |
| [13] |
Obrosov A, Shevalye H, Coppey LJ. Effect of tempol on peripheral neuropathy in diet-induced obese and high-fat fed/low-dose streptozotocin-treated C57Bl6/J mice[J]. Free Radic Res, 2017, 51(4): 360-7. DOI:10.1080/10715762.2017.1315767 |
| [14] |
Liu YF, Li LY, Qiu MZ, et al. Renal and cerebral RAS interaction contributes to diabetic kidney disease[J]. Am J Transl Res, 2019, 11(5): 2925-39. |
| [15] |
Cepeda V, Fuertes M, Castilla J, et al. Biochemical mechanisms of cisplatin cytotoxicity[J]. Anti-cancer Agents Med Chem, 2007, 7(1): 3-18. DOI:10.2174/187152007779314044 |
| [16] |
Szturz P, Cristina V, Gomez RG, et al. Cisplatin eligibility issues and alternative regimens in locoregionally advanced head and neck cancer: recommendations for clinical practice[J]. Front Oncol, 2019, 9(4): 464-78. |
| [17] |
Ormerod MG, Orr RM, Peacock JH. The role of apoptosis in cell killing by cisplatin: a flow cytometric study[J]. Brit J Cancer, 1994, 69(1): 93-100. DOI:10.1038/bjc.1994.14 |
| [18] |
Marullo R, Werner E, Degtyareva N, et al. Cisplatin induces a Mitochondrial-ROS response that contributes to cytotoxicity depending on mitochondrial redox status and bioenergetic functions[J]. PLoS One, 2013, 8(11): e81162-75. DOI:10.1371/journal.pone.0081162 |
| [19] |
Bragado P, Armesilla A, Silva A, et al. Apoptosis by cisplatin requires p53 mediated p38alpha MAPK activation through ROS generation[J]. Apoptosis, 2007, 12(9): 1733-42. DOI:10.1007/s10495-007-0082-8 |
| [20] |
Manohar S, Leung N. Cisplatin nephrotoxicity: a review of the literature[J]. J Nephrol, 2018, 31(1): 15-25. DOI:10.1007/s40620-017-0392-z |
| [21] |
Li LL, Lai EY, Luo ZM, et al. High salt enhances reactive oxygen species and angiotensin II contractions of glomerular afferent arterioles from mice with reduced renal mass[J]. Hypertension, 2018, 72(5): 1208-16. DOI:10.1161/HYPERTENSIONAHA.118.11354 |
| [22] |
Youn CK, Kim J, Jo ER, et al. Protective effect of tempol against cisplatin-induced ototoxicity[J]. Int JMol Sci, 2016, 17(11): 1931-43. |
| [23] |
Ahmed LA, Shehata N, Abdelkader NF, et al. Tempol, a superoxide dismutase mimetic agent, ameliorates cisplatin-induced nephrotoxicity through alleviation of mitochondrial dysfunction in mice[J]. PLoS One, 2014, 9(10): e108889-900. DOI:10.1371/journal.pone.0108889 |
| [24] |
Aronovitch Y, Godinger D, Israeli A, et al. Dual activity of nitroxides as pro- and antioxidants: catalysis of copper-mediated DNA breakage and H2O2 dismutation[J]. Free Rad Biol Med, 2007, 42(9): 1317-25. DOI:10.1016/j.freeradbiomed.2007.01.017 |
| [25] |
Ge Z, Wang C, Zhang J, et al. Tempol protects against acetaminophen induced acute hepatotoxicity by inhibiting oxidative stress and apoptosis[J]. Front Physiol, 2019, 39(10): 660-73. |
| [26] |
Wang XR, Yang JW, Ji CS, et al. Inhibition of NADPH oxidasedependent oxidative stress in the rostral ventrolateral medulla mediates the antihypertensive effects of acupuncture in spontaneously hypertensive rats[J]. Hypertension, 2018, 71(2): 356-65. DOI:10.1161/HYPERTENSIONAHA.117.09759 |
| [27] |
Davis RM, Matsumoto S, Bernardo M, et al. Magnetic resonance imaging of organic contrast agents in mice: capturing the wholebody redox landscape[J]. Free Rad Biol Med, 2011, 50(3): 459-68. DOI:10.1016/j.freeradbiomed.2010.11.028 |
| [28] |
Matsumoto K, Hyodo F, Matsumoto A, et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents[J]. Clin cancer Res, 2006, 12(8): 2455-62. DOI:10.1158/1078-0432.CCR-05-2747 |
| [29] |
Czepas J, Koceva-Chyła A, Gwoździński K, et al. Different effectiveness of piperidine nitroxides against oxidative stress induced by doxorubicin and hydrogen peroxide[J]. Cell Bio Toxicol, 2007, 24(1): 101-12. |
| [30] |
Gariboldi MB, Terni F, Ravizza R, et al. The nitroxide Tempol modulates anthracycline resistance in breast cancer cells[J]. Free Rad Biol Med, 2006, 40(8): 1409-18. DOI:10.1016/j.freeradbiomed.2005.12.011 |
| [31] |
Monti E, Supino R, Colleoni M, et al. Nitroxide TEMPOL impairs mitochondrial function and induces apoptosis in HL60 cells[J]. J Cell Biochem, 2001, 82(2): 271-6. DOI:10.1002/jcb.1160 |
| [32] |
Alpert E, Altman H, Totary H, et al. 4-Hydroxy tempol-induced impairment of mitochondrial function and augmentation of glucose transport in vascular endothelial and smooth muscle cells[J]. Biochem Pharmacol, 2004, 67(10): 1985-95. DOI:10.1016/j.bcp.2004.02.005 |
| [33] |
Ding Y, Han Y, Lu QL, et al. Peroxynitrite-Mediated SIRT (sirtuin)- 1 inactivation contributes to Nicotine-Induced arterial stiffness in mice[J]. Arterioscler Thromb Vasc Biol, 2019, 39(7): 1419-31. DOI:10.1161/ATVBAHA.118.312346 |
| [34] |
Vasily DS, Alexei AT, Nina PK. Platinum complexes with bioactive nitroxyl radicals: synthesis and antitumor properties[M]. Intech Open, 2012: 385-406.
|
| [35] |
Hahn SM, Krishna MC, Deluca AM, et al. Evaluation of the hydroxylamine Tempol-H as an in vivo radioprotector[J]. Free Rad Biol Med, 2000, 28(6): 953-8. DOI:10.1016/S0891-5849(00)00176-3 |
 2019, Vol. 39
2019, Vol. 39

