糖尿病肾病(DN)是糖尿病患者最主要的并发症之一,导致终末期肾衰竭的发病机制非常复杂。近年来的文献报道,血管内皮损伤和微循环障碍是糖尿病肾病发生发展的重要发病机制[1-3]。1997年Asahara等[4]首次从成人外周血单个核细胞中分离得至CD34+细胞,因其在体外可向内皮表型细胞分化,表达内皮细胞标志物,参与出生后血管新生和内皮损伤后的修复过程[5];CD144作为内皮细胞的标志物,是内皮细胞黏附连接的主要结构蛋白,相邻的血管内皮钙黏素,细胞外结构域通过钙离子发生同质性连接形成血管内皮钙黏素连接复合体而构成了内皮细胞间的黏附连接[6-7];Hes1是Notch信号通路下游的靶基因之一,控制胚胎发育,影响细胞增殖和分化。
血管内皮的分化主要受Notch信号调控,在斑马鱼的研究中发现成血管细胞聚集到背大动脉之前,那些将要向动脉内皮细胞分化的成血管细胞中的Notch信号十分活跃,认为血管内皮因子与Notch信号通路交互对话对动静脉分化起着重要的调控作用[8],而内皮微环境中的Notch信号通路对于干细胞的维持和再生又具有非常重要的作用[9]。
本实验立足于气阴两虚夹瘀是DN的中医基本病理变化机制,益气养阴活血的院内制剂丹蛭降糖胶囊具有良好的临床疗效和大量的前期研究基础,前期研究中发现该药可降低DM大鼠腹主动脉的MCP-1和抵抗素mRNA表达水平,改善糖尿病大鼠腹主动脉超微结构[10]、能抑制心肌局部RAS激活及TGF-β1/Smad3信号通路活化,从而抑制糖尿病大鼠心肌纤维化[11]、通过减轻脂质沉积、氧化和内质网络应激,对DM大鼠的内皮功能障碍、炎症和凋亡具有内皮保护作用[12]、能有效改善DM大鼠肾脏病理形态学、明显改善大鼠的糖尿病症状,减轻肾脏损害[13]。这些研究都是基于单一因素,如血管内皮损伤、或某一信号通路、或氧化应激、或肾功能等,而对于Notch信号通路研究较少,尤其是血管内皮和Notch信号通路相关因子相互影响的研究罕见。本实验复制早期DN大鼠模型,设贝那普利西药组对照,采用丹蛭降糖胶囊高、中、低剂量组对该模型进行防治,探讨DN时血管内皮CD34、CD144细胞的变化机制以及在这一过程中Notch/Hes1通路的调节靶点,进一步研究益气养阴活血方丹蛭降糖胶囊对早期DN肾功能的保护机制。
1 材料和方法 1.1 动物模型的建立与分组实验选用SD雄性大鼠30只,大鼠购于安徽医科大学,动物证号SCXK(皖)2017-001,体质量180±20 g,适应性喂养一周后,随机分出6只为正常组(Con),余下采取左肾切除术+高脂高糖(10%猪油、2.5%胆固醇、20%蔗糖)喂养,4周后造模大鼠禁食不进水12 h,按照30 mg/kg体重腹腔注射STZ(以PH4.2的0.1 mmol/L枸橼酸缓冲液配成2%浓度),72 h后尾静脉采血测量血糖值≥16.7 mmol/L,且尿量和饮食、饮水量明显增多,为造模成功,2周后经尿白蛋白检测后确认为早期DN模型[14]。造模成功后数字随机法分为模型组(Mod)、西药组(Ben)、中药高剂量组(DZJT- H)、中药中剂量组(DZJT-M)、中药低剂量组(DZJT-L)。
1.2 药物和试剂丹蛭降糖胶囊购置于安徽中医药大学第一附属医院(批号:20140304)、贝那普利缓释片由成都地奥药业集团生产(批号:170404)、链脲左菌素(Streptozotocln, STZ)安徽华润制药公司生产(批号:20170208330),Anti-CD34,MDL生产,批号:MD4960;Anti-CD144,abcam生产,批号:ab33168。
1.3 给药参照徐淑云[15]《药理实验方法学》中的剂量给药方法,大鼠与人的折算系数为0.018,按体质量70 kg成人用量6 g/d计算,丹蛭降糖胶囊高、中、低剂量组分别按1.26、0.63、0.315 g/(kg·d)灌胃,正常组予以生理盐水灌胃,西药组予以贝那普利0.01 g/(kg·d)治疗,模型组给予等量生理盐水3-5 mL灌胃,持续8周。
1.4 动物处死治疗结束后给予大鼠称重,10%水合氯醛按照30 mg/100 g予以麻醉后,取大鼠腹主动脉血,2 h左右分离血清。
1.5 观测指标和检测方法 1.5.1 24 h尿白蛋白在处死大鼠前1 d用代谢笼收集大鼠24 h尿液,用全自动生化分析仪检测24 h尿蛋白。
1.5.2 肾组织染色病理HE染色后400倍光镜下观察肾组织结构形态。
1.5.3 肾组织Hes1检测:免疫组化法免疫组织化学染色按照试剂盒说明书进行。常规二甲苯脱蜡、梯度酒精脱水,柠檬酸盐缓冲液高压修复抗原,30 mL/L H2O2灭活内源性过氧化物酶,一抗兔抗人4 ℃孵育过夜,加入聚合物增强剂试剂A,加入辣根过氧化物酶标记的二抗小鼠/兔聚合物放大剂试剂B;DAB显色、苏木素复染、脱水、透明、封片。
1.5.4 肾组织CD34、CD144表达:Western blot技术制备SDS-PAGE凝胶、蛋白质的提取、变性、电泳,凝胶转膜、封闭,一抗为1:500稀释兔抗鼠CD34、CD144单克隆抗体,1: 10 000比例用二抗稀释液稀释辣根过氧化物酶(HRP)标记,显色、显影、定影、摄像。BANDSCAN软件条带分析,计算灰度值,以与β-actin灰度值比值作为相对表达量。
1.6 统计学方法采用SPSS21软件进行统计学分析。连续型变量采用均数±标准差进行统计学描述。正常组与模型组均数比较采用两个独立样本t检验;除正常组之外其余5组均数比较采用单因素方差分析,均数多重比较采用LSD检验(方差齐时)或Dunnett's T3检验(方差不齐时)。P<0.05为差异有统计学意义。
2 结果 2.1 大鼠24 h尿白蛋白比较24 h尿白蛋白(图 1):与正常组比较,模型组24 h尿白蛋白较正常组明显升高(P<0.05);与模型组比较,中药高、中剂量组和西药组能明显降低模型组24 h尿白蛋白(P<0.05);与西药组比较,中药高剂量组没有差异(P>0.05),但中药中、低剂量组有明显差异(P<0.05)。
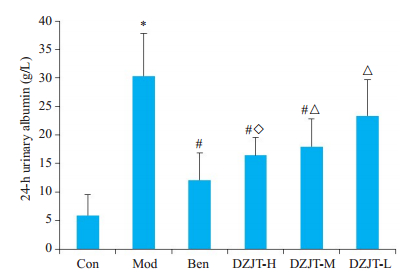
|
图 1 24 h尿白蛋白 Fig.1 Levels of 24-h urinary albumin in each group. *P<0.05 vs Con group. #P<0.05 vs Mod group; △P<0.05 vs Ben group; ◇P<0.05 vs DZJT-M group. |
|
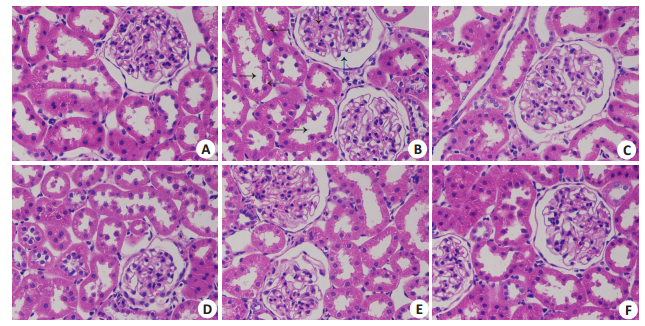
图 2 各组大鼠肾组织病理学变化 Fig.2 Changes in renal histopathology in each group (HE staining, original magnification: ×400). A: Con; B: Mod; C: Ben; D: DZJT-H; E: DZJT-M; F: DZJT-L. |
经过8周治疗后,各组大鼠肾组织HE染色,光镜下观察病理变化如下(图 1):正常组大鼠肾小球的血管球及血管系膜、肾小囊、肾小管形态基本正常;模型组大鼠可见肾小球硬化、萎缩,肾小囊囊腔增大(↑),系膜基质增多、系膜增厚增宽并可见结节样增生(↓),肾小管部分扩张(→),肾小管上皮细胞空泡变性(←);与模型组相比,各治疗组肾组织上述病理改变均不同程度地减轻,中药高剂量组改变最为明显,仅见局灶肾小球系膜基质增生,部分肾小球见节段性增生;而西药组和中药中剂量组肾小球系膜结节样增生较高剂量组明显,但比中药低剂量组轻;中药低剂量组和模型组无明显差异。
2.3 Hes1免疫组化检测及表达光镜下显示(图 3),正常组大鼠肾组织中,肾小管上皮细胞胞质中无明显阳性表达。模型组大鼠肾组织中,阳性表达呈棕黄色细颗粒状,位于肾小管上皮细胞胞质中,呈弥漫性强阳性表达。与模型组相比,各治疗组大鼠肾组织中,在部分肾小管上皮细胞胞质中呈弱阳性表达,高剂量组及西药组表达最弱,中药各剂量组呈一定的剂量效应依赖关系。
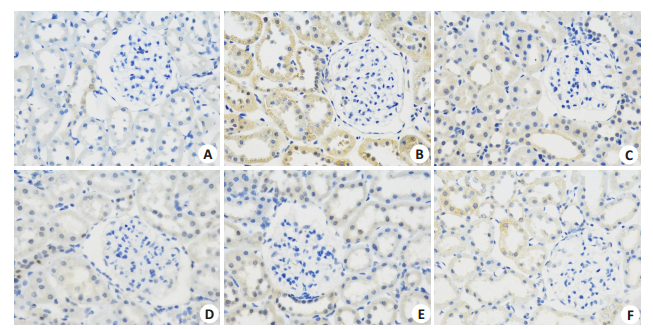
|
图 3 各组肾组织Hes1的表达 Fig.3 Immunohistochemistry for detecting Hes1 expression in the renal tissue in each group (SABC, ×400). A: Con group; B: Mod group; C: Ben group; D: DZJT-H group; E: DZJT-M group; F: DZJT-L group. |
Hes1蛋白表达量以积分光密度表示(图 4):每组内每张切片随机挑选至少3个400倍视野进行拍照。拍照时尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的积分光密度值。与正常组比较,模型组Hes1肾组织含量明显增高(P<0.05);与模型组比较,西药组、中药各剂量组肾组织含量明显降低(P<0.05),但西药组、中药各剂量组间比较没有统计学意义。
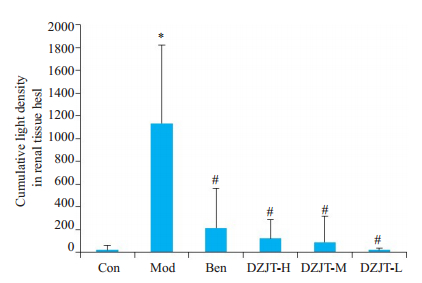
|
图 4 肾组织Hes1积分光密度 Fig.4 Cumulative optical density for Hes1 in the renal tissue in each group. *P<0.05 vs Con group; #P<0.05 vs Mod group. |
大鼠CD34的表达:与正常组比较,模型组大鼠明显升高了正常大鼠肾组织CD34蛋白表达(P<0.05);与模型组比较,中药各剂量组、西药组能明显降低模型大鼠的CD34表达(P<0.05);与西药组比较,中药各剂量组有明显差异(P<0.05),中药各剂量组间比较均有明显差异(P<0.05),以高剂量组降低效果最好。
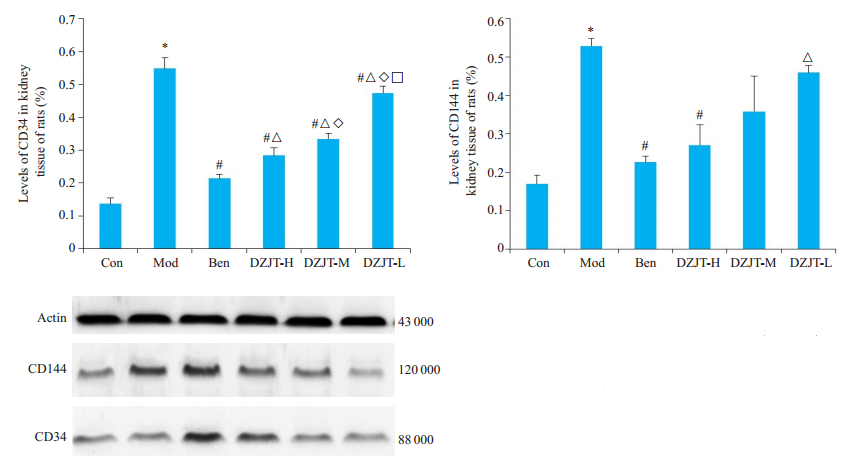
|
图 5 大鼠肾组织蛋白CD34、CD144表达量
Fig.5 Western blotting for detecting CD34 and CD144 expression in the renal tissue of the rats. C-graph is from left to right in turn. Con group; Ben group; Mod group; DZJT-M group; DZJT-L group; DZJT-H group. *P<0.05 vs Con group; #P<0.05 vs Mod group. △ |
大鼠CD144的表达:与正常组比较,模型大鼠明显升高正常大鼠肾组织CD144表达(P<0.05);与模型组比较,中药高剂量组和西药组明显降低模型大鼠CD144的表达(P<0.05),中药中剂量组、低剂量组没有降低;与西药组比较,中药低剂量组有明显差异(P<0.05)。
3 讨论本实验采用采取左肾切除术+高脂高糖喂养+小剂量腹腔注射STZ复制早期DN大鼠模型。实验结果发现,模型组肾组织CD34、CD144表达均明显升高,益气养阴活血中药各剂量组和西药贝拉普利均可以明显降低肾组织中CD34的表达,中药高剂量组和西药组可降低CD144的表达,而作为Notch通路的下游转录因子Hes1只在模型组明显升高,中药各剂量组、西药组均明显降低模型大鼠Hes1的表达,阳性表达位于肾小管上皮细胞胞质中,呈弥漫性强阳性表达。
已有人观察到单侧输尿管梗阻7 d的肾小球病变时CD34+肾小球毛细血管明显减少,而在肾小管间质病变并未明显改变,随着肾小管间质纤维化的进展,CD34+小管间质毛细血管明显减少[17];通过对肾缺血再灌注模型及内皮细胞因子治疗的实验,术后第1天观察缺血再灌注组大鼠肾组织CD34表达减少;给予内皮祖细胞治疗后,肾组织血管内皮细胞标志物CD34的表达较治疗前明显增加[18];但随着病程的进展,对干预后第5天、第10天及第17天,模型组和细胞因子治疗组肾组织CD34+细胞较正常对照组和治疗对照组显著增多,并且同时间点细胞因子治疗组较模型组增多更明显,第24天细胞因子治疗组肾组织CD34+细胞恢复正常,而模型组仍偏高,但与其他3组比较,差异无显著性意义[19]。从研究报道的结果来看,当肾组织血管损伤时CD34的表达随着病程的进展,其在损伤组织中的含量呈现由低到高的趋势,本实验的观察结果符合肾组织缺血病程有一定进展的文献报道,这是否说明骨髓内EPCs细胞的动员、迁徙、归巢需要一定的时间和过程?有待于进一步多部位动态观察研究。
以CD144为标志物的EMP与糖尿病肾病相关,糖尿病肾病患者血浆EMP水平明显增高,且EMP敏感性和特异性均较高,认为高糖是EMP形成的有效刺激物[20-23],最终导致EMP生物活性增加;同时糖尿病发病过程中,血糖及血流动力学改变等诱导Notch信号通路的配体Jagged1和受体Notch1表达增加,通过配体和受体结合,受体结构发生改变,在γ-分泌酶的介导下向细胞内释放出Notch通路的活化形式NICD1,并激活其下游基因Hes1和Hey1[24-25],本实验CD144、Hes1的检测结果与文献报道相一致,且Hes1弥漫性强阳性表达于肾组织肾小管上皮细胞胞质中。
DN是DM重要的微血管并发症之一,中医认为气阴两虚夹瘀是DN的主要病机,益气养阴活血方丹蛭降糖胶囊由太子参、丹皮、水蛭、泽泻、生地黄、菟丝子等组成,方中牡丹皮和水蛭活血散瘀,太子参、菟丝子和生地黄益气补阴,泽泻泄血中浊热。近年来从血管及内皮损伤机制的研究已证实丹蛭降糖胶囊可有效防治和干预糖尿病及其并发症[10, 29-31],尤其是方中主要药物丹皮酚具有保肝护肾、降血糖等作用[27];水蛭素具有抗凝血、抗血栓的作用[28],但机制并不十分明确。
从本实验的结果来看,随着实验进程的发展,CD34在中药各治疗组均有明显改善,CD144有一定的改善趋势,以中药高剂量治疗组有统计学意义,说明益气养阴中药丹蛭降糖胶囊可降低DN大鼠肾组织内CD34、CD144的水平,参与血管内皮损伤的修复,但以CD34较为敏感;同时中药各剂量组抑制了Notch通路转录因子的Hes1在肾小管上皮细胞胞质中的表达,中药各剂量组呈一定的剂量效应依赖关系,与CD34的改变呈一致性。说明益气养阴活血中药丹蛭降糖胶囊可通过对DN模型大鼠Notch/Hes1和CD34、CD144的调节,促使模型大鼠接受益气养阴活血中药的刺激,抑制Notch/Hes1在肾小管上皮细胞的表达,介导以CD34为主参与的血管内皮修复,抑制新生血管出芽过程中的尖端细胞数量或纠正出芽方向、路径[27-28],抵抗有功能缺陷的高密度的血管网络形成、降低尿蛋白、减轻肾组织病理损害,从而发挥益气养阴活血中药丹蛭降糖胶囊保护肾功能、延缓糖尿病肾病发展的作用。
由于中药复方成分的复杂性,本实验观察多局限于效应本身、单一层次,缺乏系统研究,当糖脂代谢异常、肾血流动力学改变,组织缺血缺氧时,内皮细胞从骨髓动员、迁徙、归巢,缺乏对骨髓、外周血液、肾组织多部位的观察;仅从Notch/Hes1通路与血管内皮CD34、CD144之间作了探讨,对于Notch通路其他下游HERP、bHLH、Hey靶基因和血管内皮因子的关系缺乏进一步研究;其次缺乏动态的观察研究.对于DM何时进行预防干预DN的发生发展,从时效性上寻找血管内皮因子与Notch通路之间的关系也许是中医药防治DN机制研究的一个重要切入点。
| [1] |
Wu SL, Li XY, Zhang HM. Effects of metformin on endothelial function in type 2 diabetes[J]. Exp Ther Med, 2014, 7(5): 1349-53. DOI:10.3892/etm.2014.1582 |
| [2] |
Krasnicki P, Dmuchowska DA, Proniewska-Skretek E, et al. Ocular haemodynamics in patients with type 2 diabetes and coronary artery disease[J]. Brit J Ophthalmol, 2014, 98(5): 675-8. DOI:10.1136/bjophthalmol-2013-304224 |
| [3] |
Tasyurek HM, Altunbas HA, Balci MK. Incretins: their physiology and application in the treatment of diabetes mellitus[J]. Diabetes Metab Res Rev, 2014, 30(5): 354-71. DOI:10.1002/dmrr.v30.5 |
| [4] |
Asahara T, Murohara T, Sullivan A, et al. Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science, 1997, 275(532): 964-7. |
| [5] |
刘竹影, 陈颖, 刘倩, 等. 血管内皮祖细胞改善骨质疏松大鼠骨髓间充质干细胞的增殖及凋亡[J]. 中国组织工程研究, 2016, 20(14): 1999-2006. DOI:10.3969/j.issn.2095-4344.2016.14.003 |
| [6] |
Bazzoni G, Dejana E. Endothelial cell- to-cell junctions: molecular organization and role in vascular homeostasis[J]. Physiol Rev, 2004, 84(3): 869-901. DOI:10.1152/physrev.00035.2003 |
| [7] |
Mehta D, Malik AB. Signaling mechanisms regulating endothelial permeability[J]. Physiol Rev, 2006, 86(1): 279-367. DOI:10.1152/physrev.00012.2005 |
| [8] |
Fish JE, Wythe JD. The molecular regulation of arteriovenous specification and maintenance[J]. Dev Dynam, 2015, 244(3, SI): 391-409. DOI:10.1002/dvdy.24252 |
| [9] |
Doan PL, Russell JL, Himburg HA, et al. Tie2(+) bone marrow endothelial cells regulate hematopoietic stem cell regeneration following radiation injury[J]. Stem Cells, 2013, 31(2): 327-37. DOI:10.1002/stem.v31.2 |
| [10] |
鲍陶陶, 杨晓春, 储全根. 丹蛭降糖胶囊对糖尿病大鼠主动脉超微结构, MCP-1, 抵抗素mRNA表达的影响[J]. 中成药, 2015, 37(9): 1888-92. |
| [11] |
郑书国, 陶善珺, 赵梦秋, 等. 丹蛭降糖胶囊对糖尿病血糖波动模型大鼠心肌纤维化的影响[J]. 中药材, 2015, 38(10): 2120-4. |
| [12] |
Lu Y, Chen Y, Li R, et al. Protective effects of Danzhi jiangtang capsule on vascular endothelial damages induced by high-fat diet and palmitic acid[J]. Biomed Pharmacot, 2018, 107(11): 1631-40. |
| [13] |
贾会玉, 那莎, 李莉, 等. 丹蛭降糖胶囊对大鼠糖尿病肾病防治作用的研究[J]. 中华中医药杂志, 2016, 31(12): 5244-7. |
| [14] |
高雪, 安至超, 何其英, 等. 高脂饲料喂养时间对2型糖尿病肾病大鼠模型的影响[J]. 中国实验动物学报, 2017, 26(1): 1-9. DOI:10.3969/j.issn.1005-4847.2017.01.001 |
| [15] |
徐叔云. 药理实验方法学[M]. 北京: 人民卫生出版社, 1982: 203.
|
| [16] |
Abdul MM, Osamu I. Elewa yaser hosny Ali; nakamura teppei; Kon yasuhiro; local CD34-positive capillaries decrease in mouse models of kidney disease associating with the severity of glomerular and tubulointerstitial lesions[J]. BMC Nephrol, 2017, 18(9): 280-92. |
| [17] |
周丽娜, 王玉新, 方林, 等. 内皮祖细胞修复缺血再灌注大鼠肾损伤[J]. 中国组织工程研究, 2014, 18(32): 5146-51. DOI:10.3969/j.issn.2095-4344.2014.32.011 |
| [18] |
毕凌云, 杨达胜, 赵德安, 等. 动员自身骨髓干细胞与缺血再灌注肾损伤细胞的凋亡与增殖[J]. 中国组织工程研究, 2013, 17(49): 8488-97. DOI:10.3969/j.issn.2095-4344.2013.49.005 |
| [19] |
刘建辉, 孙志平, 王琴, 等. 糖尿病肾病患者血浆EMP与AECA的诊断价值[J]. 热带医学杂志, 2015, 15(11): 1478-80. |
| [20] |
玛依努·玉苏甫.赵红丽. 丹参多酚酸盐治疗早期糖尿病肾病的临床价值研究[J]. 医学综述, 2015, 21(23): 4382-4. DOI:10.3969/j.issn.1006-2084.2015.23.059 |
| [21] |
Gupta N, Wish JB. Erythropoietin mimetic peptides and erythropoietin fusion proteins for treating anemia of chronic kidney disease[J]. Curr Opin Nephrol Hypertens, 2018, 27(5): 345-50. DOI:10.1097/MNH.0000000000000430 |
| [22] |
Mansour A, Elbaky AA, Kamal S, et al. Evaluation of the procoagulant potential of endothelial microparticles CD144(VECadherin) positive in coronary syndrome patients[J]. Egyp J Haematol, 2014, 39(3): 143-8. DOI:10.4103/1110-1067.148244 |
| [23] |
Ji X, Wang Z, Geamanu A, et al. Inhibition of cell growth and induction of apoptosis in non-small cell lung cancer cells by deltatocotrienol is associated with notch-1 down-regulation[J]. J Cell Biochem, 2011, 112(10): 2773-83. DOI:10.1002/jcb.23184 |
| [24] |
高峰, 刘淑霞, 赵玉峰, 等. Notch信号通路在糖尿病小鼠肾组织的表达及意义[J]. 中国组织化学与细胞化学杂志, 2014, 23(5): 445-9. DOI:10.3870/zgzzhx.2014.05.011 |
| [25] |
高家荣, 庄星星, 魏良兵, 等. 丹蛭降糖胶囊治疗2型糖尿病血管病变的作用机制研究[J]. 中药药理与临床, 2014, 30(6): 143-5. |
| [26] |
罗云, 方朝晖. 丹蛭降糖胶囊对糖尿病动脉硬化模型大鼠胸主动脉p22phoxmRNA, p47phox mRNA表达的影响[J]. 新中医, 2018(50): 5-8. |
| [27] |
杨晓春, 鲍陶陶, 储全根. 基于p38MAPK通路探讨丹蛭降糖胶囊对2型糖尿病模型大鼠血管病变的影响[J]. 中国实验方剂学杂志, 2016, 22(3): 116-20. |
| [28] |
胡云飞, 徐国兵. 牡丹皮及其主要成分丹皮酚的药理作用研究进展[J]. 安徽医药, 2014, 18(4): 589-92. DOI:10.3969/j.issn.1009-6469.2014.04.001 |
| [29] |
梁裕芬. 医用水蛭的生物学特性及药用价值概述[J]. 生物学教学, 2017, 42(10): 2-4. DOI:10.3969/j.issn.1004-7549.2017.10.001 |
| [30] |
Beets K, Huylebroeck D, Moya IM, et al. Robustness in angiogenesis: notch and BMP shaping waves[J]. Trends Genet, 2013, 29(3): 140-9. DOI:10.1016/j.tig.2012.11.008 |
| [31] |
杜潇, 张思琴, 程中, 等. 激活Notch1信号通路对胰腺癌细胞增殖的影响[J]. 南方医科大学学报, 2013, 33(10): 1494-8. |
 2019, Vol. 39
2019, Vol. 39

