2. 深圳龙华区中心医院口腔科,广东 深圳 518110
2. Department of Stomatology, Shenzhen Longhua District Central Hospital, Shenzhen 518110, China
龋病是一种牙体硬组织发生慢性进行性破坏的最常见的口腔疾病。尽管我国居民的口腔健康保健意识已得到提高,但患龋状况仍呈上升态势,第四次全国口腔健康流行病学调查结果显示,12岁儿童的患龋率比十年前上升了7.8个百分点[1]。定植于牙菌斑生物膜中的变异链球菌是最主要的致龋菌,其致龋性与其具有的产酸、耐酸的特性密切相关[2-3]。当个体口腔卫生不良时,这种革兰阳性菌便会在牙菌斑生物膜中大量繁殖和增加产酸,继而引起局部硬组织脱矿和龋病的发生[3-4]。但现有的氟化物、传统抗生素和洗必泰仍不能较好地防治龋病,甚至存在一些副作用,比如耐氟或者耐药菌株的出现,以及味觉障碍的发生[5-6],寻找安全有效的新型防龋药物是一个需要迫切解决的问题。抗菌肽作用快速,不易形成耐药,受到了广泛的关注[7]。
抗菌肽是一类具有正电性、疏水性和两亲性的小分子多肽类物质。研究表明,它们不仅能够抑制多种革兰阳性/阴性细菌的活性,甚至对传统抗生素耐药菌也有良好的抑制效果[7]。现有的抗S. mutans的抗菌肽,包括了α-防御素、β-防御素、LL-37、nisin、histatin 5和pleurocidin及其衍生肽,以及专一性靶向S. mutans的抗菌肽,如C16G2,它们均能够较好地抗浮游状态以及生物膜状态的S. mutans[8-12]。然而,由于存在着合成消耗大(肽链较长)和生物利用度低(空间位阻)等不利于临床转化的因素,目前仍没有进入防治龋病的临床应用阶段的肽类药物。
本研究将乳酸杆菌拮抗致龋菌的代谢产物reuterin 6和/或gassericin A作为抗菌肽设计的初始模板,根据两亲性正电性α-螺旋结构抗菌肽的设计理念[12]进行设计,构建出一系列短链线性α-螺旋结构型的抗菌肽,从中筛选出低毒、高活性、快速的新型抗菌肽,并探讨它抗S. mutans等口腔致病菌的作用,以初步明确它们应用于防治龋病等口腔细菌感染性疾病的潜力。
1 材料和方法 1.1 材料 1.1.1 菌株和细胞株S. mutans ATCC25175,北京大学口腔医学院中心实验室惠赠。临床分离株金黄色葡萄球菌(Staphylococcus aureus, S. aureaus),南方医科大学南方医院检验科临床分离株。黏性放线菌(Actinomyces viscosus,A. viscosus)ATCC15987、粪肠球菌(Enterococcus faecalis,E. faecalis)ATCC47077、牙龈卟啉单胞菌(Porphyromonas gingivalis,P. gingivalis)ATCC33277以及具核梭杆菌(Fusobacterium nucleatum,F. nucleatum)ATCC25586,购自广东省菌种保藏中心(GDMCC)。原代人牙周膜成纤维细胞(HPDFs),分离、培养于南方医科大学南方医院口腔科正畸患者的正常牙周组织(经知情同意)。
1.1.2 实验药物抗菌肽序列如表 1所示,均由南京肽业(Nanjing Peptide Biotech Ltd.)公司合成,肽C端均进行酰胺化,N端不作修饰。纯度均达95%以上。
| 表 1 AT-1及其衍生肽的特性和抗菌活性 Tab.1 Physicochemical parameters and antimicrobial activities ofAT-1 and its derivatives |
脑心浸液(BHI)肉汤、平板(青岛海博);eBHI肉汤、血平板;托德·休伊特(TH)肉汤、平板(青岛海博);DMEM培养基(Hyclone);胎牛血清(FBS;Gibico);双抗(Hyclone);CCK8试剂盒(Dojindo);洗必泰(上海源叶);红霉素(上海生工)。
1.1.4 仪器Anoxomat Mark Ⅱ厌氧微需氧培养系统(MART);细菌振荡培养箱(上海一恒);CO2恒温细胞培养箱(Thermo);台式高速离心机(Eppendorf);SpectraMax M5酶标仪(Molecuar Devices);倒置显微镜CKX41(OLYMPUS)等仪器。
1.2 方法 1.2.1 抗菌肽的设计通过Prabi网站(https://prabi.ibcp.fr/htm/site/web/home)预测环状细菌素reuterin 6和/或gassericin A中的α-螺旋结构区域,选取α-螺旋结构(即活性区域)所在区域作为AT-1。通过Heliquest网站(http://heliquest.ipmc.cnrs.fr/)获得AT-1的极性面和非极性面上氨基酸,并使用精氨酸替换极性面上的非带正电氨基酸,以及使用赖氨酸或色氨酸替换非极性面上的带电氨基酸和弱疏水性氨基酸,由此构建AT-2、AT-3和AT-4;使用色氨酸替换AT-2的极性面上R6、K7和R10位置的氨基酸,由此构建AT-5、AT-6和AT-7。最后分析AT-1及其衍生肽的正电荷数、相对分子质量和疏水性。
1.2.2 细菌培养及细胞培养S. mutans ATCC25175、A. viscosus ATCC15987以及E. faecalis ATCC47077培养于BHI肉汤、平板,放置于37 ℃、厌氧环境中培养。P. gingivalis ATCC33277以及F. nucleatum ATCC25586培养于eBHI肉汤、血平板,放置于37 ℃、厌氧环境中培养。临床分离株S. aureaus培养于TH肉汤、平板,放置于37 ℃、需氧环境中培养。HPDFs培养于含10% FBS的DMEM培养基(含1%双抗),放置于37 ℃、含5% CO2的恒温细胞培养箱中培养。
1.2.3 细菌敏感性实验按照临床和实验室标准协会(CLSI)的推荐指示[13],检测AT-1及其衍生肽的最小抑菌浓度(MICs)和最小杀菌浓度(MBCs)。在96孔板上用BHI肉汤对各抗菌肽进行倍比稀释,然后加入生长对数期、终浓度为1 × 106 CFU/mL的S. mutans ATCC25175。空白对照组不加入细菌。培养24~48 h,肉眼观察各孔的浑浊程度。从所有肉眼无浑浊的孔中取液至BHI平板上,培养2 d。检测AT-7抗其他口腔致病菌(临床分离株S. aureaus、A. viscosus ATCC15987、E. faecalis ATCC47077、P. gingivalis ATCC33277和F. nucleatum ATCC25586)的MICs和MBCs,步骤同前。
1.2.4 细胞毒性实验按照5 × 103细胞/孔,将生长状态良好的第2代HPDFs铺至96孔板中。培养过夜,去上清,加入浓度为0~200 μg/mL的抗菌肽溶液,培养48 h。去上清,每孔加入100 μL的10% CCK8(DMEM配制),孵育2 h,波长450 nm状态下酶标仪检测其OD值。使用GraphPad Prism 7.0软件,计算它们的50%细胞毒性率所对应的浓度(CC50)。
1.2.5 杀菌-时效实验关于抗菌肽的杀菌动力学检测方法参考Ersoy等人的杀菌-时效实验[14]。在96孔板上用TH肉汤对各抗菌肽进行稀释至它们各自对应的1×MBCs,加入生长对数期、终浓度为1 × 106 CFU/mL的S. mutans ATCC25175,分别在0、5、10、20、40、60、100、160、220和300 min时各取适量混合液到PBS中稀释、涂板。培养2 d,计数存活菌落数。存活率=各个时间点的存活菌落数/0时的存活菌落数×100%。检测AT-7抗S. mutans ATCC25175的杀菌-时效实验,同时增加洗必泰和红霉素作为阳性药物,步骤同前。
1.2.6 耐药性诱导实验按照Habets和Brockhurst的方法[15],检测了AT- 7、洗必泰和红霉素对S. mutans ATCC25175的耐药性诱导能力。第1代进行的耐药性诱导实验过程同MICs的实验过程,其中0.5 × MICs中的S. mutans ATCC25175被调整至1 × 106 CFU/mL后继续和药物培养24~48 h,得出第2代的MICs。以此类推,重复至第10代为止。每组设立3个复孔,并将其中的最大值(MICs)作为每一代的最终结果。
1.2.7 统计学方法每个实验均至少设立3个复孔,以及各组计量资料均以均数±标准差的形式表示(除非特殊说明)。利用Graphpad Prism 7.0软件通过单因素方差分析的方法进行统计学分析,检验水准α=0.05,P < 0.05代表具有统计学差异。
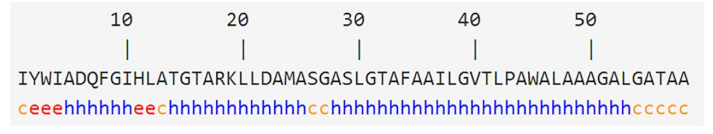
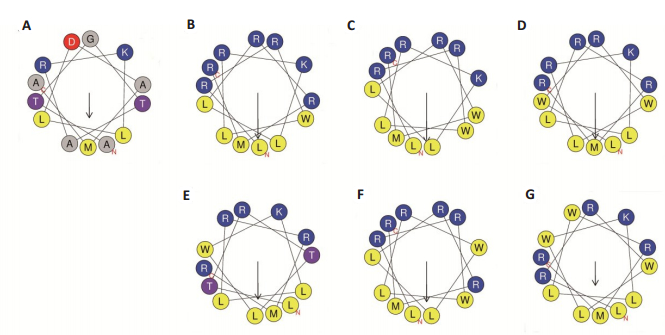
2 结果 2.1 AT-1及其衍生肽的分子设计和理化性质环状细菌素reuterin 6和/或gassericin A中存在着三段α-螺旋结构区域,即h区域,其间由无序的卷尾结构(c区域)连接成环(图 1)。选取含有数量最多的带电性氨基酸的α-螺旋结构区域作为改造的母肽,即AT-1,以及通过氨基酸的替换方式得到了一系列AT-1的衍生肽。AT-1及其衍生肽在螺旋轮上的氨基酸分布情况如图 2所示。AT-2、AT-3和AT-4上的极性面和非极性面分别处于两侧,表明了它们具有完美的两亲性。而AT-5、AT-6和AT-7的极性面均被单个或成对色氨酸的替换介入而破坏了两亲性。
|
图 1 环状细菌素reuterin 6和/或gassericinA的结构域 Fig.1 Structural domain of circular bacteriocins reutericin 6 and/or gassericin A. h: Alpha helix; c: Random coil; e: Extended strand. |
|
图 2 AT-1及其衍生肽的螺旋图 Fig.2 Helical wheel of AT-1 and its derivatives. A: AT-1; B: AT-2; C: AT-3; D: AT-4; E: AT-5; F: AT-6; G: AT-7. The hydrophilic residues are highlighted in blue and the hydrophobic residues in yellow. |
相比于抗菌活性非常低的AT-1,衍生肽的抗S. mutans ATCC25175活性比它高5.3到46倍(表 1)。疏水性越高,抗菌肽的抗菌活性越强。AT-7具有最高的疏水性和最好的抗菌活性。有趣的是,尽管AT-3和AT- 4具有相同的净电荷数和疏水性数值,但AT-3在HPLC上的保留时间大于AT-4的保留时间,即AT-3的实际疏水性比AT-4的高,所以AT-3的抗菌活性更高。
2.3 具有抗菌活性的AT-1衍生肽的理化性质与细胞毒性的关系药物对细胞的选择性是检验它们是否适合应用于临床治疗的关键所在。我们检测了具有抗菌活性的AT-1衍生肽处理48 h后对HPDFs产生的毒性作用。AT-1衍生肽产生的细胞毒性结果与理论结果一致,即随着抗菌肽的疏水性增加,产生的细胞毒性便越大,而不完美两亲性抗菌肽AT-5、AT-6和AT-7的细胞毒性普遍较低(表 2)。
| 表 2 AT-1及其衍生肽作用于HPDFs的细胞毒性 Tab.2 Cytotoxicity ofAT-7 towards HPDFs |
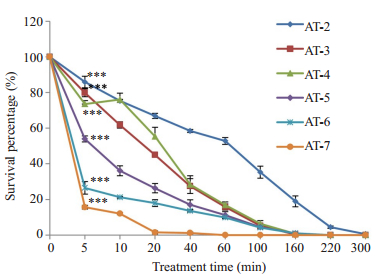
AT-1衍生肽的杀菌效应具有时间依赖性,以及杀菌速率与疏水性之间存在着正比关系。不完美两亲性的结构亦能进一步提高抗菌肽的杀菌速率,不完美两亲性AT-7具有最高的抗S. mutans速率(图 3;5 s时,AT-7相比于阴性对照组,P=0.0001)。
|
图 3 AT-1衍生肽作用于S. mutans ATCC25175的杀菌动力学 Fig.3 Bactericidal kinetics of the derivatives of AT-1 in S. mutans ATCC25175. ***P < 0.001 compared to untreated control. |
鉴于AT-7具有较高的抗菌活性、较快的抗菌速率和较好的生物相容性,我们选择AT-7作为抗S. mutans的目标抗菌肽。
AT-7对多数口腔致病菌均具有良好的抗菌活性,包括口腔粘膜相关致病菌S. mutans、难治性根尖周炎相关致病菌E. faecalis,牙周病相关致病菌A. viscosus、P. gingivalis和F. nucleatum。除了E. faecalis对AT-7不敏感外,AT-7抗其他口腔致病菌的MICs均是6.25 μg/mL(表 3)。
| 表 3 AT-7抗口腔致病菌的活性 Tab.3 Antimicrobial activity ofAT-7 against common oral pathogens |
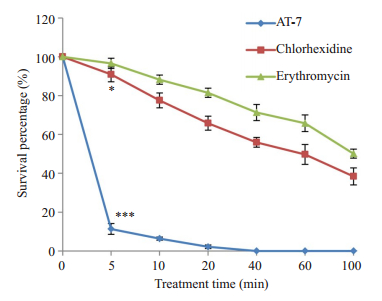
AT-7对S. mutans ATCC25175的杀菌能力具有时间依赖性。在5 min的作用时间内,AT-7便能够抑制88.7%的S. mutans ATCC25175的活性,而洗必泰和红霉素在同样的条件处理下仅抑制不足10%的S. mutans ATCC25175的活性(图 4;5 s时,AT-7相比于阴性对照组,P=0.0001)。
|
图 4 AT-7、洗必泰和红霉素作用于S. mutans ATCC25175的杀菌动力学 Fig.4 Bactericidal kinetics of AT-7, chlorhexidine and erythromycin in S. mutans ATCC25175. *P < 0.05, ***P < 0.001 vs untreated control. |
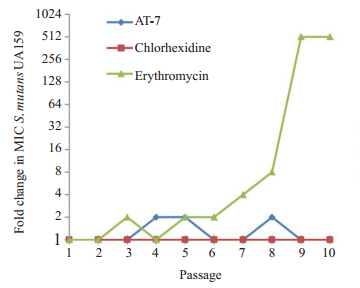
经过连续10代的耐药性诱导,仍不能产生对AT-7有耐药性的S. mutans ATCC25175,比如AT-7对第一代和第十代的S. mutans ATCC25175有着一致的MICs。然而,红霉素经过同样的连续10代处理后,产生了耐药性提高了512倍的S. mutans ATCC25175(图 5)。因此,若适当控制AT-7的使用,将不会引起S. mutans发生耐药。
|
图 5 AT- 7、洗必泰和红霉素连续10代内的诱导耐药性S. mutans ATCC25175产生的情况 Fig.5 Evaluation of resistance to AT-7, chlorhexidine and erythromycin in S. mutans ATCC25175 induced for 10 serial passages. The results are presented as fold changes in MIC of every passage relative to that of the first passage. |
乳酸杆菌占口腔微环境中菌群种类的1%,它们的存在与良好的口腔健康有着密切关系[16]。乳酸杆菌产生的代谢产物reuterin 6和gassericin A均可有效抑制S. mutans的生长、繁殖和生物膜形成[17-19],已有临床研究证实它们的临床运用可降低菌斑指数[16],提示reuterin 6和gassericin A与S. mutans之间存在着拮抗关系。reuterin 6和gassericin A是由同一氨基酸序列(58个氨基酸)组成、但空间结构不尽相同的环状细菌素[20]。鉴于它们的提取和合成的工序复杂、消耗巨大,本研究运用了两亲性正电性α-螺旋结构抗菌肽的设计理念对reuterin 6和/或gassericin A进行改造,以降低它们的合成消耗,同时又可以保持其防龋优势。
鉴于精氨酸和色氨酸的特殊性质[21-22],本研究更倾向于使用精氨酸替换抗菌肽的极性面上的非带正电氨基酸,以及使用赖氨酸和色氨酸替换非极性面上带电性氨基酸和弱疏水性氨基酸。精氨酸的胍基侧链能够与菌膜上脂质头部的磷酸基团形成双氢键,还可以和芳香残基之间发生静电性阳离子-π作用,从而促进了抗菌肽结合并插入细菌细胞膜[21]。同时,色氨酸亦能够通过锚定的方式增加抗菌肽与菌膜之间的结合力[22]。另外,我们构建的AT-1衍生肽带有5~7个净正电荷,也符合α-螺旋结构型抗菌肽的设计原则。带有4至6个净正电荷是最优的选择;超过6个净正电荷时,抗菌活性提升不明显,甚至可能会因同名电荷相互排斥而导致活性降低的情况出现[23]。因此,AT-1衍生肽具有严格的理论可行性,而实际的抗菌活性结果也进一步证明了此结论。
疏水性与抗菌活性之间具有明显的正比相关。本研究表明,AT-1衍生肽的疏水性越高,抗S. mutans活性则越强,该结论与Wang等人的研究结论一致[24]。这是由于α-螺旋型抗菌肽主要是通过静电作用与带负电的细菌细胞质膜磷脂分子相互吸引,然后通过非极性面的疏水作用在质膜上形成孔洞,继而引起胞内物质渗出,导致细菌死亡[25]。其中,疏水性决定了抗菌肽破裂菌膜的能力[25]。然而,当抗菌肽的疏水性超过特定的阈值时,随着疏水性的增加,它们的抗菌活性反而会降低,这是因为高疏水性的抗菌肽在水溶液中容易发生二聚化,而这种结构“妨碍”了抗菌肽与菌膜之间的作用[26]。因此,合理提高抗菌肽的疏水性是成功设计出高活性抗菌肽的关键。
人体或动物体内共生菌所产生的物质,经过长期的遗传、环境选择,对人体或动物无明显的毒副作用[16]。也就是说,天然抗菌肽reuterin 6和gassericin A具备良好的生物相容性。然而,经过一系列的改造,人工合成的抗菌肽的毒性往往会增加[8, 26],AT-1衍生肽具有比AT-1更高的细胞毒性。同时,细胞毒性与抗菌肽的疏水性之间同样也存在着正比的关系,即疏水性越高,抗菌肽的细胞毒性越大。这是由于抗菌肽的疏水性不仅赋予了抗菌肽以插入原核细胞的细胞膜的能力,也提高了它们破坏真核细胞的细胞膜的能力[26]。同样地,两亲性促进了抗菌肽的细胞毒性的形成,因为真核细胞的细胞膜本身并不带电,而抗菌肽与它们之间发生的结合作用只能够依靠两亲性发挥作用[27]。因此,破坏抗菌肽的两亲性便可以破坏这种结合作用,后续的插入细胞膜过程亦会因此而减少[27]。比如本研究构建的不完美两亲性抗菌肽AT-7具有最低的细胞毒性,但它的抗菌活性仍然保持较高的水平。
另外,我们还发现疏水性可能是影响抗菌肽杀菌速率的重要因素之一,但目前仍未见报道。抗菌速率与疏水性之间可能存在着正比关系,即在阈值内,疏水性越高,AT-1衍生肽的抗菌速率越高。这说明疏水性不仅能够增加抗菌肽破裂菌膜的能力,还进一步提高抗菌肽插入菌膜、形成孔洞的速率。值得注意的是,不完美两亲性的结构可能也是影响抗菌肽杀菌速率的重要因素之一,而且提升程度更高。不完美两亲性抗菌肽AT-7的杀菌速率明显比其他衍生肽更高。不完美两亲性抗菌肽的结构是通过破坏极性面而形成的,这也在一定程度上减缓了极性面上同性相斥的负面影响,因此我们推测这种结构能够增加抗菌肽的有效正电性,继而增强了抗菌肽与菌膜之间依靠静电作用而结合的能力。
考虑到生物相容性和实际临床应用的效果,我们选择了抗菌活性较好、细胞毒性较低和杀菌速率较高的AT-7作为我们的目标抗菌肽。同时我们也发现AT-7能够抑制多数口腔致病菌的活性,并具有十分显著的抗S. mutans速率和不易发展出耐药菌株的特性。这些均表明AT-7在抗菌功能上有可能取代常用漱口水(洗必泰、甲硝唑),具有被开发为用于口腔细菌感染性疾病的预防和治疗的潜力。
本研究中,我们构建了一系列AT-1衍生肽和进一步验证了两亲性正电性α-螺旋结构抗菌肽的设计原则的合理性,并发现了疏水性和破坏两亲性的两种设计方式均能提高抗菌肽的杀菌速率;筛选出低毒、高活性、快速的新型抗菌肽AT-7,有望成为防治龋病以及防治口腔细菌感染性疾病的肽类药物。
| [1] |
冯希平.中国居民口腔健康状况--第四次中国口腔健康流行病调查报告.第十八次口腔预防医学学术年会论文汇编, 2018. 10. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-HZKQ201810001004.htm
|
| [2] |
Koo H, Falsetta ML, Klein MI. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm[J]. J Dent Res, 2013, 92(12): 1065-73. DOI:10.1177/0022034513504218 |
| [3] |
Cugini C, Shanmugam M, Landge N, et al. The role of exopolysaccharides in oral biofilms[J]. J Dent Res, 2019, 22(4): 22034519845001. |
| [4] |
Chen LL, Chakraborty B, Zou J, et al. Amino sugars modify antagonistic interactions between commensal oral streptococci and streptococcus mutans[J]. Appl Environ Microbiol, 2019, 85(10): e00319-70. |
| [5] |
Guo LH, Mclean JS, Yang Y, et al. Precision-guided antimicrobial peptide as a targeted modulator of human microbial ecology[J]. Proc Natl Acad Sci USA, 2015, 112(24): 7569-74. DOI:10.1073/pnas.1506207112 |
| [6] |
Charugundla BR, Anjum S, Mocherla M. Comparative effect of fluoride, essential oil and chlorhexidine mouth rinses on dental plaque and gingivitis in patients with and without dental caries: a randomized controlled trial[J]. Int J Dent Hyg, 2015, 13(2): 104-9. DOI:10.1111/idh.2015.13.issue-2 |
| [7] |
Tonk M, Vilcinskas A. The medical potential of antimicrobial peptides from insects[J]. Curr Top Med Chem, 2017, 17(5): 554-75. |
| [8] |
Khurshid Z, Najeeb S, Mali M, et al. Histatin peptides: Pharmacological functions and their applications in dentistry[J]. Saudi Pharm J, 2017, 25(1): 25-31. DOI:10.1016/j.jsps.2016.04.027 |
| [9] |
Kreling PF, Aida KL, Massunari L, et al. Cytotoxicity and the effect of cationic peptide fragments against cariogenic bacteria under planktonic and biofilm conditions[J]. Biofouling, 2016, 32(9): 995-1006. DOI:10.1080/08927014.2016.1218850 |
| [10] |
Arora A, Smajhi S, Mishra A. Antibacterial properties of human beta defensin-3 derivative: CHRG01[J]. J Biosci, 2018, 43(4): 707-15. DOI:10.1007/s12038-018-9790-1 |
| [11] |
Tong ZC, Ni LX, Ling JQ. Antibacterial peptide nisin: A potential role in the inhibition of oral pathogenic bacteria[J]. Peptides, 2014, 60(10): 32-40. |
| [12] |
Zhang MJ, Wei W, Sun YM, et al. Pleurocidin congeners demonstrate activity against Streptococcus and low toxicity on gingival fibroblasts[J]. Arch Oral Biol, 2016, 70(10): 79-87. |
| [13] |
Wikler M. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard[J]. CLSI, 2012, 29(2): MA8-07. |
| [14] |
Ersoy SC, Abdelhady W, Li L, et al. Bicarbonate resensitization of methicillin-resistant staphylococcus aureus to beta-lactam antibiotics[J]. Antimicrob Agents Ch, 2019. DOI:10.1128/aac.00496-19 |
| [15] |
Habets MG, Brockhurst MA. Therapeutic antimicrobial peptides May compromise natural immunity[J]. Biol Lett, 2012, 8(3): 416-8. DOI:10.1098/rsbl.2011.1203 |
| [16] |
Caufield PW, Schoen CN, Saraithong P, et al. Oral lactobacilli and dental caries: a model for niche adaptation in humans[J]. J Dent Res, 2015, 94(9, 2): 110S-8S. |
| [17] |
Kang MS, Oh JS, Lee HC, et al. Inhibitory effect of lactobacillus reuteri on periodontopathic and cariogenic bacteria[J]. J Microbiol, 2011, 49(2): 193-9. DOI:10.1007/s12275-011-0252-9 |
| [18] |
Wen ZT, Liao SM, Bitoun JP, et al. Streptococcus mutans displays altered stress responses while enhancing biofilm formation by lactobacillus casei in mixed-species consortium[J]. Front Cell Infect Microbiol, 2017, 7(12): 524. |
| [19] |
Pandey N, Malik RK, Kaushik JK, et al. Gassericin a: a circular bacteriocin produced by lactic acid bacteria lactobacillus gasseri[J]. World J Microbiol Biotechnol, 2013, 29(11): 1977-87. DOI:10.1007/s11274-013-1368-3 |
| [20] |
Gabrielsen C, Brede DA, Nes IF, et al. Circular bacteriocins: biosynthesis and mode of action[J]. Appl Environ Microbiol, 2014, 80(22): 6854-62. DOI:10.1128/AEM.02284-14 |
| [21] |
Torcato IM, Huang YH, Franquelim HG, et al. Design and characterization of novel antimicrobial peptides, R-BP100 and RW-BP100, with activity against gram-negative and gram-positive bacteria[J]. BBActa-Biomembranes, 2013, 1828(3): 944-55. DOI:10.1016/j.bbamem.2012.12.002 |
| [22] |
Bi XN, Wang C, Dong WB, et al. Antimicrobial properties and interaction of two Trp-substituted cationic antimicrobial peptides with a lipid bilayer[J]. JAntibiot, 2014, 67(5): 361-8. |
| [23] |
Gagnon MC, Strandberg E, Grau-Campistany A, et al. Influence of the length and charge on the activity of alpha-helical amphipathic antimicrobial peptides[J]. Biochemistry, 2017, 56(11): 1680-95. DOI:10.1021/acs.biochem.6b01071 |
| [24] |
Wang YL, Truex NL, Vo ND, et al. Effects of charge and hydrophobicity on the oligomerization of peptides derived from IAPP[J]. Bioorg Med Chem, 2018, 26(6): 1151-6. DOI:10.1016/j.bmc.2017.10.001 |
| [25] |
Yang ZY, He SQ, Wang JJ, et al. Rational design of short peptide variants by using Kunitzin- RE, an Amphibian-derived bioactivity peptide, for acquired potent broad-spectrum antimicrobial and improved therapeutic potential of commensalism coinfection of pathogens[J]. J Med Chem, 2019, 62(9): 4586-605. DOI:10.1021/acs.jmedchem.9b00149 |
| [26] |
Khara JS, Lim FK, Wang Y, et al. Designing alpha-helical peptides with enhanced synergism and selectivity against Mycobacterium smegmatis: Discerning the role of hydrophobicity and helicity[J]. Acta Biomater, 2015, 28(12): 99-108. |
| [27] |
Zhu X, Dong N, Wang ZY, et al. Design of imperfectly amphipathic alpha-helical antimicrobial peptides with enhanced cell selectivity[J]. Acta Biomater, 2014, 10(1): 244-57. |
 2019, Vol. 39
2019, Vol. 39

