在大鼠胎儿肺发育过程中,维生素D(VD)对肺成熟起着重要的调节作用,其活性形式即1α, 25(OH)2D3,是肺成熟的一个旁分泌因子[1]。VD受体在气道平滑肌细胞中表达,它的激活抑制平滑肌细胞的增生[2]。VD增加肺泡上皮-间质分化的物质的表达,增加LIF和肺泡Ⅱ型细胞增殖,增加肺泡数目及肺泡间隔的厚度[3]。研究显示,VD可通过调控多种免疫细胞,改变细胞因子如白细胞介素-1和干扰素-γ的分泌,影响免疫应答,从而改善炎症诱发支气管肺发育不良(BPD)模型的肺泡发育[4]。更重要的是,VD可作为肺成熟的一个旁分泌因子,增加肺泡上皮-间质分化物质的表达,增加肺泡Ⅱ型细胞增殖,上调肺泡表面活性物质合成,促进血管内皮细胞增生,促进肺泡化进程[5]。
本研究应用VD对高氧诱导的新生鼠BPD动物模型的肺终末呼吸单位损伤程度、VEGF基因表达水平、肺组织微血管形式、肺组织炎性因子和前炎性因子水平、肺组织细胞凋亡和增生等方面的影响,研究VD对BPD的保护作用,探讨VD治疗BPD的效果和可行性。经检索目前国内外尚未见相关报道。
1 材料和方法 1.1 研究对象本研究应用刚出生尚未断奶无特定病原体级Wistar幼鼠36只,体质量8~20 g,母鼠由南方医科大学动物实验中心提供,动物生产许可证号:SCXK粤2015-0041。应用高氧诱导的BPD新生小鼠模型[6],具体操作:将36只新生鼠置于封闭氧箱中,持续输入氧气,测氧仪监测维持FiO2为0.60,CO2浓度 < 0.5%(用碱石灰吸收CO2),温度23~26 ℃,湿度50.0%~60.0%,每日09:00开箱1 h,添加水、饲料、更换垫料,建立高氧诱导BPD新生小鼠模型。出生后立即给予实验处理,无菌手术在珠江医院中心实验室进行。依据不同处理随机分为4组,每组新生鼠均为9只:有2组新生鼠出生后即置于室内空气环境,其中空气+VD组每天肌肉注射VD(参照文献[7]实验剂量),空气+生理盐水组每天肌肉注射生理盐水;另外2组新生鼠出生后置于高氧环境,其中高氧+VD组每天肌肉注射VD(剂量同A组),高氧+生理盐水组每天肌注生理盐水。
1.2 研究方法 1.2.1 标本采集上述处理3周后,将各组实验鼠称重后处死,同时抽取心室内血液,采用ELISA方法测定血清VD水平。
1.2.2 肺组织形态学观察分离肺组织病理切片制作和组织细胞形态学检查取不同处理组小鼠的肺组织,4%甲醛溶液固定后,制作石蜡切片,HE染色,光镜下观察并分析肺终末呼吸单位的组织形态。
1.2.3 肺终末呼吸单位损伤参数观测用图像分析软件对辐射状肺泡计数(RAC)、肺泡次级间隔体积密度,比较不同处理组的肺终末呼吸单位损伤参数。
1.2.4 血管内皮生长因子(VEGF)、VEGF受体2(VEGFR2)mRNA水平检测设计并合成针对VEGF基因、VEGF-R2基因的引物,提取不同处理组小鼠肺的总mRNA,逆转录合成cDNA第一链,采用real time RTPCR方法分别检测VEGF mRNA和VEGF-R2 mRNA水平。
1.2.5 肺组织VEGF和VEGF-R2水平测定购买抗小鼠VEGF和VEGF-R2抗体。取不同处理组实验小鼠的肺组织,提取总蛋白,采用经典的Western blot方法检测VEGF和VEGF-R2水平。
1.3 统计学分析采用SPSS 17.0软件进行统计学处理,计量资料采用以均数±标准差表示,两组比较采用配对样本t检验,P < 0.05为差异有统计学意义。
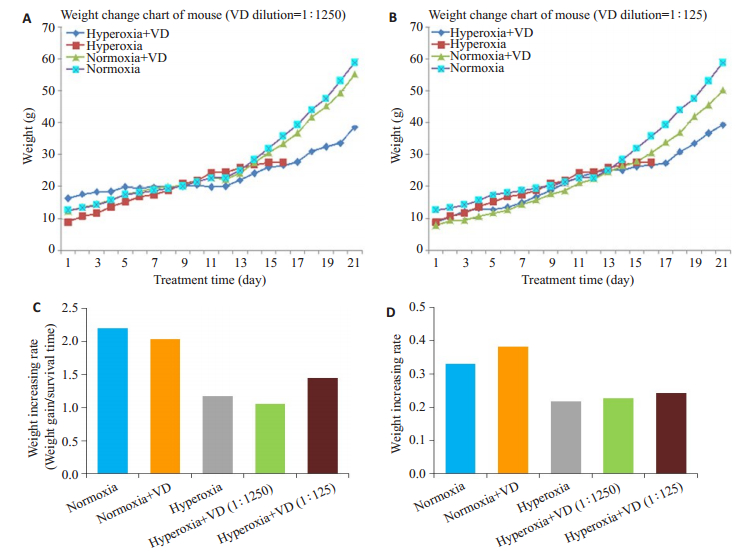
2 结果 2.1 小鼠体质量及肺部组织重量变化高氧+VD(1250倍)组和高氧+VD(125倍)组的小鼠存活率(存活21 d)高于高氧+生理盐水组(存活16 d)(图 1A、B)。空气+生理盐水组和空气+VD组的体质量增长速率大于高氧+生理盐水组(图 1C);高氧+VD(125倍)组的体质量增长速率高于高氧+生理盐水组。空气+生理盐水组和空气+VD组的肺组织重量大于高氧+生理盐水组(图 1D);高氧+VD(1250倍)组和高氧+VD(125倍)组的肺组织重量与高氧+生理盐水组相比,呈明显的上升趋势。
|
图 1 不同处理小鼠体质量及肺组织质量变化 Fig.1 Changes in body weight and lung tissue weight of the mice with different treatments. A: Weight changes of mice in 1: 1250 VD dilution group; B: Weight changes of the mice in 1: 125 VD dilution group; C: Weight gain rate of the mice; D: Lung tissue weight changes of mice. |
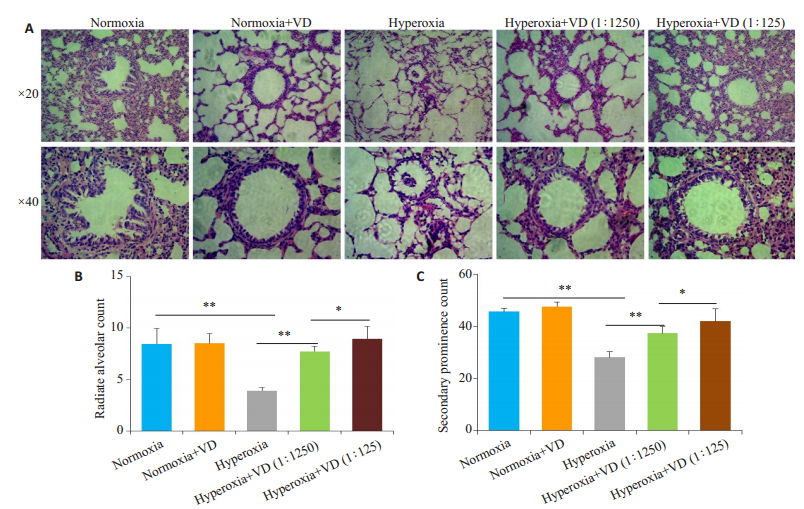
空气+VD组肺组织形态结构完整,支气管杯状上皮细胞无明显脱落及增生,肺泡间壁无明显增厚(图 2)。而高氧+生理盐水组的肺泡呈不规则结构,部分肺泡融合,整体数量减少,肺泡间隔明显变薄,支气管上皮细胞杯状增生。高氧+VD(1250倍)组肺组织受损情况较高氧+生理盐水组显著减轻,肺泡结构完整,支气管杯状上皮细胞无明显脱落及增生,肺泡间隔厚薄较均匀;高氧+VD(125倍)组肺组织形态结构完整,支气管杯状上皮细胞无明显脱落及增生,肺泡间壁无明显增厚。
|
图 2 不同处理小鼠肺组织病理观察及计数 Fig.2 Pathological observation of lung tissue of the mice with different treatments. A: HE staining; B: Radiation alveolar count; C: Secondary prominence count; *P < 0.01, **P < 0.001. |
空气+生理盐水组与空气+VD组的RAC差异无统计学意义(P>0.05,图 2B);与空气+生理盐水组相比,高氧+生理盐水组的RAC明显降低(P < 0.001);与高氧+生理盐水组相比,高氧+VD(1250倍)组的RAC升高(P < 0.001),且当稀释倍数降低,高氧+VD(125倍)组的RAC比高氧+VD(1250倍)组显著升高(P < 0.01)。
2.4 次级突起计数空气+生理盐水组与空气+VD组的次级突起计数差异无统计学意义(P>0.05,图 2C);与空气+生理盐水组相比,高氧+生理盐水组的次级突起明显降低(P < 0.001);与高氧+生理盐水组相比,高氧+VD(1250倍)组的次级突起计数显著升高(P < 0.001),且当稀释倍数降低,高氧+VD(125倍)组的次级突起比高氧+VD(1250倍)组显著升高(P < 0.01)。
2.5 各组肺组织凋亡的变化DAPI组只有少量阳染着色,FITC及Overlay各组别课件大量阳染细胞核,核基本均匀着色(图 3)。
|
图 3 不同组别小鼠肺组织凋亡情况(TUNEL染色) Fig.3 Cell apoptosis in the lung tissue of the mice (TUNEL staining). |
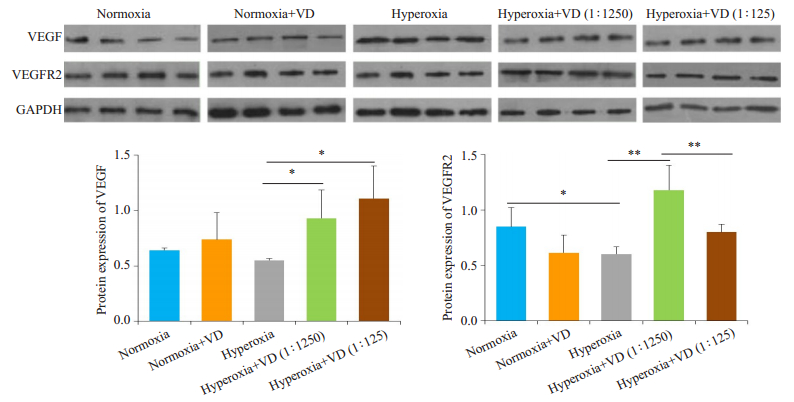
高氧+生理盐水组的VEGF表达量低于空气+生理盐水组和空气+VD组,高氧+VD(1250倍)组和高氧+VD(125倍)组的VEGF表达量高于高氧+生理盐水组(P < 0.05,图 4)。
|
图 4 VEGF与VEGFR2在不同组别小鼠中的蛋白表达量 Fig.4 Protein expressions of VEGF and VEGFR2 in the lungs of the mice in different groups. *P < 0.01, **P < 0.001. |
高氧+生理盐水组的VEGFR2表达量低于空气+生理盐水组(P < 0.05),空气+VD组的VEGFR2表达量与低于空气+生理盐水组(P < 0.05);高氧+VD(1250倍)组的VEGFR2表达量高于高氧+生理盐水组(P < 0.001)和高氧+VD(125倍)组(P < 0.001),高氧+VD(125倍)组的表达量也高于高氧+生理盐水组(P < 0.05)。但高氧+VD(1250倍)组的VEGFR2表达量高于高氧+生理盐水组(P < 0.001),与HE染色、辐射状肺泡计数以及次级突起计数的趋势相反。
3 讨论BPD的发病机制复杂,涉及多种因素的相互作用,与肺泡发育停滞密切相关,肺泡化依赖于循环糖皮质激素、视黄体和VD [8]。有研究证明孕母和新生儿维生素25-OHD水平与早产儿的BPD发育有关[9]。低水平的血清25-OHD与在大多数VLBWI中增加的RDS和BPD的严重程度有关[10],在有间质性肺病的患者中,VD缺乏的发生率很高,并且与肺功能的减少有关[11]。研究发现VD治疗提高了大鼠在体内的内毒素暴露后的存活率和婴儿肺结构的变化[12],有试验证明VD似乎可以保护新生大鼠的超氧诱导肺损伤[13],提示VD可能在BPD的发病、修复机制中起重要作用。本研究发现排除外界环境因素,VD组的小鼠生存率高于生理盐水组,这可以推断VD通过促进肺成熟及下调肺炎症反应,从而对BPD起保护作用。有研究提出VD缺乏会导致肺功能缺损,这主要由肺容积的差异引起的,肺大小的差异可能足以解释改变的肺功能和呼吸系统疾病的流行程度[14]。本研究中空气组肺组织重量、体积等各方面发育明显优于高氧组,可推断高氧对肺造成一定的损伤并抑制其发育;肺组织重量与高氧+生理盐水组相比,呈明显的上升趋势;同时,空气组小鼠的体质量增长幅度明显大于高氧组,显然肺损伤会影响小鼠整体的生长发育;VD组小鼠的体质量增长亦高于生理盐水组,VD组肺组织重量、体积等明显优于生理盐水组,提示BPD状态下增加VD可增加肺组织重量,为肺成熟提供物质基础。
任何VD干预的关键问题是用量。有研究对39例早产儿的随机临床试验发现,在出生后3月里,每天服用200国际单位的VD组与960国际单位的VD组相比,高剂量组对辅助通气需求减少[15]。血清25-OHD是VD的最佳指标,但目前没有共识指南推荐可用的最佳血清25-OHD水平[16]。当前美国儿科学会指南建议所有儿童每天摄入400国际单位的VD,但没有针对早产儿的具体指导方针。儿童内分泌学会建议所有年龄段的儿童血清25-OHD水平>20 ng/mL。在这些极早产的婴儿中,脐带血、校正胎龄36周的25-OHD均水平与BPD的发展不相关。值得注意的是,给予目前的补充水平上,所有的早产儿已经达到了25(OH)D>30 ng/mL,等同于成人和儿童人群足量[17]。目前对VD添加的剂量、途径及频次、VD结合蛋白仍处于动物实验及临床试验阶段,有学者认为有一个肺泡VD旁分泌系统[18],上述各因素对患儿预后影响仍存在争议。一项荟萃分析指出:在早产儿中,每天补充VD的剂量为800~1000国际单位,与400 U相比,不仅在发育过程中,而且在免疫功能方面也更好[19-20]。本研究发现VD125倍和VD1250倍的对比,小鼠的平均体质量呈增长趋势,但125倍的增长率明显大于VD1250倍。有研究提出VD对肺泡型Ⅱ细胞、成纤维细胞增殖、表面活性物质合成和肺泡化有显著的积极作用[5],另有研究发现1-25(OH)2D3加速了胎儿鼠型Ⅱ型肺细胞的生理成熟,并可能是正常肺功能在出生时发病的关键因素[7]。有学者证明了VD能刺激人类Ⅱ型肺泡上皮细胞产生和分泌肺表面活性剂的中相关的磷脂[5]。本研究中高氧+VD(125倍)或+VD(1250倍),其RAC、次级突起计数均高于高氧+生理盐水组,可推断高浓度VD更有助于对肺的保护作用。导致与BPD相关的肺部疾病的另一个主要因素是肺血管的生长和过度的肺血管重建[21]。有研究指出在既定的时间点上,与其应用经典或持续肺泡化机制,不如看作健康的肺泡微血管系统具有很高的适应能力和满足任何需要。更重要的是,健康的肺在整个生命周期中具有适应、纠正和重建其结构的能力。然而,病变的肺,如纤维化和肺气肿的肺失去了这种能力。下一步的挑战将是研究为什么病变的肺会失去它,以及如何纠正它[22]。有研究发现VD治疗在实验绒毛膜羊膜炎中保持胎盘功能,这些影响可能是由血管生长的增加所调节的。高氧+VD(1250倍)组和高氧+VD(125倍)组的VEGF表达量显著高于高氧+生理盐水组,提示VD可提高VEGF的表达量,且随着浓度的升高,VEGF表达量也升高。在早期出生时间点上蛋白质表达的差异表明VD缺乏可能会导致在以后的生命中通过受损的肺表面活性剂的产生和抗氧化应激能力以及增强的胶原蛋白合成而导致肺结构和功能的改变[23]。
研究指出VD是决定5岁以下儿童患肺炎风险的重要营养因素,补充VD对肺炎负担有积极影响[24]。另外有大量的证据表明VD在宿主对不同感染的反应过程密切相关,组织特异性合成VD的活性形式1-25(OH) 2D3可能与先天的和适应性免疫系统功能相关,减少感染几率,有助于体质量增长[18],早期和持续的VD治疗可以在由产前接触内毒素引起的支气管肺发育不良模型实验中提高存活率并保持肺的生长,提示对肺发育有一定的间接保护及促进作用[15]。
随着新生儿医学的进步,对BPD的认识逐步深化,概念不断发生变化,如何改善BPD肺生长、成熟的主要问题仍然是研究热点,近年研究使用动物模型对BPD的发病机制、影响因素的新见解,试图为新的临床试验提供新的治疗策略[25-27]。本研究的不足之处:各组小鼠的基础体质量有一定差异;小鼠与母鼠生活环境的好坏对其生长发育也有一定的影响;氧浓度的调试也是关键因素;高氧对母鼠同样也有影响,从而影响了小鼠的营养状态。
| [1] |
Lykkedegn S, Sorensen GL, Beck-Nielsen SS, et al. Vitamin D depletion in pregnancy decreases survival time, Oxygen saturation, lung weight and body weight in preterm rat offspring[J]. PLoS One, 2016, 86(1): 102-13. |
| [2] |
Halayko AJ, Tran T, Gosens R. Phenotype and functional plasticity of airway smooth muscle: role of caveolae and caveolins[J]. Proc Am Thorac Soc, 2008, 5(1): 80-8. DOI:10.1513/pats.200705-057VS |
| [3] |
Sakurai R, Shin E, Fonseca S, et al. 1 alpha, 25(OH)(2)D-3 and its 3-epimer promote rat lung alveolar epithelial-mesenchymal interactions and inhibit lipofibroblast apoptosis[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(3): L496-505. DOI:10.1152/ajplung.90539.2008 |
| [4] |
Liu CB, Chen Z, Li W, et al. Vitamin D enhances alveolar development in antenatal lipopolysaccharide-treated rats through the suppression of interferon-gamma production[J]. Front Immunol, 2018, 8(12): 1923-35. |
| [5] |
Lykkedegn S, Sorensen GL, Beck-Nielsen SS, et al. The impact of vitamin D on fetal and neonatal lung maturation. a systematic review[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308(7): L587-602. DOI:10.1152/ajplung.00117.2014 |
| [6] |
黄铃沂, 段江, 封志纯. 支气管肺发育不良小鼠模型的建立[J]. 中国实验动物学报, 2009, 17(3): 186-8, 247. DOI:10.3969/j.issn.1005-4847.2009.03.006 |
| [7] |
Nadeau K, Montermini L, Mandeville I, et al. Modulation of Lgl1 by steroid, retinoic acid, and vitamin D models complex transcriptional regulation during alveolarization[J]. Pediatr Res, 2010, 67(4): 375-81. DOI:10.1203/PDR.0b013e3181d23656 |
| [8] |
Saadoon A, Ambalavanan N, Zinn K, et al. Effect of prenatal versus postnatal vitamin D deficiency on pulmonary structure and function in mice[J]. Am J Respir Cell Mol Biol, 2017, 56(3): 383-92. DOI:10.1165/rcmb.2014-0482OC |
| [9] |
Cetinkaya M, Cekmez F, Erener-Ercan T, et al. Maternal/neonatal vitamin D deficiency: a risk factor for bronchopulmonary dysplasia in preterms[J]. J Perinatol, 2015, 35(10): 813-7. DOI:10.1038/jp.2015.88 |
| [10] |
Kazzi S, Karnati S, Puthuraya SA. Vitamin D deficiency and respiratory morbidity among African American very low birth weight infants[J]. Early Hum Dev, 2018, 119(1): 19-24. |
| [11] |
Hagaman JT, Panos RJ, Mccormack FX, et al. Vitamin D deficiency and reduced lung function in connective tissue-associated interstitial lung diseases[J]. Chest, 2011, 139(2): 353-60. DOI:10.1378/chest.10-0968 |
| [12] |
Mandell E, Seedorf G, Gien J, et al. Vitamin D treatment improves survival and infant lung structure after intra-amniotic endotoxin exposure in rats: potential role for the prevention of bronchopulmonary dysplasia[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(5): L420-8. DOI:10.1152/ajplung.00344.2013 |
| [13] |
Kose M, Bastug O, Sonmez MF, et al. Protective effect of vitamin D against hyperoxia-induced lung injury in newborn rats[J]. Pediatr Pulmonol, 2017, 52(1): 69-76. DOI:10.1002/ppul.v52.1 |
| [14] |
Zosky GR, Berry LJ, Elliot JG, et al. Vitamin D deficiency causes deficits in lung function and alters lung structure[J]. Am J Respir Crit Care Med, 2011, 183(10): 1336-43. DOI:10.1164/rccm.201010-1596OC |
| [15] |
Yang Y, Feng Y, Chen X, et al. Is there a potential Link between vitamin D and pulmonary morbidities in preterm infants[J]. J Chin Med Assoc, 2018, 81(5): 482-6. DOI:10.1016/j.jcma.2017.07.011 |
| [16] |
Konstantinopoulou S, Tapia IE. Vitamin D and the lung[J]. Paediatr Respir Rev, 2017, 24(1): 39-43. |
| [17] |
Joung KE, Burris HH, Van Marter LJ, et al. Vitamin D and bronchopulmonary dysplasia in preterm infants[J]. J Perinatol, 2016, 36(10): 878-82. DOI:10.1038/jp.2016.115 |
| [18] |
Bozzetto S, Carraro S, Giordano G, et al. Asthma, allergy and respiratory infections: the vitamin D hypothesis[J]. Allergy, 2012, 67(1): 10-7. |
| [19] |
Wagner CL, Hollis BW. The implications of vitamin D status during pregnancy on mother and her developing child[J]. Front Endocrinol(Lausanne), 2018, 9(4): 500-12. |
| [20] |
Yang Y, Li Z, Yan G, et al. Effect of different doses of vitamin D supplementation on preterm infants-an updated meta-analysis[J]. J Matern Fetal Neonatal Med, 2018, 31(22): 3065-74. DOI:10.1080/14767058.2017.1363731 |
| [21] |
Mandell E, Powers KN, Harral JW, et al. Intrauterine endotoxininduced impairs pulmonary vascular function and right ventricular performance in infant rats and improvement with early vitamin D therapy[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(12): L1438-46. DOI:10.1152/ajplung.00302.2015 |
| [22] |
Schittny JC. Development of the lung[J]. Cell Tissue Res, 2017, 367(3): 427-44. DOI:10.1007/s00441-016-2545-0 |
| [23] |
Chen L, Wilson R, Bennett E, et al. Identification of vitamin D sensitive pathways during lung development[J]. Respir Res, 2016, 193(2): 47-59. |
| [24] |
Karim T, Muhit M, Khandaker G. Interventions to prevent respiratory diseases-nutrition and the developing world[J]. Paediatr Respir Rev, 2017, 22(1): 31-7. |
| [25] |
Jobe AH. The new bronchopulmonary dysplasia[J]. Curr Opin Pediatr, 2011, 23(2): 167-72. DOI:10.1097/MOP.0b013e3283423e6b |
| [26] |
Vasiliou JE, Lui S, Walker SA, et al. Vitamin D deficiency induces Th2 skewing and eosinophilia in neonatal allergic airways disease[J]. Allergy, 2014, 69(10): 1380-9. DOI:10.1111/all.2014.69.issue-10 |
| [27] |
Reichetzeder C, Chen H, Foeller MA, et al. Maternal vitamin D deficiency and fetal programming-lessons learned from humans and mice[J]. Kidney Blood Press Res, 2014, 39(4): 315-29. DOI:10.1159/000355809 |
 2019, Vol. 39
2019, Vol. 39

