2. 遵义医药高等专科学校,贵州 遵义 563006;
3. 遵义医科大学附属医院肾病风湿科,贵州 遵义 563006
2. Zunyi Medical and Pharmaceutical College, Zunyi 563006, China;
3. Department of Nephrology, Affiliated Hospital of Zunyi Medical University, Zunyi 563006, China
环孢素A(CsA)是临床广泛推荐的抗移植后排异反应及肾脏免疫性疾病的一线用药,但由于长期使用而产生的慢性肾毒性又限制了其应用[1]。探讨长期使用CsA导致的慢性环孢素肾病的发病机制及防治策略成为现阶段的研究热点[2]。肾脏纤维化或肾小管间质纤维化不仅仅是慢性环孢素肾病的主要病理特征,亦是公认的各种慢性肾脏病进展至终末期肾病的共同和最终途径[3-5]。肾小管上皮细胞间充质转分化是导致肾脏纤维化发生的重要机制之一[4, 6]。参与肾脏纤维化的诸多因素中,TGF-β1长期以来被认为是肾小管上皮细胞间充质转分化的关键介质[7-8]。因此,探讨肾小管上皮细胞间充质转分化中TGF-β1信号网络,为多靶点干预肾脏纤维化相关疾病提供基础理论依据具有重要意义[9-10]。
本课题组前期慢性环孢素肾病动物模型研究发现肾脏存在转化生长因子-β1(TGF-β1)/Smads/整合素连接激酶(ILK)基因异常表达,并与肾小管间质纤维化相关[11]。成纤维细胞特异蛋白-1(FSP1)相较于α平滑肌肌动蛋白(α-SMA)和波形蛋白,具有更高的成纤维细胞特异性[12]。但是,TGF-β1/ILK/FSP1是否在环孢素诱导的肾小管间质纤维化进程中扮演重要作用,ILK是否诱导FSP1表达,促进肾小管上皮间充质转化尚不清楚。因此,本研究旨在通过体外特异阻断剂及基因沉默技术,探讨TGF-β1/ILK/FSP1通路在慢性环孢素肾病中肾小管上皮细胞间充质转分化中的作用。
1 材料和方法 1.1 材料大鼠肾小管上皮细胞株(NRK-52E)来源于中科院细胞库。DMEM-H培养基(Gibco),胎牛血清(HyClone),环孢素A、TGF-β1受体阻断剂SB431542(Sigma),RNAiso Reagent、反转录反应试剂、SYBR Master Mixture(大连宝生物公司),兔抗大鼠TGF-β1多克隆抗体(SC-1179R)(北京中杉金桥公司),兔抗大鼠ILK多克隆抗体、HRP标记山羊抗兔二抗(Santa Cruz),兔抗大鼠S100A4多克隆抗体(Proteintech),ELx800酶标仪(Bio-TEK),5% CO2的培养箱、NanoDrop 1000(Thermo Scientic),逆转录仪(C1000)、荧光定量PCR扩增仪(Bio Rad)。
1.2 方法 1.2.1 构建及鉴定ILK-RNAi慢病毒表达载体(ILKshRNA)根据大鼠ILK基因干扰靶点合成4条干扰序列,与phU6-MCS-CMV-EGFP连接产生ILKshRNA慢病毒载体,转入细菌感受态细胞。干扰序列引物及详细步骤见文献[13]。实时荧光定量PCR检测慢病毒载体感染大鼠NRK-52E细胞中ILKmRNA水平的表达。
1.2.2 细胞培养与分组细胞常规复苏后传代培养,选取2~4代细胞,当细胞长至70%~80%融合,用无血清培养基培养静止24 h进行同步化后再进行试验。将同步化后到细胞按照105/mL浓度接种入6孔板中,2 mL/孔。细胞增殖实验明确CsA作用NRK-52E的最佳剂量和最佳时间,即CsA1 mg/L,作用48 h。
将NRK-52E细胞培养分为5组:CsA处理组(CsA 1 mg/L);TGF-β1干预组:TGF-β1受体阻断剂SB431542 10 μmol/L预处理1 h后+CsA 1 mg/L;ILKshRNA干预组:转染阳性ILK shRNA 72 h(剂量MOI=20),联合添加CsA 1 mg/L;阴性对照组:转染阴性ILK shRNA 72 h(剂量MOI=20),联合添加CsA 1 mg/L;空白对照组。倒置相差显微镜下观察各组细胞形态。
1.2.3 实时荧光定量PCR依据RNAiso Reagent说明书提取制备总RNA,Nano-Drop 1000测定RNA的纯度及浓度。按照TaKaRa逆转录试剂盒说明书逆转录cDNA,反应体系为:5×Prime Script buffer 2 μL,Prime Script RT Enzyme Mix 10.5 μL,o1igo dT primer 0.5 μL,random 6-mers 0.5 μL,total RNA 6.5 μL。37 ℃逆转录15 min,85 ℃灭活逆转录酶5 s,模板cDNA 4 ℃保存。实时荧光定量PCR引物见表 1。总反应体系12 μL,包括:SYBR Master Mix(2×)5 μL、上游引物1.5 μL、下游引物1.5 μL、模板cDNAl μL和nuclease free water 3 μL。Taq酶活化95 ℃2 min,变性、退火和延伸分别为95 ℃ 15 s、60 ℃15 s和72 ℃1 min,40个循环。60 ℃~95 ℃检测溶解曲线。以Ct值为统计参数,按2-△△Ct法计算TGF-β1、ILK和FSP1mRNA的相对表达量。
| 表 1 实时荧光定量PCR引物对 Tab.1 Primer sequences for quantitative real-time PCR |
收集各组细胞按照细胞裂解液RIPA的说明书操作,提取总蛋白,BCA法蛋白定量后,SDS-聚丙烯酰胺凝胶电泳,电转运至PVDF膜,加入适量的封闭液,分别加入一抗(TGF-β 1:200;ILK 1:100;FSP-1:1 :800;GAPDH 1 :5000)、荧光标记二抗(1 :10 000)孵育,曝光、显影成像,以GAPDH作为内参,进行灰度分析。
1.2.5 细胞爬片免疫组化制作肾小管上皮细胞爬片,滴加4%多聚甲醛室温固定10 min,0.3%Triton-X100作用15~20 min。山羊血清封闭,按α-SMA一抗(1:100)、二抗(1:5000)孵育;DAB显色,苏木素染核,梯度酒精脱水,中性树胶封片,当即拍照,采用Image-Pro Plus软件进行图像分析。
1.3 统计学处理采用SPSS19.0进行统计学分析,计量资料以均数±标准差表示,组间比较采用单因素方差分析,多组数据两两比较采用LSD检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 ILKshRNA感染NRK-52E细胞中ILK表达实时荧光定量PCR结果显示,与空白对照组相比,4条ILK干扰序列中,ILKshRNA2和4转染NRK-52E细胞后,ILKmRNA表达水平均降低(P < 0.05)。经计算ILKshRNA2和4mRNA水平基因敲除率分别为66.3%、78.3%。免疫印迹检测ILK蛋白的表达与mRNA表达趋势一致,ILK蛋白沉默效率分别为52.0%、37.40%(图 1)。
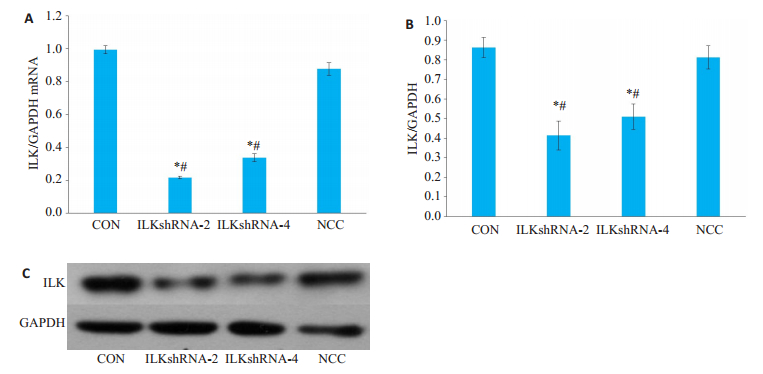
|
图 1 ILKshRNA感染NRK-52E细胞中ILK表达 Fig.1 ILK expression in NRK-52e cells infected with ILKshRNA. A: Real-time PCR; B: Western blotting; C: Quantitative analysis of ILK protein expression. *P < 0.05 vs Control group; #P < 0.05 vs Negative control group. |
不同方式处理NRK-52E细胞的形态变化如图 2,空白对照组细胞呈现典型的上皮细胞铺路石样形态特征,球形或立方样融合的单层细胞;经CsA处理后,铺路石样生长状态消失,细胞呈梭形肥大并拉长,且与邻近细胞分离。在CsA处理的细胞中加入TGF-β1阻断剂SB431542和ILKshRNA后,NRK-52E细胞上皮-间充质改变的现象被抑制,大部分细胞呈现正常上皮细胞形态;阴性对照组细胞形态与CsA处理的细胞形态近似。
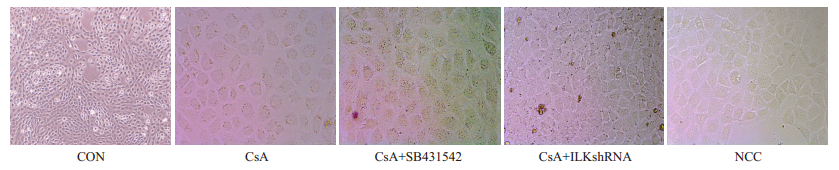
|
图 2 NRK-52E细胞形态学改变 Fig.2 Morphological changes of NRK-52E cells (Original magnification, ×200). |
与空白对照组比较,细胞经环孢素处理后TGF-β1、ILK和FSP1mRNA表达均上调(P < 0.05);经TGF-β1阻断剂SB431542处理后,TGF-β1、ILK和FSP1mRNA水平较CsA组明显降低(P < 0.05);经ILKshRNA沉默后,ILK和FSP1mRNA水平较CsA组明显降低(P < 0.05),TGF-β1mRNA水平差异无统计学意义;阴性对照组与CsA组各因子水平差异无统计学意义(P>0.05,图 3)。
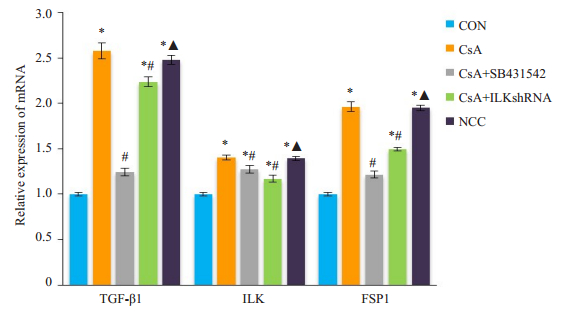
|
图 3 NRK-52细胞TGF-β1、ILK及FSP1mRNA的表达 Fig.3 Expression of TGF-1, ILK and FSP1 mRNA in NRK-52 cells. *P < 0.05 vs control group; #P < 0.05 vs CsAgroup; ▲P < 0.05 vs CsA+ILKshRNAgroup. |
与空白对照组比较,经环孢素诱导后各组细胞TGF-β1、ILK、FSP-1蛋白表达上调(P < 0.05);经TGF-β1阻断剂SB431542处理后,TGF-β1、ILK和FSP1蛋白表达水平较CsA组降低(P < 0.05);经ILKshRNA沉默后,ILK和FSP1蛋白水平较CsA组降低(P < 0.05),TGF-β1蛋白水平差异无统计学意义;阴性对照组较CsA组各因子水平差异无统计学意义(P>0.05,图 4)。
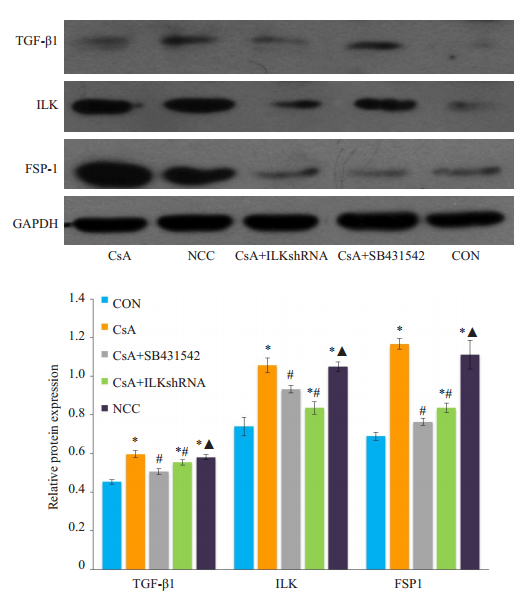
|
图 4 NRK-52细胞TGF-β1、ILK及FSP-1蛋白表达 Fig.4 Expression of TGF-β1, ILK and FSP-1 proteins in NRK-52 cells. A: Western blotting; B: Quantitative analysis of proteins expression. *P < 0.05 vs control group; #P < 0.05 vs CsA group; ▲P < 0.05 vs CsA+ILKshRNAgroup. |
与空白对照组比较,经环孢素诱导后肾小管上皮细胞α-SMA阳性表达细胞数增多(P < 0.05);经TGF-β1阻断剂SB431542及ILKshRNA处理后,α-SMA阳性表达细胞数均较CsA组降低(P < 0.05);阴性对照组与CsA组的差异无统计学意义(P>0.05,图 5)。
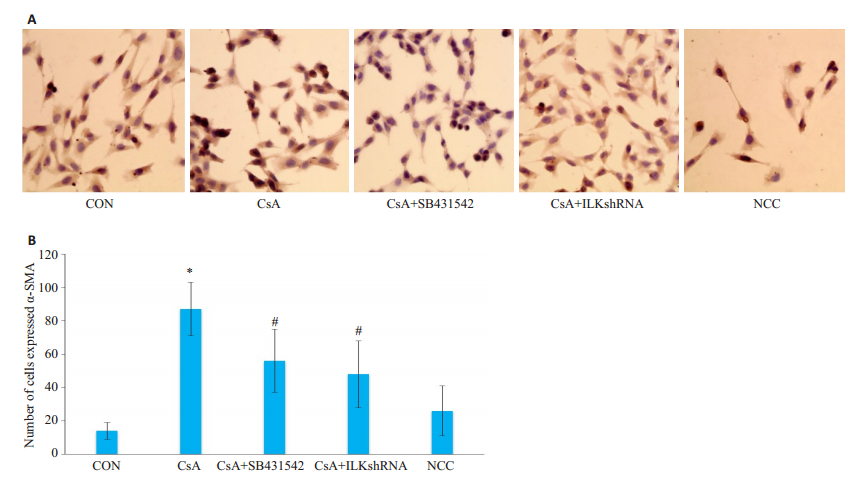
|
图 5 NRK-52细胞α-SMA蛋白表达 Fig.5 Expression of α-SMA in NRK-52 cells. A: Immunohistochemistry, × 400; B: Number of cells expressed α-SMA; *P < 0.05 vs control group; #P < 0.05 vs CsAgroup. |
本课题发现ILK及FSP1的mRNA和蛋白在环孢素诱导的肾小管上皮细胞间充质转分化过程中高表达,分别将TGF-β1抑制剂SB431542和ILKshRNA作用于由环孢素诱导的肾小管上皮细胞中,发现ILK表达降低,且FSP-1表达随之减少。这提示ILK可诱导FSP-1表达,阻断TGF-β1/ILK/FSP-1信号通路可明显减轻环孢素诱导的肾小管上皮细胞间充质转分化,减轻CsA的肾毒性。慢性环孢素肾病是长期使用环孢素产生的肾毒性反应,其主要特征表现在肾功能进行性恶化、入球小动脉透明样变性、炎症细胞浸润、肾小管萎缩伴上皮细胞空泡变性,条索状间质纤维化[11]。体外实验将环孢素作用于人近端肾小管上皮细胞后,细胞形态发生改变,包括细胞伸长、细胞骨架重排、细胞间分离增加以及细胞连接被破坏[14-16]。本研究应用1 mg/L环孢素作用NRK-52E细胞48 h后,同样发现细胞铺路石样生长状态消失,细胞呈梭形肥大并拉长,且与邻近细胞分离;另外,a-SMA是肾小管上皮细胞成纤维化的标志分子,本研究经环孢素作用后,其阳性表达细胞数量明显升高,提示环孢素诱导的细胞出现了肾小管上皮-间充质转化。
ILK是一种生物学活性多样化的丝氨酸/苏氨酸蛋白激酶[17]。既往研究认为,ILK与整合素胞质结构域相互作用,将细胞内骨架蛋白与细胞外基质连接并传递重要生物信号即细胞-细胞外基质交互作用,在肾脏上皮细胞间充质转分化中发挥作用[18-20]。近年来研究显示ILK可能是肾脏纤维化TGF-β1信号转导途径中的关键介质[21-23]。作为蛋白激酶,ILK能够消除TGF-β1诱导的Akt和GSK-3b磷酸化,并在很大程度上恢复E-cadherin和ZO-1的表达[24-25]。抑制ILK也阻断了TGF-β1介导的纤连蛋白、Snail1、纤溶酶原激活物抑制剂1的诱导[26-28]。另外,研究发现ILK的表达随TGF-β1的改变而变化[29-30]。本研究中,应用TGF-β1受体阻断剂SB431542 10 μmol/L作用于环孢素诱导的肾小管上皮细胞中,发现ILK mRNA和蛋白水平均明显降低,提示ILK的表达受TGF-β1的调控。
FSP-1参与细胞生长和分化、细胞支架、微管动力学、钙信号传递、细胞周期调节等[31-32]。有研究证实机体非肿瘤细胞中只有成纤维细胞表达FSP-1,提示FSP-1是成纤维细胞的特异性标志[33]。有研究发现,糖尿病肾病患者足细胞中也存在上皮细胞间充质转分化现象,FSP-1与ILK共定位于足细胞并高表达[34-35],提示二者在肾脏纤维化过程中相关,但相互之间是否存在诱导关系尚不清楚,且在慢性环孢素肾病中是否有FSP-1的表达也不清楚。本研究前期构建并筛选ILKmRNA有效沉默达78.3%,蛋白沉默率为52.0%的ILK慢病毒载体作用于NRK-52E细胞预先沉默ILK基因表达,结果发现环孢素刺激导致的细胞形态变化逐渐恢复为上皮细胞形态,并且明显抑制FSP-1基因和蛋白表达上调,提示ILK作为TGF-β1通路下游因子诱导FSP-1表达,至少部分参与CsA诱导肾小管上皮细胞间充质转分化过程。
综上所述,本研究提示在环孢素诱导的肾小管间质转分化的过程中,ILK作为TGF-β1信号通路的下游重要效应因子,诱导成纤维细胞特异标志FSP-1的表达。肾成纤维细胞增生及过量表达胶原等细胞外基质导致了肾脏间质纤维化的形成,通过抑制FSP-1基因或拮抗FSP-1蛋白的表达,有望成为抑制肾脏间质纤维化的有效干预措施。阻抑ILK基因可以阻断TGF-β1诱导FSP-1的表达,明显减轻了CsA诱导的上皮细胞间充质转分化,减轻CsA的肾毒性,为肾间质纤维化的临床靶点治疗提供了新的实验基础。
| [1] |
Wu Q, Wang X, Nepovimova E, et al. Mechanism of cyclosporine anephrotoxicity: oxidative stress, autophagy and signalings[J]. Food Chem Toxicol, 2018, 118(6): 889-907. |
| [2] |
Damiano S, Ciarcia R, Montagnaro S, et al. Prevention of nephrotoxicity induced by Cyclosporine-A: role of antioxidants[J]. J Cell Biochem, 2015, 116(3): 364-9. |
| [3] |
Zhu YC, Wang YK, Bai SJ, et al. Suppression of CIP4/par6 attenuates TGF-beta 1-induced epithelial-mesenchymal transition in NRK-52E cells[J]. Int J Mol Med, 2017, 40(4): 1165-71. DOI:10.3892/ijmm.2017.3100 |
| [4] |
彭芬芬, 李红瑜, 尹柏辉, 等. 替米沙坦抑制单侧输尿管梗阻小鼠肾脏Mtdh表达而减轻肾脏纤维化[J]. 南方医科大学学报, 2019, 39(2): 156-61. |
| [5] |
王寅, 董俊容, 罗正茂, 等. 尿激酶对环孢素A慢性肾病大鼠肾间质纤维化及转化生长因子TGF-β1的影响[J]. 南方医科大学学报, 2009, 29(2): 2449-52. |
| [6] |
Song Y, Peng CL, Lv SS, et al. Adipose-derived stem cells ameliorate renal interstitial fibrosis through inhibition of EMT and inflammatory response via TGF-beta 1 signaling pathway[J]. Int Immunopharmacol, 2017, 44(7): 115-22. |
| [7] |
Sutariya B, Jhonsa D, Saraf MN. TGF-β: the connecting Link between nephropathy and fibrosis[J]. Immunopharmacol Immunotoxicol, 2016, 38(1): 39-49. DOI:10.3109/08923973.2015.1127382 |
| [8] |
Zhang Y, Li H, Zhu J, et al. Role of artesunate in TGFβ1 induced renal tubular epithelialmesenchymal transdifferentiation in NRK52E cells[J]. Mol Med Rep, 2017, 16(6): 8891-9. DOI:10.3892/mmr.2017.7728 |
| [9] |
谭州科, 罗茜, 杨蝶, 等. 槲皮素通过转化生长因子-β1/Smad通路减轻环孢素诱导的大鼠肾小管间质纤维化[J]. 中华实验外科杂志, 2015, 32(8): 1933-5. DOI:10.3760/cma.j.issn.1001-9030.2015.08.055 |
| [10] |
曾强林, 白志勋, 王丹, 等. 抑制TGF-β1对慢性环孢素肾病小鼠Smad2/3及ILK信号分子的影响[J]. 中国免疫学杂志, 2017, 33(4): 511-5. |
| [11] |
谭州科.槲皮素对环孢素慢性肾毒性致肾小管间质纤维化的影响及可能的机制[D].遵义: 遵义医学院, 2009. http://cdmd.cnki.com.cn/article/cdmd-10661-2010016404.htm
|
| [12] |
Bruneval P, Rossert J, Bariety J. Renewal of FSP1: a marker of fibrogenesis on human renal biopsies[J]. Kidney Int, 2005, 68(3): 1366-7. DOI:10.1111/j.1523-1755.2005.00546.x |
| [13] |
白志勋, 陆静, 杨亦彬. 大鼠ILK-RNAi慢病毒表达载体的构建及鉴定[J]. 贵州医药, 2016, 40(7): 675-7. DOI:10.3969/j.issn.1000-744X.2016.07.001 |
| [14] |
Liu QF, Ye JM, Yu LX, et al. Klotho mitigates cyclosporine Ainduced epithelial-mesenchymal transition and renal fibrosis in rats[J]. Int Urol Nephrol, 2017, 49(2): 345-52. DOI:10.1007/s11255-016-1439-0 |
| [15] |
Jin MH, Lv PF, Chen GY, et al. Klotho ameliorates cyclosporine A induced nephropathy via PDLIM2/N-kB p65 signaling pathway[J]. Biochem Biophys Res Commun, 2017, 486(2): 451-7. DOI:10.1016/j.bbrc.2017.03.061 |
| [16] |
Yuan J, Benway CJ, Bagley J, et al. MicroRNA-494 promotes cyclosporine-induced nephrotoxicity and epithelial to mesenchymal transition by inhibiting PTEN[J]. Am J Transplant, 2015, 15(6): 1682-91. DOI:10.1111/ajt.13161 |
| [17] |
Olmos G, Lopez-Ongil S, Ruiz Torres MP. Integrin-linked kinase: a new actor in the ageing process[J]. Exp Gerontol, 2017, 100(3): 87-90. |
| [18] |
Raman A, Reif GA, Dai Y, et al. Integrin-Linked kinase signaling promotes cyst growth and fibrosis in polycystic kidney disease[J]. J Am Soc Nephrol, 2017, 28(9): 2708-19. DOI:10.1681/ASN.2016111235 |
| [19] |
Zheng G, Zhang J, Zhao H, et al. α3 integrin of cell-cell contact mediates kidney fibrosis by integrin-linked kinase in proximal tubular E-Cadherin deficient mice[J]. Am J Pathol, 2016, 186(7): 1847-60. DOI:10.1016/j.ajpath.2016.03.015 |
| [20] |
Han KS, Li N, Raven PA, et al. Targeting integrin-linked kinase suppresses invasion and metastasis through downregulation of Epithelial-to-Mesenchymal transition in renal cell carcinoma[J]. Mol Cancer Ther, 2015, 14(4): 1024-34. DOI:10.1158/1535-7163.MCT-14-0771 |
| [21] |
Serrano I, Mcdonald PC, Lock FE, et al. Role of the integrin-linked kinase/Rictor complex in TGFβ-1-induced epithelial- mesenchymal transition[J]. Oncogene, 2013, 32(1): 50-60. DOI:10.1038/onc.2012.30 |
| [22] |
Qi FH, Cai PP, Liu X, et al. Adenovirus-mediated P311 inhibits TGFbeta 1-induced epithelial-mesenchymal transition in NRK-52E cells via TGF-beta 1-Smad-ILK pathway[J]. Biosci Trends, 2015, 9(5): 299-306. DOI:10.5582/bst.2015.01129 |
| [23] |
何凤, 喻陆, 童俊容, 等. 整合素连接激酶在梗阻性肾病肾小管上皮细胞转分化中的作用及尿激酶对其表达调节的研究[J]. 南方医科大学学报, 2009, 29(5): 909-13. |
| [24] |
Zhang YH, Wang B, Guo F, et al. Involvement of the TGF beta 1-ILKAkt signaling pathway in the effects of hesperidin in type 2 diabetic nephropathy[J]. Biomed Pharmacother, 2018, 105(4): 766-72. |
| [25] |
Yan Q, Luo H, Wang B, et al. Correlation between PKB/Akt, GSK-3β expression and tubular epithelial-mesenchymal transition in renal allografts with chronic active antibody-mediated rejection[J]. Exp Ther Med, 2017, 13(5): 2217-24. DOI:10.3892/etm.2017.4261 |
| [26] |
Li Y, Tan X, Dai C, et al. Inhibition of integrin-linked kinase attenuates renal interstitial fibrosis[J]. J Am Soc Nephrol, 2009, 20(9): 1907-18. DOI:10.1681/ASN.2008090930 |
| [27] |
Wei MG, Sun W, He WM, et al. Ferulic acid attenuates TGF-β1-Induced renal cellular fibrosis in NRK-52E cells by inhibiting Smad/ILK/snail pathway[J]. Evid Based Complement Alternat Med, 2015, 27(4): 619720-32. |
| [28] |
Niu HL, Nie L, Liu MD, et al. Benazepril affects integrin-linked kinase and smooth muscle alpha-actin expression in diabetic rat glomerulus and cultured mesangial cells[J]. BMC Nephrol, 2014, 15(8): 135-44. |
| [29] |
杨俊伟, 陈香美, 王笑云, 等. 整合素连锁激酶介导转化生长因子β1上调肾小管上皮细胞表达纤连蛋白的研究[J]. 中华肾脏病杂志, 2005, 21(11): 61-4. |
| [30] |
Ortega VR, Gonzalez RM, Ruiz TM, et al. Collagen I up regulates extracellular matrix gene expression and secretion of TGF-by cultured human mesangial cells[J]. Am Physiol cell Physiol, 2004, 286(6): C1335-43. DOI:10.1152/ajpcell.00279.2003 |
| [31] |
Strutz F, Okada H, Lo CW, et al. Identification and characterization of a fibroblast marker: FSP1[J]. J Cell Biol, 1995, 130(2): 393-405. DOI:10.1083/jcb.130.2.393 |
| [32] |
Medkova A, Srovnal J, Potomkova J, et al. Multifarious diagnostic possibilities of the S100 protein family: predominantly in pediatrics and neonatology[J]. World J Pediatr, 2018, 14(4): 315-21. DOI:10.1007/s12519-018-0163-5 |
| [33] |
Loeffler I, Liebisch M, Allert S, et al. FSP1-specific SMAD2 knockout in renal tubular, endothelial, and interstitial cells reduces fibrosis and epithelial-to-mesenchymal transition in murine STZinduced diabetic nephropathy[J]. Cell Tissue Res, 2018, 372(1): 115-33. DOI:10.1007/s00441-017-2754-1 |
| [34] |
Yamaguchi Y, Iwano M, Suzuki DA, et al. Epithelial-Mesenchymal transition as a potential explanation for podocyte depletion in diabetic nephropathy[J]. Am J Kidney Dis, 2009, 54(4): 653-64. DOI:10.1053/j.ajkd.2009.05.009 |
| [35] |
Li Y, Yang J, Dai C, et al. Role for integrin-linked kinase in mediating tubular epithelial to mesenchymal transition and renal interstitial fibrogenesis[J]. J Clin Invest, 2003, 112(4): 503-16. DOI:10.1172/JCI200317913 |
 2019, Vol. 39
2019, Vol. 39

