2. 蚌埠医学院第一附属医院放疗科,安徽 蚌埠 233000;
3. 蚌埠医学 院呼吸系病临床基础安徽省重点实验室,安徽 蚌埠 233000
2. Department of Radiotherapy, First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, China;
3. Anhui Clinical and Preclinical Key laboratory of Respiratory Disease, Bengbu Medical College, Bengbu 233030, China
肺癌是全球癌症相关死亡的主要原因之一,每年有160万人死于肺癌[1]。大约80%的肺癌患者依据组织学亚型统称为非小细胞肺癌(NSCLC),在确诊时,约有70%的NSCLC患者都已进入晚期或存在转移的情况,所以大多数NSCLC患者都无法进行根治手术治疗[2]。无驱动基因突变的晚期非小细胞肺癌的传统治疗是基于全身化疗,虽然化疗可以延长晚期疾病患者的生存率,但其显著的临床不良反应或过度的治疗毒性常常是治疗失败的原因[3-4]。近年来,越来越多的临床研究表明表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)对EGFR敏感突变的晚期NSCLC患者具有延长无进展生存期(PFS)和减轻临床症状的作用,EGFR-TKI被认为是这组患者的一线治疗方案[5-7]。然而,尽管EGFR-TKI治疗EGFR敏感突变型NSCLC的初期疗效较好,但在许多临床试验中,PFS很少超过12个月,大多数患者治疗后短期内发生了获得性耐药[8-9]。进一步提高非小细胞肺癌的临床治疗效果,迫切需要寻求新的治疗途径。
苦参碱是一种重要的中草药,已有的研究表明苦参碱具有抗病毒[10]、抗炎[11]、抗氧化和抗肿瘤等多种药理活性[12-13],也有研究认为苦参碱可能是治疗非小细胞肺癌的一种有前途的替代抗癌药物[14-15]。苦参碱能显著抑制肺癌细胞的增殖,促进凋亡和自噬[16-17]。Akt信号通路已经被证明是可以调控增殖和侵袭相关的重要基因[18]。然而,苦参碱对肺癌细胞体外生长和侵袭的影响是否通过诱导肺癌细胞发生自噬相关性死亡,以及苦参碱的抗肿瘤机制是否与Akt信号通路相关尚不清楚。本实验通过研究苦参碱对A549细胞细胞增殖、凋亡、自噬和AKT信号通路的影响,以探讨苦参碱对A549细胞的抗肿瘤作用可能的分子机制,为临床治疗NSCLC提供新的策略。
1 材料和方法 1.1 材料人非小细胞肺癌A549细胞(中国科学院上海细胞生物学研究),苦参碱(matrine,成都瑞芬思生物科技有限公司),二甲基亚砜(DMSO,Sigma),小牛血清(Lonsera),RPMI1640(Hyclone),吖啶橙(Sigma),CCK-8(Biomiky),AnnexinV-FITC/PI试剂盒(凯基生物),胰酶细胞消化液、青霉素-链霉素、RIPA裂解液、PMSF、BCA蛋白浓度测定试剂盒(碧云天),LY294002(APExBIO)β-actin、LC3B、AKT、p-AKT、anti-mTOR、p-mTOR(ABclonal)。CO2培养箱(Thermo),普通光学倒置显微镜(Nikon),MultiSkan3酶标仪(Thermo),普通光学倒置显微镜(Nikon),FACSCalibur流式细胞仪(BD),垂直电泳仪(Bio-Rad)。
1.2 方法 1.2.1 细胞培养A549细胞用含10%小牛血清、100U/mL的青霉素-链霉素的RPMI1640培养基,在37℃、5% CO2条件下静置培养。细胞贴壁生长良好,每3d传代1次。当细胞生长到对数期时,用胰酶处理细胞,得到单细胞悬液,然后根据实验要求将细胞进行分组实验。
1.2.2 CCK-8法细胞增殖检测将密度为4×103/孔的A549细胞接种到96孔板中,每孔100μL,置于37℃、5%CO2培养箱中培养,待细胞贴壁后,加入不同浓度matrine(0,0.4,0.8,1.2,1.6,2.0g/L)为实验组,以不加matrine处理组为对照组。在培养箱内继续培养24、48、72h后,每孔加入10μLCCK-8溶液,培养箱内孵育2h,用酶标仪测定在A450nm处的吸光度值(A)。每个浓度设平行重复5孔,重复实验3次。计算:细胞抑制率(IR)=(对照组A-实验组A)/对照组A×100%,细胞存活率(%)=(实验组A/对照组A)×100%。
1.2.3 形态学观察收集对数期细胞,将细胞接种于24孔板,密度为1×106/孔。37℃、5%CO2孵育培养,细胞贴壁后,分别加入不同浓度matrine,继续培养48h后,尽去旧培养液,用PBS缓冲液清洗3次,用1μg/mL吖啶橙(AO)染色,避光染色15min,PBS洗3次,应用倒置荧光显微镜观察细胞形态并拍照,实验重复3次。
1.2.4 细胞凋亡检测取A549细胞按每孔含1×106细胞接种于6孔板中,细胞贴壁后,分别加入不同浓度matrine和PI3K特异性抑制剂LY294002(10nmol/L)作为阳性对照,继续培养24、48、72h。将细胞制成细胞悬液,用AnnexinV-PI双染试剂盒染色,上流式细胞仪检测,实验重复3次。
1.2.5 Westernblot检测相关蛋白表达分组及加药情况同1.2.4,每组A549细胞经RIPA裂解液(强RIPA:PMSF=1:100)冰上裂解40min,4℃,12000r/min,离心15min,取上清于EP管中,用BCA蛋白定量试剂盒测定蛋白浓度。电泳(p-mTOR和totalmTOR用6% SDS-PAGE,p-AKT和totalAKT用10%SDS-PAGE,LC3B用12%SDS-PAGE,各组内参均用β-actin),转膜,封闭1h后,分别用对应稀释后的兔一抗4℃孵育过夜,TBST洗膜3次后,分别用山羊抗兔二抗室温摇床孵育2h,TBST洗膜3次,ECL发光试剂盒发光显影,化学发光仪采集图像,ImageJ软件分析条带灰度值。
1.2.6 统计分析采用SPSS17.0Windows软件包进行统计分析。数据以均数±标准差表示,所有实验均重复3次。采用单因素方差分析(ANOVA)评价实验组间的差异,P < 0.05为差异有统计学意义。
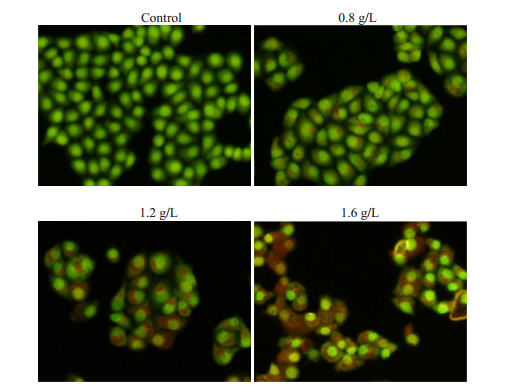
2 结果 2.1 苦参碱处理后A549细胞的形态学变化在倒置荧光显微镜下观察不同浓度苦参碱处理A549细胞24h的情况。0.4g/L苦参碱处理后细胞生长良好,细胞核周围仅可见散在颗粒;0.8g/L苦参碱处理后细胞生长缓慢,细胞不规则,空泡大小不一,导致细胞体积增大;1.2g/L苦参碱处理后,观察到细胞质空泡和肿胀细胞,但细胞膜完整;当苦参碱浓度达到1.6g/L时,细胞萎缩加剧,细胞碎片和悬浮细胞明显增多,吖啶橙染色,可以观察到自噬液泡。相反,未处理的A549细胞呈长梭形或鹅卵石样,细胞核不规则,核固缩现象少见(图 1)。
|
图 1 苦参碱诱导A549细胞自噬 Fig.1 Matrine induces autophagy in A549 cells. Autophagic vacuoles (red staining) can be seen in A549 cells following treatment with various concentrations of matrine (Acridine orange staining, magnification, ×200). |
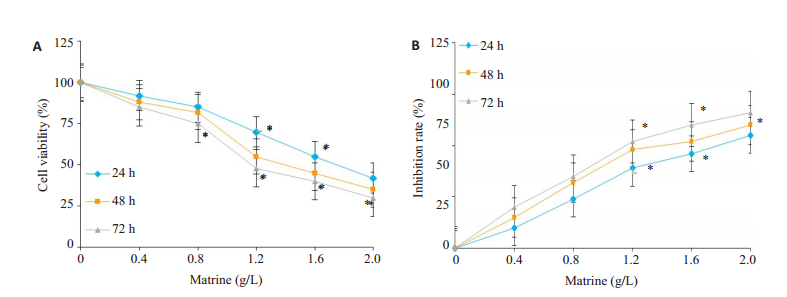
分别用0、0.4、0.8、1.2、1.6、2.0g/L苦参碱处理细胞,采用CCK-8细胞测定法测定A549细胞24、48、72h活力,0.8g/L苦参碱处理48、72h后细胞活力略有下降(分别为19.1、23.3%)。在加入0.8g/L以上苦参碱后,48、72h组细胞增殖明显受到抑制(P < 0.05,图 2)。在48和72h时苦参碱的半数抑制浓度(IC50)分别为1.68g/L和1.44g/L。
|
图 2 苦参碱对A549细胞的增殖抑制作用呈剂量和时间依赖性 Fig.2 Matrine dose- and time-dependently inhibits A549 cell proliferation. A: Cell viability assessed by CCK-8 assay at 24, 48, and 72 h; B: Inhibition rate of cell proliferation (%). The experiments were performed in triplicate and the data are expressed as Mean±SD (*P < 0.05). |
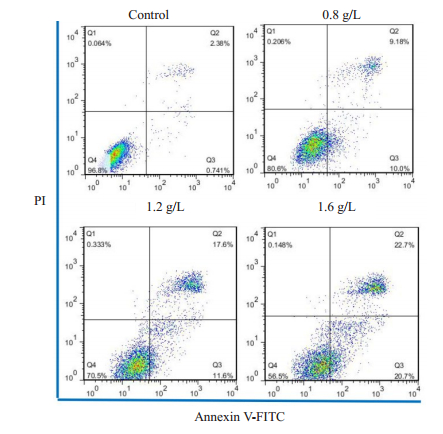
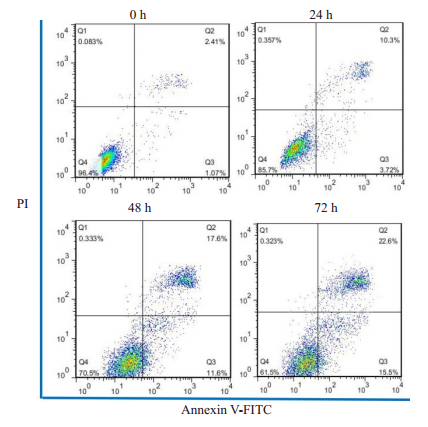
在空白对照组中,0g/L苦参碱处理A549细胞48h后,2.41%的细胞处于早期凋亡,1.07%的细胞处于晚期凋亡。当苦参碱浓度分别达到0.8g/L和1.2g/L时,早期凋亡细胞的百分比分别增加到9.18%和17.60%,而晚期凋亡细胞的百分比分别增加到10.00%和11.60%。当苦参碱浓度达到1.6g/L时,A549细胞凋亡率与对照组和低浓度组比较,差异均有统计学意义(P < 0.05,图 3)。此外,细胞凋亡率在苦参碱处理24、48、72h后逐渐呈时间依赖性增加(图 4)。
|
图 3 苦参碱诱导A549细胞凋亡,凋亡呈剂量依赖性 Fig.3 Matrine dose-dependently induces apoptosis in A549 cells. The apoptosis of A549 cells treated with 0, 0.8, 1.2, and 1.6 g/L matrine for 48 h was analyzed by flow cytometry with Annexin V/PI staining. |
|
图 4 苦参碱诱导A549细胞凋亡呈时间依赖性 Fig.4 Matrine time-dependently induces apoptosis in A549 cells. Flow cytometry with Annexin V/PI staining showed the apoptotic cell populations after treatment with 1.2 g/L matrine at different time points. |
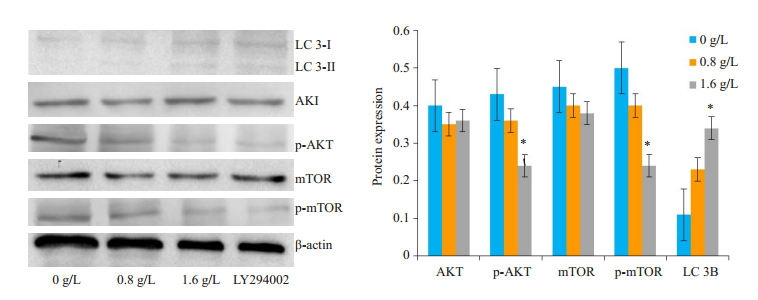
为了进一步阐明AKT信号通路是否靶向调控苦参碱对A549细胞的生长抑制作用,我们研究了苦参碱处理的A549细胞中AKT、pAKT、mTOR、p-mTOR等下游蛋白的变化,观察到1.6g/L苦参碱与PI3K特异性抑制剂LY294002(10nmol/L)一样,较对照组显著降低了A549肺癌细胞中p-AKT和p-mTOR的表达(P < 0.05),并且诱导细胞自噬和凋亡,自噬相关蛋白LC3B在苦参碱处理的A549细胞中的表达呈剂量依赖性增加(P < 0.05,图 5)。
|
图 5 Western blotting分析显示苦参碱处理后A549细胞中LC 3B升高,p-AKT/p-mTOR降低 Fig.5 Western blotting showing significant upregulation of light chain 3B (LC 3B) expression and reduction of p-AKT and p-mTOR expressions in matrine-treated A549 cells (*P < 0.05). No significant changes are found in AKT and mTOR protein expressions in A549 cells after matrine treatment. |
苦参碱是一种重要的具有抗癌作用中草药,近年来,苦参碱的抗肿瘤活性引起了人们的广泛关注,苦参碱可能是治疗非小细胞肺癌的一种有前途的替代抗癌药物[14-15]。细胞分化异常和增殖失控是恶性细胞区别于正常细胞的两个显著特征。许多已发表的文献表明苦参碱具有多种药理作用,包括通过抑制A549细胞株的增殖而具有抗肿瘤活性[19-21]。本研究CCK-8结果表明,不同浓度苦参碱对A549细胞增殖抑制率较对照明显提高,且不同浓度苦参碱处理A549细胞株后细胞增殖抑制呈剂量依赖性和时间依赖性增加,这与上述研究结果基本一致。
细胞凋亡是一种基因程序化的、活跃的细胞自杀过程,在体内平衡和清除不需要的细胞方面起着至关重要的作用。细胞程序性死亡的异常是恶性转化过程中重要的遗传变化之一,因此,抑制细胞增殖和诱导细胞凋亡是恶性肿瘤的主要治疗策略。苦参碱不仅能抑制肿瘤细胞增殖,还能诱导细胞分化和凋亡[22-23]。为了进一步揭示其抗癌作用的机制,本实验进行了DAPI染色,观察苦参碱通过诱导细胞凋亡发挥抗癌作用,发现不同浓度苦参碱处理A549细胞48h后,凋亡细胞数量明显增多,且呈剂量依赖性。此外,细胞凋亡率在1.2g/L苦参碱处理24、48、72h后逐渐呈时间依赖性增加。自噬,也称为Ⅱ型程序性细胞死亡,与肿瘤的发生和发展密切相关。自噬能够促进或抑制细胞凋亡,说明自噬在多种组织细胞中具有不同的功能。但自噬和凋亡之间的确切关系是复杂的,例如,咪唑仑被报道可诱导肺癌A549细胞的自噬细胞死亡,这表明干扰肺癌细胞的自噬可能是肺癌的潜在治疗手段[24-25]。根据以往资料,0.4g/L苦参碱处理肺癌和骨肉瘤细胞48h后,细胞形态会发生改变,细胞增殖受到抑制[21, 26]。本研究采用不同浓度苦参碱处理A549细胞,当苦参碱浓度超过1.2g/L时,用荧光显微镜观察可以观察到吖啶橙染色细胞的自噬液泡,因此认为苦参碱可诱导肺癌A549细胞自噬,同时促进细胞凋亡,抑制细胞增殖。在免疫印迹分析中发现苦参碱诱导的细胞自噬的同时也上调A549细胞自噬蛋白LC3B的表达,这些结果表明苦参碱可能是通过诱导凋亡和自噬在肺癌A549细胞中表现出抗肿瘤活性。
为了进一步探讨苦参碱抑制A549细胞增殖和诱导细胞自噬及凋亡的可能分子机制,我们研究了不同浓度苦参碱对p-AKT、AKT、p-mTOR、mTOR表达的影响,并观察PI3K特异性抑制剂LY294002对A549细胞自噬和凋亡的影响,发现苦参碱对p-AKT、p-mTOR的表达呈浓度依赖性降低,而AKT、mTOR的表达基本没有变化,推测苦参碱抑制A549细胞增殖和诱导细胞自噬及凋亡作用可能是由于抑制了PI3K/AKT/mTOR信号通路的磷酸化实现的。许多已发表的文献表明PI3K/ AKT/mTOR信号通路的阻断在调节自噬中起重要作用[27-28]。Zhao等也报道吉非替尼通过阻断PI3K/AKT/ mTOR通路诱导肺癌细胞自噬和凋亡,抑制细胞增殖,从而起到抑制肿瘤的作用,但吉非替尼诱导的自噬与肺癌细胞凋亡的关系及其机制尚需进一步研究[29]。也有研究认为抑制PI3K/AKT/mTOR信号通路促进肿瘤细胞自噬,激活PI3K/AKT/mTOR信号通路抑制自噬[30-31]。在本研究中,1.6g/L苦参碱和PI3K特异性抑制剂LY294002(10nmol/L)都可以减少p-AKT和p-mTOR的表达,诱导A549细胞自噬和凋亡增加,表明苦参碱诱导A549细胞自噬和凋亡有可能是通过抑制PI3K/AKT/mTOR的途径实现的。
苦参碱可能通过抑制PI3K/AKT/mTOR信号通路,抑制A549细胞增殖,诱导细胞自噬和凋亡,具有抑制肿瘤的作用,提示苦参碱的诱导自噬和凋亡作用可能是一种有前途的NSCLC治疗策略。然而,苦参碱诱导的A549细胞自噬与凋亡的确切关系及其机制尚需进一步研究。
| [1] |
Torre L, Bray F, Siegel R, et al. Global cancer statistics, 2012: Global cancer statistics, 2012[J]. Ca-Cancer J Clin, 2015, 65: 87-108. DOI:10.3322/caac.21262 |
| [2] |
Molina JR, Yang P, Cassivi SD, et al. Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship[J]. Mayo Clin Proc, 2008, 83(5): 584-94. DOI:10.1016/S0025-6196(11)60735-0 |
| [3] |
Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. N Engl J Med, 2002, 346(2): 92-8. DOI:10.1056/NEJMoa011954 |
| [4] |
Scagliotti GV, Parikh P, Von Pawel J, et al. Phase Ⅲ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21): 3543-51. DOI:10.1200/JCO.2007.15.0375 |
| [5] |
Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs[J]. JAMA, 2014, 311(19): 1998-2006. DOI:10.1001/jama.2014.3741 |
| [6] |
Mok TS, Wu YL, Thongprasert S, et al. Gefitinib or carboplatinpaclitaxel in pulmonary adenocarcinoma[J]. N Engl J Med, 2009, 361(10): 947-57. DOI:10.1056/NEJMoa0810699 |
| [7] |
Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutationpositive non-small-cell lung cancer (OPTIMAL, CTONG/0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 710-1. DOI:10.1016/S1470-2045(11)70194-2 |
| [8] |
Tong CWS, Wu WKK, Loong HHF, et al. Drug combination approach to overcome resistance to EGFR tyrosine kinase inhibitors in lung cancer[J]. Cancer Lett, 2017, 405(1): 100-10. |
| [9] |
Uchibori K, Inase N, Araki M, et al. Brigatinib combined with antiEGFR antibody overcomes osimertinib resistance in EGFR-mutated non-small-cell lung cancer[J]. Nat Commun, 2017, 8: 14768. DOI:10.1038/ncomms14768 |
| [10] |
Long Y, Lin XT, Zeng KL, et al. Efficacy of intramuscular matrine in the treatment of chronic hepatitis B[J]. HBPD Int, 2004, 3(1): 69-72. |
| [11] |
Cheng H, Xia B, Zhang L, et al. Matrine improves 2, 4, 6-trinitrobenzene sulfonic acid-induced colitis in mice[J]. Pharmacol Res, 2006, 53(3): 202-8. |
| [12] |
Tan C, Qian X, Jia R, et al. Matrine induction of reactive Oxygen species activates p38 leading to caspase-dependent cell apoptosis in non-small cell lung cancer cells[J]. Oncol Rep, 2013, 30(5): 2529-35. DOI:10.3892/or.2013.2727 |
| [13] |
Zhang P, Wang Z, Chong T, et al. Matrine inhibits proliferation and induces apoptosis of the androgen-Independent prostate cancer cell line PC-3[J]. Mol Med Rep, 2012, 5(3): 783-7. |
| [14] |
Zhang QC, Jiang SJ, Zhang S, et al. Histone deacetylase inhibitor trichostatin A enhances anti-tumor effects of docetaxel or erlotinib in A549 cell line[J]. Asian Pac J Cancer Prev, 2012, 13(7): 3471-6. DOI:10.7314/APJCP.2012.13.7.3471 |
| [15] |
Ulasli SS, Celik S, Gunay E, et al. Anticancer effects of thymoquinone, caffeic acid phenethyl ester and resveratrol on A549 non-small cell lung cancer cells exposed to benzo (a) pyrene[J]. Asian Pac J Cancer Prev, 2013, 14(10): 6159-64. DOI:10.7314/APJCP.2013.14.10.6159 |
| [16] |
Hou G, Li N, Ma YH, et al. Expressions of Survivin and Pglycoprotein in non-small cell lung cancer and their relationship with effectiveness of matrine and pacilitaxel[J]. Chin J Cancer Prev Trea, 2013, 20: 350-353. |
| [17] |
Lin X, Chen QS, Huang C, et al. Matrine induces cell apoptosis and necroptosis dependent on RIPKs of lung cancer cells[J]. Int J Clin Exp Med, 2018, 11(7): 6980-6. |
| [18] |
Sun X, Zhuo XB, Hu YP, et al. A novel matrine derivative WM622 inhibits hepatocellular carcinoma by inhibiting PI3K/AKT signaling pathways[J]. Mol Cell Biochem, 2018, 449(1/2): 47-54. |
| [19] |
Lu Z, Xiao Y, Liu X, et al. Matrine reduces the proliferation of A549 cells via the p53/p21/PCNA/eIF4E signaling pathway[J]. Mol Med Rep, 2017, 15(5): 2415-22. DOI:10.3892/mmr.2017.6331 |
| [20] |
Liu YQ, Li Y, Qin J, et al. Matrine reduces proliferation of human lung cancer cells by inducing apoptosis and changing miRNA expression profiles[J]. Asian Pac J Cancer Prev, 2014, 15(5): 2169-77. DOI:10.7314/APJCP.2014.15.5.2169 |
| [21] |
Xie W, Lu J, Lu Q, et al. Matrine inhibits the proliferation and migration of lung cancer cells through regulation of the protein kinase B/glycogen synthase kinase-3β signaling pathways[J]. Exp Ther Med, 2018, 16(2): 723-9. |
| [22] |
Zhao XB, Qin Y, Niu YL, et al. Matrine inhibits hypoxia/ reoxygenation-induced apoptosis of cardiac microvascular endothelial cells in rats via the JAK2/STAT3 signaling pathway[J]. Biomed Pharmacother, 2018, 106: 117-24. DOI:10.1016/j.biopha.2018.06.003 |
| [23] |
An Q, Han C, Zhou YB, et al. Matrine induces cell cycle arrest and apoptosis with recovery of the expression of miR-126 in the A549 non-small cell lung cancer cell line[J]. Mol Med Rep, 2016, 14(5): 4042-8. DOI:10.3892/mmr.2016.5753 |
| [24] |
An HK, Kim KS, Lee JW, et al. Mimulone-Induced autophagy through p53-Mediated AMPK/mTOR pathway increases CaspaseMediated apoptotic cell death in a549 human lung cancer cells[J]. PLoS One, 2014, 9(12): e114607-26. DOI:10.1371/journal.pone.0114607 |
| [25] |
Lu HY, Chang YJ, Fan NC, et al. Synergism through combination of chemotherapy and oxidative stress-induced autophagy in A549 lung cancer cells using redox-responsive nanohybrids: a new strategy for cancer therapy[J]. Biomaterials, 2015, 42: 30-41. DOI:10.1016/j.biomaterials.2014.11.029 |
| [26] |
Ma K, Huang MY, Guo YX, et al. Matrine-induced autophagy counteracts cell apoptosis via the ERK signaling pathway in osteosarcoma cells[J]. Oncol Lett, 2016, 12(3): 1854-60. DOI:10.3892/ol.2016.4848 |
| [27] |
Heras-Sandoval D, Pérez-Rojas JM, Hernández-Damián J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J]. Cell Signal, 2014, 26(12): 2694-701. DOI:10.1016/j.cellsig.2014.08.019 |
| [28] |
Kumar D, Shankar S, Srivastava RK. Rottlerin induces autophagy and apoptosis in prostate cancer stem cells via PI3K/Akt/mTOR signaling pathway[J]. Cancer Lett, 2014, 343(2): 179-89. DOI:10.1016/j.canlet.2013.10.003 |
| [29] |
Zhao ZQ, Yu ZY, Li J, et al. Gefitinib induces lung cancer cell autophagy and apoptosis via blockade of the PI3K/AKT/mTOR pathway[J]. Oncol Lett, 2016, 12(1): 63-8. DOI:10.3892/ol.2016.4606 |
| [30] |
Wang C, Zhang X, Teng Z, et al. Downregulation of PI3K/Akt/ mTOR signaling pathway in curcumin-induced autophagy in APP/ PS1 double transgenic mice[J]. Eur J Pharmacol, 2014, 740: 312-20. DOI:10.1016/j.ejphar.2014.06.051 |
| [31] |
Datta K, Suman S, Jr AJF. Radiation persistently promoted oxidative stress, activated mTOR via PI3K/Akt, and downregulated autophagy pathway in mouse intestine International[J]. Int J Biochem Cell Biol, 2014, 57: 167-76. DOI:10.1016/j.biocel.2014.10.022 |
 2019, Vol. 39
2019, Vol. 39

