2. 南方医科大学中西医结合医院 病理科,广东 广州 510330
2. Department of Pathology, Hospital of Integrated Traditional Chinese and Western Medicine, Southern Medical University, Guangzhou 510330, China
血管翳用于描述由浆细胞、巨噬细胞、及淋巴细胞共同形成、释放免疫球蛋白与类风湿因子、滑膜的炎症和滑膜成纤维细胞活跃的增殖导致血管翳的形成和软骨、骨、肌腱、韧带和血管的破坏的病理过程[1-2]。一般认为,血管翳被认为是类风湿关节炎(RA)的基本的特征性病理病变[3-4]。
局部慢性局部缺氧、炎症可能导致外周角膜血管化形成血管翳[5]。在强直性脊柱炎、脊柱关节病变中也存在血管翳形成的病理学改变[6]。近年来,在骨关节炎(OA)患者观察到血管翳的存在,并且与RA血管翳具有相似的促炎和抗炎细胞因子谱表达[7],有学者将骨关节炎的软骨病变命名为“血管翳样组织” [8-9],也有学者直接认定这样的病变类型为血管翳[7]。但对OA血管翳的研究非常有限。
我们在临床工作中,偶然间发现OA患者滑膜活检标本病理学上存在血管翳形成,且时常难以与RA鉴别。本文拟进一步通过临床病理学观察,研究RA与OA滑膜血管翳在组织病理形态学方面的异同。
1 资料和方法 1.1 标本来源纳入南方医科大学附属中西医结合医院风湿科2018年入院、符合入选标准的72例RA患者和24例OA患者的滑膜组织(由关节腔镜手术获取,有2例患者滑膜取自踝关节,其余患者均取自膝关节)。患者入选标准:(1)RA和OA患者分别达到ACR/EULAR分类诊断标准[10]、确诊为RA,或EULAR膝骨关节炎诊断标准[11]、确诊为OA;(2)B超显示能够见到低回声组织,即血管翳,达到关节腔镜检测和治疗的标准;(3)活检部位未经过关节腔内注射、或光动力治疗等相关可能直接影响关节滑膜组织学形态的治疗;(4)排除感性关节炎、结核性关节炎、痛风性关节炎等其他关节疾病,排除活动性感染、肿瘤等;(5)患者本人或监护人同意将活检组织用于本研究。本研究通过南方医科大学中西医结合医院伦理委员会批准,所有登记的患者均签署知情同意书。
1.2 HE染色组织学分析从本院病理科根据病案系统调出每个入选患者的HE染色切片。经2位高年资病理专家对病理切片进行再次分析。并对滑膜细胞增生程度、血管增生程度、纤维组织增生程度、淋巴细胞浸润程度几个方面进行量化评分,评分标准参考动物RA模型研究[12]及结合病理专家经验;对有无浆细胞浸润采用计数统计。
滑膜细胞(FLS)增生程度:0,无滑膜细胞增生;1,FLS轻度增生;2,FLS中度增生;3,FLS重度增生。
血管增生程度:0,无血管增生;1,血管轻度增生;2,血管中度增生;3,血管重度增生。
纤维组织增生程度:0,无纤维组织增生;1,纤维组织轻度增生;2,纤维组织中度增生;3,纤维组织重度增生。
淋巴细胞浸润程度:0,无淋巴细胞;1,淋巴细胞轻度浸润;2,淋巴细胞中度浸润;3,淋巴细胞重度浸润。
有无浆细胞浸润:有浆细胞浸润(+);无浆细胞浸润(-)。
1.3 统计学分析用Graph Pad Prism 7.0软件进行统计分析。定性检查采用Chi-square检验;所有定量数据都以均值±标准差表示,定量检测使用t检验进行统计学分析。P < 0.05被认为具有统计学差异。
2 结果 2.1 OA、RA患者基本情况所有入选的RA患者均为检测到类风湿因子(RF)和抗CCP抗体阳性,所有OA患者的这两种自身抗体均阴性。两组患者基本情况见表 1。
| 表 1 RA、OA患者一般情况 Tab.1 Demographic and general clinical data of RA and OA patients |
OA滑膜也存在着血管翳形成,但OA-FLS增生程度、纤维组织增生程度和淋巴细胞浸润程度,及浆细胞浸润比例明显低于RA血管翳;血管增生程度低于RA血管翳,但差异无统计学意义(表 2)。
| 表 2 OA、RA患者滑膜标本组织学比较 Tab.2 Comparison of histology of the synovial specimens between patients with OA and RA |
24例OA滑膜组织中,2例患者显微镜下显示仅见纤维脂肪组织,其余均有不同程度的滑膜增生、炎症细胞浸润等,其程度明显逊于RA(具体参见上述OA、RA患者滑膜标本组织学比较)。但在独立分析每个病理切片时,难以从组织病理学将OA、RA相鉴别。因为存在着增生较轻、炎症细胞浸润较轻的RA血管翳,同时存在着增生程度高、血管生成丰富的OA血管翳。所以在不结合临床症状及血液检查的情况下,病理检查不能对OA、RA作出鉴别(图 1)。
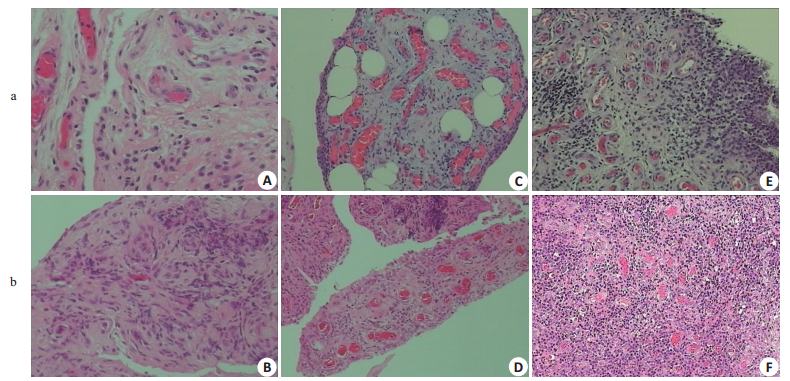
|
图 1 OA(a)血管翳模仿RA(b) Fig.1 OA (a) pannus resembles that of RA (b) (HE staining, × 10). A, B: FLS hyperplasia of OA and RA; C, D: Vascular formation of OA and RA synovium; E, F: Inflammatory cell infiltration of OA and RA synovium. |
骨关节炎(OA)是一种由关节软骨和下方骨质破坏引起的关节疾病[13]。最常见的症状是关节疼痛和僵硬[14]。最初,症状可能仅在运动后发生,但随着时间的推移它们可能会变得持续性发作;其他症状包括关节肿胀,活动范围减小,以及当背部受到影响时,手臂和腿部无力或麻木;最常见的关节是手指末端附近的拇指,颈部,下背部,膝盖和臀部[15]。血管翳通过隔绝骨头从滑膜获取营养、释放多种炎性介质与蛋白水解酶,对关节软骨、软骨下骨、韧带、肌腱等组织进行侵蚀,引致骨关节软骨破坏、软骨下骨溶解、关节囊破坏松弛、关节错位、融合,以致骨化[16]。血管翳的本质是,慢性炎症引起的纤维化及新生血管生成等病理变化;RA滑膜分泌组织因子,诱发了外源性凝血途径,并促进血管生成[17]。所以血管翳的形成与中医“痹症”的气血瘀滞极为相似[18]。传统认为血管翳是RA的特征性关节病理特征[19]。但近年来,国外对OA的滑膜组织进行了一定研究,发现OA滑膜也存在着血管翳的形成,有学者以“血管翳样组织”命名[20]。
Nakamura等[21]的研究发现,在肉眼上71.4%(15/ 21)的OA关节中可以发现了软骨表面上的血管样组织的病灶和斑块形成。综合当前研究显示,在病理机制上,OA与RA存在着分子生物学的相似之处。OA血管翳细胞对Ⅰ型胶原和波形蛋白呈阳性,此外它们还表达Ⅱ型胶原和聚集蛋白聚糖。在OA血管翳细胞中检测到基质金属蛋白酶(MMP)-1,MMP-3和MMP-13的自发表达[7];与OA软骨细胞相比,在培养的OA血管翳的上清液中检测到相似或更高水平的MMP,以MMP-3水平最为显著。另外HIF-1α、VEGF在OA滑膜组织中表达明显高于急性创伤性滑膜炎患者, 它们在滑膜炎滑膜组织中表达具有相关性,共同促进OA发病[22]。Furuzawa等[7]对5例OA及RA的滑膜组织对比研究发现,所有患者均有血管或纤维性血管翳;在所有组织样品中观察到滑膜增殖、炎性浸润和细胞外基质蛋白减少。OA中的软骨细胞增殖低于RA软骨。OA滑膜组织表达的蛋白多糖水平低于RA滑膜。OA中的Ⅱ型胶原蛋白水平低于RA软骨。与OA血管翳相比,在RA血管翳的上清液中发现显着更高水平的IL-1β(P < 0.05)。在OA和RA血管翳上清液中检测到相似水平的TNF-α,IL-8和金属蛋白酶组织抑制因子(TIMP)-1。由此可见,OA与RA的血管翳形成,不仅是组织形态学层面的相似,也存在分子生物学机制的相同之处。
血管翳形成的基础是滑膜炎,滑膜炎是自身免疫起源的慢性炎性关节疾病的主要特征,例如RA和脊柱关节病(SpA)[23]。它还可以作为OA的继发性炎症症状发生,其主要由软骨和软骨下骨的生物力学应力诱导。OA的现代概念已经从现代成像学显示出表型永久性改变,表现出涉及软骨,软骨下骨和滑膜炎症的复杂和多组织病理学。即使在可见的软骨变性发生之前,滑膜也可能显示出显着的变化,单核细胞的浸润,滑膜衬里层的增厚和炎性细胞因子的产生[24]。对RA的研究表明,滑膜在关节炎症和破坏中起主导作用,如滑膜组织学的变化所示:由于CD68 +细胞的浸润以及增殖和B型滑膜细胞凋亡减少,滑膜衬里层增厚;下衬层的新生血管形成;T细胞、B细胞、浆细胞和巨噬细胞浸润;粘附分子表达的改变,包括αV整联蛋白的表达,其可能在新生血管形成和血管翳形成中起重要作用。这些观察结果表明滑膜是炎症的主要部位,由自身反应性T细胞和巨噬细胞以及主要的效应器官引发,因其增生性、侵袭性的血管翳导致软骨和骨侵蚀[25-26]。
综上所述,OA的滑膜病变和RA的滑膜病变,着血管翳形成方面存在着差异,也存在着从形态学到分子生物学变化趋势的相似之处。本研究对OA患者滑膜活检标本病理切片显微镜下的复习,发现OA患者存在着明确的血管翳生成,其增生程度,炎症程度明显低于RA,具有统计学差异;但在独立分析每个病理切片时,难以从组织病理学将OA、RA相鉴别。
在骨关节炎的治疗方面,研究表明英夫利昔单抗治疗可以减少RA近端指间关节中的继发性OA事件,而不依赖于炎症的减少,这表明抗TNF-α治疗可能通过其他途径对抗继发OA而不是抑制炎症;当然抗TNF-α在原发性手OA治疗中的作用需要进一步研究[27]。近年来国外在采用生物制剂干预OA,包括抗肿瘤坏死因子试剂[28]、生长因子[29]和IL-1拮抗剂等[30]。例如作为RA的一线用药,甲氨蝶呤也被尝试用于骨关节炎的治疗;国外研究时,用量甚至高达20 mg每周[20]。所以,我们的研究结果也给骨关节炎的治疗方法拓展也提供了启发和理论依据。
| [1] |
Ostrowska M, Maśliński W, Prochorec-Sobieszek M, et al. Cartilage and bone damage in rheumatoid arthritis[J]. Reumatologia, 2018, 56(2): 111-20. DOI:10.5114/reum.2018.75523 |
| [2] |
Wang DM, Lin L, Peng JH, et al. Pannus inflammation in sacroiliitis following immune pathological injury and radiological structural damage:a study of 193 patients with spondyloarthritis[J]. Arthritis Res Ther, 2018, 20(1): 120. |
| [3] |
中华医学会风湿病学分会. 2018中国类风湿关节炎诊疗指南[J]. 中华内科杂志, 2018, 57(4): 242-51. DOI:10.3760/cma.j.issn.0578-1426.2018.04.004 |
| [4] |
Shi J, Ermann J, Weissman BN, et al. Thinking beyond pannus: a review of retro-odontoid pseudotumor due to rheumatoid and nonrheumatoid etiologies[J]. Skeletal Radiol, 2019, [Epub ahead of print]. https://link.springer.com/article/10.1007/s00256-019-03187-z
|
| [5] |
Jakobiec FA, Stacy RC, Mendoza PR. Hyperplastic corneal pannus:An immunohistochemical analysis and review[J]. Surv Ophthalmol, 2014, 59(4): 448-53. DOI:10.1016/j.survophthal.2013.10.005 |
| [6] |
Singh S, Balakrishnan C, Maheshwari S. Pannus and enthesitis in the atlanto-axial region in ankylosing spondylitis[J]. Int J Rheum Dis, 2015, 8(2): 138-40. |
| [7] |
Furuzawa-Carballeda J, Macip-Rodr Guez PM, Cabral AR. Osteoarthritis and rheumatoid arthritis pannus have similar qualitative metabolic characteristics and pro-inflammatory cytokine response[J]. Clin Exp Rheumatol, 2008, 26(4): 554-60. |
| [8] |
Shibakawa A, Aoki H, Masuko-Hongo K, et al. Presence of pannuslike tissue on osteoarthritic cartilage and its histological character[J]. Osteoarthritis Cartilage, 2003, 11(2): 133-40. DOI:10.1053/joca.2002.0871 |
| [9] |
Yang CC, Lin CY, Wang HS, et al. Matrix metalloproteases and tissue inhibitors of metalloproteinases in medial plica and pannuslike tissue contribute to knee osteoarthritis progression[J]. PLoS One, 2013, 8(11): e79662. DOI:10.1371/journal.pone.0079662 |
| [10] |
Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J]. Ann Rheum Dis, 2010, 69(9): 1580-8. DOI:10.1136/ard.2010.138461 |
| [11] |
Zhang W, Doherty M, Peat G, et al. EULAR evidence-based recommendations for the diagnosis of knee osteoarthritis[J]. Ann Rheum Dis, 2010, 69(3): 483-9. DOI:10.1136/ard.2009.113100 |
| [12] |
Cascao R, Vidal B, Lopes IP, et al. Decrease of CD68 synovial macrophages in celastrol treated arthritic rats[J]. PLoS One, 2015, 10(12): e142448. |
| [13] |
Kontio T, Viikari-Juntura E, Solovieva S. Impact of osteoarthritis on work participation and working life years lost[J]. J Rheumatol, 2019, [Epub ahead of print]. http://www.jrheum.org/content/early/2019/04/24/jrheum.181284
|
| [14] |
Allen KD, Golightly YM. Epidemiology of osteoarthritis:state of the evidence[J]. Curr Opin Rheumatol, 2015, 27(3): 276-83. DOI:10.1097/BOR.0000000000000161 |
| [15] |
Felson DT, Zhang YQ, Hannan MT, et al. The incidence and natural history of knee osteoarthritis in the elderly. The framingham osteoarthritis study[J]. Arthritis Rheum, 1995, 38(10): 1500-5. DOI:10.1002/(ISSN)1529-0131 |
| [16] |
Smolen JS, Aletaha D, Barton A, et al. Rheumatoid arthritis[J]. Nat Rev Dis Primers, 2018, 4: 18001. DOI:10.1038/nrdp.2018.1 |
| [17] |
Chen L, Lu Y, Chu Y, et al. Tissue factor expression in rheumatoid synovium:a potential role in pannus invasion of rheumatoid arthritis[J]. Acta Histochem, 2013, 115(7): 692-7. DOI:10.1016/j.acthis.2013.02.005 |
| [18] |
李光耀, 姜泉. 从痰瘀痹阻论治类风湿关节炎[J]. 中医杂志, 2018, 59(12): 1063-5. |
| [19] |
Joyce AA, Williams J, Shi J, et al. Atlanto-axial pannus in patients with and without rheumatoid arthritis[J]. J Rheumatol, 2019, [Epub ahead of print]. http://www.jrheum.org/content/early/2019/03/24/jrheum.181429
|
| [20] |
Wenham CY, Grainger AJ, Hensor EM, et al. Methotrexate for pain relief in knee osteoarthritis:an open-label study[J]. Rheumatology, 2013, 52(5): 888-92. DOI:10.1093/rheumatology/kes386 |
| [21] |
Yuan GH, Tanaka M, Masuko-Hongo K, et al. Characterization of cells from pannus-like tissue over articular cartilage of advanced osteoarthritis[J]. Osteoarthritis Cartilage, 2004, 12(1): 38-45. DOI:10.1016/j.joca.2003.08.004 |
| [22] |
段鑫, 李奇, 林荔军, 等. 骨关节炎滑膜组织中缺氧诱导因子-1α、血管内皮生长因子的表达[J]. 南方医科大学学报, 2011, 31(1): 117-20. |
| [23] |
Stahnke K, Morawietz L, Moroder P, et al. Synovitis as a concomitant disease in shoulder pathologies[J]. Arch Orthop Trauma Surg, 2019, [Epub ahead of print]. https://link.springer.com/article/10.1007%2Fs00402-019-03152-4
|
| [24] |
Mathiessen A, Conaghan PG. Synovitis in osteoarthritis:current understanding with therapeutic implications[J]. Arthritis Res Ther, 2017, 19(1): 18. |
| [25] |
Zvaifler NJ, Firestein GS. Pannus and pannocytes. Alternative models of joint destruction in rheumatoid arthritis[J]. Arthritis Rheum, 1994, 37(6): 783-9. DOI:10.1002/(ISSN)1529-0131 |
| [26] |
Baeten D, Demetter P, Cuvelier C, et al. Comparative study of the synovial histology in rheumatoid arthritis, spondyloarthropathy, and osteoarthritis:influence of disease duration and activity[J]. Ann Rheum Dis, 2000, 59(12): 945-53. DOI:10.1136/ard.59.12.945 |
| [27] |
Guler-Yuksel M, Allaart CF, Watt I, et al. Treatment with TNFalpha inhibitor infliximab might reduce hand osteoarthritis in patients with rheumatoid arthritis[J]. Osteoarthritis Cartilage, 2010, 18(10): 1256-62. DOI:10.1016/j.joca.2010.07.011 |
| [28] |
吴江怡, 陈昊, 杨柳. 骨关节炎的关节腔内注射药物及生物制剂治疗现状[J]. 骨科临床与研究杂志, 2019, 4(02): 113-9. |
| [29] |
Setiawan I, Suyasa IK, Astawa P, et al. Recombinant platelet derived growth factor-BB and hyaluronic acid effect in rat osteoarthritis models[J]. J Orthop, 2019, 16(3): 230-3. DOI:10.1016/j.jor.2019.02.028 |
| [30] |
Wenham CY, Mcdermott M, Conaghan PG. Biological therapies in osteoarthritis[J]. Curr Pharm Des, 2015, 21(17): 2206-15. DOI:10.2174/1381612821666150310144940 |
 2019, Vol. 39
2019, Vol. 39

