随着我国肥胖人口的日益增多,肥胖已逐渐成为严重危害我国人民健康的一种重要疾病。肥胖不仅影响整个机体的正常生理功能,还能增加动脉粥样硬化、冠心病、糖尿病等重大疾病的发病危险,严重危害机体健康[1]。近年来西方各国对肥胖及其并发症的治疗费用投入也大量增加。因此,开发利用减肥降脂效果的产品的相关研究对提高肥胖疾病患者的生活质量,保持人体健康有重要意义。
共轭亚油酸(CLA)主要存在于反刍动物的脂肪以及牛奶制品中[2-3],具有免疫、抗癌、抗动脉粥样硬化、抗氧化、抗过敏、抗糖尿病、降血脂、影响骨形成等多方面生物学功能[4-5]。虽然CLA与LA(亚油酸)结构相似,但功能作用却相反[6],CLA可以抑制脂肪酸合成酶(FAS)基因的表达,上调脂肪动员和分解相关酶的表达而发挥减肥降脂、降糖作用[7]。有体内研究显示,喂食CLA可显著促进肥胖小鼠(ob/ob)和高脂饮食所致的肥胖型大鼠的脂肪动员和分解,降低体质量,改善胰岛素抵抗[8-10]。临床试验也表明,每天服用3~4 g的混合CLA可减低正常成人、肥胖患者和中老年人的脂肪含量,改善糖尿病患者的胰岛素敏感性[9]。然而,虽然目前已有大量研究证实CLA在减肥降脂调节糖脂代谢方面有较好效果,但其在糖脂代谢方面的分子机制还不完全清楚,有待进一步探讨。
因此,本文利用肥胖糖尿病小鼠模型(db/db)小鼠作为研究对象,观察共轭亚油酸对db/db小鼠体质量、饮食、饮水量的影响,检测血糖、血脂、肝脏脂肪含量,分析共轭亚油酸对肥胖糖尿病糖脂代谢的影响,并研究其分子作用机制。
1 材料和方法 1.1 实验动物及饲养8周龄的雄性BKS.Cg-Dock7m+/+Leprdb/JNju小鼠购自Jackson Laboratories(Bar Harbor, Maine 04609 USA)。动物处置按照《南方医科大学实验动物管理办法(试行)》和《南方医科大学实验动物伦理审查指南(试行)》原则进行。置于SPF级动物房饲养,垫料及普通饲料均购自南方医科大学实验动物中心。
1.2 药品及试剂逆转录试剂盒、Real time PCR试剂盒等(TAKARA);PVDF膜(优宁维);BSA、SDS-PAGE凝胶试剂盒、5×蛋白loading buffer(谷歌生物);化学发光试剂盒(ECL)Enhanced Chemiluminescent Kit(全式金生物);BCA蛋白定量试剂盒(赛默飞);Tris、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulphase, SDS)、甲醇等(卓升生物)。PPARα,PPARγ,CD36,CHREBP,SREBP-1c,GAPDH,ACC,P-ACC等抗体(Cell Signaling Technology)。
1.3 动物分组与处理将模型鼠随机分成两组,6只/组,两组小鼠每天分别给予200 μL生理盐水和200 μL CLA混合物(c9,t11- CLA,t10,c12-CLA)灌胃给药处理1月。取材检测各项指标。
1.4 小鼠体质量,进食量,进水量及血糖检测对照组和共轭亚油酸处理组小鼠每7 d检测1次体质量、食物摄入量和水分摄入量,每15 d进行1次口服糖耐量测试。血糖浓度是用血糖检测仪测定,测定结果利用Graph Pad进行统计分析后作图。
1.5 三酰甘油及胆固醇浓度测定经过1月共轭亚油酸处理后,将小鼠麻醉后心脏取血,血液室温静置1 h,6000 r/min离心5 min,分离血清,用HITACHI 7150全自动生化分析仪测定三酰甘油和胆固醇浓度。测定结果用Graph Pad软件进行统计分析。
1.6 组织取材及HE染色麻醉小鼠后,取肝脏组织,一部分置于液氮中保存用以提取蛋白和RNA,一部分置于4%的多聚甲醛中固定用于石蜡包埋切片,另取一部分新鲜肝脏组织置于PBS保存及时用于制作肝脏冰冻切片。将石蜡切片进行HE染色观察肝脏组织形态变化。已制作好的石蜡切片进行脱蜡水化-苏木素染色-分化-返蓝-脱水透明-伊红染色-脱水透明-封片的步骤处理后得到HE染色切片,用Axio Scope A1显微镜拍照分析。
1.7 口服糖耐量(OGTT)测定在实验前将两组小鼠断粮12 h,测定空腹血糖后,立即给予每组小鼠一定量的葡萄糖溶液灌胃,分别测定灌胃后30、60、120 min各个时间点的血糖浓度。测定结果用graph pad进行统计分析。
1.8 油红“O”染色将肝脏样品的冷冻切片样品用4%甲醛-磷酸盐(PH7.4)固定10 min,用水冲洗,然后用60%异丙醇冲洗,并用0.4%油红“O”染料染色10 min。用水和60%异丙醇洗涤后,切片用苏木精染色,然后在显微镜下观察这些样品。
1.9 HepG2细胞处理及ELISA检测以空白组和亚油酸处理组为对照,分别用50 μmol/L c9,t11-cla和t10,c12-cla处理HepG2细胞,取细胞上清按照乙酰辅酶A ELISA试剂盒说明书对上清中乙酰辅酶A含量进行检测。
1.10 定量PCR分析通过Trizol方法从肝组织和处理好的HepG2细胞中提取总RNA,然后使用Nano Drop 1000(Nano Drop Technologies,Wilmingto,Delaware,USA)定量,并使用逆转录试剂盒将其反转录成cDNA。使用以下引物通过实时定量PCR检测GAPDH,CD36,PPARγ,PPARα,CHREBP和SHREBP-1c基因的表达:5'-GGACCTCA TGGCCTACATGG- 3'(正向)和5'- TAG GGC CTC TCT TGC TCA GT-3'(反向);5'-AAGCTATTGCGAC ATGATT- 3'(正向),5'- GAT CCG AAC ACA GCG TAG AT - 3'(反向);5'- CGAGAAGGAGAAGCTGT TGG-3'(正向),5'-TCA GCG GGA AGG ACTTTATG- 3'(反向);5'-CTCCCTCCTTACCCTTGGAG-3'(正向),5'-GCC TCT GAT CACCACCATTT-3'(反向);5'-GTC CGATATCTCCGACACACTCTT-3'(正向),5'-CATTG CCAACATAAGCATCTTCTG- 3'(反向)和5'- CAG GCT GAG AAA GGA TGC TC-3'(正向),5'-TCAGTG CCAGGTTAGAAGCA-3'(反向)。检测结果采用2-△△ct法分析后作图。
1.11 Western blot分析获得两组肝组织和处理好的细胞,分别加入RIPA,肝组织用组织匀浆仪进行研磨,用细胞刮将细胞刮下,12 000 r/min离心取上清,BCA法测定上清中蛋白浓度。对样品的蛋白含量标准化后在SDS-聚丙烯酰胺凝胶上分离蛋白质进行电泳分析。然后转移到PVDF膜上,首先用脱脂乳封闭膜2 h,并分别用多克隆抗体,PPARγ(1:2000),PPARα(1:2000),CD36(1:1000),SREBP-1c(1:1000),CHREBP(1:3000),GAPDH(1: 5000),ACC(1:3000),P-ACC(1:1000)4 ℃孵育过夜,回收抗体后用PBST洗涤3次,然后分别与辣根过氧化物酶偶联的抗兔或小鼠二抗(1: 5000)室温孵育1 h,经PBST洗涤后,使用ECL Plus(Pierce,New Jersey,USA)检测目标蛋白质。
1.12 统计学处理采用Graph Pad Prism 5对数据进行统计分析。计量资料以均数±标准差描述,独立样本采用t检验,P < 0.05为差异有统计学意义。
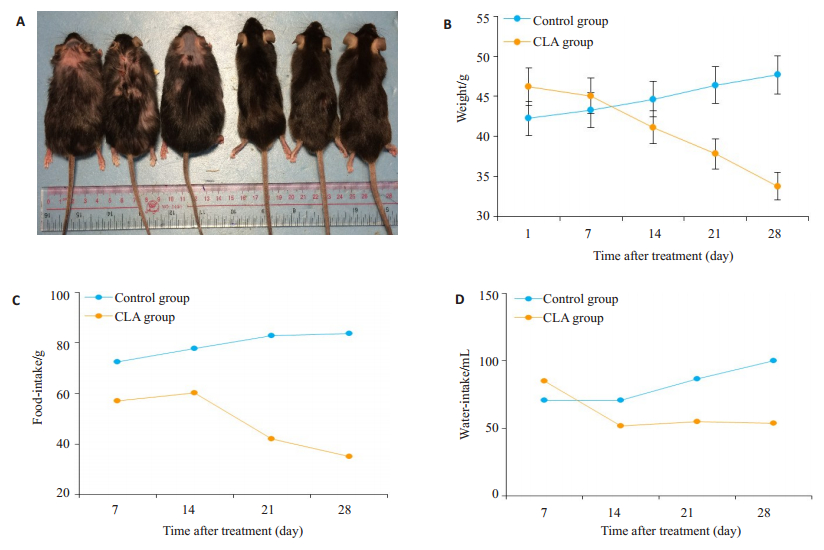
2 结果 2.1 CLA灌胃给药处理后db/db小鼠体质量,进食量,饮水量明显下降与生理盐水组相比,CLA灌胃给药后可明显减少糖尿病小鼠的体质量,进食量与饮水量(图 1)。
|
图 1 CLA灌胃给药处理组与生理盐水组相比db/db小鼠的体质量,进食量,饮水量下降 Fig.1 Comparison of body weight, food intake and water intake of db/db mice between saline and CLA groups. A: Body types in the two groups; B: Body weight in the two groups; C: Food intake in the two groups; D: Water intake in the two groups. CLA: Conjugated linoleic acid. |
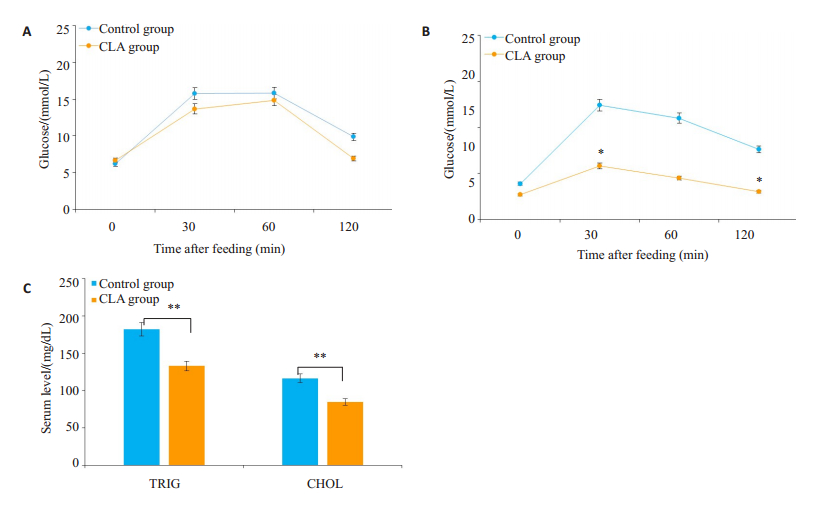
实验开始后15 d和30 d对两组小鼠进行餐后口服糖耐量检测(OGTT)。在第15天,CLA组的餐后血糖与对照组没有出现显著性差异(图 2A)。第30天,CLA组空腹血糖显著低于对照组;口服糖耐量明显升高,血糖变化更加稳定。口服葡萄糖后2 h,血糖基本恢复到正常水平(图 2B)。共轭亚油酸处理30 d后,与对照组相比,共轭亚油酸组三酰甘油与胆固醇水平明显降低(P < 0.01,图 2C)。
|
图 2 与对照组相比,CLA处理组口服糖耐量,三酰甘油,胆固醇水平降低 Fig.2 Comparison of oral glucose tolerance, triglyceride, and cholesterol levels between the control and CLA treatment groups (*P < 0.05, **P < 0.01 vs control group). |
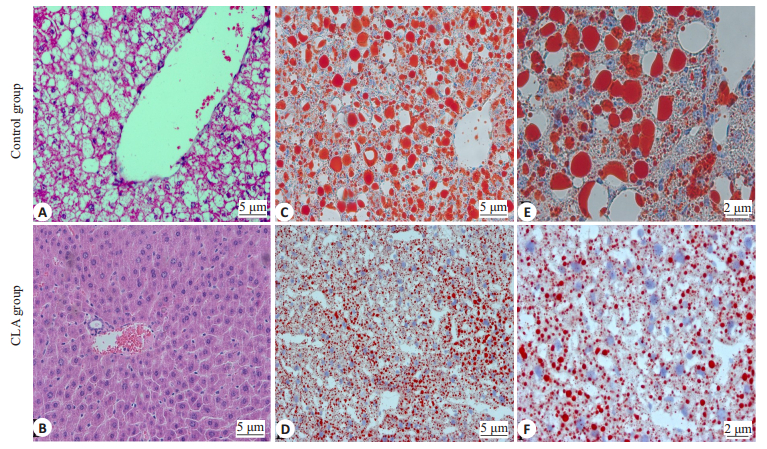
共轭亚油酸处理30 d后,取小鼠肝脏做病理学切片。显微镜下观察肝组织病理切片,结果显示生理盐水处理组肝脏有很多大脂滴空泡液,共轭亚油酸组中有少量小的脂质空泡(图 3A、B)。油红“O”染色显示在生理盐水组肝脏中有大滴脂肪(红色斑块)累积(图 3C、E),CLA组肝脏组织红色脂肪斑块变小,脂质堆积显著减少(图 3D、F)。
|
图 3 小鼠肝脏病理学切片HE染色和油红染色结果 Fig.3 Liver histology in the two groups. (A-D: ×200: E, F: ×400). A: HE staining in control group; B: HE staining in CLA group; C, E: Oil Red O staining in control group; D, F: Oil Red O staining in CLA group. |
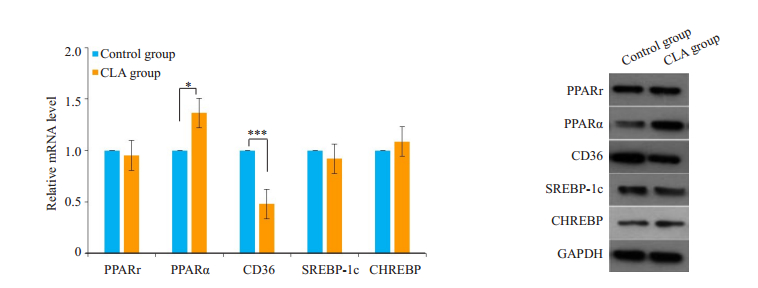
提取两组小鼠肝脏组织RNA和蛋白检测糖脂代谢相关蛋白表达量。共轭亚油酸组小鼠肝脏中CD36 mRNA的水平明显降低(P < 0.001)。PPARα mRNA水平明显提高(P < 0.05)。PPARγ、SREBP-1C、CHREBP等基因mRNA水平没有显著性差异(图 4A)。Western blot结果显示,实验组小鼠肝脏PPARα蛋白表达量明显增加而CD36蛋白表达量明显减少。SREBP-1C蛋白表达量略有减少。其他蛋白的表达在两组间无明显差异(图 4B)。
|
图 4 共轭亚油酸组和对照组小鼠肝脏PPARα、PPARγ、CD36、SREBP-1C和CHREBP基因mRNA和蛋白水平变化 Fig.4 Comparison of the expressions of PPARɑ, PPARγ, CD36, SREBP-1c and CHREBP in the liver of the mice between the two groups. A: mRNA expression levels of the genes in two groups detected by qPCR, *P < 0.05, ***P < 0.001 vs control group; B: Proteins expressions of the genes in the two groups detected by Western blotting. |
将两种CLA分别加入培养好的HepG2细胞中处理若干小时,以LA处理组作为LA对照组,未处理组作为阴性对照(CTL)组。提取各组细胞RNA、蛋白和培养上清检测相关基因表达发现,与CTL组相比LA处理细胞在mRNA水平上各基因无显著性变化,而两种CLA均能在mRNA水平上显著下调CD36(P < 0.01),上调PPARα(P < 0.001)的表达(图 5A)。Western blot结果显示LA处理细胞后PPARα明显下调,CD36表达量明显增多。CLA处理后细胞PPARα显著上调,CD36表达量显著降低(图 5B);同时检测细胞中ACC、P-ACC表达量,结果显示P-ACC含量明显增加(图 5D)。ELISA结果显示CLA能显著增加细胞上清中乙酰辅酶A含量(P < 0.01,图 5C)。
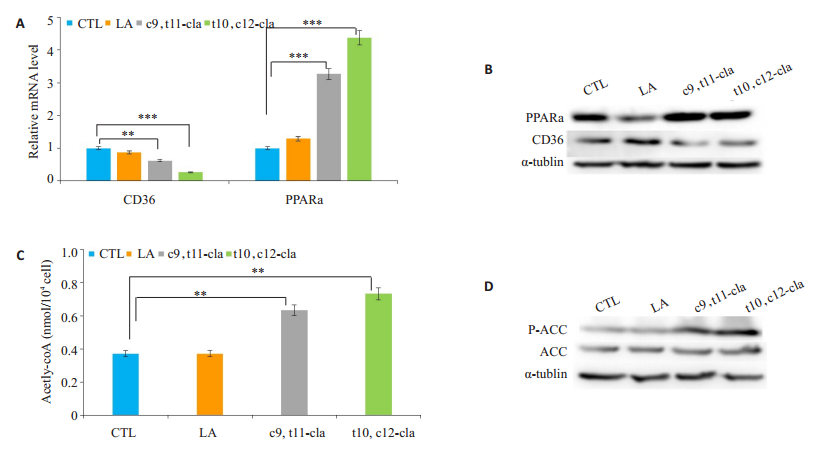
|
图 5 两种共轭亚油酸与亚油酸处理HepG2细胞后脂质相关蛋白PPARα、P-acc、CD36的基因mRNA水平和蛋白水平变化 Fig.5 Comparison of the expression levels of PPARα, P-acc and CD36 in HepG2 cells treated with two conjugated linoleic acid and linoleic acid. A: mRNA expression levels of the genes detected by qPCR; B, D: Proteins expressions detected by Western blotting; C: Detection of acetyl-CoA content in the cell supernatant by ELISA. **P < 0.01, ***P < 0.001 vs control group. |
绝大多数的肥胖和糖尿病患者都是由于不良的饮食结构和生活习惯所致,是能量的摄取和消耗不平衡造成的。其中,脂肪酸摄取过量和脂肪酸构成比例失调是最主要的因素。维持ω-6/ω-3脂肪酸摄取比例平衡是保持健康的必要条件,ω-6脂肪酸摄入过多,或者ω-6/ω-3脂肪酸的比例失调都会诱发肥胖,并进一步导致糖尿病和心脑血管意外等严重疾病[11]。
CLA抗糖尿病、改善胰岛素和脂代谢、减少肥胖引起的炎症动物模型、改善胰岛素抵抗与治疗心血管疾病作用[12-13]。在欧美市场上购买到的共轭亚油酸保健品一般是按照c9,t11-CLA:t10,c12-CLA=1: 1的比例添加。因此,为了验证CLA对肥胖糖尿病小鼠糖脂代谢的影响,本实验决定使用50% c9,t11-CLA和50% t10,c12- CLA混合物给小鼠补充CLA。
我们发现:共轭亚油酸对改善糖尿病小鼠脂质代谢有显著的效果,肝脏组织学切片和油红“O”染色结果显示,经过CLA混合物治疗,小鼠肝脏细胞形态趋于正常,脂肪累积明显减少,表明50% c9,t11-CLA和50% t10,c12-CLA混合物能有效降低肝脏脂质积累,改善肝细胞功能。这些结果表明,CLA混合物对改善糖尿病小鼠糖脂代谢有较好的疗效。
几个与代谢有关的分子表达水平的检测结果显示,CLA混合物能明显上调肝脏组织里转录因子PPARα表达,下调CD36蛋白的表达。PPARα是脂质分子的核受体之一,具有转录因子活性,是调控脂肪与能量代谢的核心分子。PPARα激活或表达上调可以抑制脂肪的合成,促进脂肪的氧化分解,改善脂质代谢[14-15];抑制PPARα会导致肝脏脂肪累积,影响脂质代谢[16]。有研究报道,两种共轭亚油酸异构体c9,t11-CLA和t10,c12-CLA均可激活PPARα,促进脂肪酸氧化和酮生成,降低血糖和调节脂类的吸收和存储[17]。本文的研究结果与上述报道基本一致。CD36是一种位于细胞膜上的脂质转运蛋白,参与脂质内吞和摄取。CD36在单核细胞、血小板、巨噬细胞、微血管内皮细胞、脂肪细胞、肌细胞、肠细胞和肝细胞中都有表达。据报道,肝细胞可以通过CD36吸收脂肪酸,肝脏中CD36的丰度与脂肪肝的严重程度呈正相关[18-19]。最近,一项研究表明,在小鼠和人类中,随着年龄的增长,肝脏CD36的表达水平升高与脂肪肝的易感性有关[25]。本文结果也显示出实验组中肝脏组织CD36表达明显下调。
肥胖与2型糖尿病密切相关。控制体重是预防和治疗糖尿病的有效手段。有数据显示,对于肥胖糖尿病患者,体重下降7%~10%可以显著提高血清胰岛素水平、改善肝功能和生活质量[20-24]。我们的研究结果显示,50% c9,t11-CLA和50% t10,c12-CLA混合物在减低小鼠饮食量、体质量,降低血脂和胆固醇水平的同时,也能降低血糖,提高糖耐量。表明CLA能同时改善体内脂肪和糖的代谢。
此外,共轭亚油酸能显著提高db/db小鼠生活质量。对比两组小鼠形态,实验组小鼠体型较苗条,毛发光滑,而对照组小鼠出现了严重的毛发脱落和四肢溃烂,表明此时对照组小鼠肥胖、糖尿病病症已经比较严重,而共轭亚油酸可以有效地改善糖尿病病症,提高糖尿病小鼠生活质量。
为进一步验证共轭亚油酸对脂质代谢的调节作用,我们利用两种不同的共轭亚油酸处理HepG2细胞并与空白对照组和亚油酸组进行对比。结果也显示与control组和LA组相比用两种CLA处理细胞后转录因子PPARα上调,脂质转运蛋白CD36下调,这与动物实验结果一致。另外,ELISA结果显示CLA能显著上调肝细胞中乙酰辅酶A的含量,乙酰辅酶A是脂肪酸氧化分解的产物,参与多种代谢途径[26-27]。这进一步表明CLA可能是通过上调PPARα来促进脂质氧化分解。同时对于乙酰辅酶A羧化酶(ACC)的检测结果显示两种CLA均能明显增加P-ACC含量,促进ACC磷酸化使其失活。据研究报道ACC受多种转录因子调控参与脂肪合成与沉积,其磷酸化后活性降低从而减少脂质合成[28-30]。这些结果初步揭示共轭亚油酸可能通过激活PPARα,促进脂质氧化分解;抑制CD36表达,减少脂质内吞和摄取;促进ACC磷酸化,减少脂质合成与沉积等多方面发挥调节脂质代谢的作用,但究竟是由哪种效应起主导作用,各基因之间是否有直接联系还需进一步研究。
总之,本研究结果证实,共轭亚油酸能显著改善肥胖糖尿病小鼠的糖脂代谢。其作用与调节PPARα、CD36及ACC相关通路有关。这将为临床上治疗2型糖尿病提供一条新思路,值得更深入的研究。
| [1] |
陈光亮, 李莉, 严尚学, 等. 盐酸西布曲明对营养性肥胖大鼠的减肥作用[J]. 中国临床药理学与治疗学, 2003, 8(1): 55-8. DOI:10.3969/j.issn.1009-2501.2003.01.014 |
| [2] |
Chin SF, Liu W, Storkson JM, et al. Dietary sources of conjugated dienoic isomers of linoleic acid, a newly recognized class of anticarcinogens[J]. Food Compos Anal, 1992, 5(3): 185-97. DOI:10.1016/0889-1575(92)90037-K |
| [3] |
Ma DW, Wierzbicki AA, Field CJ, et al. Conjugated linoleic acid in Canadian dairy and beef products[J]. J Agric Food Chem, 1999, 47(5): 1956-60. DOI:10.1021/jf981002u |
| [4] |
Finer N, Ryan DH, Renz CL, et al. Prediction of response to sibutramine therapy in obese non-diabetic and diabetic patients[J]. Diabetes Obes Metab, 2006, 8(2): 206-13. DOI:10.1111/dom.2006.8.issue-2 |
| [5] |
Belury MA. Dietary conjugated linoleic acid in health:Physiological effects and mechanisms of action[J]. Annu Rev Nutr, 2002, 22(4): 505-31. |
| [6] |
Pariza MW, Ha YL. Conjugated dienoic derivatives of linoleic acid: a new class of anticarcinogens[J]. Med Onco, 1990, 7(2/3): 169-71. |
| [7] |
Sandri EC, Camera M, Sandri EM, et al. Peroxisome proliferatoractivated receptor gamma (PPAR gamma) agonist fails to overcome trans-10, cis-12 conjugated linoleic acid (CLA) inhibition of milk fat in dairy sheep[J]. Animal, 2018, 12(7): 1405-12. DOI:10.1017/S1751731117002956 |
| [8] |
Stangl GI. Conjugated linoleic acids exhibit a strong fat-to-lean partitioning effect, reduce serum VLDL lipids and redistribute tissue lipids in food-restricted rats[J]. J Nutr, 2000, 130(5): 1140-6. DOI:10.1093/jn/130.5.1140 |
| [9] |
Riserus U, Vessby B, Arnlov J, et al. Effects of cis-9, trans-11 conjugated linoleic acid supplementation on insulin sensitivity, lipid peroxidation, and proinflammatory markers in obese men[J]. Am J Clin Nutr, 2004, 80(2): 279-83. DOI:10.1093/ajcn/80.2.279 |
| [10] |
Rungapamestry V, De Roos B, Mcmonagle J, et al. Inter-organ proteomic analysis reveals insights into the molecular mechanisms underlying the anti-diabetic effects of cis-9, trans-11 conjugated linoleic acid in ob/ob mice[J]. Proteomics, 2010, 69(OCE1): E16. |
| [11] |
Simopoulos AP. An increase in the omega-6/omega-3 fatty acid ratio increases the risk for obesity[J]. Nutrients, 2016, 8(3): 128. DOI:10.3390/nu8030128 |
| [12] |
de Roos B, Rucklidge G, Reid M, et al. Divergent mechanisms of cis9, trans11-and trans10, cis12-conjugated linoleic acid affecting insulin resistance and inflammation in apolipoprotein E knockout mice:a proteomics approach[J]. FASEB Journal, 2005, 19(9): 1746. |
| [13] |
Moloney F, Toomey S, Noone E, et al. Antidiabetic effects of cis-9, trans-11-conjugated linoleic acid May be mediated via antiinflammatory effects in white adipose tissue[J]. Diabetes, 2007, 56(3): 574-82. DOI:10.2337/db06-0384 |
| [14] |
Li Y, Zhao JY, Zheng HY, et al. Treatment of nonalcoholic fatty liver disease with total alkaloids in rubus aleaefolius Poir through regulation of fat metabolism[J]. Evid Based Complement Alternat Med, 2014(10): 768540. |
| [15] |
Ferré P. The biology of peroxisome proliferator-activated receptors:relationship with lipid metabolism and insulin sensitivity[J]. Diabetes, 2004, 53(Suppl 1): S43-50. |
| [16] |
Elvira Lopez-Oliva M, Garcimartin A, Munoz-Martinez E. Dietary alpha-lactalbumin induced fatty liver by enhancing nuclear liver X receptor alpha beta/sterol regulatory element-binding protein-1c/PPAR gamma expression and minimising PPAR alpha/carnitine palmitoyltransferase-1 gamma expression and AMP-activated protein kinase alpha phosphorylation associated with atherogenic dyslipidaemia, insulin resistance and oxidative stress in Balb/c mice[J]. Brit J Nutr, 2017, 118(11): 914-29. DOI:10.1017/S000711451700232X |
| [17] |
Sanyal AJ, Campbell-Sargent C, Mirshahi F, et al. Nonalcoholic steatohepatitis:Association of insulin resistance and mitochondrial abnormalities[J]. Gastroenterology, 2001, 120(5): 1183-92. DOI:10.1053/gast.2001.23256 |
| [18] |
Buque X, Cano A, Miquilena-Colina ME, et al. High insulin levels are required for FAT/CD36 plasma membrane translocation and enhanced fatty acid uptake in obese Zucker rat hepatocytes[J]. Am J Physiol Endocrinol Metab, 2012, 303(4): E504-14. DOI:10.1152/ajpendo.00653.2011 |
| [19] |
Petta S, Handberg A, Marchesini G, et al. High sCD36 plasma level is associated with steatosis and its severity in patients with genotype 1 chronic hepatitisC[J]. J Viral Hepat, 2013, 20(3): 174-82. DOI:10.1111/jvh.2013.20.issue-3 |
| [20] |
Zhou J, Jia WP, Bao YQ, et al. Study on prevalence and risk factors of fatty liver of patients with type 2 diabetes[J]. zhonghua yi xue za zhi, 2007, 87(32): 2249-52. |
| [21] |
Targher G, Bertolini L, Padovani RA, et al. Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients[J]. Diabetes Care, 2007, 30(5): 1212-8. DOI:10.2337/dc06-2247 |
| [22] |
Ahmad F, Considine RV, Bauer TL, et al. Improved sensitivity to insulin in obese subjects following weight loss is accompanied by reduced protein-tyrosine phosphatases in adipose tissue[J]. Metabolism, 1997, 46(10): 1140-5. DOI:10.1016/S0026-0495(97)90206-7 |
| [23] |
Berne C. The orlistat Swedish type 2 diabetes study group:a randomized study of orlistat in combination with a weight management programme in obese patients with type 2 diabetes treated with metformin[J]. Diabet Med, 2005, 22: 612-8. DOI:10.1111/dme.2005.22.issue-5 |
| [24] |
Vettor R, Serra R, Fabris R, et al. Effect of sibutramine on weight management and metabolic control in type 2 diabetes-A metaanalysis of clinical studies[J]. Diabetes Care, 2005, 28(4): 942-9. DOI:10.2337/diacare.28.4.942 |
| [25] |
García-Monzón C, Lo Iacono O, Crespo J, et al. Increased soluble CD36 is linked to advanced steatosis in nonalcoholic fatty liver disease[J]. Eur J Clin Invest, 2014, 44(1): 65-73. DOI:10.1111/eci.2013.44.issue-1 |
| [26] |
Theodoulou FL, Sibon OC, Jackowski SA. Coenzyme a and its derivatives:Renaissance of a textbook classic[J]. Biochem Soc Trans, 2014, 42(4): 1025-32. DOI:10.1042/BST20140176 |
| [27] |
Shi L, Tu BP. Acetyl-CoA and the regulation of metabolism:mechanisms and consequences[J]. Curr Opin Cell Biol, 2015, 33: 125-31. DOI:10.1016/j.ceb.2015.02.003 |
| [28] |
李亮, 程彦伟. 乙酰辅酶A羧化酶在治疗肥胖中的潜在作用[J]. 生命的化学, 2007(2): 180-2. DOI:10.3969/j.issn.1000-1336.2007.02.030 |
| [29] |
Terpstra AM, Beynen AC, Everts H, et al. The decrease in body fat in mice fed conjugated linoleic acid is due to increases in energy expenditure and energy loss in the excreta[J]. J Nutr, 2002, 132(5): 940-5. DOI:10.1093/jn/132.5.940 |
| [30] |
Bassaganya-Riera J, Hontecillas-Magarzo R, Bregendahl K, et al. Effects of dietary conjugated linoleic acid in nursery pigs of dirty and clean environments on growth, empty body composition, and immune competence[J]. J Anim Sci, 2001, 79(3): 714-21. DOI:10.2527/2001.793714x |
 2019, Vol. 39
2019, Vol. 39

