近年来,计算机断层扫描(CT)、磁共振成像(MRI)、活组织检查及其他蛋白质生物标志物检测等方法在NSCLC的诊断中已非常成熟,但是其敏感性及特异性在NSCLC的早期诊断中仍有一定的局限性。因此,探究一种新型生物标志物用于NSCLC早期诊断极其迫切。
miRNA逐渐成为在诊断、预后、个性化治疗和疾病管理等方面潜在有用的生物标志物[1-2]。尽管miRNA在临床实践中显示出巨大的应用前景,但是要获得组织活检是较为困难的,因此不能用于恶性肿瘤患者的临床筛查。最近研究证明,miRNA也能稳定地存在血液中,这为恶性肿瘤患者的无创诊断应用带来了希望[3]。到目前为止,miRNA-23a和miRNA-451在乳腺癌[4-6]、胃癌[7]、胰腺癌[8]及食管鳞状细胞癌[9]等恶性肿瘤中已有相关报道,但在NSCLC中尚少研究,尤其作为NSCLC的潜在生物标志物方面的深入研究未见报道。
本研究通过实时荧光定量PCR(qRT-PCR) NSCLC病例和健康对照miRNA23-a及miRNA-451在组织和血浆中的表达差异及相关性。与传统肿瘤标志物CEA相比,miRNA-23a和miRNA-451联合检测时,AUCROC/灵敏度/特异度均得到改善。本研究通过瞬时转染技术,在NSCLC细胞系A549中分别抑制miRNA-23a和miRNA-451的表达,进一步探究沉默miRNA后对其靶标的影响,miRNA-23a及miRNA-451在NSCLC的潜在诊断生物标志物。
1 资料和方法 1.1 患者和标本所有受试者(50名健康对照人员和50名NSCLC患者)于2016年1月~2017年8月在南方医科大学深圳医院进行招募。NSCLC患者包括腺癌25例、鳞状细胞癌20例、大细胞癌5例。根据TNM分期,Ⅰ/Ⅱ期34例,Ⅲ/Ⅳ期16例。在手术切除前,所有NSCLC患者均未接收术前放疗及化疗。肿瘤分期根据国际抗癌联盟(UIAC)最新版肺癌TNM分期标准进行确定。通过外科手术获得NSCLC患者的肿瘤组织及癌旁组织。使用乙二胺四乙酸(EDTA)抗凝采血管采集NSCLC患者术前和术后血液样本,及健康对照人员血液样本,采集量为5 mL。以癌旁组织或健康人员作为对照组。NSCLC患者的临床病理特征总结于表 1。(在收集肿瘤组织和血液样本前,均获得参与者的书面知情通知书。该研究得到南方医科大学深圳医院伦理委员会批准。)
| 表 1 miRNA-23a及miRNA-451的表达与NSCLC临床病理特征的相关性 Tab.1 Correlation of miRNA-23a and miRNA-451 expressions with clinicopathological characteristics of patients with NSCLC |
Trizol RNA试剂(Invitrogen),MiRNeasy Serum/Plasma试剂盒(Qiagen),HG TaqMan miRNA反转录试剂盒(新海基因,中国),HG TaqMan miRNA定量PCR试剂盒(新海基因),SYBR Green Master Mix(Thermo Fish scientific)试剂盒。
1.2.2 仪器Biosystems7500实时PCR系统(Thermo Fisher),SDS软件2.1版(Applied Biosystem;Thermo Fisher scientific)。
1.3 方法 1.3.1 提取RNA使用Trizol RNA试剂(Invitrogen)从肿瘤组织中提取RNA, 将RNA沉淀溶解于20 μL RNA储存缓冲液(Ambion)中并在-70 ℃下储存直至使用。使用MiRNeasy Serum/Plasma试剂盒(Qiagen)提取血浆中的总RNA。具体方法可参照试剂盒说明书。
1.3.2 实时荧光定量PCR(qRT-PCR)分析使用TRIzol(Invitrogen)试剂盒提取组织的总RNA,MiRNeasy Serum/Plasma试剂盒(Qiagen)提取血浆中的总RNA,再使用HG TaqMan miRNA反转录试剂盒(新海基因)进行逆转录获得cDNA,使用HG TaqMan miRNA定量PCR试剂盒(新海基因)及Biosystems7500实时PCR系统(Thermo Fisher)进行qRT-PCR检测miRNA。该试剂盒采用了特异性上游引物和采用FAM标记的特异性miRNA TaqMan探针,使用TaqMan RNU6B miRNA定量PCR试剂盒(新海基因)作为miRNA的标准对照,去离子水作为阴性对照。在检测SPRY2 mRNA和MIF mRNA的表达时,使用SYBR Green Master Mix(Thermo Fish scientific)试剂盒,严格按照厂家说明书进行操作,GAPDH(Thermo Fish scientific)作为SPRY2 mRNA和MIF mRNA表达的标准对照,去离子水作为阴性对照。热循环条件是在95 ℃下预变性15 min,然后在95 ℃下进行循环10 s并在60 ℃下退火/延伸1 min,共40个循环。使用SDS软件2.1版(Applied Biosystem;Thermo Fisher scientific)计算定量循环荧光值Cq,并使用2-△△Cq方法计算相对表达水平。引物序列如下:SPRY2 mRNA正向:5'-TACTCCGCGTGCGCTTGT AG-3',反向:5'-GGCTTTGCACCAACCCCTCT-3';MIF mRNA正向:5'-CCACCTTCGCCTAAGAGCCG-3',反向:5'-CACCAGAAGGTTGGGGTGGG-3';GAPDH正向:5'-GCTGGCCCGATTTCTCCTCC-3',反向:5'-TGACTCAGCTTCTCCCGGCT-3'。
1.3.3 细胞转染人类非小细胞肺癌细胞A549(科佰生物科技)。miRNA-23a抑制剂及阴性对照(NC)抑制剂,miRNA-451抑制剂及阴性对照(NC)抑制剂均(锐博生物科技)。Lipofectamine 2000(Thermo Fisher)按照制造商的方案进行细胞转染。
1.4 统计学处理PRISM 5.0版和SPSS23.0版进行所有统计学分析。使用独立样本t检验或单向ANOVA评估两种miRNA的表达水平与各种临床病理学参数之间的关系,分析两组间差异使用t检验。使用受试者工作特征曲线(ROC曲线)和线下面积(AUC)来评估血浆miRNA作为NSCLC的诊断能力。Youden指数的最大值作为选择最佳截止点的标准。使用Spearman等级分析来评估血浆和肿瘤组织之间miRNA水平的相关性。P<0.05表示有统计学意义。
2 结果 2.1 通过qRT-PCR验证miRNA在肿瘤组织和血浆中的表达差异结果表明,miRNA-23a和miRNA-451的表达水平在肿瘤组织和血浆中表现出相同的趋势。与对照组相比,NSCLC组的miRNA-23a在肿瘤组织(图 1A)和血浆(图 1B)中显著升高,P<0.05;而miRNA-451在肿瘤组织(图 1C)和血浆(图 1D)中则显著下降。
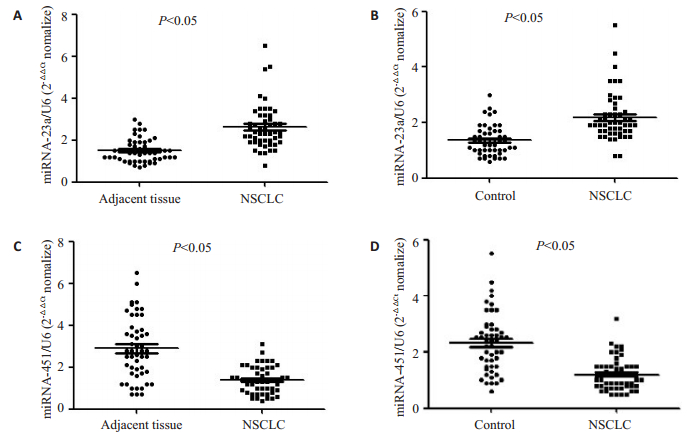
|
图 1 qRT-PCR方法检测miRNA的表达水平 Fig.1 Expression of miRNA-23a and miRNA-451 in NSCLC patients detected by qRT-PCR. miRNA-23a was significantly elevated in the tumor tissue (A) and plasma (B) of NSCLC patients (n=28), but miRNA-451 was significantly decreased in the tumor tissue (C) and plasma (D) (n=28). |
如图 2所示,miRNA在血浆和肿瘤组织的相关性分别为:miRNA-23a(y=0.693,图 2A),miRNA-451(y= 0.821,图 2B)。
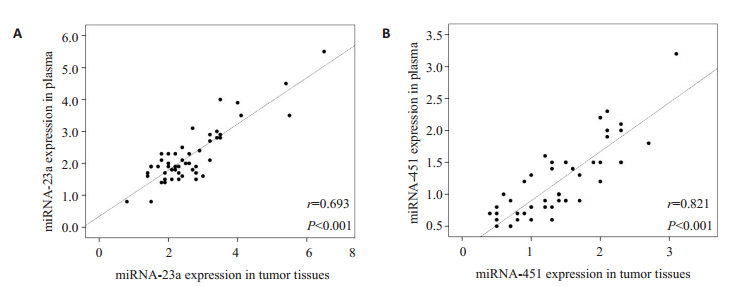
|
图 2 评估血浆及肿瘤组织中的miRNA-23a(A)和miRNA-451(B)表达的相关性 Fig.2 Correlation analysis of miRNA-23a (A) and miRNA- 451 (B) levels between the plasma and tumor tissues. |
以手术前相比,手术后1个月miRNA表达水平有显著性变化,miRNA-23a(图 3A)表达明显受到抑制,反而,miRNA-451(图 3B)表达明显升高(P<0.05)。
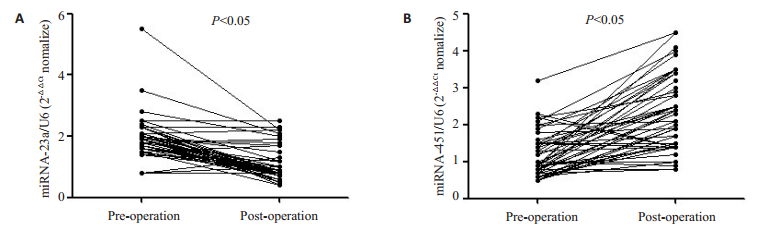
|
图 3 血浆中差异表达的miRNA起源 Fig.3 Origin of differentially expressed miRNAs in the plasma. miRNA-23a (A) expression in the plasma was significantly reduced and miRNA-451 (B) was significantly increased postoperatively in NSCLC patients. |
通过使用受试者工作特征曲线(ROC曲线)和线下面积(AUC)来研究miRNA在NSCLC中的临床诊断意义,包括50名NSCLC和50名健康对照人员。miRNA-23a/miRNA-451的AUCROC分别为0.831/0.835。选择约登指数(即敏感度+特异度-1)最大值时的特异度和灵敏度。miRNA-23a/miRNA-451的灵敏度分别为84%/72%,特异度分别为70%/82%。而传统的肿瘤标志物CEA的AUCROC/灵敏度/特异度分别为0.711/76%/58%。这些结果表明,miRNA-23a和miRNA-451可作为NSCLC筛选的有潜力生物标志物,综合分析其诊断性能稍高于CEA。若2种miRNA并联检测时,AUCROC/灵敏度/特异度分别为0.900/78%/86%。与单项miRNA检测或CEA相比,提高了NSCLC的诊断性能(图 4)。
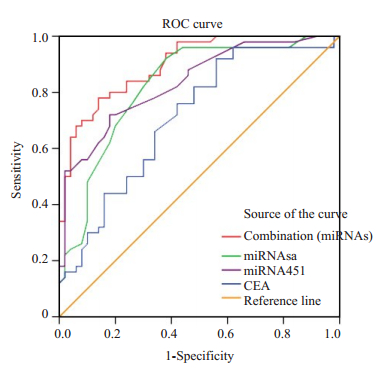
|
图 4 健康对照人员和NSCLC患者的血浆miRNA-23a和miRNA-451的ROC曲线 Fig.4 ROC curves of plasma miRNA-23a and miRNA-451 levels from NSCLC patients and healthy controls. |
与阴性对照抑制剂组(NC)相比,miRNA-23a和miRNA-451抑制效果明显(图 5A、B,P<0.01)。与阴性对照抑制剂组(NC)相比,抑制miRNA-23a的A549细胞中SPRY2 mRNA表达水平显著升高(图 5C,P<0.01);同样,miRNA-451下调后提高了MIF miRNA的表达水平,具有显著性差异(图 5D,P<0.01)。
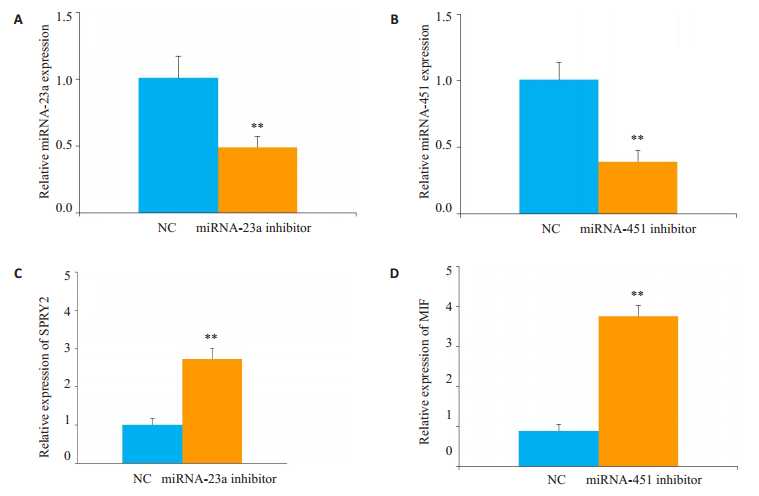
|
图 5 沉默miRNA后对其靶标的影响 Fig.5 Effect of inhibiting miRNA-23a and miRNA-451 on their respective target in A549 cells detected using qRTPCR. miRNA-23a(A) and miRNA-451(B) were significantly inhibited (**P < 0.01). C: Expression level of SPRY2 mRNA in A549 cells transfected with miRNA-23a inhibitor or NC inhibitor (**P < 0.01); D: miRNA-451 inhibitor increased the expression level of MIF miRNA in A549 cells (**P < 0.01). NC: Negative control inhibitor group. |
现阶段已证实NSCLC肿瘤组织中特异性miRNA在癌症诊断和预后具有潜在的价值[10],但对于NSCLC患者血浆中miRNA的诊断价值尚少报道。在我们的研究中,通过使用qRT-PCR方法,对NSCLC患者的肿瘤组织和血浆中的miRNA-23a和miRNA-451进行分析,结果显示miRNA-23a和miRNA-451的表达水平在肿瘤组织和血浆中表现出相同的趋势,并且呈高度相关。与对照组相比,NSCLC组的miRNA-23a在肿瘤组织和血浆中显著升高;然而miRNA-451在肿瘤组织和血浆中则显著下降。以此同时,我们通过分析miRNA在NSCLC患者手术前和手术后血浆中的表达差异,为血浆的miRNA来自于肿瘤组织并且可以实践于临床提供了可靠的证据。
Wei-Qing Qu课题组发现miRNA-23a的表达水平在NSCLC组织中,与癌旁组织相比显著上调,表明了miRNA-23a可能在NSCLC中发挥致癌作用[11]。Wang等人报道,miRNA-451是NSCLC组织中下调最多的miRNA,其通过靶向ras相关蛋白14(RAB14)在NSCLC中起肿瘤抑制剂的作用[12]。在本研究中,我们通过实时荧光定量PCR(qRT-PCR)测定NSCLC组织中miRNA-23a和miRNA-451的表达水平,结果与上述报道相符。同时,我们还检测了血浆中miRNA-23a和miRNA-451的表达水平,分析miRNA-23a和miRNA-451在对照组及NSCLC组的差异,使用受试者工作特征曲线(ROC曲线)和线下面积(AUC)评估这2种miRNA及传统肿瘤标志物CEA在NSCLC中的诊断能力,结果显示miRNA23-a与miRNA-451的综合诊断性能稍高于CEA,可能是NSCLC的可靠诊断工具。
Sprouty同系物2(SPRY2)是一个重要的肿瘤抑制因子,并受许多miRNA的调节[13-15]。研究表明在胃癌中miR-23a能够直接靶向SPRY2,通过抑制SPRY2激活ERK信号传导,从而促进AGS细胞的增殖、迁移和侵袭[16]。巨噬细胞移动抑制因子(MIF)在癌症中发挥多功能作用,如增殖、迁移、微环境调节、新血管生成、自噬和耐药[17]。Liu等[18]证实了MIF是miRNA-451的直接靶标,在鼻咽癌中miRNA-451的上调通过直接靶向MIF降低细胞增殖,集落形成,细胞迁移和体外侵袭,并抑制体内一种抑制肿瘤生长。然而,SPRY2,MIF分别为miRNA-23a和miRNA-451的靶基因在NSCLC的作用机制尚未见研究。在本研究中,我们通过瞬时转染技术,在NSCLC细胞系A549中分别抑制miRNA-23a和miRNA- 451的表达,使用qRT- PCR方法检测抑制miRNA细胞中SPRY2及MIF的表达水平。初步实验提示SPRY2,MIF可能是miRNA-23a及miRNA-451在NSCLC的潜在作用靶标。
miRNA-451位于染色体17q11.2,并使用miRNA-144逆转的蛋白质进行转录[19]。miRNA-451则在结直肠癌、乳腺癌、肝细胞癌、食管鳞癌、膀胱癌中具有抑癌功能,在肿瘤组织中异常下调[6, 20-23]。这些结果表明miRNA-451是癌症发生和发展的重要调节因子,可能是早期筛查的潜在生物标志物。在本次实验中,miRNA-451在NSCLC肿瘤组织及患者血浆中显著下调。
目前,许多研究表明,血浆中miRNA- 23a或miRNA-451的单独表达亦或是与其他miRNA联合表达,都可能与癌症患者的特定临床结果相关,这表明miRNA-23a和miRNA-451作为非侵袭性的生物标志物在癌症诊断中的潜力[24-25]。Yong等[26]发现miRNA-23a在结肠癌患者血清中显著上调,当结合miRNA-193a-3p和miRNA-388-5p时,ROC曲线面积为0.887(灵敏度80.0%,特异性84.4%,准确度83.3%),证明其作为结直肠癌分级诊断的能力。Redova等人发现miRNA-451在肾癌患者血清中显著下调,miRNA-451和miRNA-378结合时,灵敏度为81%,特异性为83% [27]。本研究结果显示,miRNA-23a和miRNA-451均具有高度灵敏性和特异性,敏感度分别为84%/72%,特异度分别为70%/82%。而传统的肿瘤标志物CEA的AUCROC/灵敏度/特异度分别为0.711/76%/58%。结果提示:miRNA-23a和miRNA-451可作为NSCLC筛选的有潜力生物标志物,综合分析其诊断性能稍高于CEA。而当这三种miRNA联合检测时,AUCROC/灵敏度/特异度分别为0.900/78%/86%。与单项miRNA检测或CEA相比,显著性地提高了NSCLC的诊断性能。这表明miRNA-23a和miRNA-451联合检测可能是NSCLC的可靠诊断工具。
SPRY2是Sprouty家族成员并抑制受体酪氨酸激酶信号传导。已有研究表明,SPRY2在不同人类癌症中发挥抑癌作用[14, 28-29]。SPRY2在NSCLC中主要通过拮抗不同水平浓度的受体酪氨酸诱导的信号传导起到抑癌作用[30]。巨噬细胞移动抑制因子(MIF)是一种进化上高度保守的多效趋化因子,由Bloom和Bennett于1966年鉴定为T细胞分泌的蛋白质并抑制巨噬细胞的迁移。近年来,越来越多研究表明MIF参与致癌作用,在头颈癌、肝癌、卵巢癌及非小细胞肺癌等人类癌症的组织及细胞中呈过表达状态[31-34]。在本研究中,miRNA-23a抑制剂能显著地提高A549细胞中SPRY2 mRNA的表达水平;同样,敲低miRNA-451后,MIF mRNA显著升高,结果提示SPRY2,MIF可能是miRNA-23a及miRNA-451在NSCLC的潜在作用靶标。
| [1] |
White NM, Fatoohi E, Metias M, et al. Metastamirs: a stepping stone towards improved cancer management[J]. Nat Rev Clin Oncol, 2011, 8: 75-84. DOI:10.1038/nrclinonc.2010.173 |
| [2] |
Metias SM, Lianidou E, Yousef GM. MicroRNAs in clinical oncology: at the crossroads between promises and problems[J]. J Clin Pathol, 2009, 62: 771-6. DOI:10.1136/jcp.2009.064717 |
| [3] |
Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci USA, 2008, 105: 10513-8. DOI:10.1073/pnas.0804549105 |
| [4] |
Wu Q, Lu Z, Li H, et al. Next-generation sequencing of microRNAs for breast cancer detection[J]. J Biomed Biotechnol, 2011, 2011: 597145. |
| [5] |
Wu Q, Wang C, Lu Z, et al. Analysis of serum genome-wide microRNAs for breast cancer detection[J]. Clin Chim Acta, 2012, 413: 1058-65. DOI:10.1016/j.cca.2012.02.016 |
| [6] |
ZS Wu, Q Wu, CQ Wang, et al. MiR-339-5p inhibits breast cancer cell migration and invasion in vitro and may be a potential biomarker for breast cancer prognosis[J]. BMC Cancer, 2010, 10: 542-51. DOI:10.1186/1471-2407-10-542 |
| [7] |
Nakatani F, Ferracin M, Manara MC, et al. miR-34a predicts survival of Ewing's sarcoma patients and directly influences cell chemo-sensitivity and malignancy[J]. J Pathol, 2012, 226: 796-805. DOI:10.1002/path.3007 |
| [8] |
Frampton AE, Castellano L, Colombo T, et al. Integrated molecular analysis to investigate the role of microRNAs in pancreatic tumour growth and progression[J]. Lancet, 2015, 385(Suppl. 1): S37. |
| [9] |
Komatsu S, Ichikawa D, Kawaguchi T, et al. Plasma microRNA profiles: Identification of miR-23a as a novel biomarker for chemoresistance in esophageal squamous cell carcinoma[J]. Oncotarge, 2016, 7: 62034-48. |
| [10] |
Pu M, Li C, Q i X, et al. MiR-1254 suppresses HO-1 expression through seed region-dependent silencing and non-seed interaction with TFAP2A transcript to attenuate NSCLC growth[J]. PLOS Genet, 2017, 13: e1006896. DOI:10.1371/journal.pgen.1006896 |
| [11] |
Qu WQ, Liu L, YuZ. Clinical value of microRNA-23a upregulation in non-small cell lung cancer[J]. Int J Clin Exp Med, 2015, 8(8): 13598-603. |
| [12] |
Wang R, Wang ZX, Yang JS, et al. MicroRNA-451 functions as a tumor suppressor in human non-small cell lung cancer by targeting ras-related protein 14 (RAB14)[J]. Oncogene, 2011, 30: 2644-58. DOI:10.1038/onc.2010.642 |
| [13] |
Chandramouli S, Yu CY, Yusoff P, et al. Tesk1 interacts with Spry2 to abrogate its inhibition of ERK phosphorylation downstream of receptor tyrosine kinase signaling[J]. J Biol Chem, 2008, 283: 167991. |
| [14] |
Wu G, Qin XQ, Guo JJ, et al. AKT/ERK activation is associated with gastric cancer cell resistance to paclitaxel[J]. Int J Clin Exp Pathol, 2014, 7: 144958. |
| [15] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using realtime quantitative PCR and the 2(Dalta Dalta C (T)) method[J]. Methods, 2001, 25: 4028. |
| [16] |
YingJia Li, Hui Chen, PengFei She, et al. microRNA23a promotes cell growth and metastasis in gastric cancer via targeting SPRY2mediated ERK signaling[J]. Oncol Letters, 2018, 15: 8433-41. |
| [17] |
Richard V, Kindt N, Saussez S. Macrophagemigration inhibitory factor involvement inbreast cancer (Review)[J]. Int J Oncol, 2015, 47: 1627-33. DOI:10.3892/ijo.2015.3185 |
| [18] |
Liu N, Jiang N, Guo R, et al. MiR-451 inhibits cell growth and invasion by targeting MIF and is associated with survival in nasopharyngeal carcinoma[J]. Mol Cancer, 2013, 12: 123. DOI:10.1186/1476-4598-12-123 |
| [19] |
Dore LC, Amigo JD, Dos SC, et al. A GATA-1-regulated microRNA locus essential for erythropoiesis[J]. Proc Natl Acad Sci, 2008, 105: 3333-8. DOI:10.1073/pnas.0712312105 |
| [20] |
MD Jansson, ND Damas, Lees M, et al. miR-339-5p regulates the p53 tumor-suppressor pathway by targeting MDM2[J]. Oncogene, 2015, 34: 1908-18. DOI:10.1038/onc.2014.130 |
| [21] |
YL Wang, CM Chen, XM Wang, et al. Effects of miR-339-5p on invasion and prognosis of hepatocellular carcinoma[J]. Clin Res Hepatol Gastroenterol, 2016, 40: 51-6. DOI:10.1016/j.clinre.2015.05.022 |
| [22] |
杨艳. miRNA-21、miRNA-451在食管鳞癌患者血清中的表达和放疗疗效评估中的作用[D].安徽: 蚌埠医学院, 2017: 1-46. http://cdmd.cnki.com.cn/Article/CDMD-10367-1017112463.htm
|
| [23] |
包佑根, 巢海潮, 朱遵伟, 等. miRNA-451在膀胱癌组织中的表达及其临床意义[J]. 实用癌症杂志, 2016, 31(11): 1754-8. DOI:10.3969/j.issn.1001-5930.2016.11.005 |
| [24] |
Wang N, Tan HY, Feng YG, et al. microRNA-23a in human cancer: Its roles, mechanisms and therapeutic relevance[J]. Cancers, 2019, 11(1): 7. |
| [25] |
Li ZZ, Li YY, Fu J, et al. Clinical utility of microRNA-451 as diagnostic biomarker for human cancers[J]. Biosci Rep, 2019, 39(1): BSR20180653. DOI:10.1042/BSR20180653 |
| [26] |
Yong FL, Law CW, Wang CW. Potentiality of a triple microRNA classifier: MiR-193a-3p, miR-23a and miR-338-5p for early detection of colorectal cancer[J]. BMC Cancer, 2013, 13: 280. DOI:10.1186/1471-2407-13-280 |
| [27] |
Redova M, Poprach A, Nekvindova J, et al. Circulating miR-378 and miR-451 in serum are potential biomarkers for renal cell carcinoma[J]. J Transl Med, 2012, 10: 55. DOI:10.1186/1479-5876-10-55 |
| [28] |
Liu C, Liang S, Xiao S, et al. MicroRNA-27b inhibits Spry2 expression and promotes cell invasion in glioma U251 cells[J]. Oncol Letters, 2015, 9: 1393-7. DOI:10.3892/ol.2015.2865 |
| [29] |
Chandramouli S, Yu CY, Yusoff P, et al. Tesk1 interacts with Spry2 to abrogate its inhibition of ERK phosphorylation downstream of receptor tyrosine kinase signaling[J]. J Biol Chem, 2008, 283: 1679-91. DOI:10.1074/jbc.M705457200 |
| [30] |
李锦意, 柳莉丹, 陈永锋. Sprouty蛋白与疾病关系的研究进展[J]. 皮肤性病诊疗学志, 2018, 25(2): 107-10. |
| [31] |
Kindt N, Preillon J, Kaltner H, et al. Macrophage migration inhibitory factor in head and neck squamous cell carcinoma: Clinical and experimental studies[J]. J Cancer Res Clin Oncol, 2013, 139: 727-37. DOI:10.1007/s00432-013-1375-7 |
| [32] |
Wang D, Luo L, Chen W, et al. Significance of the vascular endothelial growth factor and the macrophage migration inhibitory factor in the progression of hepatocellular carcinoma[J]. Oncol Rep, 2014, 31: 11991204. |
| [33] |
Krockenberger M, Kranke P, Hausler S, et al. Macrophage migration-inhibitory factor levels in serum of patients with ovarian cancer correlates with poor prognosis[J]. Anticancer Res, 2012, 32: 5233-8. |
| [34] |
赵娣. CD163与MIF在非小细胞肺癌的表达及对血管生成的影响[D].河南: 郑州大学, 2018: 1-49. http://cdmd.cnki.com.cn/Article/CDMD-10459-1018107044.htm
|
 2019, Vol. 39
2019, Vol. 39

