创伤性脑损伤(TBI)是常见的外伤类型之一。TBI的发病率高、死亡率与致残率高,其中还具有中低年龄段、男性发病率高的特点,造成社会和家庭的极大负担,威胁公共卫生和社会经济发展[1-2]。
成熟分化的神经元细胞曾被认为不具有自发再生能力[3-4],现有观点认为轴突再生障碍和神经前体细胞分化,与宿主细胞所处的微环境有关[5]。脂肪干细胞[6],是从脂肪组织中分离培养出的具有多项分化能力的脂肪来源干细胞(ADSCs),近年被尝试用于自体干细胞移植治疗神经系统疾病[7-10]。施旺细胞(SCs)可分泌多种神经营养因子、改善神经细胞微环境,并经广泛体外实验证实其可诱导各种多潜能干细胞向神经细胞分化[11]。被移植的细胞与宿主细胞间能否成功建立信息连接,是重建中枢神经系统功能性网络的关键,这一过程早期取决于能否建立通畅的缝隙连接通讯[12]。
细胞缝隙连接(GJ)是由缝隙连接蛋白(Cx)组合形成连接子并在相邻细胞膜之间衔接而成的膜通道结构[13-14]。细胞间通讯方式中以缝隙连接最为直接、快捷[15]。目前已发现20余种Cx,其中Cx43在神经系统,特别是星形胶质细胞中分布最广[16-17]。Cx43被证实可通过多种途径发挥抑制细胞凋亡[18-21]、促进创面愈合[22]、保护神经元[23]的作用。Cx43功能受连接蛋白磷酸化状态调节。许多生长因子均可参与蛋白磷酸化调节[24],然而,神经生长因子对间隙连接功能的影响尚不清楚[25]。在前期研究中,我们成功完成了从SD大鼠脂肪组织中分离、纯化ADSCs细胞,通过参考体外诱导骨髓基质干细胞(BMSCs)分化为施旺细胞的方法[40-41]获得类施万细胞,并表达施万细胞标志物GFAP,S-100。称其为脂肪干细胞来源的施旺细胞(ADSCs-SCs)。验证了ADSCs-SCs有可以和神经元及胶质细胞形成Cx43缝隙连接的功能。利用RNAi慢病毒转染技术抑制ADSCs-SCs中的Cx43表达。本次研究中,我们进一步在动物模型上移植培养的ADSCs细胞、ADSCs-SCs细胞和Cx43表达抑制的ADSCs-SCs细胞,通过测定动物模型损伤灶的神经生长因子(NGF)表达水平,来分析Cx43的可能作用机制。
1 材料和方法 1.1 材料 1.1.1 实验动物健康SD大鼠40只,雄性,SPF级,体质量200±20 g,无全身及运动异常。于中南大学湘雅医学院动物实验中心屏障内常规食水饲喂适应1周后开始实验。
1.1.2 主要试剂与仪器Revert Aid H Minus First Strand cDNA Synthesis Kit试剂盒(Fermentas)、SYBR GreenPCR Master Mix试剂盒(ABI)、DNase I(Fermentas)、NGF抗体(一抗)(Abcam)、β-Actin抗体(一抗)(SANTA)、Goat Anti Rabbit IgG/HR(二抗)(Abcam)、Goat Anti Mouse IgG/HRP(二抗)(SANTA)、PBS缓冲液粉剂(北京赛驰生物科技有限公司)、手术显微镜和大鼠脑立体定向仪(中南大学湘雅三医院神经外科)、高速离心机(SIGMA)、荧光显微镜(Leica Corp)、Realtime-PCR仪, ABI 7900型(ABI)、水平电泳槽JYSPC(北京君意东方仪器公司)、分光光度计(Nano Drop2000)、DG-Ⅲ双稳数显电泳仪(北京鼎国生物技术发展中心)、Western blot电泳仪及附件(BIO-RAD)、数码相机Canon IXUS65。
1.1.3 移植用的细胞由前期实验提供分离自大鼠脂肪组织的ADSCs,及其诱导后得到ADSC-SCs,并进行GFAP、S-100、P75免疫细胞化学染色结果示阳性。细胞形态及染色结果曾发表于《杨靓.脂肪干细胞来源施万细胞在大鼠脑损伤中的应用[D].中南大学, 2011》。ADSC-SCs经慢病毒转染后获得Cx43沉默细胞与NC对照细胞。
1.2 实验方法 1.2.1 动物模型制备SD大鼠麻醉消毒后,沿中线无菌切开头皮,暴露颅骨,显微镜下于颅骨冠状缝后2 mm至冠状缝前4 mm、中线左侧旁开4 mm形成骨窗。划开术区硬脑膜,毁损骨窗下运动区2 mm深度皮层,制成2 mm×2 mm×2 mm空腔,缝合切口。麻醉清醒后观察大鼠,如出现站立不稳、一侧肢体瘫痪,提尾时向一侧转圈等神经功能受损征象为阳性。皮下注射环孢霉素A(15 mg·kg-1·d-1)以预防感染直至处死动物。恢复饲养7 d,参考改良Bederson评分对手术动物进行评估。(改良Bederson评分标准为无神经损伤症状0分;提尾悬空时,对侧前爪不能完全伸展1分;前肢抵抗对侧推力能力下降2分;向对侧转圈3分)。选取3分大鼠入选、分组等待移植,共20只成功造模,剔除其余死亡动物、造模评分不足、备用动物。
1.2.2 Western blot法对移植细胞Cx43水平检测由前期实验提供的ADSCs-SCs组A1/2/3,慢病毒-NC转染的施旺细胞为组B1/2/3,慢病毒Cx43沉默施旺细胞为组C1/2/3。对其进行胰蛋白酶处理、离心、收集,吹洗,制成1×109/L浓度细胞悬液。以Western-blot检测移植细胞Cx43表达水平。
1.2.3 动物模型分组及细胞移植成功建模SD大鼠共20只,随机分为4组,每组各5只:在手术后第7天,称重后原方案麻醉、原路开颅,在显微镜下处理局部脑组织,清理预置的移植腔,止血。以10 μL微量进样器,按组别分别注入生理盐水10 μL(组1对照组)、10 μL ADSCs细胞悬液(组2)、10 μL ADSCs-SCs细胞悬液(组3)或10 μL Cx43沉默ADSCs-SCs细胞悬液(组4)。然后取小块人工硬脑膜覆盖移植腔,表明再以筋膜缝合覆盖,缝合头皮。麻醉苏醒后观察手术动物生命体征。稳定后继续常规饲养及皮下注射抗生素。定期对动物进行Bederson评分与Garcia JH(从大鼠自主运动、体态对称性、前肢伸展功能、网屏实验、身体双侧触觉、双侧胡须反射等6个方面评定大鼠神经功能损伤程度,功能正常时得分最高18分)评分。
移植后第7天(6 dpt),处死大鼠。冰上操作采集损伤区域及损伤周边区域边缘各200 mg脑组织以供后续提取Western blot样本、RNA样本使用。
1.2.4 Western blot法测定移植后脑组织NGF水平采用Total protein Extraction Kit试剂盒,从脑组织损伤区剪取约0.5 mg组织置于组织匀浆器中。经裂解、离心、一抗、孵育、洗涤,二抗,洗涤,加入发光底物,结果阳性条带以Gel pro4.0版凝胶光密度分析软件处理。
1.2.5 RT-PCR法测定移植后脑组织NGF表达水平Trizol和氯仿提取总RNA制成RNA原液,分光光度计测量总RNA的浓度和纯度。去除基因组DNA。每样本设置3个平行孔,以Revert Aid H Minus First Strand cDNA Synthesis Kit试剂盒生成cDNA。以SYBR Green PCR Master Mix试剂盒定量实时PCR扩增(引物序列见表 1)计算目的基因mRNA相对含量。
| 表 1 RT-PCR引物序列 Tab.1 Sequence data of RT-PCR primers Species/gene name |
所得结果应用SPSS 24.0软件进行统计处理,计量资料以均数±标准差表示,采用多方差分析进行组间比较。P<0.05为差异有统计学意义。
2 结果 2.1 移植前细胞荧光染色及Western-blot法测定Cx43水平结果 2.1.1 移植前ADSC-SCs细胞经转染慢病毒后Cx43荧光染色情况(图 1)。
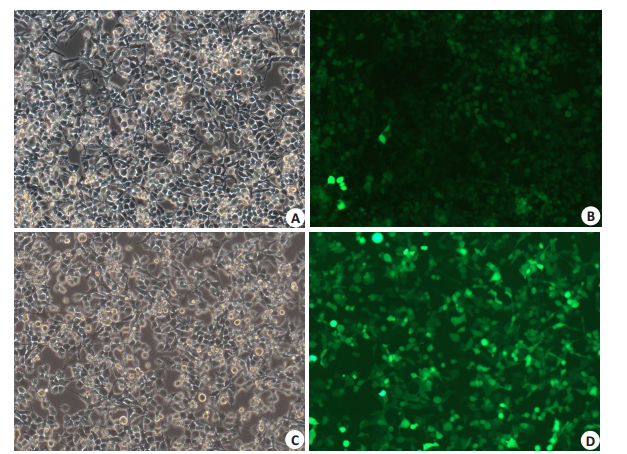
|
图 1 移植用ADSC-SC细胞 Fig.1 Induction of ADSC-SCs and identification of Cx43 expression. 1: ADSC-SCs with RNAi for Cx43, under light microscope (A) and after fluorescence immunocytochemistry (B). 2: ADSC-SCs with RNAi for NC, under light microscope (C) and after fluorescence immunocytochemistry (D) (Original magnification: ×400). |
NC慢病毒转染的施旺细胞Cx43表达水平与未转染的施旺细胞基本相同;RNAi沉默Cx43慢病毒转染的施旺细胞Cx43表达水平明显下降(表 2,图 2)。
| 表 2 移植前各组细胞Cx43表达水平 Tab.2 Cx43 expression in ADSCs and ADSC-SCs transfected with RNAi-NC and RNAi-Cx43 |
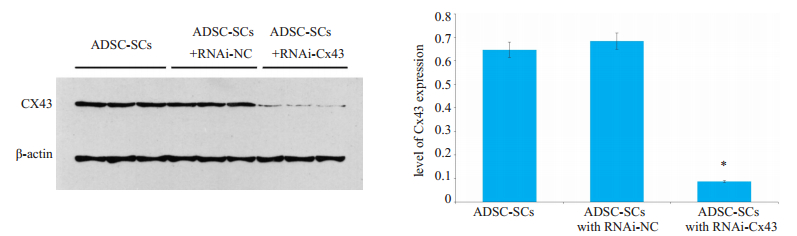
|
图 2 移植前细胞Cx43表达WB结果:ADSC细胞经NC对照组慢病毒转染与Cx43沉默慢病毒转染后Cx43表达差异 Fig.2 Expression of Cx43 in ADSCs and ADSC-SCs transfected with RNAi-NC and RNAi-Cx43. The level of Cx43 in ADSCsSCs with RNAi for Cx43 group is significantly lower than both ADSCs-SCs group and ADSCs- SCs with RNAi for NC control group. *P < 0.05 vs control group. |
| 表 3 移植后各时间点各组Garcia JH评分 Tab.3 Garcia JH scores in each group at different time points after transplantation |
移植手术后各组大鼠Garcia JH评分显示手术后7 d内,大鼠运动功能随着时间推移可逐渐改善,在移植后第3天开始出现显著性差异,干细胞移植后大鼠运动功能改善优于对照组1。将数据经过多变量方差分析我们发现,2/3/4组移植组大鼠神经功能Garcia复合评分与对照组1差异有统计学意义(P<0.05),而2/3/4组组间差异无统计学意义(P>0.05)。
1 dpt:细胞移植组2/3/4与对照组相比,Garcia评分无显著性差异(P>0.05)。
3 dpt、6 dpt:细胞移植组2/3/4与对照组大鼠相比,Garcia评分有统计学差异。ADSC组、SC+RNAi-NC组与SC+RNAi-Cx43组间差异无统计学意义(P>0.05)。
移植操作7 d内,大鼠运动功能随着时间推移可逐渐改善。以移植后3 d起开始具有显著性差异(P<0.05)。3 dpt时优于1 dpt,6 dpt时优于3 dpt。
细胞移植大鼠运动功能改善优于对照组。
移植ADSCs组2与移植SCs细胞组3/4,在移植后7 d内运动功能改善无显著差异(P>0.05)。
移植慢病毒转染SCs细胞组3/4,在移植后7 d内对大鼠运动功能改善无明显差异,慢病毒载体是否沉默Cx43未见统计学差异(P>0.05)。
2.3 Western blot法测定损伤区域NGF表达水平WB结果显示(图 3):对照组的NGF表达明显低于移植组2/3/4。移植Cx43表达被沉默的施旺细胞大鼠脑损伤组织NGF表达低于移植Cx43表达正常的施旺细胞组。(P<0.05)移植Cx43表达正常的施旺细胞(ADSCs-SCs+RNAi-NC组3)大鼠脑组织NGF含量与移植ADSCs(组2)的大鼠脑组织没有显著差异。移植RNAi-Cx43细胞的NGF表达与组2和组3可能有差异(0.1<P<0.05)。
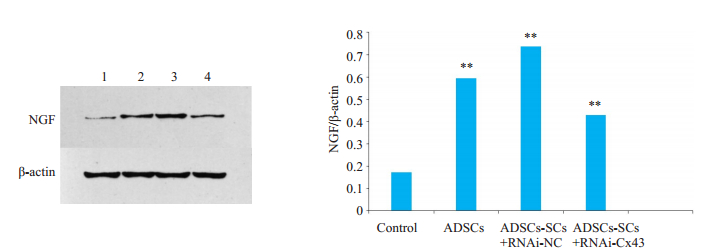
|
图 3 Western blot法测定各组NGF表达水平 Fig.3 Determination of NGF expression levels in each group after cell transplantation by Western blotting. 1: Control group by saline. 2: Transplantation with ADSCs; 3: Transplantation with RNAi-NC transfectioned ADSCs-SCs; 4: Transplantation with RNAi-Cx43 transfectioned ADSCs-SCs. **P < 0.00 vs control group. |
制备的RNA原液浓度=A260nm×100(稀释倍数)×40(μg/mL)/1000=RNA浓度(mg/mL)。分光光度计测定计算A260 nm/A280 nm比值,比值≥1.8。
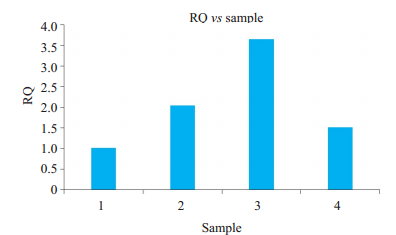
2.4.2 RT-PCR熔点曲线及产物测量结果PCR反应产物NGF的熔点曲线(图 4)。各组目的基因NGF的mRNA相对含量显示(图 5),mRNA在移植组2/3/4转录水平均高于对照组1。移植组2/3/4组中Cx43表达正常的施旺细胞组NGF mRNA水平最高,其次为ADSCs移植组,最后为Cx43表达抑制的施旺细胞组。损伤区域NGF WB与RT-PCR结果平行性良好。
|
图 4 反应产物熔点曲线 Fig.4 Melting point curve of reaction product. |
|
图 5 各组目的基因mRNA相对含量 Fig.5 Relative mRNA levels of target genes in each group. 1: Con; 2: ADSCs; 3: ADSCs-SCs+RNAi-NC; 4: ADSCs-SCs+RNAi-Cx43. All the parameters had difference(P < 0.05) among multi-group. |
有研究证实移植的异体干细胞可以从旁分泌途径改善损伤区神经元微环境[26-27]、促进内源性神经前体细胞在患区组织中增殖、迁移、分化[28]、迁徙到脑缺血区域并分化成为神经元细胞及神经胶质细胞,形成新的突触与宿主的神经网络整合这三个方面改善脑损伤后的神经功能[29-30]。实现利用ADSCs进行自体干细胞移植可避免诸多临床与伦理问题。
大鼠脑损伤模型常选用Feeney法,即在暴露大鼠一侧顶骨后,可在相似位置形成5 mm骨窗,或保留颅骨完整,利用特定高度打击砝码沿滑轨自由落体撞击骨窗内硬膜下脑组织,造成闭合脑损伤,或可合并颅骨骨折制成开放性脑损伤模型。常用能量有400 g×cm~ 800 g×cm,损伤程度随撞击力和撞击面积正相关,以大鼠出现四肢抽搐、血压呼吸波动、甚至呼吸暂停为造模成功标志。Feeney法造成的脑损伤因硬膜完整、撞击灶位于原位,随进入伤后水肿高峰期可继发颅高压,甚至死亡,术后全身症状重。撞击运动皮层区后偏瘫症状可能为脑挫伤皮质水肿后压迫所致,随水肿消退逐渐恢复。优点是不合并颅骨骨折的颅内污染少,颅内感染可能性低;应用广泛,重复性好,易于平行对比。而皮质捣毁法术中切除损伤区域运动皮质,损伤范围确定,术后颅内容物减少,症状局限,麻醉恢复后意识恢复快,对侧偏瘫症状明显,术侧肢体无功能影响。残留组织空腔可供原位移植,相应造成的开放性脑损伤并遗留死腔,并移植外源物,增加感染风险。
Garcia评分对神经功能损伤受到广泛应用[42-46]。通过对造模时、移植前、移植后运动功能观察,对照组大鼠表现出自恢复能力,可能与神经系统自身可塑性有关。相应地应用Feeney法造模后大鼠运动障碍也会逐渐恢复[47]。从移植后评分可知:无论移植ADSCs或ADSCsSCs,移植了外源干细胞都优于对照组恢复情况。但移植组组间无显著性差异,提示施旺细胞有替代间ADSCs以及其他充质干细胞进行细胞移植的潜能。
移植干细胞后的神经功能恢复与成功建立功能性细胞缝隙连接息息相关[31]。Nathalie等[32]的研究证实细胞缝隙连接和Cx43在神经前体细胞分化过程中起到重要作用,提示我们在渡过脑损伤急性期后、进入修复期时,Cx43表达上调可以促进神经元再生[33-35]。Cx43同样也被证实具有诱导和调节神经元、神经胶质细胞增殖分化的功能[36-37]。早先尝试应用干细胞移植促进神经系统损伤恢复的研究中,Cx43作为重要影响因子,在移植细胞与宿主原生神经祖细胞的增殖、分化过程中发挥作用[38]。实验中运动能力RNAi-Cx43与RNAi-NC组间无明显差异,这种情况同样也出现在Reaume等人于1995年建立的Cx43基因敲除小鼠模型,通过对该模型的观察,未发现重大的中枢神经系统异常[39]。同时二者的WB结果与PCR结果均提示Cx43沉默组的NGF表达显著性低于NC组。由此我们推测:相比更现代化的动物步态分析系统(如CatWalk步态分析系统),传统的Garcia评分以及其他常用量表(如Bederson评分),由观测员主观目测二分类变量而计分的评价方式已略显粗糙[47]。实验有改进的空间,如增加更多的样本大鼠,通过增加检查时间点并按点处死取材,采用更精细、客观的运动评价方式。在该动物模型中,Cx43可影响NGF表达,进而可能通过促进NGF的表达起到神经保护作用。同时说明NGF不是衡量在体模型运动障碍恢复能力的可靠标记物。4、移植细胞通过其他缝隙连接蛋白提供了某些补偿机制,如Cx32等,其机制也许与形成异型缝隙连接通道有关。
Algarni等[49]在对小鼠N2a细胞核人神经母细胞瘤细胞的实验中,提出NGF抑制ERK1/2,PKB和PKC依赖途径刺激转谷氨酰胺酶2(Transglutaminase 2,TG2)酶活性,起到NGF诱导细胞保护作用和神经节外生长作用。NGF可以调节神经元细胞中的cAMP水平,cAMP作为小分子可以通过细胞间隙连接,NGF活化与TG2磷酸化间的关系尚未明确有待进一步研究。
综上所述,ADSCs与ADSCs-SCs有利用于干细胞移植治疗脑损伤造成的大鼠功能障碍、有望于干细胞移植的应用前景。在移植细胞与宿主细胞作用,发挥神经修复过程中,Cx43可以促进损伤区域NGF的表达。在接下来的研究中我们希望能够通过加入示踪法研究NGF来源,进一步揭示Cx蛋白家族在神经损伤修复过程中的作用。希望为治疗神经损伤提供新的方法和思路。
| [1] |
Ghobrial GM, Amenta PS, Maltenfort MA, et al. Longitudinal incidence and concurrence rates for traumatic brain injury and spine injury - A twenty year analysis[J]. Clin Neurol Neurosurg, 2014, 123(8): 174-80. |
| [2] |
Moorin R, Miller TR, Hendrie D. Population-based incidence and 5-year survival for hospital-admitted traumatic brain and spinal cord injury, Western Australia, 2003-2008[J]. J Neurol, 2014, 261(9): 1726-34. DOI:10.1007/s00415-014-7411-y |
| [3] |
Schwab ME, Bartholdi D. Degeneration and regeneration of axons in the lesioned spinal cord[J]. Physiol Rev, 1996, 76(2): 319-70. DOI:10.1152/physrev.1996.76.2.319 |
| [4] |
Kuscha, Veronika. Cellular and axonal plasticity in the lesioned spinal cord of adult zebrafish[D]. Edinburgh: University of Edinburgh, 2011.
|
| [5] |
Hong-Shi F, Yan W, Guo-Ping C. Microenvironment for axonal regeneration after peripheral nerve injury(review)[J]. Chin J Rehabil Theory Pract, 2015(3): 288-91. |
| [6] |
Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implication for cell-based therapies[J]. Tissue Eng, 2001, 7(2): 211-28. DOI:10.1089/107632701300062859 |
| [7] |
Wang J, Guo QL, Neurology DO. Adipose-derived stem cell transplantation inhibits the expression of Nogo-A in the perilesional cortex of rats with focal cerebral ischemia[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2016, 32(1): 39. |
| [8] |
Andres RH, Guzman R, Ducray AD, et al. Cell replacement therapy for intracerebral hemorrhage[J]. Neurosurg Focus, 2008, 24(3/4): E16. |
| [9] |
Wernig M, Benninger F, Schmandt T, et al. Functional integration of embryonic stem cell-derived neurons in vivo[J]. Journal of Neuroscience, 2004, 24(22): 5258-68. DOI:10.1523/JNEUROSCI.0428-04.200 |
| [10] |
Wang JH, Liu N, Weng JS, et al. Effects of adipose-derived stem cell transplantation on the angiogenesis and the expression of bFGF and VEGF in the brain post focal cerebral ischemia in rats[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2008, 24(10): 958-61. |
| [11] |
Hirata H, Hibasami H, Yoshida T, et al. Nerve growth factor signaling of p75 induces differentiation and ceramide-mediated apoptosis in Schwann cells cultured from degenerating nerves[J]. Glia, 2001, 36(3): 245-58. |
| [12] |
Talaveron R, Matarredona ER, de la Cruz RR, et al. Implanted neural progenitor cells regulate glial reaction to brain injury and establish gap junctions with host glial cells[J]. Glia, 2014, 62(4): 623-38. DOI:10.1002/glia.22630 |
| [13] |
Fishman GI, Eddy RL, Shows TB, et al. The human connexin gene family of gap junction proteins: distinct chromosomal locations but similar structures[J]. Genomics, 1991, 10(1): 250-6. |
| [14] |
Goodenough D, Goliger JA, Connexins PC. And intercellular communication[J]. Annu Rev Biochem, 1996, 65(65): 475-502. |
| [15] |
Maeda S, Nakagawa S, Suga M, et al. Structure of the connexin 26 gap junction Channel at 3.5 angstrom resolution[J]. Nature, 2009, 458(7238): U61-597. |
| [16] |
Magnotti LM, Goodenough DA, Paul DL. Deletion of oligodendrocyte Cx32 and astrocyte Cx43 causes white matter vacuolation, astrocyte loss and early mortality[J]. Glia, 2011, 59(7): 1064-74. DOI:10.1002/glia.v59.7 |
| [17] |
Nagy JI, Ionescu AV, Lynn BD, et al. Coupling of astrocyte connexins Cx26, Cx30, Cx43 to oligodendrocyte Cx29, Cx32, Cx47: Implications from normal and connexin32 knockout mice[J]. Glia, 2003, 44(3): 205-18. |
| [18] |
Plotkin LI, Manolagas SC, Bellido T. Transduction of cell survival signals by connexin-43 hemichannels[J]. J Biol Chem, 2002, 277(10): 8648-57. DOI:10.1074/jbc.M108625200 |
| [19] |
Ping PP, Song CX, Zhang J, et al. Formation of protein kinase C epsilon-Lck signalling modules confers cardioprotection[J]. J Clin Invest, 2002, 109(4): 499-507. DOI:10.1172/JCI0213200 |
| [20] |
Lin JH, Yang J, Liu SJ, et al. Connexin mediates gap junctionindependent resistance to cellular injury[J]. J Neurosci, 2003, 23(2): 430-41. DOI:10.1523/JNEUROSCI.23-02-00430.2003 |
| [21] |
Huang RP, Hossain MZ, Huang R, et al. Connexin 43 (cx43) enhances chemotherapy-induced apoptosis in human glioblastoma cells[J]. Int J Cancer, 2001, 92(1): 130-8. DOI:10.1002/(ISSN)1097-0215 |
| [22] |
Theodoric N, Bechberger JF, Naus CC. Role of gap junction protein connexin43 in astrogliosis induced by brain injury[J]. PLoS One, 2012, 7(10): e47311. DOI:10.1371/journal.pone.0047311 |
| [23] |
Siushansian R, Bechberger JF, Cechetto DF, et al. Connexin43 null mutation increases infarct size after stroke[J]. J Comp Neurol, 2001, 440(4): 387-94. DOI:10.1002/(ISSN)1096-9861 |
| [24] |
Cushing P, Bhalla R, Johnson AM, et al. Nerve growth factor increases connexin43 phosphorylation and gap junctional intercellular communication[J]. J Neurosci Res, 2005, 82(6): 788-801. DOI:10.1002/(ISSN)1097-4547 |
| [25] |
Boulton TG, Nye SH, Robbins DJ, et al. ERKs: a family of protein-serine/threonine kinases that are activated and tyrosine phosphorylated in response to insulin and NGF[J]. Cell, 1991, 65(4): 663-75. DOI:10.1016/0092-8674(91)90098-J |
| [26] |
Tang YL, Zhao Q, Qin X, et al. Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J]. Ann Thorac Surg, 2005, 80(1): 229-36. DOI:10.1016/j.athoracsur.2005.02.072 |
| [27] |
Baraniak PR, Mcdevitt TC. Stem cell paracrine actions and tissue regeneration[J]. Regen Med, 2010, 5(1): 121-43. DOI:10.2217/rme.09.74 |
| [28] |
Parent JM, Vexler ZS, Gong C, et al. Rat forebrain neurogenesis and striatal neuron replacement after focal stroke[J]. Ann Neurol, 2002, 52(6): 802-13. DOI:10.1002/(ISSN)1531-8249 |
| [29] |
Kondziolka D, Wechsler L, Goldstein S, et al. Transplantation of cultured human neuronal cells for patients with stroke[J]. Neurology, 2000, 55(4): 565-9. DOI:10.1212/WNL.55.4.565 |
| [30] |
Zhao LR, Wm D, Reyes M, et al. Human bone marrow stem cells exhibit neural phenotypes and ameliorate neurological deficits after grafting into the ischemic brain of rats[J]. Exp Neurol, 2002, 174(1): 11-20. |
| [31] |
Contreras JE, Sanchez HA, Veliz LP, et al. Role of connexin-based gap junction channels and hemichannels in ischemia-induced cell death in nervous tissue[J]. Brain Res Brain Res Rev, 2004, 47(1/3): 290-303. |
| [32] |
Duval N, Gomes D, Calaora V, et al. Cell coupling and Cx43 expression in embryonic mouse neural progenitor cells[J]. Glia, 2002, 115(1): S40-1. |
| [33] |
Boulay AC, Gilbert A, Moreira VO, et al. Connexin 43 controls the astrocyte immunoregulatory phenotype[J]. Brain Sci, 2018, 8(4): 50. DOI:10.3390/brainsci8040050 |
| [34] |
Greer K, Chen J, Brickler T, et al. Modulation of gap junctionassociated Cx43 in neural stem/progenitor cells following traumatic brain injury[J]. Brain Res Bull, 2017, 134(9): 38-46. |
| [35] |
Chen W, Guo YJ, Yang WJ, et al. Phosphorylation of connexin 43 induced by traumatic brain injury promotes exosome release[J]. J Neurophysiol, 2018, 119(1): 305-11. DOI:10.1152/jn.00654.2017 |
| [36] |
Meier C, Rosenkranz K. Cx43 expression and function in the nervous system - implications for stem cell mediated regeneration[J]. Front Physiol, 2014, 5(6): 106. |
| [37] |
Laird DW. Life cycle of connexins in health and disease[J]. Biochem J, 2006, 394(Pt 3): 527-43. |
| [38] |
Yu B, Ma HY, Kong L, et al. Enhanced connexin 43 expression following neural stem cell transplantation in a rat model of traumatic brain injury[J]. Arch Med Sci, 2013, 9(1): 132-8. |
| [39] |
Reaume AG, Desousa PA, Kulkarni S, et al. Cardiac malformation in neonatal mice lacking connexin43[J]. Science, 1995, 267(525): 1831-4. |
| [40] |
王辉, 高志强, 李予鲁, 等. 大鼠骨髓间质细胞向Schwann-like细胞的诱导分化[J]. 基础医学与临床, 2005, 25(4): 358-61. |
| [41] |
Dezawa MS, Takano M. Schwann cells originating in myeloid interstitial cells[Z]. 2006: U.S. Patent No. 6, 989, 271.
|
| [42] |
程发峰, 宋文婷, 郭少英, 等. 三种神经功能评分在鼠类局灶性脑缺血模型评价中的比较[J]. 中国康复医学杂志, 2011, 26(4): 337-41. DOI:10.3969/j.issn.1001-1242.2011.04.009 |
| [43] |
乔琳, 胡彬, 常明则, 等. 两种神经功能评分评价大鼠局灶性脑缺血模型的初步研究[J]. 山西医科大学学报, 2012, 43(12): 893-5, 973. DOI:10.3969/J.ISSN.1007-6611.2012.12.002 |
| [44] |
Desland FA, Afzal A, Warraich Z, et al. Manual versus Automated Rodent Behavioral Assessment: comparing Efficacy and Ease of Bederson and Garcia Neurological Deficit Scores to an Open Field Video-Tracking System[J]. J Cent Nerv Syst Dis, 2014, 6(6): 7-14. |
| [45] |
Suto Y, Nagata K, Ahmed SM, et al. A concomitant bone fracture delays cognitive recovery from traumatic brain injury[J]. J Trauma Acute Care Surg, 2018, 85(2): 275-84. DOI:10.1097/TA.0000000000001957 |
| [46] |
Nagata K, Browne KD, Suto Y, et al. Early heparin administration after traumatic brain injury: Prolonged cognitive recovery associated with reduced cerebral edema and neutrophil sequestration[J]. J Trauma Acute Care Surg, 2017, 83(3): 406-12. DOI:10.1097/TA.0000000000001590 |
| [47] |
秦琨, 田歌, 张润, 等. CatWalk步态检测方法在大鼠脑损伤模型运动功能评估中的应用[J]. 中华神经医学杂志, 2011, 10(12): 1191-6. DOI:10.3760/cma.j.issn.1671-8925.2011.12.002 |
| [48] |
张润, 秦琨, 法志强, 等. Catwalk系统评估脐带间充质干细胞移植治疗大鼠脑损伤后运动功能的恢复情况[J]. 南方医科大学学报, 2012, 32(4): 449-55. |
| [49] |
Algarni AS, Hargreaves AJ, Dickenson JM. Activation of transglutaminase 2 by nerve growth factor in differentiating neuroblastoma cells: A role in cell survival and neurite outgrowth[J]. Eur J Pharmacol, 2018, 820(2): 113-29. |
 2019, Vol. 39
2019, Vol. 39

