2. 皖南医学院附属弋矶山医院心脏大血管外科,安徽 芜湖 241001;
3. 皖南医学院附属弋矶山医院影像中心,安徽 芜湖 241001;
4. 苏州大学附属第一医院神经内科,江苏 苏州 215000
2. Department of Cardiovascular Surgery, Yijishan Hospital, Wuhu 241001, China;
3. Imaging Center, Yijishan Hospital, Wuhu 241001, China;
4. Department of Neurology, First Affiliated Hospital of Soochow University, Suzhou 215000, China
卒中后抑郁(PSD)是缺血性脑卒中最常见的并发症之一,既往资料报道其发病率波动于25%~79%[1]。PSD的发生与临床结局呈负相关,表现为认知功能损害和功能康复延迟,尤其影响了卒中患者5年内的生存质量[2],增加卒中预后风险和死亡率,成为卒中康复的重要障碍。临床上鉴于脑卒中的高死亡率、高致残率,同时缺血性脑卒中约占全部脑卒中的80%,故对于缺血性脑卒中卒中后抑郁的早期发现和诊断是卒中临床康复的重中之重。
大量研究表明炎症通过刺激不同促炎标志物在急性缺血性卒中和抑郁中发挥重要作用,参与PSD的发生发展[3-4]。IL-17是具有强大促炎作用的细胞因子,IL-6主要参与细胞免疫和炎症反应过程,在大脑对损伤的炎症反应中其主要作用,同时也参与一些精神疾病的病理生理过程[5],但其与卒中后抑郁的相关性暂不明确。同时在临床工作过程中,中性粒细胞与淋巴细胞的比值(NLR)和血小板与淋巴细胞的比值(PLR)是一种易得且廉价的实验室指标,其在反映炎症状态和梗死不良预后方面具有重要价值[6-7],同时还被认为与精神疾病有关[8-9],尤其是抑郁症。目前尚未有研究结果报道NLR、PLR、IL-17、IL-6与卒中后抑郁的关系。既往研究表明炎症反应在卒中后抑郁的发病过程中起重要作用。而在临床工作中早期预测卒中后抑郁对卒中预后的价值显得尤为重要。本研究中我们引入临床上常见易得指标NLR和PLR,以及实验室中与炎症状态及氧化应激反应密切相关的IL-17、IL-6,探讨其与急性缺血性脑卒中卒中后抑郁的相关性。以期为临床工作中早期预测卒中后抑郁提供帮助。
1 资料和方法 1.1 研究对象本研究序贯性纳入2015年3月~2017年9月就诊于皖南医学院弋矶山医院神经内科卒中病房首次诊断急性脑梗死的患者561例,所有入选患者均符合WHOMONICA有关急性缺血性脑卒中的诊断标准以及《中国急性缺血性脑卒中诊治指南2010》诊断标准[10],并在入院后24 h内通过计算机断层扫描(CT)或磁共振成像(MRI)结果进行验证。排除标准为:(1)患者自述精神疾病,卒中前诊断为抑郁;(2)患者诊断为痴呆或明显认知障碍,意识水平下降;(3)严重失语或肌音障碍,视觉或听觉障碍;(4)代谢异常、肿瘤、严重的急性炎症性疾病;(5)血液系统疾病;(6)随访中丢失、退出研究或死亡的患者。所有患者随访3个月,最终376人完成随访,最终纳入研究。同时从我院体检中心招募120名健康志愿者作为对照。
本研究经皖南医学院附属第一附属弋矶山医院伦理委员会批准(批准号:(2015)伦审研第(57)号)。所有参与者或其亲属之前均签署书面知情同意书。
1.2 临床资料的收集以及一般因素的评定 1.2.1 收集患者一般临床资料包括人口统计学(年龄、性别、体质量指数、教育程度等)、血管危险因素(高血压、高脂血症、糖尿病、缺血性心脏病、心房颤动、吸烟、饮酒)、卒中病因学分型(按TOAST [11]标准进行分类:大动脉粥样硬化、小血管闭塞、心源性栓塞、其他明确病因、病因未明确)、卒中严重程度(基线NIHSS评分于患者入院后24 h内由经认证的神经内科专业医师评价)、神经功能恢复状况(采用改良Rankin量表(mRS)[12]3个月随访时由经认证的神经内科专业医师评价)、实验室指标(入院24 h内从我院急诊科或病房采集静脉血标本,通过计算外周血标本中中性粒细胞或血小板与淋巴细胞的比值,得到NLR和PLR值。所有入组患者入院后第14天采集空腹静脉血4 mL,室温下静置2 h,3000 r/min离心15 min,冰箱内低温保存待测,IL-17、浓度采用酶联免疫吸附法测定,IL-17、IL-6 ELISA试剂盒购于上海西唐生物科技有限公司,均严格按照试剂盒说明书操作)。
1.2.2 影像资料搜集入院24 h内通过颅脑CT和MRI(飞利浦64排螺旋CT, 3.0T GE Multisync LCD)行卒中病灶定位,所有图像均由两名或两名以上经认证的神经科医生以盲法进行复查评价。MRI弥散加权图像上高信号区域被认为是急性脑梗死,并记录病灶位置。对于未行MRI检查的急性缺血性患者115人进行计算机断层扫描图像分析。
1.3 抑郁状态的判定及分组对所有入组患者以门诊或病房方式随访3个月,根据患者临床症状按照DSM-IV(SCID-I-R)诊断标准诊断抑郁,分为卒中后非抑郁障碍组和卒中后抑郁障碍组;并根据Hamilton抑郁量表(HAMD-17)行抑郁程度的评价,其中17>评分值≥7为轻度抑郁,24>评分值≥17为中度抑郁,评分值≥24为重度抑郁。
1.4 统计学分析数据采用双录法录入ACCESS数据库,导入SPSS 23.0软件进行统计学处理,计量资料首先进行K-S检验评价正态性,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数及四分位数间距表示,两组组间比较采用Mann-Whitney U检验,多组组间比较采用KruskalWallis H test检验;计数资料以频数和百分率表示,组间比较采用χ2检验。以单变量分析中P < 0.1的变量为自变量,是否出现抑郁症状作为应变量(no major depression=0,major depression=1)进行多变量logistic回归分析评价PSD相关因素,计算优势比(OR)及其95%可信区间(CI)。以P < 0.05表示有统计学意义。
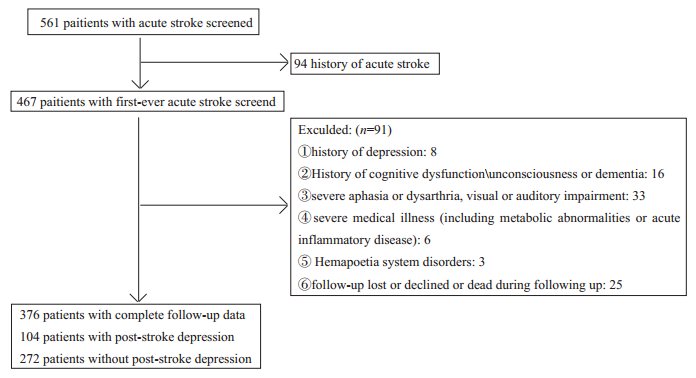
2 结果研究期间共收治了561例缺血性卒中患者,其中既往有脑梗死或脑出血病史者94例,发病前诊断抑郁者8例,发病前有认知功能障碍或痴呆患者16例,严重失语无法获得HAMD评分者33例,严重器质性疾病者6例,血液系统疾病者3例,随访失联或退出者25例,最终入组以首发缺血性脑卒中入院且完成3个月随访者376例(图 1)。纳入患者在基线特征[年龄(P=0.573)、性别(P=0.811)、NIHSS(P=0.542)和BMI(P=0.296)]与研究初期总入组患者相似。入组患者中, 男性患者224例(59.57%),女性152例(40.43%);年龄为61.37±10.34年。急性缺血性脑卒中合并抑郁症状者(3月随访)104例(27.66%)。
|
图 1 研究流程图 Fig.1 Flow chart of participant recruitment. |
对入组患者的人口学资料、血管危险因素、卒中病因学分型、卒中部位、基线NIHSS评分、MMSE评分、mRS评分、实验室指标等临床资料进行统计(表 1),单因素分析显示:性别、受教育年限、BMI、独居、卒中功能缺损程度(NIHSS评分)、认知功能障碍(MMSE评分)、神经功能恢复程度(mRS评分)、实验室指标(NLR、PLR、IL-17、IL-6)与PSD的发生具有显著相关性。而缺血性脑卒中常见的血管危险因素(如高血压、高脂血症、糖尿病、缺血性心脏病、房颤、吸烟、饮酒等)与PSD的发生没有显著性关联。卒中病因学分型(TOAST分型)、卒中部位在PSD组和非PSD组之间无显著性差异。根据Hamilton抑郁量表(HAMD-17)对卒中后抑郁症状组行抑郁程度的评价,分为3个亚组:其中17>评分值≥7为轻度抑郁,24>评分值≥17为中度抑郁,评分值≥24为重度抑郁。分组分析显示:对相关临床和实验室指标(NLR、PLR、IL-17、IL-6)随着抑郁症状的加重,炎症相关指标均升高,且3组之间具有显著性差异(表 2)。
| 表 1 研究对象的人口统计学及临床基线资料 Tab.1 Baseline clinical characteristics of patients with and without major depression at 3 months |
| 表 2 观察组各亚组中炎症相关指标的比较 Tab.2 Comparisons of serum levels of inflammatory factors among patients with PSD of different severities |
将表 1中P < 0.1的变量作为自变量,是否存在抑郁症状作为应变量进行多变量logistic回归分析显示(表 3):对年龄、性别、受教育年限、BMI、独居、NIHSS评分、MMSE评分、mRS评分进行调整后,NLR第三四分位数(即NLR≥4.02)PLR第三四分位数;与缺血性卒中后抑郁状态的发生具有独立相关性。各亚组中炎症指标随抑郁症状加重而升高,且有统计学差异(P < 0.05),故对重度抑郁患者(HAMD≥24)的亚组中炎症指标,调整相关因素后行多变量logistic回归分析发现此四组炎症相关指标仍是重度抑郁的独立预测因素。研究中还发现调整相关因素后,BMI(OR1.156,95%CI 1.044~1.193,P=0.021)、独居(OR1.912,95%CI 1.175~3.010,P=0.004)、NIHSS评分(OR1.304,95%CI 1.013~1.652,P=0.003)、mRS评分(OR1.615,95%CI 1.072~2.431,P=0.021)也与PSD发生具有独立相关性。
| 表 3 卒中后抑郁一般因素和相关实验室指标的多因素Logistic回归分析 Tab.3 Multivariate logistic model of the clinical determinants of PSD |
PSD是急性缺血性脑血管病常见的并发症之一,具有高发病率、高致残率[13]。既往研究报道PSD的发生率为18.5%~51.2% [14-15]。这可能与卒中后抑郁的判定时间、心理评估方法以及判定标准不同相关,说明卒中后抑郁的诊断是一个动态过程,不同时间点对于卒中后抑郁的发病率有重要影响。本研究发现PSD在入院后3个月的发生率为27.7%,与既往研究基本符合。
NLR和PLR与精神疾病,尤其是抑郁症的发生有显著相关性[16]。NLR和PLR水平升高与重度抑郁症风险增加相关[17-18]。同时大量研究认为NLR和PLR与脑梗死的预后具有显著相关性[6]。到目前为止,这两个指标与卒中后抑郁的关系尚未见报道。本研究发现入院时血清NLR和PLR水平的增高与卒中后3个月PSD的发生风险具有密切相关性。对相关因素(年龄、性别、受教育年限、BMI、独居、NIHSS评分、MMSE评分、mRS评分)进行调整后,NLR第三四分位数(NLR≥4.02)和PLR第三四分位数(PLR≥203.74)是缺血性卒中PSD发生的独立预测因素。
NLR和PLR是临床上易得且廉价的可以反映炎症状态的指标[19-20],既往研究中NLR作为一种全身炎症反应的生物标志物,发现其增加与炎症因子的产生和氧化应激的增加有关[21]。梗死发生时,外周血免疫细胞,尤其是中性粒细胞,通过受损的血脑屏障迁移至颅内坏死区。在损伤部位,通过分泌不同的炎症介质、促炎症因子发挥免疫预防作用[22],同时这些分泌的炎性相关因子诱导了免疫级联放大反应,引起细胞功能障碍和氧化应激[23]。炎症状态改变颅内神经内分泌功能,同时降低单胺类神经递质的合成和分泌,导致卒中后抑郁的发生[5]。另一方面,淋巴细胞的减少反映了机体的病理应激状态,提示预后不良[24]。因此我们认为NLR同时反映了卒中后的炎症状态和卒中后抑郁状态的形成诱因,故一定程度上可以预测PSD的形成。
血小板是一种特殊的炎症指标,较高的血小板计数不仅是炎症的结果,也是炎症的预测指标。血小板活化在包括抑郁在内的精神障碍性疾病中发挥重要作用,同时也是心脑血管疾病发病率增加的危险因素[25]。梗死区域炎性介质通过激活巨噬细胞产生大量活化血小板。而活化血小板通过释放促炎症因子调控内皮细胞的通透性,招募单核细胞迁移和聚集[26],从而增强炎症反应。另一方面,炎症诱导活化的血小板内部致密颗粒释放羟色胺。而5-羟色胺在抑郁症形成中发挥重要作用。同时来源于活化血小板的促炎症因子,参与启动、维持和调节炎症反应,在抑郁症发生发展过程中发挥重要作用。再次,促炎症因子、活化血小板可能对脑源性神经营养因子(BDNF)和BDNF受体(TrkB)磷酸化表达产生不良影响,这些蛋白在抑郁症的发病机制中发挥重要作用[27]。由此可见,血小板活化与梗死后的炎症反应以及抑郁的发生均互为因果。因此,我们认为结合血小板和淋巴细胞水平的PLR也是PSD比较稳定的预测因子。
越来越多的证据表明炎症通过炎症通路和炎症介质参与到抑郁症的病因学中。在抑郁患者中由下丘脑-垂体-肾上腺轴(HPA)产生的炎症和促炎症因子被激活[28],从而增加HPA轴的活性,产生正反馈,改变神经传导。另一方面,氧化应激在重度抑郁症的病理生理学中起着至关重要的作用[29]。而同时本研究认为NLR、PLR是通过反映PSD形成过程中的炎症反应和氧化应激过程而成为PSD的预测因子,因此通过实验室检测促炎症因子IL-17、IL-6在PSD患者静脉血中的水平来验证PSD患者的炎症反应和氧化应激。
本研究发现IL-17、IL-6在PSD组明显高于非PSD组,且其水平随抑郁程度加重而升高,有统计学差异。在调整相关危险因素后IL-17、IL-6与PSD具有独立相关性。对PSD患者亚组研究中发现,在调整相关危险因素后,IL-17、IL-6与重度抑郁状态具有独立相关性。我们考虑可能有以下一些机制参与:(1)炎症因子(IL-17、IL-6)通过作用于5-羟色胺、去甲肾上腺素等单胺类神经递质,影响神经元突触中单胺类神经递质的浓度、数量、功能,导致其数量或功能下降[30]。单胺类神经递质在维持神经系统兴奋性方面起着重要作用,其数量或功能的减少会导致抑郁症的发生。(2)炎症因子影响边缘系统-下丘脑-垂体-肾上腺(HPA)轴活性[31],在过度兴奋的状态下分泌大量的皮质醇通过细胞毒性损害神经细胞。(3)炎症因子可能通过某些神经通路影响脑源性神经营养因子(BDNF)的生成[32]。外周血的炎症因(IL-17、IL-6)促进炎症免疫反应,导致机体神经递质分泌紊乱,而脑源性神经营养因子减少影响神经细胞的的增殖分化,减少神经可塑性,在抑郁发生过程中起重要作用。
本研究存在以下不足:(1)样本量小,非多中心研究,一些患有严重疾病,或重度失语,严重意识障碍的患者被排除在研究之外,可能低估了PSD的发病率;(2)由于随访时间较短,一些抑郁事件相关的重要因素未纳入搜集,如抗抑郁药物的服用、心理治疗和社会支持情况,而这些因素有可能影响PSD的诊断;(3)部分NIHSS评分较高的患者被排除在外,部分患者在随访前死亡,有研究表明PSD可能更常见于严重的功能损害病人[33],故可能低估了PSD的发生情况;(4)NLR、PLR仅通过患者入院24 h内血液学检测结果计算一次,但这些指标在PSD的发生过程中可能存在动态变化,故我们在今后的研究中需要对梗死后不同时间点NLR、PLR的变化与PSD的发生进行进一步的研究;(5)反映炎症和氧化应激的实验室指标检测有限,不能完全反映PSD发生过程的病理生理反应,今后的研究中需要针对多种指标开展检测。
虽然本研究有一定的局限性,但我们的研究证实了入院时的NLR、PLR是缺血性脑卒中后3个月PSD的独立预测因素,而且炎症指标IL-6、IL-17也印证了炎症在PSD发生过程中的重要作用。在今后的临床工作中,对于缺血性脑卒中患者,尤其是入院时NLR和PLR值较高的患者,应重点给与早期抑郁状态的评估,重视早期心理干预和预防,对PSD早发现、早治疗,对于患者的预后将有良好的影响。
| [1] |
Luis A, Salma A, Anthony GR, et al. Natural history, predictors, and associations of depression 5 years after stroke: the South London Stroke Register[J]. Stroke, 2011, 42(7): 1907-11. DOI:10.1161/STROKEAHA.110.605808 |
| [2] |
Babkair LA. Risk factors for poststroke depression: an integrative review[J]. J Neurosci Nurs, 2017, 49(2): 73-84. DOI:10.1097/JNN.0000000000000271 |
| [3] |
Ferrari F, Villa RF. The neurobiology of depression: an integrated overview from biological theories to clinical evidence[J]. Mol Neurobiol, 2017, 54(7): 4847-65. DOI:10.1007/s12035-016-0032-y |
| [4] |
Ayerbe L, Ayis S, Crichton S, et al. The long-term outcomes of depression up to 10 years after stroke; the south london stroke register[J]. J Neurol Neurosurg Psychiatry, 2014, 85(5): 514-21. DOI:10.1136/jnnp-2013-306448 |
| [5] |
Becker KJ. Inflammation and the silent sequelae of stroke[J]. Neurotherapeutics, 2016, 13(4): 801-10. DOI:10.1007/s13311-016-0451-5 |
| [6] |
Qun S, Tang Y, Sun J, et al. Neutrophil-to-lymphocyte ratio predicts 3-month outcome of acute ischemic stroke[J]. Neurotox Res, 2017, 31(3): 444-52. DOI:10.1007/s12640-017-9707-z |
| [7] |
Chandrashekara S, Mukhtar Ahmad M, Renuka P, et al. Characterization of neutrophil-to-lymphocyte ratio as a measure of inflammation in rheumatoid arthritis[J]. Int J Rheum Dis, 2017, 20(10): 1457-67. DOI:10.1111/apl.2017.20.issue-10 |
| [8] |
Ozdin S, Sarisoy G, Boke O. A comparison of the neutrophillymphocyte, platelet-lymphocyte and monocyte-lymphocyte ratios in schizophrenia and bipolar disorder patients - a retrospective file review[J]. Nord J Psychiatry, 2017, 71(7): 509-12. DOI:10.1080/08039488.2017.1340517 |
| [9] |
Ivkovic M, Pantovic-Stefanovic M, Dunjic-Kostic B, et al. Neutrophil-to-lymphocyte ratio predicting suicide risk in euthymic patients with bipolar disorder: Moderatory effect of family history[J]. Compr Psychiatry, 2016, 66: 87-95. DOI:10.1016/j.comppsych.2016.01.005 |
| [10] |
中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组. 中国急性缺血性脑卒中诊治指南2010[J]. 中华神经科杂志, 2010, 2(4): 50-59. |
| [11] |
Brott T, Adams HP, Olinger CP, et al. Measurements of acute cerebral infarction: a clinical examination scale[J]. Stroke, 1989, 20(7): 864-70. DOI:10.1161/01.STR.20.7.864 |
| [12] |
Huybrechts KF, Caro JJ, Xenakis JJ, et al. The prognostic value of the modified Rankin Scale score for long-term survival after firstever stroke[J]. Cerebrovasc Dis, 2008, 26(4): 381-7. DOI:10.1159/000151678 |
| [13] |
Lee EJ, Kim JS, Chang DI, et al. Differences in therapeutic responses and factors affecting post-stroke depression at a later stage according to baseline depression[J]. J Stroke, 2018, 20(2): 258-67. |
| [14] |
Tang CZ, Zhang YL, Wang WS, et al. Serum levels of highsensitivity C-reactive protein at admission are more strongly associated with poststroke depression in acute ischemic stroke than homocysteine levels[J]. Mol Neurobiol, 2016, 53(4): 2152-60. DOI:10.1007/s12035-015-9186-2 |
| [15] |
Zhu L, Han B, Wang L, et al. The association between serum ferritin levels and post-stroke depression[J]. J Affect Disord, 2016, 190: 98-102. DOI:10.1016/j.jad.2015.09.074 |
| [16] |
Demircan F, Gozel N, Kilinc F, et al. The impact of red blood cell distribution width and neutrophil/lymphocyte ratio on the diagnosis of major depressive disorder[J]. Neurol Ther, 2016, 5(1): 27-33. |
| [17] |
Cai L, Luoyi XU, Wei L, et al. Relationship of mean platelet volume to MDD: a retrospective study[J]. Shanghai Arch Psychiatry, 2017, 29(1): 21-9. |
| [18] |
Kayhan F, Gunduz S, Ersoy SA, et al. Relationships of neutrophillymphocyte and platelet-lymphocyte ratios with the severity of major depression[J]. Psychiatry Res, 2017, 247: 332-5. DOI:10.1016/j.psychres.2016.11.016 |
| [19] |
Afari ME, Bhat T. Neutrophil to lymphocyte ratio (NLR) and cardiovascular diseases: an update[J]. Expert Rev Cardiovasc Ther, 2016, 14(5): 573-7. DOI:10.1586/14779072.2016.1154788 |
| [20] |
Li DY, Hao XY, Ma TM, et al. The prognostic value of platelet-tolymphocyte ratio in urological cancers: A meta-analysis[J]. Sci Rep, 2017, 7(1): 15387. DOI:10.1038/s41598-017-15673-2 |
| [21] |
Kasama T, Miwa Y, Isozaki T, et al. Neutrophil-derived cytokines: potential therapeutic targets in inflammation[J]. Curr Drug Targets Inflamm Allergy, 2005, 4(3): 273-9. DOI:10.2174/1568010054022114 |
| [22] |
Mayadas TN, Cullere X, Lowell CA. The multifaceted functions of neutrophils[J]. Annu Rev Pathol, 2014, 9: 181-218. DOI:10.1146/annurev-pathol-020712-164023 |
| [23] |
Shichita T, Sakaguchi R, Suzuki M, et al. Post-ischemic inflammation in the brain[J]. Front Immunol, 2012, 3: 132. |
| [24] |
Gibson PH, Cuthbertson BH, Croal BL, et al. Usefulness of neutrophil/lymphocyte ratio as predictor of new-onset atrial fibrillation after coronary artery bypass grafting[J]. Am J Cardiol, 2010, 105(2): 186-91. DOI:10.1016/j.amjcard.2009.09.007 |
| [25] |
Gokdemir MT, Karakilcik AZ, Gokdemir GS. Prognostic importance of paraoxonase, arylesterase and mean platelet volume efficiency in acute ischaemic stroke[J]. J Pak Med Assoc, 2017, 67(11): 1679-83. |
| [26] |
Dietrich-Muszalska A, Wachowicz B. Platelet haemostatic function in psychiatric disorders: Effects of antidepressants and antipsychotic drugs[J]. World J Biol Psychiatry, 2017, 18(8): 564-74. DOI:10.3109/15622975.2016.1155748 |
| [27] |
Cortese GP, Barrientos RM, Maier SF, et al. Aging and a peripheral immune challenge interact to reduce mature brain-derived neurotrophic factor and activation of TrkB, PLCgamma1, and ERK in hippocampal synaptoneurosomes[J]. J Neurosci, 2011, 31(11): 4274. DOI:10.1523/JNEUROSCI.5818-10.2011 |
| [28] |
Furtado M, Katzman MA. Examining the role of neuroinflammation in major depression[J]. Psychiatry Res, 2015, 229(1-2): 27-36. DOI:10.1016/j.psychres.2015.06.009 |
| [29] |
Ormonde Do Carmo MB, Mendes-Ribeiro AC, Matsuura C, et al. Major depression induces oxidative stress and platelet hyperaggregability[J]. J Psychiatr Res, 2015, 61: 19-24. DOI:10.1016/j.jpsychires.2014.12.009 |
| [30] |
Berk M, Plein H, Ferreira D. Platelet glutamate receptor supersensitivity in major depressive disorder[J]. Clin Neuropharmacol, 2001, 24(3): 129-32. DOI:10.1097/00002826-200105000-00002 |
| [31] |
Keller J, Gomez R, Williams G, et al. HPA axis in major depression: cortisol, clinical symptomatology and genetic variation predict cognition[J]. Mol Psychiatry, 2017, 22(4): 527-36. DOI:10.1038/mp.2016.120 |
| [32] |
Cortese GP, Barrientos RM, Maier SF, et al. Aging and a peripheral immune challenge interact to reduce mature brain-derived neurotrophic factor and activation of TrkB, PLCgamma1, and ERK in hippocampal synaptoneurosomes[J]. J Neurosci, 2011, 31(11): 4274-9. DOI:10.1523/JNEUROSCI.5818-10.2011 |
| [33] |
Ayerbe L, Ayis S, Wolfe CD, et al. Natural history, predictors and outcomes of depression after stroke: systematic review and metaanalysis[J]. Br J Psychiatry, 2013, 202(1): 14-21. |
 2019, Vol. 39
2019, Vol. 39

