2. 中山大学附属东华医院肾内科,广东 东莞 523000
2. Department of Nephrology, Donghua Hospital Affiliated to Sun Yat-sen University, Dongguan 523000, China
腹膜透析患者残余肾功能的减退是发生心脑血管事件的独立危险因素[1-2]。腹膜透析患者残余肾功能有利于腹膜透析病人容量负荷的控制、减轻心室肥厚的严重程度,有利于增强食欲、膳食蛋白质和总热量摄取,减轻炎症状态[2]。影响腹膜透析患者残余肾功能的因素有很多,患者蛋白尿的程度、发生腹膜炎的频次、葡萄糖的暴露、透析前的基础残余肾小球滤过率以及利尿剂、造影剂的使用等均会影响残余肾功能减退的速度[3]。而肾内肾素-血管紧张素系统的活化是加速残余肾功能减退的重要因素,目前研究主要关注如何使用药物或改良腹透液的生物相容性[4-6]。有研究提示,慢性肾衰大鼠盐敏感性增加,高盐摄入加速肾损伤的进展[7]。后续研究提示高盐饮食可诱导肾脏局部RAS表达[8-10],从而加速慢性肾脏病病人残余肾功能的丧失[11-12]。控制钠的摄入可下调肾素血管紧张素醛固酮系统的活性,有效降低血压、减少尿蛋白、减轻容量负荷,明显减低缺血性心脏病、脑卒中的发生率[13-15]。限盐已作为高血压治疗的一部分,2007 ESH/ESC高血压指南就提出高血压人群的限盐标准为100 mmol Na/d(约6 g NaCl/d)[16]。
但在最近对慢性肾病的大规模干预研究中,钠的状况很少被提及,慢性肾病患者的钠摄入量仍与一般人群相似,对于控制钠的摄入对腹透病人残余肾功能减退的进程以及可能的利弊,缺乏深入研究。因此,本研究对腹膜透析患者进行研究,观察饮食摄盐量与残余肾功能的关系,明确盐负荷对腹膜透析患者残余肾功能的影响,以希通过控制盐的摄入,达到有效保护腹膜透析患者残余肾功能的目的。
1 资料和方法 1.1 研究对象纳入2016年1月1日~2017年12月30日在南方医科大学南方医院住院或者门诊就诊的腹膜透析患者。纳入标准:(1)年龄≥18岁;(2)连续非卧床腹膜透析治疗持续时间≥3月;(3)未使用利尿剂情况下,尿量≥100 mL/24 h;(4)1月内无腹膜炎病史;(5)无急性感染或急性传染病;(6)无恶性高血压、心衰及恶性肿瘤等消耗性疾病;(7)能正常进食,无明显营养不良(≥60%理想体质量);(8)可以提供详细饮食记录。排除标准:接受激素、免疫抑制剂治疗者,接受化疗或烷化剂治疗;尿量 < 100 mL/24 h。
1.2 相关参数糖尿病诊断依据为美国糖尿病协会发布的糖尿病诊断标准[17]:空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L或者既往诊断糖尿病并接受降糖治疗。高血压的诊断采用《中国高血压防治指南2018年修订版》 [18]建议的标准:非同日3次测量血压收缩压≥ 140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg或既往有高血压病史和(或)目前在使用降压药物。心脑血管疾病:临床诊断的缺血性心脏病、心衰、周围血管病变以及脑卒中。缺血性心脏病指出现心肌梗塞、接受冠状动脉重建术、心绞痛、心电图或其他试验检查出现冠状动脉缺血表现。心衰指超声心动图检查显示射血分数低于40%或按纽约心脏病学会标准心功能Ⅲ~Ⅳ级。周围血管病变指因继发于周围血管病变而出现跛行、截肢(指、趾)、外周动脉血管成形术或反复的蜂窝组织炎、皮肤感染、坏疽。无尿定义为连续2月尿量 < 100 mL/24 h或残余肾功能 < 1 mL/min。
1.3 3 d饮食记录计算患者日摄盐量参照文献[19],患者保持原有膳食习惯,记录连续3 d(2工作日,1休息日)的饮食情况,包括时间、地点、食物名称、重量和烹饪方法等。饮食登记表由专业营养师评估每位患者记录的准确性。使用饮食计算软件(德国费森尤斯卡比)计算患者日均盐、蛋白质、脂肪、钙、磷、钠、钾、氯等摄入量。
1.4 腹透病人残余肾功能等透析充分性指标的测定参照文献[20],计算腹膜透析患者残余肾功能、腹膜肌酐清除率溶质清除率、残余肾Kt/V,腹膜Kt/V。24 h尿钠排泄量(mg)=尿钠浓度(mmol/L)×尿量(L)×23;24 h透析钠排泄量(mg)= [流出透析液钠浓度(mmol/L)×24 h总流出透析液量(L)-流入腹透液钠浓度(mmol/L)×24 h总流入透析液量(L)] ×23;24 h总钠排泄量(mg)=24 h尿钠排泄量+24 h透析钠排泄量。
1.5 分组本研究共纳入符合条件的腹膜透析患者33例,纳入患者按要求进行饮食3 d记录。根据患者饮食记录,计算出患者日摄钠量,换算为盐(NaCl)摄入量。以钠摄入量3.0 g/d(相对于NaCl 7.6 g/d)为分组标线,将患者分为2组,分别为19例低盐组(摄钠量≤3.0 g/d)和14例高盐组(摄钠量>3.0 g/d)。
1.6 研究终点前瞻性观察12月,每3月随访1次。研究终点为研究期间或在研究期间内残余肾功能的丧失(无尿)。
1.7 其他临床数据入选研究对象完成相应资料收集,包括人口统计学数据、终末期肾脏病的原发病、既往病史(包括心脑血管疾病史)、腹透治疗方案、合并用药情况以及生化指标(如血尿常规,血生化:尿素氮、肌酐、尿酸、总二氧化碳结合力、血糖、钾、钠、氯、钙、磷、血清白蛋白等,尿液生化:尿素氮、肌酐、钾、钠),腹透液生化(血糖、肌酐、尿素氮等)。上述所有生化及检查指标均在南方医院进行检测。
本研究方案已获得广东省肾脏病研究所伦理委员会批准,此研究符合赫尔辛基宣言和伦理审査临床研究的国际标准。所有患者在进入研究前,都得到了研究者关于本研究内容及其权利义务的充分告知,并签署了书面知情同意书。
1.8 统计学处理采用SPSS 23.0软件进行统计分析。计数资料用率表示,近似正态分布的连续变量使用均数±标准差表示,对于偏态分布的连续型变量使用中位数与四分位数间距表示。两组比较时,对于分类变量使用卡方检验,近似正态分布的连续型变量使用t检验,偏态分布的连续型变量使用非参数Mann-Whitney U检验。基线值和终点值比较时,正态分布的连续型变量使用配对t检验,偏态分布的连续型变量使用Wilcoxon秩和检验。使用Pearson相关系数评估变量之间的相关性。使用线性回归分析残余肾功能的下降和摄盐量的关系。双侧检验P < 0.05为差异有统计学意义。
2 结果 2.1 研究对象基线资料特征33名患者中,男性19例(57.6%),女性14例(42.4%);年龄42.06±14.47岁,透析时长3(3,7.7)月,血肌酐为992 μmol/L(627~2227 μmol/L),基线eGFR为4.51±1.66 mL/(min·1.73 m2)。终末期肾病的主要病因:慢性肾小球肾炎疾病(26例,78.8%),髙血压肾损害(4例,12.1%),糖尿病肾病(2例,6.1%)。低盐组与高盐组年龄、性别、体质量指数、基线透析龄等差异无统计学意义(P>0.05)。慢性肾衰竭的原发病因及高血压、糖尿病等合并症差异也无统计学意义(P>0.05)。基线时两组间血红蛋白、白蛋白、前白蛋白、碱性磷酸酶、血糖、C反应蛋白、总胆固醇、低密度脂蛋白均差异无统计学意义(P>0.05,表 1)。
| 表 1 腹膜透析患者基线资料特征 Tab.1 Baseline characteristics of PD patients |
如表 2所示,两组患者所使用的透析液浓度、透析超滤量差异无统计学意义(P>0.05)。高盐组患者的日均钠摄入量高于低盐组患者[3.60 g(3.22,4.53)vs 2.40 g(1.99,2.78),P=0.000];与低盐组患者相比,高盐组患者腹透液钠排泄量[1.56(1.19,2.44)g/d vs 0.45(0.10,0.67)g/d,P=0.000]及总钠排泄量清除[3.30(2.53,4.43)g/d vs 2.21(0.85,3.75)g/d,P=0.021]高于低盐组患者;但两组患者尿钠排泄量差异并无统计学意义(P> 0.05)。将钠排泄量和饮食钠摄入量进行相关分析发现,钠的总排泄量、腹透液中钠的排泄量与饮食中钠的摄入总量之间存在正相关(r=0.536,P=0.0013;r=0.901,P=0.000),而通过尿液排泄的钠量与饮食中钠的摄入总量之间无相关关系(P=0.540)。将钠排泄总量、腹透液中钠的排泄量与饮食中钠的摄入总量进行回归分析发现,钠的总排泄与钠的摄入(β=0.416,95%CI:0.170~0.666,P < 0.0018)以及腹透液钠的排泄与钠的摄入相关(β=0.489,95%CI:0.395~0.582,P < 0.001,图 1)。
| 表 2 腹膜透析患者钠盐摄入和钠排泄 Tab.2 Analysis of aodium intake and excretion in PD patients |
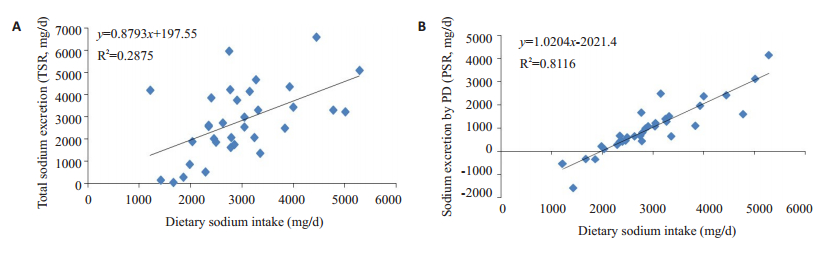
|
图 1 腹膜透析患者饮食钠摄入量与钠排泄量的关系 Fig.1 Correlation between dietary sodium intake and sodium excretion in PD patients. |
在12月的研究内,低盐组有4例、高盐组有6例患者丧失残余肾功能,差异无统计学意义(P=0.747)。两组进入无尿状况的时间分别为4.02(3.79~10.03)月和7.64(3.38~12.00)月,差异无统计学意义(P=0.542)。和基线时相比,到达研究终点时患者的腹膜透析肌酐清除率[39.73(34.75,44.16)vs 40.81(38.06,46.12)L/(w·1.73 m2),P=0.034]和Kt/V(1.67±0.52 vs 1.71±0.52)有所升高,但残肾肌酐清除率[42.27(15.37,58.35)vs 11.75(0,30.30) L/(w·1.73 m2),P=0.000]及残肾Kt/V(0.88 ± 0.56 vs 0.45 ± 0.43,P=0.000)、总肌酐清除率[79.84(56.93,99.98)vs 54.25(45.84,71.89)L/(w·1.73 m2),P=0.000]及总Kt/V(2.55±0.81 vs 2.17±0.55,P=0.000)均降低(表 3)。
| 表 3 腹膜透析患者基线和终点的临床参数比较 Tab.3 Comparison of the clinical characteristics of PD patients at baseline and at the endpoint (n=33) |
研究观察期间,腹透患者残余肾功能的下降值,低盐组为17.48±11.22 L/(w·1.73 m2),高盐组为30.20± 18.30 L/(w·1.73 m2),差异有统计学意义(P=0.032,图 2)。进一步对影响患者残余肾功能的相关因素进行相关及回归分析,发现残余肾功能的下降和基线肌酐清除率(r=0.669,P < 0.001)、基线尿量(r=0.490,P=0.005)、盐摄入的高低(r=0.362,P=0.041)和既往有无心血管疾病史(r=0.161,P=0.002)相关(表 4)。单因素回归分析显示影响残余肾功能的因素包括基线肌酐清除率、基线时的尿量、摄盐量的高低、和既往有无心血管疾病病史,多因素回归分析显示,影响残余肾功能的独立危险因素包括基线残余肾肌酐清除率(β=0.402,95%CI:0.255~0.549,P < 0.001)和摄盐量的高低(β=14.646,95%CI:7.426~21.866,P < 0.001,表 5)。

|
图 2 腹膜透析患者残余肾肌酐清除率的变化 Fig.2 Changes of the residual renal creatinine clearance rate in PD patients. |
| 表 4 肾残留CCr下降与影响因素的相关性 Tab.4 Factors associated with the reduction of residual renal CCr in PD patients |
| 表 5 腹膜透析患者残余肾CCr下降相关变量的logistic回归分析 Tab.5 Logistic regression analysis of variables related to reduced residual renal CCr in PD patients |
残余肾功能是影响慢性肾脏病患者预后的一个极其重要的决定因素和指标[21]。既往研究提示,慢性肾脏病时高盐摄入加速肾小球滤过率降低和慢性肾脏病进展,肾脏预后与盐摄入量有关[22]。高盐饮食主要通过容量负荷增加导致高血压发生,高盐可诱导肾脏局部肾素-血管紧张素-醛固酮系统(RAAS)表达,适当控制钠的摄入可下调肾内RAAS的活性[23-25]。而肾内RAAS的活化是慢性肾病病人残余肾功能减退的重要原因[8],使用RAAS阻滞剂可延缓慢性肾脏病患者残余肾功能的减退[26-28]。故推测控制饮食中盐的摄入可能有类似使用RAAS阻断剂的效果。为证实控盐的效果,国内外的学者进行了相关研究[29]。Krikken等[23]研究发现,高钠摄入增加慢性肾脏病患者的血压和蛋白尿,加重肾小球的高超滤状态,并减弱对RAAS阻断剂的反应。Dong等[30]研究发现,钠的饮食摄入量独立预测了腹透透析患者的心血管疾病发生率和死亡率,但认为低钠饮食会增加腹透病人的全因死亡率。但是,该报道观察患者钠的平均摄入量是1.82 g/d,相当于盐NaCl量4.55 g/d,此摄入量一般被认为是极低盐的摄入。既往的观察性研究已报道摄盐量与心血管病死亡率之间存在J形曲线,极低盐或高盐膳食均导致心血管病死亡率增高[31]。而本研究观察组的患者平均饮食钠摄入量为2.96 g,相应NaCl摄入量为7.53 g/d,研究结果提示,日常饮食中的盐摄入对腹透患者残余肾功能的减退存在影响。高钠饮食会加速腹膜透析患者残余肾功能的下降。尽管在国际指南中有对慢性肾脏病患者钠摄入量的推荐,为50~85 mmol/d,但对腹透患者而言,什么样的钠盐摄入才是合理的盐负荷状态,仍是需要进一步回答的问题。
正确评估盐摄入量是合理限盐的重要前提,由于3 d饮食登记本身存在的缺陷,目前对人群饮食钠盐的评估仍缺乏精确的科学手段。对于非透析状态慢性肾脏病患者,盐摄入量评估方法主要有点尿钠测定法、24 h尿钠测定法及膳食调查法,其中24 h尿钠是最常用最可靠的方法[32]。但是随着肾功能损害的加重,患者会出现不同程度的钠清除障碍,故这一准则可能不适用,动物研究显示肾脏大部分切除的狗对大负荷剂量钠摄入的清除反应明显下降,其保钠功能亦同时减弱[33]。对于腹透患者来说,除了通过尿液排钠,还通过腹透液来排泄钠。由于透析模式的存在,患者体内钠的排泄模式是否与未透析的人群类似?Kim等[34]研究结果显示,腹膜透析患者每日总钠清除与膳食钠摄入相关,且与腹透清除钠有关;但有研究显示,连续非卧床腹膜透析患者钠摄入量的改变与其通过肾脏排出的尿钠、腹膜透析液排出钠量的改变不平行,总钠摄入量的变化不会导致患者总钠清除的相应变化,腹透液及尿中钠清除都不能如实反映连续非卧床腹膜透析患者饮食中钠摄入[35]。而本研究发现,腹透液中钠的排泄量与饮食钠的摄入量相关,而尿钠排泄与饮食钠摄入并不相关。对于这些不同的结果,需要更多循证医学研究证据。本研究发现腹透排泄钠的能力与患者饮食摄钠量有关。高钠饮食患者可透过腹透清除更多的钠,而低钠饮食患者腹透排泄钠的水平亦随之减少。有趣的是,腹透尚可给某些极低钠盐饮食患者补充钠盐,这也就避免了由于过度限盐而导致患者体内缺钠的风险,从而维持患者血钠的稳定。对于极低盐摄入的腹透患者,腹透液也是补充钠盐的一个途径。
我国大部分地区人均钠摄入量200 mmol/d(约12 g NaCl/d)[36]。我国积极推行减盐干预措施等多方面工作,每日摄盐量呈下降趋势。按《中国防治慢性病中长期规划(2017~2025年)》,我国人均食盐摄入量在2020、2025和2030年分别要降到9.5、8.9和8.4 g/d [37-38]。对于盐敏感人群(慢性肾脏病、肥胖、代谢综合征等)应如何限盐,目前的研究仍不足。本研究观察时间短,病例数较少,得出的结论尚需更多的样本量及更长的观察时间来验证。对此本课题已在继续观察研究中,并启动相关临床多中心研究及基础研究,以进一步证实,通过控制饮食中盐的摄入这一有效、简捷、经济的手段,来有效保护腹膜透析患者残余肾功能,为提高腹透治疗质量,减轻腹膜透析患者、社会医疗负担,提供有力证据。
| [1] |
国家肾病学医疗质量管理与控制中心. 2016年全国腹膜透析登记数据分析[C].北京: 全国质控工作会议, 2016-12-23.
|
| [2] |
Wang AY, Brimble KS, Brunier GA, et al. ISPD cardiovascular and metabolic guidelines in adult peritoneal dialysis patients part I - assessment and management of various cardiovascular risk factors[J]. Perit Dial Int, 2015, 35(4): 379-87. DOI:10.3747/pdi.2014.00279 |
| [3] |
Szeto CC, Kwan BC, Chow K, et al. Predictors of residual renal function decline in patients undergoing continuous ambulatory peritoneal dialysis[J]. Perit Dial Int, 2015, 35(2): 180-8. DOI:10.3747/pdi.2013.00075 |
| [4] |
Nongnuch A, Assanatham M, Panorchan K, et al. Strategies for preserving residual renal function in peritoneal dialysis patients[J]. Clin Kidney J, 2015, 8(2): 202-11. DOI:10.1093/ckj/sfu140 |
| [5] |
Htay H, Cho Y, Pascoe EM, et al. Predictors of residual renal function decline in peritoneal dialysis patients: the balANZ trial[J]. Perit Dial Int, 2017, 37(3): 283-9. DOI:10.3747/pdi.2016.00206 |
| [6] |
Shen JI, Saxena AB, Vangala S, et al. Renin-angiotensin system blockers and residual kidney function loss in patients initiating peritoneal dialysis: an observational cohort study[J]. BMC Nephrol, 2017, 18(1): 196-207. DOI:10.1186/s12882-017-0616-4 |
| [7] |
Dworkin LD, Benstein JA, Tolbert E, et al. Salt restriction inhibits renal growth and stabilizes injury in rats with established renal disease[J]. J Am Soc Nephrol, 1996, 7(3): 437-42. |
| [8] |
Kobori H, Navar LG. Urinary angiotensinogen as an novel biomarker of intrarenal renin-angiotensin system in chronic kidney disease[J]. Int Rev Thromb, 2011, 6(2): 108-16. |
| [9] |
Zhuo JL, Ferrao FM, Zheng Y, et al. New frontiers in the intrarenal renin-angiotensin system: a critical review of classical and new paradigms[J]. Front Endocrinol (Lausanne), 2013, 21(4): 166-75. |
| [10] |
Cao W, Li A, Wang L, et al. A salt-induced reno-cerebral reflex activates renin-angiotensin systems and promotes CKD progression[J]. J Am Soc Nephrol, 2015, 26(7): 1619-33. DOI:10.1681/ASN.2014050518 |
| [11] |
Cianciaruso B, Bellizzi V, Minutolo R, et al. Salt intake and renal outcome in patients with progressive renal disease[J]. Miner Electrolyte Metab, 1998, 24(4): 296-301. DOI:10.1159/000057385 |
| [12] |
Sanders PW. Effect of salt intake on progression of chronic kidney disease[J]. Curr Opin Nephrol Hypertens, 2006, 15(1): 54-60. DOI:10.1097/01.mnh.0000186853.23512.a5 |
| [13] |
Verhave JC, Hillege HL, Burgerhof JG, et al. Sodium intake affects urinary albumin excretion especially in overweight subjects[J]. J Intern Med, 2004, 256(4): 324-30. DOI:10.1111/jim.2004.256.issue-4 |
| [14] |
Titze J, Ritz E. Salt and its effect on blood pressure, target organ damage: new pieces in an old puzzle[J]. J nephrol, 2009, 22(2): 177-89. |
| [15] |
Krikken JA, Lely AT, Bakker SJ, et al. The effect of a shift in sodium intake on renal hemodynamics is determined by body mass index in healthy young men[J]. Kidney Int, 2007, 71(3): 260-5. DOI:10.1038/sj.ki.5002011 |
| [16] |
Mancia G, De Backer G, Dominiczak A, et al. 2007 guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European society of hypertension(ESH) and of the European society of cardiology[J]. J Hypertens, 2007, 25(6): 1105-87. DOI:10.1097/HJH.0b013e3281fc975a |
| [17] |
Jiang JP, Chen PY, Chen JH, et al. Accumulation of tissue advanced glycation end products correlated with glucose exposure dose and associated with cardiovascular morbidity in patients on peritoneal dialysis[J]. Atherosclerosis, 2012, 224(1): 187-94. |
| [18] |
《中国高血压防治指南》修订委员会. 中国高血压防治指南2018年修订版[J]. 心脑血管病防治, 2019, 19(1): 1-44. |
| [19] |
Dong J, Li Y, Yang Z, et al. Time-dependent associations between total sodium removal and mortality in patients on peritoneal dialysis[J]. Perit Dial Int, 2011, 31(4): 412-21. DOI:10.3747/pdi.2010.00103 |
| [20] |
van Olden RW, Krediet RT, Struijk DG, et al. Measurement of residual renal function in patients treated with continuous ambulatory peritoneal dialysis[J]. J Am Soc Nephrol, 1996, 7(5): 745-50. |
| [21] |
Diaz-Buxo JA, White SA, Himmele R. The importance of residual renal function in peritoneal dialysis patients[J]. Adv Perit Dial, 2013, 40(29): 19-24. |
| [22] |
Sanghavi S, Vassalotti JA. Dietary Sodium: a therapeutic target in the treatment of hypertension and CKD[J]. J Ren Nutr, 2013, 23(3): 223-7. DOI:10.1053/j.jrn.2013.01.027 |
| [23] |
Krikken JA, Laverman GD, Navis G. Benefits of dietary Sodium restriction in the management of chronic kidney disease[J]. Curr Opin Nephrol Hypertens, 2009, 18(6): 531-8. DOI:10.1097/MNH.0b013e3283312fc8 |
| [24] |
Susic D, Frohlich ED. Salt consumption and cardiovascular, renal, and hypertensive diseases: clinical and mechanistic aspects[J]. Curr Opin Lipidol, 2012, 23(1): 11-6. |
| [25] |
Wright JA, Cavanaugh KL. Dietary Sodium in chronic kidney disease: a comprehensive approach[J]. Semin Dial, 2010, 23(4): 415-21. DOI:10.1111/sdi.2010.23.issue-4 |
| [26] |
Liu X, Dai C. Advances in understanding and management of residual renal function in patients with chronic kidney disease[J]. Kidney Dis, 2016, 2(4): 187-96. DOI:10.1159/000449029 |
| [27] |
Vilar E, Farrington K. Emerging importance of residual renal function in end-stage renal failure[J]. Semin Dial, 2011, 24(5): 487-94. DOI:10.1111/sdi.2011.24.issue-5 |
| [28] |
Nessim SJ, Bargman JM. The peritoneal-renal syndrome[J]. Nat Rev Nephrol, 2013, 9(5): 302-6. DOI:10.1038/nrneph.2013.43 |
| [29] |
Lambers Heerspink HJ, Navis G, Ritz E. Salt intake in kidney disease-a missed therapeutic opportunity[J]. Nephrol Dial Transplant, 2012, 27(9): 3435-42. DOI:10.1093/ndt/gfs354 |
| [30] |
Dong J, Li YJ, Yang ZK, et al. Low dietary sodium intake increases the death risk in peritoneal dialysis[J]. Clin J Am Soc Nephrol, 2010, 5(2): 240-7. DOI:10.2215/CJN.05410709 |
| [31] |
Alderman MH. Presidential address: 21st scientific meeting of the international society of hypertension-dietary sodium and cardiovascular disease: the 'J'-shaped relation[J]. J Hypertens, 2007, 25(5): 903-7. DOI:10.1097/HJH.0b013e3280c14394 |
| [32] |
Smyth A, Dunkler D, Gao P, et al. The relationship between estimated sodium and potassium excretion and subsequent renal outcomes[J]. Kidney Int, 2014, 86(6): 1205-12. DOI:10.1038/ki.2014.214 |
| [33] |
Bourgoignie JJ, Kaplan M, Gavellas G, et al. The relationship between estimated sodium and potassium excretion and subsequent renal outcomes[J]. Kidney Int, 1982, 21(6): 820-6. DOI:10.1038/ki.1982.105 |
| [34] |
Kim SM, Lee EK, Kang SS, et al. Simple method to estimate daily sodium intake during measurement of dialysis adequacy in chronic peritoneal dialysis patients[J]. Asia Pac J Clin Nutr, 2017, 26(6): 1001-6. |
| [35] |
Cheng LT, Wang T. Changes in total sodium intake do not lead to proportionate changes in total sodium removal in CAPD patients[J]. Perit Dial Int, 2006, 26(2): 218-23. |
| [36] |
Liu Z. Dietary Sodium and the incidence of hypertension in the Chinese population: a review of nationwide surveys[J]. Am J Hypertens, 2009, 22(9): 929-33. DOI:10.1038/ajh.2009.134 |
| [37] |
国务院办公厅.国务院办公厅关于印发中国防治慢性病中长期规划(2017~2025年)的通知[EB/OL].[2017-02-14]. http://www.gov.cn/zhengce/content/2017-02/14/content_5167886.htm.
|
| [38] |
李园, 骆蓉, 张普洪. 减盐防控慢性病进展[J]. 中华预防医学杂志, 2018, 52(7): 757-60. DOI:10.3760/cma.j.issn.0253-9624.2018.07.016 |
 2019, Vol. 39
2019, Vol. 39

