乳腺癌是女性最常见的恶性肿瘤之一,20%~30%的早期乳腺癌,终因复发转移发展为晚期乳腺癌[1-2]。乳腺癌的侵袭、转移是导致肿瘤相关死亡的主要原因之一,发现和明确肿瘤转移相关基因及其分子机制具有重要意义。本课题组前期实验发现丝裂原活化蛋白激酶激酶4(MAP2K4)在乳腺癌中作为癌基因促进了乳腺癌细胞的增殖、侵袭及转移[3],它通过参与MAPK通路的信号级联放大效应过程,在肿瘤发展中起重要作用[4],我们进一步通过免疫共沉淀及蛋白质谱,筛选到了与MAP2K4相互作用的蛋白中链酰基辅酶A脱氢酶(ACADM)(MCAD;小鼠基因Acadm;人类基因ACADM)。该蛋白位于线粒体中,属于酰基辅酶A脱氢酶家族,也是4种直链酰基辅酶A脱氢酶之一,催化线粒体中脂肪酰基辅酶A酯的β-氧化的第一个脱氢步骤,与酰基辅酶A氧化酶共同催化酰基辅酶A硫酯脱氢成相应的反式-2-烯酰基-CoA [5],直接影响β-氧化途径中的中链脂肪酸的代谢,并间接影响甘油三酯的代谢。
遗传性MCAD缺陷是一种常染色体隐性、遗传性线粒体脂肪酸氧化紊乱疾病,可引起2-羟基戊二酸尿症、大量乳酸尿症、癫痫发作,昏迷甚至出现猝死,与较高的发病率和死亡率相关[6-7]。同时,ACADM也被报道可通过其轻链在细胞凋亡中发挥重要作用[8-9]。ACADM与肿瘤的关系,仅在结直肠癌中有过相关报道[10-11],然而在其他癌种包括乳腺癌中尚未见公开报道,其对肿瘤的作用及分子机制知之甚少。鉴于MAP2K4在乳腺癌中的促癌作用,我们推测ACADM同样影响乳腺癌的发生及发展。因此,本研究将比较ACADM在乳腺癌组织及正常组织中的表达,并通过体内外实验来探讨ACADM对乳腺癌的影响及其相关分子作用机制。
1 材料和方法 1.1 细胞和试剂人乳腺癌细胞株MCF-7、T47D(上海生命科学院细胞库),于37 ℃,5% CO2恒温培养。RPMI l640培养基、DMEM/HIGH GLUCOSE培养基(美国Hyclone),FBS(美国GIBCO),慢病毒LV-ACADM、阴性对照慢病毒LV(山东维真公司),shACADM、阴性对照慢病毒LV(上海吉凯基因公司),EdU试剂盒(广州锐博生物科技公司)。
1.2 方法 1.2.1 Oncomine数据来源本研究从Oncomine(www.oncomine.org)数据库下载基因芯片数据集NM_ 000016,芯片总共包含34例样本,其中8例正常乳腺癌组织和26例乳腺癌组织样本。
1.2.2 转染慢病毒选取生长状态良好、处于指数生长期的细胞,在24孔板每孔内铺104细胞,放入恒温细胞培养箱培养8~12 h后可开始进行,按说明书转染体系进行转染,设置对照组及实验组,8 h后及时换液。维真转染体系:病毒X μL(X=MOI×每孔细胞数×103/病毒滴度)+ADV-HR Y μL+完全培养基300 μL。吉凯24孔板转染体系:polybrane 50 μL(Opti-Mem稀释200倍)+病毒X μL(X=MOI×每孔细胞数×103/病毒滴度)+OptiMem 350 μL +完全培养基100 μL,总体系500 μL。shACADM靶点序列:TGGGAGAAAGGAATTAAACAT,发卡结构序列:CTCGAG。
1.2.3 噻唑蓝增殖实验取处于指数生长期、状态良好的细胞铺入96孔板(8000~12 000/孔),每天实验组与对照组均设置5个复孔。第1天5个复孔每孔细胞加20 μL噻唑蓝(浓度为5 mg/mL)试剂,避光,4 h后吸尽孔内液体,向每孔内加入150 μL DMSO,轻轻吹打使蓝紫色结晶完全溶解,测定A490 nm,测完后超净台内吸出DMSO。每隔24 h,重复上述步骤1次,绘制细胞生长曲线,分析数据。
1.2.4 EdU细胞增殖实验取处于指数生长期、状态良好的细胞铺入96孔板(8000/孔),贴壁后进行EdU标记(细胞培养基按1000:1的比例稀释EdU溶液,配成EdU培养基,每孔加入50 μL EdU培养基),2 h后弃去旧培基进行细胞固定、Apollo染色,每孔加入100 μL的Apollo染色反应液(按说明书体系配制),用锡纸包裹避光,室温摇床缓慢摇动孵育30 min,弃去染色液。经渗透剂作用后进行DNA染色(30 μL DAPI染色液/孔),弃DAPI,PBS清洗后倒置荧光显微镜下观察并拍照,保存图片,数据分析。
1.2.5 Transwell小室体外迁移实验、Boyden体外侵袭实验取指数生长期的MCF-7和T47D细胞饥饿处理后,向Transwell小室上室中加入105细胞,下室内加入500 μL的完全培养基,于37 ℃细胞培养箱中培养一定时间后,将擦干净的上室放入下室中的4%多聚甲醛内固定,吉姆萨染色,计数并统计结果,实验重复3次。Boyden体外侵袭实验:每个上室内加入约50 μL无血清培基稀释的基质胶至凝固后加入细胞,其余步骤基本同Transwell小室体外迁移实验。
1.2.6 Western blot常规提取并变性蛋白后行10%十二烷基硫酸钠-十二烷基硫酸钠电泳,转膜,经封闭后加入一抗(按对应说明书稀释),4 ℃孵育过夜,洗涤后加入兔二抗或鼠二抗室温孵育1 h,洗涤后利用化学发光凝胶成像分析仪观察蛋白表达情况。
1.2.7 裸鼠尾静脉转移模型将20只6周龄雌性BALB/c小鼠随机分成两组,分别接受尾静脉注射人LV-MCF-7- ACADM细胞及阴性对照组(用100 μL无菌PBS重悬配置细胞悬液,每只注射106细胞)。6周后处死裸鼠,观察测量转移瘤的大小,固定包埋组织,切片染色分析结果。
1.2.8 苏木精-伊红染色法(HE染色法)石蜡组织切片放至60 ℃烤箱烘烤2 h后,逐步脱蜡(二甲苯Ⅰ:15 min,二甲苯Ⅱ:15 min,100%、95%、90%、80%、70%乙醇各2 min),苏木精染核2 min放入双蒸水中清洗,盐酸酒精分化2~5 s,水洗返蓝7~10 min,伊红染色2 min,逐步脱水后中性树脂封片。
1.3 统计学分析采用SPSS 19.0和GraphPad Prism7统计软件对相应的实验结果数据进行统计学分析,组间差异比较采用独立样本t检验,至少进行3次独立重复实验,结果用均数±标准差表示,P < 0.05为差异有统计学意义。
2 结果 2.1 数据库分析ACADM在癌组织及正常组织中的表达量为探究ACADM在乳腺癌组织与正常组织的表达差异,首先在Oncomine公共数据库内进行搜索,Oncomine整合了GEO、TCGA和已发表的文献等来源的RNA和DNA-seq数据,通过对乳腺癌组织与正常组织的表达量对比,发现ACADM在癌组织中表达明显升高,差异有统计学意义(P < 0.05,图 1)。
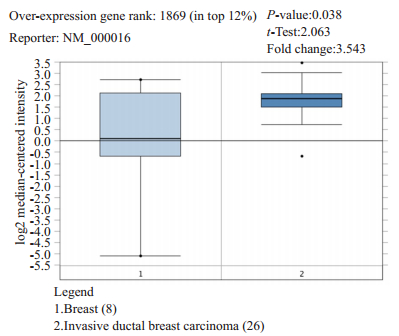
|
图 1 Oncomine数据库中ACADM在正常乳腺组织与乳腺癌组织中的表达差异 Fig.1 Expression of ACADM in normal breast tissues and breast cancer tissues in Oncomine database. |
为探究ACADM对乳腺癌细胞的作用,构建了ACADM慢病毒载体(带有GFP表达),包装成成熟慢病毒感染乳腺癌细胞株MCF-7、T47D,阴性对照为LEV,利用Western blot检测ACADM在两株乳腺癌细胞中的表达情况,实验组ACADM蛋白表达量明显升高,过表达效果良好,用转染后的细胞进行接下来的实验(图 2C)。
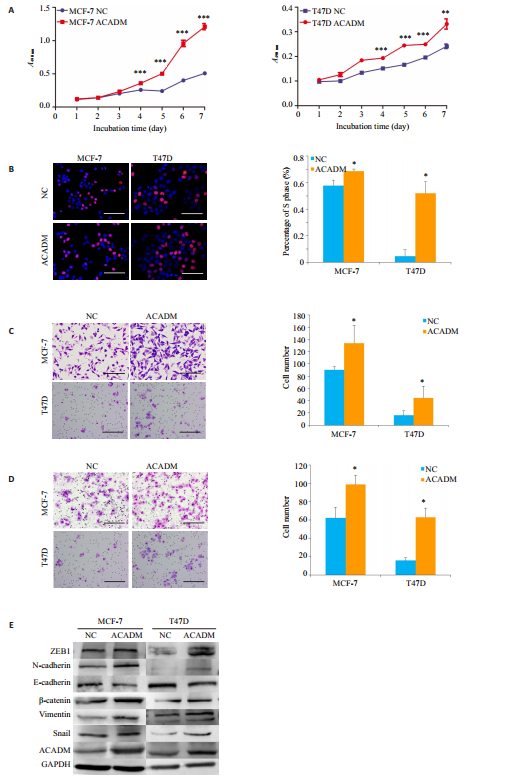
|
图 2 ACADM促进乳腺癌MCF-7和T47D细胞的体外增殖、侵袭及迁移能力 Fig.2 ACADM overexpression promotes invasion, migration and EMT of breast cancer MCF-7 and T47D cells in vitro. A: MTT assay showing enhanced proliferation of MCF-7 and T47D cells overexpressing ACADM; B: EdU experimental showing increased DNA replication activity of MCF-7 and T47D cells overexpressing ACADM; C: Transwell chamber assay showing enhanced migration ability of estrogen receptor-positive breast cancer cells MCF-7 and T47D overexpressing ACADM; D: Boyden assay showing enhanced invasion ability of MCF-7 and T47D cells overexpressing ACADM; E: Western blotting for detecting the expressions of proteins involved in EMT signaling pathway. Scale bar: 80 μm. *P < 0.05 vs NC. ***P < 0.05 vs NC. |
噻唑蓝体外增殖实验显示,过表达ACADM后,MCF-7及T47D细胞的体外增殖能力得到提高,差异有统计学意义(P < 0.05,图 2A)。EdU实验结果显示,过表达ACADM后,MCF-7及T47D细胞的体外DNA复制活性得到提高,差异有统计学意义(P < 0.05,图 2B)。
Transwell体外迁移实验显示,在过表达ACADM后,MCF-7及T47D的穿膜细胞数明显增多,差异有统计学意义(P < 0.05,图 2C),细胞体外迁移能力增强。同时,Boyden体外侵袭实验显示,过表达ACADM后,MCF-7及T47D实验组的穿膜细胞数较对照组明显增多,差异有统计学意义(P < 0.05,图 2D),表明细胞体外侵袭能力增强。进一步通过Western blot检测侵袭、转移及EMT相关指标发现,以GADPH为内参,过表达ACADM的MCF-7及T47D细胞系对比对照组,Ncadherin、ZEB1、β-Catenin、Vimentin、Snail蛋白表达量上调,而E-Cadherin下调,过表达ACADM调节了乳腺癌细胞的EMT信号通路相关蛋白水平的表达(图 2E)。
2.3 沉默ACADM表达后乳腺癌细胞体外侵袭、迁移能力下降为确认ACADM对乳腺癌细胞的作用,进一步构建了shACADM慢病毒载体(带有GFP表达),包装成成熟慢病毒感染乳腺癌细胞株MCF-7及T47D,利用Western blot检测ACADM在两种乳腺癌细胞系中的表达情况,实验组ACADM蛋白表达量明显下调,用转染后的细胞进行接下来的实验(图 3C)。
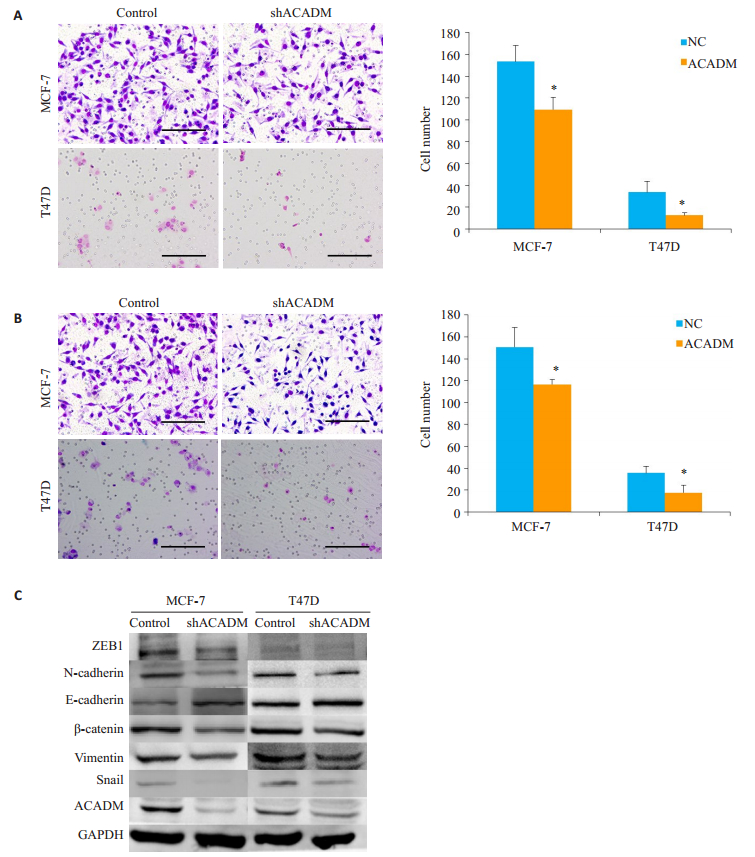
|
图 3 沉默ACADM表达后乳腺癌细胞体外侵袭、迁移能力下降 Fig.3 Invasion and migration of breast cancer cells with ACADM silencing in vitro. A: Transwell chamber assay showing that shACADM inhibited the migration ability of MCF-7 and T47D cells in vitro; B: Boyden assay showing that shACADM suppressed the migration ability of MCF-7 and T47D cells in vitro; C: Western blotting for detecting the protein expressions involved in EMT signaling pathway. Scale bar: 80 μm. *P < 0.05 vs NC. |
Transwell体外迁移实验显示,在沉默ACADM表达后,MCF-7及T47D的穿膜细胞数明显减少,细胞体外迁移能力减弱,差异具有统计学意义(P < 0.05,图 3A)。同时,Boyden体外侵袭实验显示,沉默ACADM后,MCF-7及T47D实验组的穿膜细胞数较对照组明显减少,细胞体外侵袭能力减弱,差异具有统计学意义(P < 0.05,图 3B)。我们通过Western blot检测沉默ACADM表达后的侵袭、转移及EMT相关指标发现,以GADPH为内参,N-cadherin、ZEB1、β-catenin、Vimentin、Snail蛋白表达量下调,而E-cadherin上调(图 3C)。
2.4 动物实验证实ACADM能促进乳腺癌细胞侵袭及迁移能力本研究进行了动物实验验证ACADM对于乳腺癌的作用,利用LV-MCF-7-ACADM细胞构建了裸鼠乳腺尾静脉转移模型(每组n=10),培养6周后分别取其肺、肝组织进行了HE染色。结果发现,过表达ACADM的实验组10只裸鼠中有7只出现了不同程度的肺及肝转移,而对照组中仅4只出现了肝转移且程度较过表达ACADM组明显轻,该组10只裸鼠均未见明显肺部转移瘤(图 4)。
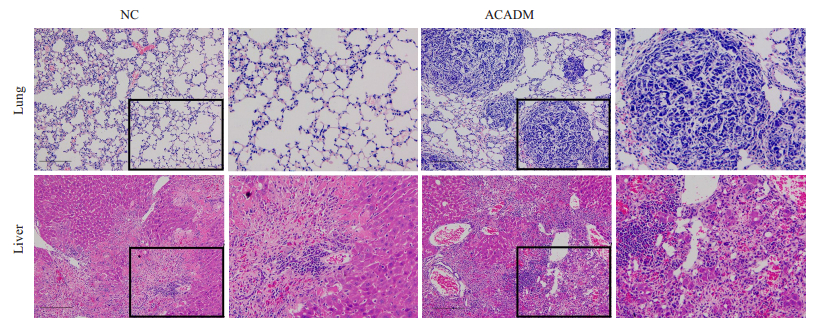
|
图 4 动物实验证实ACADM能促进乳腺癌细胞侵袭及迁移能力 Fig.4 ACADM overexpression promotes breast cancer cell invasion and migration in nude mice. Scale bar: 80 μm. |
肿瘤的形成和发展过程中,特别是在实体瘤的迅速增殖过程中,由于相对血供不足,常常伴随着葡萄糖等营养物质和氧气的供给不足[12]。肿瘤细胞会通过代谢模式的改变以适应恶劣的微环境[13-14]。肿瘤细胞可通过代谢重编程如Warburg效应来逃避正常的细胞凋亡程序,增强增殖和迁徙能力[15-16]。此外肿瘤细胞也常常发生谷氨酰胺代谢和脂代谢的重编程,例如在缺乏葡萄糖等应激情况下,肿瘤细胞通过增强脂肪酸氧化分解来提供能量和营养物质,维持细胞存活[17]。基于前期实验结果,本研究筛选到了与MAP2K4相互作用蛋白—中链酰基辅酶A脱氢酶即ACADM,它通过直接作用β-氧化途径中的中链脂肪酸的代谢而影响甘油三酯的代谢[6, 9, 18]。
为了明确ACADM在乳腺癌中的具体作用,本研究首先通过公共数据库比较了ACADM在乳腺癌组织与正常乳腺组织中的表达量,结果显示癌组织中ACADM表达量明显高于正常乳腺组织。为探究ACADM在乳腺癌发生发展中的作用,我们进行了稳定过表达及沉默ACADM的乳腺癌细胞株(MCF-7、T47D)的体外功能实验,证实ACADM能明显提高乳腺癌细胞的体外增殖、迁移及侵袭能力,而裸鼠尾静脉转移模型也在体内水平证明ACADM能提高MCF-7细胞的侵袭及转移能力。以上结果表明ACADM增强了乳腺癌细胞的增殖、侵袭及转移能力,在乳腺癌中扮演促癌基因的角色。
上皮-间质转化(EMT)是肿瘤侵袭、转移的一种重要形式,其通过促进细胞间连接的丧失,细胞-基质粘附和细胞骨架的重组,导致与上皮细胞相关的顶端极性的丧失和获得间充质特征[19]。通常在由EMT介导的肿瘤侵袭、转移过程中,播散的癌细胞展现了类似干细胞的自我更新能力,以此产生肉眼可见的转移[20-21]。EMT在乳腺癌、结直肠癌、卵巢癌等多种癌种中被报道促进了肿瘤的侵袭、转移,与疾病复发和存活显著相关[22-23]。为了探讨ACADM促进乳腺癌细胞侵袭、转移能力的具体分子作用机制,本研究通过Western blot检测了下游EMT相关信号通路蛋白,发现MCF-7及T47D乳腺癌细胞过表达ACADM后,N-Cadherin、ZEB1、β-Catenin、Vimentin、Snail蛋白表达量上调,E-Cadherin下调,而沉默ACADM表达后出现了与上述结果相反的趋势,说明ACADM可能促进了乳腺癌细胞的EMT过程,并且可能通过此过程增强了乳腺癌细胞的侵袭及转移能力。
既往研究报道ACADM在结直肠癌中是预后有利的因素,但研究仅观察了ACADM表达水平同结直肠癌患者生存预后之间的关系,未进行详细的机制研究,并且在其他癌种中尚未见类似的报道。本研究与其有不一致性,推测有以下可能,首先不同癌种之间肿瘤细胞有明显异质性,并且具有其时间和空间特异性,同一基因可能在不同肿瘤中发挥不同作用[24],其次乳腺癌的发生发展与雌孕激素密切相关,而脂肪酸代谢与体内激素水平存在互相影响,因此ACADM有可能通过调节脂肪酸代谢进而影响激素水平最终达到影响肿瘤发生、发展的结果。ACADM在以往的研究中以脂肪酸β-氧化中的关键作用备受关注[25-26]。越来越多的研究表明,肿瘤的发生发展与代谢重编程相关,如脂肪酸合成和氧化之间的平衡在肿瘤发生、发展过程中失衡,从而影响了肿瘤的发生、发展[14, 17, 27]。同时,已有部分研究报道了体内代谢状态对EMT过程的影响。乳腺癌与肥胖、脂质代谢密切相关,肥胖患者被发现有更多的生物侵袭性肿瘤,生存率远低于非肥胖患者的生存率[28-29],因此我们推测ACADM在乳腺癌中的促癌作用可能与脂质代谢调节失衡并促进EMT过程相关,不过具体机制仍需进一步探究。
综上所述,本研究提示ACADM在乳腺癌细胞(MCF-7、T47D)中可作为候选癌基因,它明显促进了乳腺癌细胞的EMT过程并提高了其迁移及侵袭能力,进一步研究脂代谢相关基因ACADM,将为乳腺癌的转移和治疗提供新的研究思路。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.v68.6 |
| [2] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [3] |
Liu S, Liu YY, Li R. Expressions of MAP2K4 and estrogen receptor and their clinical significance in invasive breast cancer[J]. J South Med Univ, 2016, 37(4): 488-93. |
| [4] |
Davis RJ. Signal transduction by the JNK group of MAP kinases[J]. Cell, 2000, 103(2): 239-52. |
| [5] |
Kim JP, Miura R. Acyl-CoA dehydrogenases and acyl-CoA oxidasesstructural basis for mechanistic similarities and differences[J]. Eur J Biochem, 2004, 271(3): 483-93. |
| [6] |
Tolwani RJ, Farmer SC, Johnson KR, et al. Structure and chromosomal location of the mouse medium-chain acyl-CoA dehydrogenase-encoding gene and its promoter[J]. Gene, 1996, 170(2): 165-71. |
| [7] |
Ensenauer R, Winters JL, Parton PA, et al. Genotypic differences of MCAD deficiency in the Asian population: novel genotype and clinical symptoms preceding newborn screening notification[J]. Genet Med, 2005, 7(5): 339-43. DOI:10.1097/01.GIM.0000164548.54482.9D |
| [8] |
Liang M, Yao G, Yin M, et al. Transcriptional cooperation between p53 and NF-κB p65 regulates microRNA-224 transcription in mouse ovarian granulosa cells[J]. Mol Cell Endocrinol, 2013, 370(1/2): 119-29. |
| [9] |
Lim W, Bae H, Song G. Differential expression of apolipoprotein D in male reproductive system of rats by high-fat diet[J]. Andrology, 2016, 4(6): 1115-22. DOI:10.1111/andr.12250 |
| [10] |
Uhlen M, Zhang C, Lee S, et al. A pathology atlas of the human cancer transcriptome[J]. Science, 2017, 357(52): 63-75. |
| [11] |
Guo H, Zeng W, Feng L, et al. Integrated transcriptomic analysis of distance-related field cancerization in rectal cancer patients[J]. Oncotarget, 2017, 8(37): 61107-17. |
| [12] |
Jiang P, Du WJ, Wang XW, et al. p53 regulates biosynthesis through direct inactivation of glucose-6-phosphate dehydrogenase[J]. Nat Cell Biol, 2011, 13(3): 310-U278. |
| [13] |
Deberardinis RJ, Lum JJ, Hatzivassiliou G, et al. The biology of cancer: Metabolic reprogramming fuels cell growth and proliferation[J]. Cell Metab, 2008, 7(1): 11-20. |
| [14] |
vander Heiden MG, Cantley LC, Thompson CB. Understanding the warburg effect: the metabolic requirements of cell proliferation[J]. Science, 2009, 324(5930): 1029-33. DOI:10.1126/science.1160809 |
| [15] |
Hsu PP, Sabatini DM. Cancer cell metabolism: warburg and beyond[J]. Cell, 2008, 134(5): 703-7. DOI:10.1016/j.cell.2008.08.021 |
| [16] |
San-Millán I, Brooks GA. Reexamining cancer metabolism: lactate production for carcinogenesis could be the purpose and explanation of the Warburg Effect[J]. Carcinogenesis, 2017, 38(2): 119-33. |
| [17] |
Carracedo A, Cantley LC, Pandolfi PP. Cancer metabolism: fatty acid oxidation in the limelight[J]. Nat Rev Cancer, 2013, 13(4): 227-32. DOI:10.1038/nrc3483 |
| [18] |
Touw CM, Smit G, de Vries M, et al. Risk stratification by residual enzyme activity after newborn screening for medium-chain acylCoA dehyrogenase deficiency: data from a cohort study[J]. Orphanet J Rare Dis, 2012, 7(1): 52-65. DOI:10.1186/1750-1172-7-52 |
| [19] |
Guttilla IK, Adams BD, White BA. ER alpha, microRNAs, and the epithelial-mesenchymal transition in breast cancer[J]. Trends Endocrinol Metab, 2012, 23(2): 73-82. DOI:10.1016/j.tem.2011.12.001 |
| [20] |
Thiery JP. Epithelial-mesenchymal transitions in development and pathologies[J]. Curr Opin Cell Biol, 2003, 15(6): 740-6. DOI:10.1016/j.ceb.2003.10.006 |
| [21] |
Mani SA, Guo WJ, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133(4): 704-15. |
| [22] |
Thiery JP, Acloque H, Huang RY, et al. Epithelial-Mesenchymal transitions in development and disease[J]. Cell, 2009, 139(5): 871-90. DOI:10.1016/j.cell.2009.11.007 |
| [23] |
Park SM, Gaur AB, Lengyel E, et al. The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2[J]. Genes Dev, 2008, 22(7): 894-907. DOI:10.1101/gad.1640608 |
| [24] |
Vogelstein B, Papadopoulos N, Velculescu VE, et al. Cancer genome landscapes[J]. Science, 2013, 339(6127): 1546-58. DOI:10.1126/science.1235122 |
| [25] |
Ji S, Yang RJ, Lu CY, et al. Differential expression of PPAR gamma, FASN and ACADM genes in various adipose tissues and longissimus dorsi muscle from yanbian yellow cattle and Yan yellow cattle[J]. Asian Australas J Anim Sci, 2014, 27(1): 10-8. DOI:10.5713/ajas.2013.13422 |
| [26] |
Smith EH, Thomas C, Mchugh D, et al. Allelic diversity in MCAD deficiency: the biochemical classification of 54 variants identified during 5 years of ACADM sequencing[J]. Mol Genet Metab, 2010, 100(3): 241-50. DOI:10.1016/j.ymgme.2010.04.001 |
| [27] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-74. DOI:10.1016/j.cell.2011.02.013 |
| [28] |
Calle EE, Kaaks R. Overweight, obesity and cancer: epidemiological evidence and proposed mechanisms[J]. Nat Rev Cancer, 2004, 4(8): 579-91. DOI:10.1038/nrc1408 |
| [29] |
Protani M, Coory M, Martin JH. Effect of obesity on survival of women with breast cancer: systematic review and meta-analysis[J]. Breast Cancer Res Treat, 2010, 123(3): 627-35. |
 2019, Vol. 39
2019, Vol. 39

