2. 南方医科大学南方医院 感染内科,广东 广州 510515;
3. 南方医科大学中西医结合医院外科,广东 广州 510315
2. Department of Infectious Diseases, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China;
3. Department of Surgery, Hospital of Integrated TCM and Western Medicine, Southern Medical University, Guangzhou 510315, China
肝细胞癌(HCC)约90%发生在肝硬化的基础上。肝硬化结节,特别是大于1 cm的结节或不断增大的结节,本质上是HCC的癌前病变。在我国,肝硬化主要来自慢性乙型肝炎(CHB),通过肝纤维化(Fib)途径逐渐进展到肝硬化(Cir)。因此,要减少HCC的发生,必须把防治的重点前移到控制CHB-Fib和CHB-Cir,通过抗病毒和抗肝纤维化来阻止肝硬化的发生,甚至逆转乙肝肝硬化。由于肝纤维化一旦启动之后会不断进展[1];已经形成的肝纤维化或早期肝硬化,仍然没有特效的西药治疗[2]。临床上迫切需要HBV抗病毒药物联合有效的抗肝纤维化药物,以共同作用,不仅从病因上控制HBV,同时也阻止CHB-Fib进展,对已经形成的肝纤维化、肝硬化有所逆转,进而降低CHB相关肝硬化和HCC的发生率。我们先前报道了随访96周的恩替卡韦前瞻性队列研究,表明恩替卡韦抗病毒与复方鳖甲软肝片(FFBJ)抗肝纤维化具有协同治疗效应,能协同改善CHB-Fib患者的总体预后[3]。我们进一步设计了前瞻性、配对对照的3个抗病毒药物的研究队列,对CHB-Fib患者采用不同的抗病毒药物联合抗纤维化或单用抗病毒的方案治疗,首次进行了长达144周的随访观察和比较分析,效果良好。现将取得的疗效和安全性数据报道如下。
1 资料和方法 1.1 研究对象与分组所有研究对象均来自南方医科大学南方医院肝病中心随访研究队列中的CHB-肝纤维化病例,随访时间从2010年6月~2018年6月。所有患者均符合2010年中华医学会肝病学分会与感染病学分会联合制订的《慢性乙型肝炎防治指南》 [4]和2010年中国中西医结合学会肝病专业委员会制定的《肝纤维化中西医结合诊疗指南》 [5]的诊断标准。本研究为前瞻性、对照、开放的队列研究,符合纳入标准的患者将按性别、年龄(相差≤5岁)、HBeAg状态、肝脏硬度值(LSM, FibroScan检测)基本匹配后按1:1分别进入单用恩替卡韦(ETV)组、恩替卡韦联合复方鳖甲软肝片组研究队列(ETV队列);同样方法配对后按1: 1进入单用替诺福韦酯(TDF)组和替诺福韦酯联合复方鳖甲软肝片组研究队列(TDF队列),以及单用阿德福韦酯(ADV)组和阿德福韦酯联合复方鳖甲软肝片组研究队列(ADV队列)。本研究已通过南方医科大学南方医院伦理委员会审查,所有纳入患者均为自愿参与并签署书面知情同意书。具体分组及分析流程见图 1。
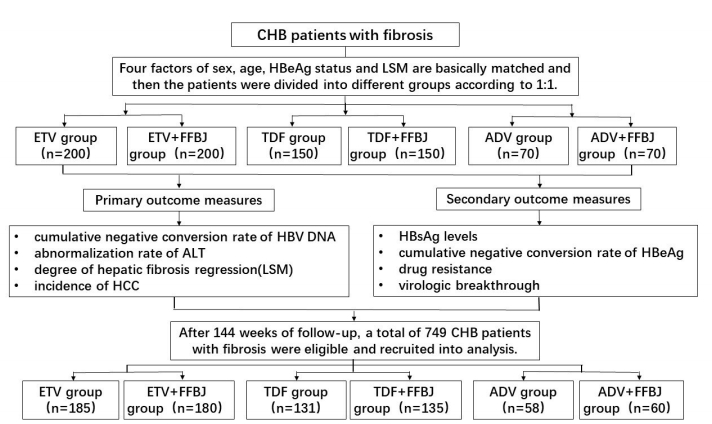
|
图 1 研究队列及病例情况分析流程图 Fig.1 Flow chart showing assignment of the patients and data analysis. CHB: Chronic hepatitis B; LSM: Liver stiffness measurement; ALT: Alanine aminotransferase; HCC: Hepatocellular carcinoma; ETV: Entecavir; TDF: Tenofovir disoproxil fumarate; ADV: Adefovir dipivoxil; FFBJ: Fufang Biejiaruangan tablet. |
入组标准:诊断为慢性乙型肝炎;年龄大于18岁;肝穿刺组织学评分S2以上或相应LSM≥7.2 kPa;患者自愿并能够遵守按时服药的要求以及定期随访复查的要求,签署书面知情同意书。排除标准:其他肝炎病毒重叠感染者;其他原因引起的肝纤维化、肝硬化患者;合并酒精性肝病、药物性肝病、自身免疫性肝病者;妊娠或哺乳期妇女;有肝功能失代偿病史或目前有肝功能失代偿的证据:Child-Pugh为B或C级,或曾出现过腹水、消化道出血、肝性脑病或者自发性细菌性腹膜炎等情况;或有以下证据提示为肝脏肿瘤者:B超或其他影像学检查发现可疑性结节或证实为肝癌或血清甲胎蛋白(AFP)≥200 ng/mL。
1.3 治疗方法恩替卡韦队列联合治疗组的患者予口服恩替卡韦(中美上海施贵宝制药有限公司或江苏正大天晴公司),1次/d,0.5 mg/次;复方鳖甲软肝片(内蒙古福瑞中蒙药科技股份有限公司),3次/d,4片/次;单用组予恩替卡韦1次/d,0.5 mg/次。替诺福韦酯队列联合治疗组的患者予口服替诺福韦酯(美国吉利德公司生产,葛兰素史克有限公司代理,天津),1次/d,300 mg/次;复方鳖甲软肝片3次/d,4片/次;单用组予替诺福韦酯1次/d,300 mg/次。阿德福韦酯队列联合治疗组的患者予口服阿德福韦酯(天津药物研究院药业有限责任公司),1次/d,10 mg/次;复方鳖甲软肝片,3次/d,4片/次;单用组予阿德福韦酯1次/d,10 mg/次。
1.4 观测指标及检测方法 1.4.1 观测指标所有入组的患者在治疗开始后的前48周,每12周随访1次,治疗48周以后每24周随访1次。随访复查项目包括:血常规、肝肾功能、HBsAg、HBeAg、HBeAb、血清HBV DNA精确定量(内标法)、甲胎蛋白(AFP)、LSM测定及腹部彩超,分析抗病毒疗效、安全性、耐药发生率和疾病变化情况(包括肝纤维化逆转程度以及HCC发生率)。
1.4.2 肝脏血液生物化学指标检测血常规检测仪为SYSMEX HST302全自动血细胞分析仪,肝功能检测采用日本Olympus AU800全自动生化分析仪。血清HBV DNA精确定量检测采用Cobas Taqman-48实时荧光定量全自动分析仪(罗氏公司,瑞士)及相应的定量试剂,检测下限值为20 U/mL。HBsAg、HBeAg、HBeAb采用雅培i2000平台检测。
1.4.3 腹部彩超及LSM检测腹部彩超检查采用多普勒超声系统(TOSHIBA SSH-140A, Tokyo,Japan),空腹进行。为避免观察者间误差,所有腹部彩超均由同一名医师操作。LSM检测仪器为法国Echosens的产品,配备M型标准探头,由两名经过严格培训的操作者依据操作指南完成。检测部位选择右侧腋前线至腋中线第7、8肋间或第8、9肋间,连续有效检测10次,取中位数为最终测定结果,并以弹性值(kPa)表示。
1.5 统计学处理方法应用SPSS 22.0统计软件对数据进行处理,以Kolmogorov-Smirnov法检验数据正态分布与否,根据是否服从正态分布,分别采用均数±标准差或中位值(IQR)描述变量;对于正态分布计量资料,6组同一随访时间点间的比较采用完全随机资料方差分析,同一组间不同随访时间点的比较采用重复测量资料方差分析;对于非正态分布资料,6组间比较采用多组独立样本秩和检验,同组间不同随访时间点比较采用多组相关样本秩和检验的方法,率的比较采用列联表分析的方法;计数资料率的比较采用卡方检验。所有统计分析基于双侧假设检验,以α=0.05为检验水准,P < 0.05为差异具有统计学意义。
2 结果 2.1 患者基线特征入组患者共840例,经过随访144周后,剔除其中缺乏重要数据、脱落病例以及随访时间不达标的病例,最终纳入统计分析的病例共749例。其中单用ETV组185例、ETV+FFBJ组180例;单用TDF组131例、TDF+ FFBJ组135例;单用ADV组58例;ADV+FFBJ组60例。各组患者的年龄、性别比、HBsAg水平、HBeAg阳性率、HBV DNA定量、谷丙转氨酶(ALT)、AFP、LSM水平方面的差异均无统计学意义(P>0.05),具有较好的可比性(表 1)。
| 表 1 749例CHB-肝纤维化患者基线指标比较分析 Tab.1 Baseline demographics and biochemical characteristics of 749 CHB patients with fibrosis |
随着治疗时间的延长,6组患者的HBV DNA累积转阴率均逐渐增加,HBV DNA转阴中位时间分别为24、12、12、12、72、72周,差异有统计学显著性意义(χ2=32.820,P < 0.001,图 2)。进行队列内组间的比较发现,单用抗病毒治疗组与联合抗纤维化治疗组HBV DNA积累转阴率在治疗第48、96及144周时的比较均没有统计学差异(P>0.05)。进行队列间的比较时发现,单用抗病毒治疗组(ETV组、TDF组及ADV组间的比较)及联合抗纤维化治疗组(ETV+FFBJ组、TDF+FFBJ组及ADV+FFBJ组间的比较)在治疗第48周、96周和144周时的HBV DNA累积转阴率,其组间比较均有统计学差异(P < 0.001,表 2)。
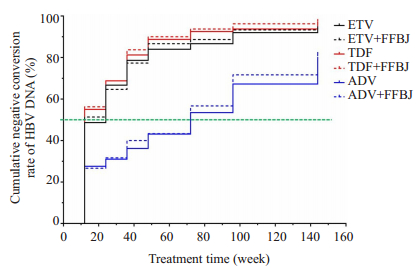
|
图 2 各组HBV DNA累积转阴率变化情况 Fig.2 Cumulative negative conversion rates of HBV DNA in each group. |
| 表 2 6组患者HBV DNA累积转阴率在48周、96周和144周的组间比较 Tab.2 Comparison of cumulative negative rates of HBV DNA at 48, 96 and 144 weeks among the 6 groups |
在治疗过程中,单用ETV组、ETV+FFBJ组、单用TDF以及TDF+FFBJ组均无耐药发生,单用ADV组以及ADV+FFBJ组分别有1例和2例患者耐药变异,耐药位点分别为rtA181V、rtA181V、rtN236T,分别换为单用恩替卡韦、恩替卡韦联合复方鳖甲软肝片、恩替卡韦联合复方鳖甲软肝片治疗后,取得病毒学应答(此3例耐药患者在最终分析时剔除)。
2.3 血清ALT变化情况的比较分析随着治疗时间延长,6组患者各随访时间点间比较,ALT异常率均逐渐下降,差异均有统计学意义(P < 0.001)。采用Kplan-Meier法对749例患者进行ALT、AST异常率的下降情况进行分析,单用ETV组、ETV+FFBJ组、单用TDF组、TDF+FFBJ组、单用ADV组和ADV+FFBJ组的ALT复常中位时间分别为24、12、12、12、36、24周,组间比较差异有统计学意义(χ2=9.568,P=0.002,图 3)。
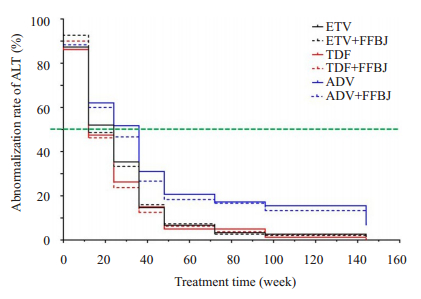
|
图 3 各组ALT异常率变化情况 Fig.3 Abnormal rates of ALT in each group. |
参考Thierry Poynard等的研究方法,将患者的FibroScan结果转化为对应的Metavir分期进行分析(F0≤5、F1≤7.1、F2≤9.5、F3≤12.5、F4.1≤20、F4.2≤50、F4.3>50),其中Metavir分期下降大于或等于1个等级则定义为肝纤维化逆转。经过治疗后,6组患者的LSM值均明显下降,≤F3期的总占比与基线相比分别为77.3% vs 32.7%、84.0% vs 32.7%、75.0% vs 30.0%、85% vs 27.5%、74.1% vs 29.3%、83.3% vs 26.7%,差异均有统计学意义(P < 0.001,图 4)。在逆转肝纤维化能力的比较方面,恩替卡韦或者替诺福韦酯并没有表现出明显优于阿德福韦酯的效果(χ单用药组2=0.873,χ联合用药组2=1.794,均P>0.05)。但是,联合用药组均比单用药组表现出更佳的逆转肝纤维化效果,差异均具有统计学意义(χETV队列2=11.345,χTDF队列2=10.160,χADV队列2=6.358,P < 0.05)。
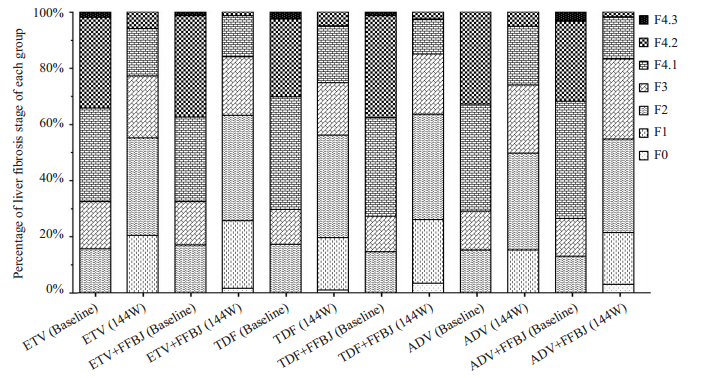
|
图 4 各组肝纤维化逆转情况 Fig.4 Reversal of liver fibrosis at baseline and at 144 weeks in each group. |
随访至144周时,单用TDF组以及TDF+FFBJ组均无HCC发生;单用ETV组、ETV+FFBJ组、单用ADV组以及ADV + FFBJ组的HCC发生率分别为2.2%、1.7%、1.7%、3.3%,发病密度分别为7.2/1000人年、5.5/1000人年、5.7/1000人年、11.1/1000人年,各组HCC发生率进行比较,差异无统计学意义(χ2=6.813,P=0.138,表 3)。本研究随访3年时总体肝癌发生率1.3%(共计10例),明显低于文献报告的未接受抗病毒治疗的CHB患者随访3年约7.2%(n=316,P < 0.05)的HCC发生率[6],提示经过长期抗病毒抗肝纤维化治疗可明显降低HCC的发生率。
| 表 3 6组患者随访期间HCC的发生率 Tab.3 Incidence of HCC in the 6 groups during the follow-up |
ETV+FFBJ组、ADV+FFBJ组分别有4例和3例患者出现服用复方鳖甲软肝片后胃肠道不适反应,改为餐后服用后症状消失。单用TDF组出现3例血清肌酐升高,但3月后复查时均恢复正常。
3 讨论在CHB由肝纤维化逐渐进展到肝硬化后,患者5年进展为肝硬化失代偿的累积发生率为15%~20%,肝癌的年发生率为3%~6%,生存率明显降低[7]。若能有效地阻止肝纤维化进展并最大程度地逆转早期肝硬化,将能够减少终末期肝病(如肝硬化失代偿、HCC)的发生[8-9]。替诺福韦酯及恩替卡韦具有强效的抗病毒效果,同时兼具高耐药屏障等特点,为目前公认的一线抗病毒药物;阿德福韦酯虽然抗病毒强度较弱,但不易耐药,在临床应用较早,费用相对便宜,仍然在坚持使用的患者较多,其适合已经将病毒载量降到很低的CHB-肝纤维化患者在定期监测下使用。中医药在肝纤维化的治疗方面具有独特的优势,经过长期的临床研究证实,复方鳖甲软肝片具有良好的抗肝纤维化效果[10-11],其由“鳖甲、赤芍、冬虫夏草、三七、紫河车、连翘、当归、莪术、党参、黄芪、板蓝根”十一味药材组成,其中,三七、赤芍、当归、黄芪等可活血化瘀,鳖甲软坚散结,连翘、板蓝根清热解毒等,具有软坚散结、化瘀通络和健脾益气等功效,是公认较为有效的抗肝纤维化三大中成药之一[12-13]。本研究在前期临床研究[3]的基础上,采用前瞻性队列研究的方法,分别按照1: 1的病例对照比例纳入CHB-肝纤维化病例构成ETV队列、TDF队列和ADV队列,首次报道比较了这3个队列单用核苷类药以及联合复方鳖甲软肝片治疗CHB-肝纤维化的3年疗效、队列间和组间的差异。
在抗病毒效果方面,对3个队列6组患者在治疗48周、96周和144周时的HBV DNA累积转阴率进行了比较分析,发现:(1)恩替卡韦和替诺福韦酯均具有强效的抗病毒作用,治疗48周时两个队列的HBV DNA累积转阴率分别为85.5%和89.5%;而阿德福韦酯队列的抗病毒效果较弱,48周时HBV DNA累积转阴率仅为43.2%;(2)对队列内进行组间比较时发现,3个队列在48周、96周和144周时的HBV DNA累积转阴率组间均没有差异,提示联用复方鳖甲软肝片并不影响这3种核苷类药物的抗病毒作用;(3)对队列间进行组间比较时,无论是单用药组还是联合用药组,3个队列在48周、96周和144周时的HBV DNA累积转阴率组间均有统计学差异,提示恩替卡韦和替诺福韦酯的抗病毒作用明显强于阿德福韦酯。上述结果与既往48、96周的报道基本一致[14-15],提示替诺福韦酯和恩替卡韦均具有强效抗病毒作用,其中替诺福韦酯作用更加快速,而阿德福韦酯抗病毒效果最弱,联用复方鳖甲软肝片不影响这3种核苷类药物的抗病毒作用。一项来自台湾的前瞻性研究纳入了3653例CHB患者,该研究结果表明,持续血清HBV DNA高载量人群发生肝癌的风险较基线低载量人群显著增高[16],提示若能在合适的时机及早开始抗病毒治疗,可降低发生肝癌的风险。
在改善肝组织炎症和ALT复常方面,ETV队列和TDF队列在治疗第48周时,ALT异常率都降到了10%以下(分别为6.8%和5.3%),而ADV队列在治疗到144周时,ALT异常率才降至10%以下,提示阿德福韦酯在促进肝功能恢复方面效果弱于恩替卡韦和替诺福韦酯。在ETV队列和ADV队列中,联合用药组的ALT复常中位时间均早于单用药组,与既往研究报道一致[3, 17],提示复方鳖甲软肝片具有独立的保肝降酶作用。
在抗肝纤维化效果方面,我们采用了基于肝脏瞬时弹性成像技术(FibroScan®检测)的LSM值来评价肝纤维化程度。瞬时弹性成像技术由于具有无创、简便、快速、重复性和安全性好的特点,目前已被国内外多数肝病指南推荐为病毒性肝炎相关肝纤维化临床评估的重要方法[18-19]。陈永鹏等[20-21]对LSM检测值与肝穿病理学评分的相关性进行了大样本的比较分析,证实LSM值与肝穿病理分期具有良好的相关性,用LSM值诊断肝纤维化程度的准确度高。特别适用于治疗过程中抗肝纤维化疗效的连续监测。我们的研究结果显示,在治疗的第48、96、144周,6组患者的Metavir分期改善≥1等级的比例逐渐增加,提示治疗时间越长,6种治疗方案的逆转肝纤维化效果越好。此外,我们对6组患者在基线与治疗144周时的肝纤维化程度进行比较分析,发现恩替卡韦或者替诺福韦酯在逆转肝纤维化能力方面并没有表现出明显优于阿德福韦酯的效果,提示3种核苷类药物在抗肝纤维化作用上没有明显差异。但是,联合用药组均比单用药组表现出更好的逆转肝纤维化效果,提示核苷类抗病毒药联合复方鳖甲软肝片能够显著提高对CHB-肝纤维化患者的抗肝纤维化疗效。既往研究表明,随着LSM升高,肝癌的风险也随之升高[22-23]。CHB患者不管是否临床诊断为肝硬化,LSM≤13.0 kPa患者的HCC年发生率均低于0.9%,LSM>13.0 kPa非肝硬化患者升高至3.26%,而临床诊断肝硬化患者则高达5.84%;动态随访LSM的变化同样发现其与HCC的发生呈正相关[24]。这些研究都提示,接受有效的抗肝纤维化治疗降低患者的LSM,从长期获益来看,可降低患者HCC的发生率。与本研究结果一致。
从CHB-肝纤维化逐步进展积累到肝硬化,再到肝细胞癌,如果没有抗病毒治疗的介入,这是一个较长期的CHB自然史过程[25-26]。这就给本研究采用抗病毒和抗肝纤维化联合治疗,来逆转肝纤维化和早期肝硬化,进而实现减少肝细胞癌发生的目标[27]创造了机会和时间。本研究纳入分析的749例CHB-肝纤维化患者,在长达144周的随访过程中,单用TDF组以及TDF+FFBJ组均无HCC发生;单用ETV组发生HCC共4例(HCC人年发病密度为7.2/1000人年),ETV+FFBJ组3例(5.5/1000人年),单用ADV组1例(5.7/1000人年),ADV+FFBJ组2例(11.1/1000人年)。与没有接受抗病毒治疗的CHB患者[6]相比较,纳入本研究的CHB患者3年累积HCC发生率显著降低(1.3% vs 7.2%,P < 0.05),提示经过长期抗病毒抗肝纤维化治疗可明显降低HCC的发生率[28]。需要指出的是,虽然TDF队列3年无1例HCC发生,可能优于恩替卡韦队列和阿德福韦酯队列,与文献报道一致[29-30]。但队列间比较的观察的人年数仍然较少。提示继续3个队列的随访研究,特别是扩大到多中心、随访更多病例、更长时间,将会给临床选择优化的抗病毒治疗方案来减少HCC的发生提供更有参考意义的数据。
综上所述,本研究通过建立前瞻性、配对对照的研究队列,对CHB肝纤维化患者采用抗病毒联合抗纤维化或单用抗病毒的方案,进行了长达144周的随访观察,发现:(1)替诺福韦酯和恩替卡韦的抗病毒效果明显优于阿德福韦酯,联用复方鳖甲软肝片不影响这3种核苷类药的抗病毒作用;(2)复方鳖甲软肝片联合核苷类HBV抗病毒药具有良好的抗肝纤维化效果,联合用药组的肝纤维化逆转程度明显优于单用抗病毒药物组;(3)与没有接受抗病毒治疗的CHB患者相比,长期抗病毒抗肝纤维化治疗可显著降低HCC的发生率;(4)6种治疗方案均表现出良好的安全性,无严重不良事件发生。
| [1] |
Weiskirchen R, Tacke F. Liver fibrosis: from pathogenesis to novel therapies[J]. Dig Dis, 2016, 34(4): 410-22. DOI:10.1159/000444556 |
| [2] |
Zhang L, Schuppan D. Traditional Chinese medicine (TCM) for fibrotic liver disease: hope and hype[J]. J Hepatol, 2014, 61(1): 166-8. DOI:10.1016/j.jhep.2014.03.009 |
| [3] |
杨年欢, 袁国盛, 周宇辰, 等. 恩替卡韦联合复方鳖甲软肝片治疗慢性乙型肝炎肝纤维化96周的临床疗效[J]. 南方医科大学学报, 2016, 36(6): 775-9. |
| [4] |
中华医学会感染病学分会中华医学会肝病学分会. 慢性乙型肝炎防治指南(2015更新版)[J]. 肝脏, 2015, 19(12): 915-32. DOI:10.3969/j.issn.1008-1704.2015.12.001 |
| [5] |
中国中西医结合学会肝病专业委员会. 肝纤维化中西医结合诊疗指南[J]. 药品评价, 2007, 4(4): 260-4. DOI:10.3969/j.issn.1672-2809.2007.04.002 |
| [6] |
Hosaka T, Suzuki F, Kobayashi M, et al. Long-Term entecavir treatment reduces hepatocellular carcinoma incidence in patients with hepatitis B virus infection[J]. Hepatology, 2013, 58(1): 98-107. DOI:10.1002/hep.26180 |
| [7] |
Bataller R, Brenner DA. Liver fibrosis[J]. J Clin Invest, 2005, 115(2): 209-18. |
| [8] |
Lok AS. Hepatitis: long-term therapy of chronic hepatitis B reverses cirrhosis[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(4): 199-200. DOI:10.1038/nrgastro.2013.13 |
| [9] |
Zoubek ME, Trautwein C, Strnad P. Reversal of liver fibrosis: from fiction to reality[J]. Best Pract Res Clin Gastroenterol, 2017, 31(2): 129-41. DOI:10.1016/j.bpg.2017.04.005 |
| [10] |
Huang CY, Shen DT, Sun S, et al. Effect of fufang biejia ruangan tablet on lowering biochemical and virological parameters of hepatic fibrosis in patients with chronic hepatitis B protocol for a systematic review and meta-analysis of randomized controlled trials and cohort studies[J]. Medicine (Baltimore), 2019, 98(17): e15297. DOI:10.1097/MD.0000000000015297 |
| [11] |
Feng FR, Ya ng, Bu BW, et al. Effects of fufang biejia ruangan pills on hepatic fibrosis in vivo and in vitro[J]. World J Gastroenterol, 2013, 19(32): 5326-33. DOI:10.3748/wjg.v19.i32.5326 |
| [12] |
蔺武, 刘心娟, 魏南, 等. 复方鳖甲软肝片抗肝纤维化疗效的系统评价[J]. 胃肠病学和肝病学杂志, 2007(1): 69-72. DOI:10.3969/j.issn.1006-5709.2007.01.021 |
| [13] |
王慧, 毕绮丽. 复方鳖甲软肝片抗肝纤维化机理及应用分析[J]. 广州医药, 2014, 45(4): 56-7. DOI:10.3969/j.issn.1000-8535.2014.04.019 |
| [14] |
Chang TT, Gish RG, de Man R, et al. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B[J]. N Engl J Med, 2006, 354(10): 1001-10. DOI:10.1056/NEJMoa051285 |
| [15] |
Marcellin P, Chang TT, Lim SG, et al. Adefovir dipivoxil for the treatment of hepatitis B e antigen-positive chronic hepatitis B[J]. N Engl J Med, 2003, 348(9): 808-16. DOI:10.1056/NEJMoa020681 |
| [16] |
Chen CJ, Yang HI, Su J, et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level[J]. JAMA, 2006, 295(1): 65-73. DOI:10.1001/jama.295.1.65 |
| [17] |
曾荣城, 陈彪, 张仁品, 等. 复方鳖甲软肝片与安络化纤丸治疗肝纤维化的疗效比较[J]. 中国医药指南, 2012, 10(33): 286. DOI:10.3969/j.issn.1671-8194.2012.33.228 |
| [18] |
陈永鹏. 瞬时弹性成像技术诊断肝纤维化专家共识(2018年更新版)[J]. 中华肝脏病杂志, 2019, 27(3): 182-91. |
| [19] |
European Association for the Study of the Liver. EASL 2017 clinical practice guidelines on the management of hepatitis B virus infection[J]. J Hepatol, 2017, 67(2): 370-98. DOI:10.1016/j.jhep.2017.03.021 |
| [20] |
Chen YP, Liang XE, Zhang Q, et al. Larger biopsies evaluation of transient elastography for detecting advanced fibrosis in patients with compensated chronic hepatitis B[J]. J Gastroenterol Hepatol, 2012, 27(7): 1219-26. DOI:10.1111/j.1440-1746.2012.07122.x |
| [21] |
Liang XE, Chen YP, Dai M, et al. Liver stiffness measurement in Chinese adult male population from a community cohort[J]. Zhonghua Gan Zang Bing Za Zhi, 2011, 19(12): 934-5. |
| [22] |
Liang LY, Wong VW, Tse YK, et al. Improvement in enhanced liver fibrosis score and liver stiffness measurement reflects lower risk of hepatocellular carcinoma[J]. Aliment Pharmacol Ther, 2019, 49(12): 1509-17. DOI:10.1111/apt.15269 |
| [23] |
Tatsumi A, Maekawa S, Sato M, et al. Liver stiffness measurement for risk assessment of hepatocellular carcinoma[J]. Hepatol Res, 2015, 45(5): 523-32. DOI:10.1111/hepr.v45.5 |
| [24] |
Jung KS, Kim SU, Ahn SH, et al. Risk assessment of hepatitis B Virus-Related hepatocellular carcinoma development using liver stiffness measurement (FibroScan)[J]. Hepatology, 2011, 53(3): 885-94. DOI:10.1002/hep.24121 |
| [25] |
European Association for the Study of the Liver. EASL clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2018, 69(1): 182-236. DOI:10.1016/j.jhep.2018.03.019 |
| [26] |
Omata M, Cheng AL, Kokudo N, et al. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update[J]. Hepatol Int, 2017, 11(4): 317-70. DOI:10.1007/s12072-017-9799-9 |
| [27] |
Pinzani M, Vizzutti F. Fibrosis and cirrhosis reversibility: clinical features and implications[J]. Clin Liver Dis, 2008, 12(4): 901. DOI:10.1016/j.cld.2008.07.006 |
| [28] |
Papatheodoridis GV, Idilman R, Dalekos GN, et al. The risk of hepatocellular carcinoma decreases after the first 5 years of entecavir or tenofovir in caucasians with chronic hepatitis B[J]. Hepatology, 2017, 66(5): 1444-53. DOI:10.1002/hep.29320 |
| [29] |
Kim BG, Park NH, Lee SB, et al. Mortality, liver transplantation and hepatic complications in patients with treatment-naive chronic hepatitis B treated with entecavir vs tenofovir[J]. J Viral Hepat, 2018, 25(12): 1565-75. DOI:10.1111/jvh.2018.25.issue-12 |
| [30] |
Choi J, Kim HJ, Lee J, et al. Risk of hepatocellular carcinoma in patients treated with entecavir vs tenofovir for chronic hepatitis B A korean nationwide cohort study[J]. JAMA Oncol, 2019, 5(1): 30-6. DOI:10.1001/jamaoncol.2018.4070 |
 2019, Vol. 39
2019, Vol. 39

