最新的流行病学调查发现,随着我国社会经济快速发展,人民生活压力增大,人口老龄化加速,脑卒中的发病率呈上升趋势,而其中77%为缺血性脑卒中,脑梗死较高的发病率及致残致死率给社会和家庭带来极大的危害和照料负担[1]。已有研究表明良好的侧支循环是决定动脉内治疗的效果的重要因素,具有良好侧支循环的患者其血管再通率更高,而侧支循环较差的颈内动脉闭塞的脑梗死患者,其预后不佳[2],尽管近年血管内治疗的研究取得很大进步,但是在急性缺血性卒中发生4.5 h之内,rt-PA溶栓治疗仍是首选[3]。在急性缺血性脑卒中发生后,脑血管的侧支循环能够改善血管血流,维持良好的脑灌注,良好的侧支循环可以拯救缺血半暗带,对静脉溶栓患者的预后有较好的预测价值[4]。目前该领域的研究的热点在于如何改善和建立良好的侧支循环,但是影响侧支循环的因素众多,尚无明确定论[5]。Toll样受体(TLRs)是一种分布于免疫细胞表面的跨膜受体,其参与特异性识别不同病原体,已证实TLR4在脑组织中有表达,且在脑缺血后的炎症应答中起着重要的作用[6]。但既往的研究多集中在TLR4与脑梗死的发生发展有关,而关于IVT后侧支循环的状态与TLR4水平之间的关系尚未报告。本研究以大脑中动脉狭窄的急性脑梗死且接受静脉rt-PA治疗的患者为对象,探讨影响侧支循环的相关因素,通过测定血清TLR4表达水平,探讨其与溶栓治疗患者侧支循环代偿的相关性。
1 资料和方法 1.1 研究对象本研究是回顾性、观察性研究,纳入2016年的9月~2018年8月在我院神经内科住院,且接受rt-PA静脉溶栓的大脑中动脉狭窄的急性脑梗死患者共65例。纳入标准:(1)符合《中国急性脑缺血性脑卒中诊治指南2014》诊断标准;且根据头颅CTA显示MCA梗死患者;(2)年龄大于18岁,且发病在4.5 h以内开始进行静脉溶栓;(3)入院时美国国立卫生研究院卒中量表(NIHSS)评分为4~25分。排除标准:(1)既往有脑出血、脑外伤、瘤卒中等病史;(2)心源性栓塞、血管内治疗患者;(3)有静脉溶栓禁忌症患者、重要脏器功能严重受损、血液病或恶性肿瘤等;(4)头颈CTA颈内动脉、椎基底动脉狭窄大于50%或闭塞;(5)拒绝配合检查及签署知情同意书的患者。本研究通过我院医学伦理委员会审批。所有受试患者于溶栓前及溶栓后1周内均进行头颈CTA检测,采用区域软脑膜评分(rLMC)评分法,该法主要评估区域包括Alberta卒中项目早期CT评分(ASPECTS)区域的M1~M6区、基底节区外侧裂部分及大脑前动脉(ACA)供血区,共9区。外侧裂区是软脑膜侧支供应较多的区域,评分较高,与正常的对侧比较:无血流供应0分;有血流,但与对侧比较较少为2分;血流丰富,与对侧相等甚至高于对侧为4分。除外侧裂的其余各部分分别为0分、1分及2分。总分为20分,评分越高提示侧支建立越好[7]。根据溶栓后rLMC评分分为侧支循环较好组(11~20分)与侧支循环较差组(0~10分)。
1.2 一般资料收集记录所有患者年龄、性别、病史,入院后第2天测量患者体重、血糖、血压及血脂。同时抽取空腹静脉血3 mL,肝素抗凝,3000 r/min离心15 min完全分离血浆,取上清放置与预冷PE管中,保存于-80 ℃冰箱待测,待标本收集后Elisa法测定血清中TLR4含量(上海康朗,klH1539c)。用NIHSS评分量表对患者溶栓前、溶栓后24 h及30 d进行评分,用改良的Rankin量表进行90 d后神经功能评定。记录患者既往药物使用情况,记录患者发病至溶栓时间,治疗经过及恢复情况。静脉溶栓治疗后12 h复查头颅CT、出现症状加重是随时复查头颅CT,以明确是否出现症状性脑出血。
1.3 治疗与评价标准对符合诊断及时间窗的脑梗死患者使用rt-PA(Boehringer Ingelheim Pharma GmbH & Co, KG)治疗,按照0.9 mg/kg来计算剂量,最大剂量不超过90 mg,其中总量的10%在1 min内推注,剩余的剂量于1 h内缓慢静脉滴注。
由三名神经内科主治医师进行rLMC评分,如结果有差别,取中间值。该方法评价侧支循环的总分为20分,评分越高提示侧支循环越好。将溶栓后90 dmRS评分0~1分定义为预后良好。2~6分定义为预后不良。
1.4 统计学方法使用SPSS24.0软件对资料进行统计分析,P < 0.05认为差异有统计学意义,P < 0.001时不给出具体P值。符合正态分布的连续变量资料用均数±标准差表示,用Levene法进行方差齐性检验,若方差相等,则采用两独立样本的t检验;若方差不等或变量资料不符合正态分布的,以中位数或者四分位间距来描述,行两独立样本Mann-Whitney U检验。计数资料以百分率表示,组间比较采用Pearson卡方检验或Fisher精确检验。采用单因素或多因素Logistic回归分析侧支循环代偿的相关因素。采用pearson相关系数对血清TLR4水平与rLMC评分进行相关分析,绘制散点图。
2 结果 2.1 一般基线资料比较结果所有患者根据rLMC评分分为两组,侧支循环良好组34人(14.53±2.35)和侧支循环较差组31人(6.35± 1.89),两组患者的包括性别、年龄构成、吸烟史、饮酒史、BMI缺血性心脏病、血脂水平、急诊溶栓时间、既往抗血小板药物使用比例等比较无差异性,具有可比性(P > 0.05)。而两组患者的糖尿病、高血压患病率、陈旧性脑梗死、入院时NIHSS评分及血清TLR4水平存在统计学差异(P < 0.05,表 1)。
| 表 1 各组一般基线资料及溶栓后TIR4水平比较 Tab.1 Baseline characteristics and levels of TLR4 of patients with good and poor leptomeningeal collaterals |
溶栓后侧支循环较好组即A组的溶栓后24 h NIHSS评分、溶栓后30 d NIHSS评分和90 d mRS评分明显低于B组,差异具有统计学意义(P < 0.05)。而预后良好比例A组高于B组,差异有统计学意义(P < 0.05)。症状性颅内出血比例A组低于B组,但未见明显差异(表 2)。
| 表 2 溶栓后两组患者临床转归比较各组血清指标比较 Tab.2 Clinical outcomes of the patients with good and poor leptomeningeal collateral after thrombolysis therapy |
将侧支循环良好组rLMC评分(14.53±2.35)和侧支循环较差组rLMC评分(6.35±1.89)进行比较,发现侧支良好组rLMC评分明显高于侧支循环较差组,差异存在统计学意义(P < 0.05)。进一步将TLR4与rLMC评分之间做Pearson相关性分析发现,TLR4水平与rLMC评分呈显著负相关(r = -0.723,P < 0.05,图 1)。
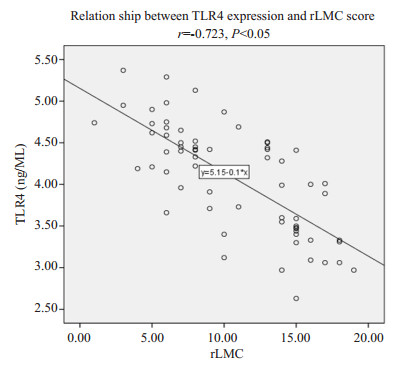
|
图 1 TLR4水平与rLMC评分的散点图 Fig.1 Scatter plot of TLR4 level vs rLMC score of the patients. The regression line shows a significant correlation between TLR4 level and rLMC scores based on the Pearson's correlation coefficient |
以侧支循环是否良好为因变量,以糖尿病、高血压、TLR4水平及陈旧性脑梗死为自变量,进行二分类多因素Logistic回归分析发现,高血糖、TLR4水平及陈旧性脑梗死与静脉rt-PA溶栓后侧支循环的代偿相关(P < 0.05,表 3)。
| 表 3 多因素Logistic回归分析 Tab.3 Logistic multivariate regression analysis of the factors associated with the compensation for collateral circulation following thrombolytic therapy |
脑卒中是发达国家的第2大痴呆及死亡原因,也是我国成人严重残疾的主要原因,而时间窗内rt-PA静脉溶栓能够改善患者预后,抢救缺血半暗带,开创了治疗急性缺血性脑卒中的新时代[8]。人类大脑侧支循环主要分为3级:Ⅰ级侧支循环即Willis环,当一侧颈内动脉严重狭窄或者闭塞的时候,通过Willis环向病灶处提供血流,改善脑组织缺血状态;Ⅱ级侧支循环即眼动脉和软脑膜吻合支,当大脑中动脉严重狭窄或者梗塞时,主要是通过Ⅱ级侧支循环代偿,保护缺血半暗带,阻止神经细胞死亡;Ⅲ级循环即新生血管[9]。在脑卒中事件中,良好的侧支循环代偿是影响卒中结果的重要因素[10-11],本研究即探讨影响侧支循环的相关因素,同时通过测定血清TLR4表达水平,探讨其与溶栓治疗患者侧支循环代偿的相关性。
3.1 良好侧支循环与rtPA静脉溶栓后的临床分析尽管静脉溶栓疗效良好,但是其早期的血管再通率只有33%~46.2%,目前大多数的研究认为良好的侧枝循环在一定程度上决定了患者溶栓后的临床好转率,减少脑梗死的病灶的体积[12],甚至一些拥有良好侧支循环的患者,即使超过了时间窗依然可以通过静脉溶栓获得良好的临床疗效[13]。CTA技术在评价侧支循环软脑膜吻合支方面具有较高的敏感性和特异性,可以了解脑血管闭塞的位置程度[14]。本研究通过对65例急性脑梗死且接受静脉溶栓的患者进行回顾性研究发现,代偿较好组患者入院时NIHSS评分、溶栓后24 hNIHSS评分和溶栓后30 dNIHSS评分低于B组,差异有统计学意义。随访90 dmRS评分发现,侧支循环丰富的患者远期功能和预后良好比例也较侧支循环差的患者更好。分析其原因可能为脑梗患者神经功能恢复呈缓慢渐进性,良好的侧支循环可以提高脑组织的缺血耐受性[15],故侧支循环良好的患者其溶栓后远期神经功能恢复更佳。本研究中症状性颅内出血比例A组也较B组减少,提示良好的侧支循环可以增强溶栓药物的利用率,在脑梗死急性期改善病灶缺血半暗带的血流,减少脑组织的损伤。台湾一项meta分析也得出类似结论,良好的侧支循环可以改善急性脑梗患者静脉溶栓后的的临床转归[13]。
3.2 影响侧支循环建立的因素本研究中侧支循环良好组糖尿病患病率较侧支循环不良组低,差异具有统计学意义,同时多因素logistic回归分析显示,糖尿病与侧支循环建立成负相关,与国内外研究一致[16]。糖尿病是脑血管病的危险因素,同时高血糖可能抑制了脑侧支循环的建立,其机制可能为血液粘稠度增高,降低血流速度,并且高血糖可抑制平滑肌钾通道、抑制血管内皮细胞舒张[17]。同时在本研究中发现A组高血压患病率较B组低,其原因可能为长期持续高血压加速血管内皮死亡,抑制了脑侧支循环的建立,不利于临床良好转归。但是在多因素logistic回归分析中,高血压与侧支循环不良的关系并无统计学意义。也有研究认为患有高血压的脑梗死患者其侧支循环的开放具有不确定性和复杂性,肾素血管紧张素醛固酮系统激活后,肾素血管紧张素Ⅱ含量更高,该物质同时具有促进和抑制血管生成的功能[18]。有动物研究表明,诱导血压升高能够减少梗死体积,同时增加软脑膜侧支循环,但是目前没有临床试验研究证实该方法的有效性及安全性[19]。是否存在某个血压水平,是对侧支循环建立和开放最有利的?这值得我们进一步深入研究。
本研究中侧支循环良好组陈旧性脑梗死率较侧支循环不良组低,差异具有统计学意义,多因素Logistic回归分析发现,陈旧性脑梗死与静脉rt-PA溶栓后侧支循环的代偿相关(P < 0.05)。其原因分析为陈旧性脑梗死患者合并有脑梗危险因素,长期处于脑低灌注状态,患者的软脑膜侧支循环代偿不良,rt-PA溶栓效果差,甚至会增加溶栓后症状性脑出血的风险[20]。
3.3 TLR4水平与侧支循环的关系Toll样受体家族(TLRs)在脑损伤的炎症应答中起着重要作用,是卒中后炎症中的促炎级联起始因子[6],其中TLR4及其下游核因子信号通路介导炎症反应,扩大脑梗死病灶,促进再灌注损伤[21-22]。研究表明,TLR4能识别脑缺血再灌注损伤释放的内源性配体,激活TLR4/ NF-κB通路过度表达,导致粘附分子和相应的受体的表达,引起一系列严重的炎症反应,从而影响神经功能[23]。TLR4能通过桥梁分子TIR结构域接头蛋白(TIRAP)与髓样分化因子初次应答基因88(MyD88)结合,而活化的TLR4能够与MyD88结合,进而募集白细胞介素-1受体相关激酶,从而激活促分裂原活化蛋白激酶与细胞核因子κB(NF-κB)信号通路,启动炎症反应[24]。TLR4的表达激活NF-κB信号通路,NF-κB从p50同型二聚体转化为具有转录活性的p60异二聚体,活化的NF-κB从细胞质转移到细胞核发挥转录作用,产生一系列炎症因子,促进炎症反应的产生,从而引起脑组织损伤,而脑损伤产生的内源性物质又可以成为TLR4配体,从而增加炎症反应,促进神经功能损害[25-26]。
本研究中侧支循环良好组血清的TLR4含量明显低于侧支循环不良组,并且血清TLR4含量与区域软脑膜侧支评分呈显著负相关,差异具有统计学意义(P < 0.05)。推测原因可能为动脉之间侧支血管的开放及血管新生有关,良好的侧支循环可以有效的较少梗死面积,挽救缺血半暗带,减轻脑组织中的炎症反应,炎症反应降低,TLR4水平出现下降。TLR4水平的高低与侧支循环状态孰为因果,其具体的机制还需要进一步动物实验证明。
最新一项动物实验显示,在雄性成年小鼠脑梗死模型中发现TLR4的特异性新型调节剂miR-1906可以通过抑制mRNA翻译来下调TLR4蛋白表达,从而挽救梗死面积及神经功能。而在敲除TLR4的情况下,miR- 1906的作用消失,表明TLR4是miR-1906的主要靶标,microRNA通过该靶标发挥其保护作用[28]。同时还有动物研究表明,姜黄素通过抑制TLR4/NF-κB信号通路,具有抑制炎症的作用,对缺血性脑损伤起到保护作用[27]。向急性脑缺血模型小鼠注射TLR4拮抗剂TAK- 242,可以降低TLR4的表达,抑制TLR4 / NF-κB信号通路,防止脑缺血的再灌注损伤[28],这可能是治疗脑缺血的新途径。
综上所述,良好的侧支循环可以增加病灶脑血流量,延长缺血半暗带存活时间,提高静脉溶栓的成功率,挽救神经元坏死,改善临床神经功能。急性脑梗死患者良好的侧枝循环可使静脉溶栓的获益增多。而急性脑梗死患者血糖、TLR4水平及陈旧性脑梗死是静脉rt-PA溶栓后侧支循环代偿不良的预测因子。侧支循环良好的患者单纯药物治疗可带来较好的临床收益,而侧支循环较差的患者除了药物治疗,可能还需要血管内介入治疗。本研究旨在探索影响患者脑血管侧支循环的因素,早期侧支循环的多途径评估对静脉溶栓患者的疗效有重要的预测价值,可以为患者的精准化、个体化治疗提高新的思路,同时提示我们改善患者侧支循环也是脑梗死患者二级预防的努力方向。
该研究也存在一定的局限性,如高血压患者未进行不同血压程度与结局的研究,我们在下一步的研究当中,可以探索不同程度的血压对侧支循环的影响。同时本研究病例数较少,可能会存在选择偏倚。由于检查设备及费用的限制,侧支循环的评价未选择DSA。
| [1] |
Wang WZ, Jiang B, Sun HX, et al. Prevalence, incidence, and mortality of stroke in China results from a nationwide PopulationBased survey of 480 687 adults[J]. Circulation, 2017, 135(8): 759-771. DOI:10.1161/CIRCULATIONAHA.116.025250 |
| [2] |
Ginsberg MD. Expanding the concept of neuroprotection for acute ischemic stroke: The pivotal roles of reperfusion and the collateral circulation[J]. Prog Neurobiol, 2016, 145-146(10-11): 46-77. |
| [3] |
Powers WJ, Derdeyn CP, Biller J, et al. 2015 american heart association/american stroke association focused update of the 2013 guidelines for the early management of patients with acute ischemic stroke regarding endovascular treatment: a guideline for healthcare professionals from the american heart association/american stroke association[J]. Stroke, 2015, 46(10): 3020-35. DOI:10.1161/STR.0000000000000074 |
| [4] |
Menon BK, Qazi E, Nambiar V, et al. Differential effect of baseline computed tomographic angiography collaterals on clinical outcome in patients enrolled in the interventional management of stroke Ⅲ trial[J]. Stroke, 2015, 46(5): 1239-44. DOI:10.1161/STROKEAHA.115.009009 |
| [5] |
Alimu W, Atikaimu W, Peierdun M, et al. Impact of collateral circulation status on favorable outcomes in thrombolysis treatment: A systematic review and meta-analysis[J]. Exp Ther Med, 2018, 15(1): 707-18. |
| [6] |
王晓晨, 吉爱国. NF-κB信号通路与炎症反应[J]. 生理科学进展, 2014, 45(1): 68-71. |
| [7] |
Liebeskind DS, Cotsonis GA, Saver JL, et al. Collaterals dramatically alter stroke risk in intracranial atherosclerosis[J]. Ann Neurol, 2011, 69(6): 963-74. DOI:10.1002/ana.22354 |
| [8] |
Abilleira S, Ribera A, Cardona P, et al. Outcomes after direct thrombectomy or combined intravenous and endovascular treatment are not different[J]. Stroke, 2017, 48(2): 375-8. DOI:10.1161/STROKEAHA.116.015857 |
| [9] |
Stoller M, Seiler C. Pathophysiology of coronary collaterals[J]. Curt Cardio Rev, 2014, 10(1): 38-56. DOI:10.2174/1573403X113099990005 |
| [10] |
Fanou EM, Knight J, Aviv RI, et al. Effect of collaterals on clinical presentation, baseline imaging, complications, and outcome in acute stroke[J]. AJNRAm J Neuroradiol, 2015, 36(12): 2285-91. DOI:10.3174/ajnr.A4453 |
| [11] |
Lau AY, Wong EH, Wong A, et al. Significance of good collateral compensation in symptomatic intracranial atherosclerosis[J]. Cerebrovasc Dis, 2012, 33(6): 517-24. DOI:10.1159/000337332 |
| [12] |
Seners P, Turc G, Maier B, et al. Incidence and predictors of early recanalization after intravenous thrombolysis a systematic review and meta-analysis[J]. Stroke, 2016, 47(9): 2409-12. DOI:10.1161/STROKEAHA.116.014181 |
| [13] |
Leng X, Lan L, Liu L, et al. Good collateral circulation predicts favorable outcomes in intravenous thrombolysis: a systematic review and mate-analysis[J]. Eur J Neurol, 2016, 23(12): 1738-49. DOI:10.1111/ene.2016.23.issue-12 |
| [14] |
Park JS, Kwak HS, Chung GH, et al. The prognostic value of CTangiographic parameters after reperfusion therapy in acute ischemic stroke patients with internal carotid artery terminus occlusion: leptomeningeal collateral status and clot burden score[J]. J Stroke Cerebrovasc Dis, 2018, 27(10): 2797-803. DOI:10.1016/j.jstrokecerebrovasdis.2018.06.010 |
| [15] |
Liebeskind DS, Caplan LR. Intracranial arteries-anatomy and collaterals[J]. Front Neurol Neurosci, 2016, 40: 1-20. |
| [16] |
Poppe AY, Majumdar SR, Jeerakathil TA, et al. Admission hyperglycemia predicts a worse outcome in stroke patients treated with intravenous thrombolysis[J]. Diabetes Care, 2009, 32(4): 617-22. DOI:10.2337/dc08-1754 |
| [17] |
Tsuruta R, Fujita M, Ono T, et al. Hyperglycemia enhances excessive superoxide anion radical Generation, oxidative stress, early inflammation, and endothelial injury in forebrain ischemia J reperfusion rats[J]. Brain Res, 2010, 13(9): 155-63. |
| [18] |
Uysal OK, Sahin DY, Duran M, et al. Association between uric acid and coronary collateral circulation in patients with stable coronary artery disease[J]. Angiology, 2014, 65(3): 227-31. DOI:10.1177/0003319713500706 |
| [19] |
Liu JL, Wang YT, Akamatsu Y, et al. Vascular remodeling after ischemic stroke: Mechanisms and therapeutic potentials[J]. Prog Neurobiol, 2014, 115(SI): 138-56. |
| [20] |
Sandercock P, Wardlaw J, Lindley R, et al. IST-3 stroke trial data available[J]. Lancet, 2016, 387(10031): 1904. |
| [21] |
Jickling GC, Zhan X, Stamova B, et al. Ischemic transient neurological events identified by immune response to cerebral ischemia[J]. Stroke, 2012, 43(4): 1006-12. DOI:10.1161/STROKEAHA.111.638577 |
| [22] |
Liu J, Chen Q, Jian Z, et al. Daphnetin protects against cerebral ischemia/reperfusion injury in mice via inhibition of TLR4/NF-κB signaling pathway[J]. Biomed Res Int, 2016, 2816056. |
| [23] |
Wang Y, Ge P, Yang L, et al. Protection of ischemic post conditioning against transient focal ischemia-induced brain damage is associated with inhibition of neuroinflammation via modulation of TLR2 and TLR4 pathways[J]. J Neuroinflammation, 2014, 11(15): 686-91. |
| [24] |
Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4): 783-801. DOI:10.1016/j.cell.2006.02.015 |
| [25] |
Vartanian KB, Stevens SL, Marsh BJ, et al. LPS preconditioning redirects TLR signaling following stroke: TRIF-IRF3 plays a seminal role in mediating tolerance to ischemic injury[J]. J Neuroinflammation, 2011, 8(1): 140. DOI:10.1186/1742-2094-8-140 |
| [26] |
Xu XM, Wen ZY, Zhao N, et al. MicroRNA-1906, a novel regulator of Toll-Like receptor 4, ameliorates ischemic injury after experimental stroke in mice[J]. J Neurosci, 2017, 37(43): 10498-515. DOI:10.1523/JNEUROSCI.1139-17.2017 |
| [27] |
Tu XK, Yang WZ, Chen JP, et al. Curcumin inhibits TLR2/4-NF-κB signaling pathway and attenuates brain damage in permanent focal cerebral ischemia in rats[J]. Inflammation, 2014, 37(5): 1544-51. DOI:10.1007/s10753-014-9881-6 |
| [28] |
Hua F, Wang J, Tang HL, et al. TAK-242, an antagonist for toll-like receptor 4, protects against acute cerebral ischemia/reperfusion injury in mice[J]. J Cereb Blood Flow Metab, 2013, 44(2, S): 536-42. |
 2019, Vol. 39
2019, Vol. 39

 ,
,