2. 福建医科大学附属第二医院神经外科,福建 泉州 362000
2. Department of Neurosurgery, Second Affiliated Hospital of Fujian Medical University, Quanzhou 362000, China
胶质瘤是最常见的原发性中枢神经系统恶性肿瘤,多呈浸润性生长,目前的治疗效果不理想[1]。丰富的肿瘤新生血管导致胶质瘤速增殖、高度侵袭和复发的重要结构基础[2]。近几年随着对胶质瘤发生、发展的不断探索,证实一种新生的肿瘤血管生成形态(VM)参与胶质瘤肿瘤侵袭[3]。因此抑制血管生成拟态成为我们研究胶质瘤侵袭的热点[4]。
迁移诱导蛋白(Mig-7)是一类小分子蛋白产物,由肝细胞生长因子(HGF)和整合素v5诱导,在正常组织中不表达,而在多种肿瘤中表达[5]。我们前期的研究发现:Mig-7与胶质瘤的级别相关,且关系到患者的预后;同时,Mig-7与胶质瘤血管生成拟态成正相关[6]。那么我们有理由相信Mig-7参与胶质瘤血管生成拟态的发生和发展。
大量研究表明VEGF是胶质瘤侵袭和迁移的关键因子,更是血管生成拟态的重要信号通路传导[7]。在正常内皮细胞中,研究显示[8]VEGF可以通过MEK/ERK信号通路导致正常内皮血管的生成。ERK通过一系列信号转导作用磷酸化活化后,从而发挥调节细胞增殖、凋亡和分化等生物学行为的作用[9]。ERK的活化是通过一系列反应激活Raf,由Raf再激活MEK,MEK则会被磷酸化,磷酸化的MEK最终激活ERK,而磷酸化的ERK则会进入细胞核,作用于相应的转录因子及核蛋白,参与血管的调控[10-12]。胶质瘤的血管生成大致可以概述为“血管生成拟态-马赛克血管-正常内皮血管生成” [4];因此,MEK/ERK信号通路可能参与胶质瘤血管生成拟态的形成。
Mig-7影响胶质瘤VM形成,MEK/ERK信号通路是血管生成最为重要的信号转导[13];但是,Mig-7能否通过MEK/ERK信号通路尚未报道,本课题将通过RNA干扰技术,由逆转录病毒介导sh-Mig-7作用胶质瘤U251,证实Mig-7抑制后可影响胶质瘤U251的迁移侵袭及血管生成拟态,并探讨其相关通路。
1 材料和方法 1.1 材料 1.1.1 细胞株人脑胶质瘤U251细胞购自中国科学院上海生命科学研究院细胞资源中心。
1.1.2 主要试剂RPMI 1640培养液、胰蛋白酶及胎牛血清(Gibco)。Taq酶、dNTP、TRIzol试剂、SYBR Prime SciptTMRT-PCR试剂盒(TaKaRa);实时荧光定量- PCR的引物由北京鼎国生物科技有限公司设计并合成。人工基质凝胶(Matrigel, BD);Transwell小室(聚酯薄膜的孔径8 μm,Coring Costar)。MEK、ERK多克隆抗体以及辣根过氧化物酶标记的山羊抗兔或山羊抗兔IgG(Santa Cruz);蛋白抑制剂及磷酸酶抑制剂(Roche);BCA蛋白测定试剂盒及ECL试剂盒(Pierce)Pierce。
携带有绿色荧光蛋白的pGCL-GFP为载体构建针对Mig-7基因重组慢病毒质粒委托北京鼎国生物科技有限公司制备。
1.2 方法 1.2.1 细胞培养及sh-Mig-7的感染采用含10%胎牛血清的RPMI 1640培养液,按常规细胞培养方法培养感染与未感染病毒的U251细胞。实验分为4组:感染sh-Mig-7慢病毒的细胞为实验组(sh-Mig-7-1组),感染sh-Mig-7慢病毒的细胞为实验组(sh-Mig-7-2组)、感染Sh-NC慢病毒的细胞为阴性对照组(sh-NC组),未作任何处理的细胞为未感染组(空白对照组)。病毒感染的流程参照产参照LipofectamineTM 2000 Transfection Reagent说明书(Invitrogen)进行转染。主要步骤:取对数生长期的U251细胞制备为单细胞悬液,以4×100/孔的密度接种于24孔板中,待生长到70%-90%融合度时,加入感染复数(MOI)值为20的病毒进行感染,96h后在荧光显微镜下各组随机选择10个视野,计数绿色荧光蛋白标记阳性细胞数、细胞总数,转染效率为绿色荧光蛋白标记阳性细胞数占细胞总数的百分比。
1.2.2 实时荧光定量PCR检测稳定转入sh-Mig-7的U251细胞中Mig-7 mRNA的表达水平收集上述4组U251细胞,用PBS洗涤细胞3次,按照TRIzol试剂盒操作手册提取细胞中的总RNA, 并按SYBR Prime SciptTM RT--PCR试剂盒说明进行反转录和PCR扩增。Mig-7基因引物序列:上游引物为5'-AGGTGGAT CCCATCCAGTTG-3',下游引物为5-AGGATTTCTG GTTTGCCCCT-3';以GAPDH为内参照,GAPDH基因引物序列:上游引物为5'-AAGGTGAAGGTCGGAGT CAA-3',下游引物为5'-AATGAAGGGGTCATTGAT GG-3'。P C R反应条件为95 ℃ 15 s,1个循环;95 ℃ 5 s、60 ℃ 31 s,共40个循环;以2-ΔΔCt值(Ct代表循环阈值)表示Mig-7 mRNA的相对表达量。每组实验均重复5次。
1.2.3 sh-Mig-7 U251细胞管腔形成的影响[14]将状态良好的U251各组细胞胰蛋白酶消化成单细胞继续培养48 h;将1 mL的枪头和24孔板放在-20 ℃预冷,BD基质胶放在碎冰中溶解;将BD基质胶铺于预冷的24孔板中,每孔400 μL,37 ℃放置30 min凝固成胶;将各组细胞胰蛋白酶消化成单细胞,细胞计数,1.5×105细胞/孔,继续培养24 h;利用共聚焦显微镜拍摄记录结果,计数各组胶质瘤细胞VM的形成水平。在高倍显微镜下随机选取5个视野,分别计数细胞所形成的官腔数目。每组实验均重复5次。
1.2.4 Sh-Mig-7对U251细胞迁移侵袭的影响[15]在孔径为8 μm的Transwell小室上层预先铺好30 μL稀释后的Matrigel;将感染24 h后的各组U251细胞,按常规处理后,用不含胎牛血清的RPMI 1640培养液调整细胞密度为5×105/mL。在Transwell小室的下层加入600 μL含20%胎牛血清的RPMI 1640培养液,上层加入200 μL细胞悬液。置于37 ℃、CO2体积分数为5%的饱和湿度的培养箱中培养24 h;采用4%的多聚甲醛溶液固定细胞15 min后,用棉签擦去小室上层的细胞,并用结晶紫染色,常规处理后,在光学显微镜下计数穿过Transwell小室聚碳酸酯膜的细胞(放大倍数为200)。每组实验均重复5次。
1.2.5 Western blot检测不同组别MEK、ERK蛋白表达水平分别收集生长状态良好的将状态良好的U251各组细胞,加入预冷的细胞裂解液(含RIPA、1×蛋白酶抑制剂和1×磷酸酶抑制剂),冰浴中充分裂解细胞。4 ℃条件下12 000×g离15 min取上清液。蛋白质经BCA法分析定量。每组样品取8 μg总蛋白,采用4%~12%TrisGlycine胶电泳后分离蛋白,并转移至PVDF膜上,用封闭液(含有5%牛血清白蛋白+0.05% Tween20的TBS)于室温下反应1h;随后分别加入一抗,体积稀释比均为1:3000)和鼠抗人-Actin单克隆抗体(内参照)(体积稀释比为1:3 000)],4 ℃反应过夜;TBST洗膜10 min×3次;加入辣根过氧化物酶标记的山羊抗兔IgG 1h,TBST漂洗5次后,用增强型化学发光试剂在Image Quant LAS 4000 mini(GE)拍照并进行蛋白质条带灰度值的分析,以目的蛋白质条带灰度值与内参照-Actin蛋白质条带灰度值的比值,再乘以100表示目的蛋白的相对表达水平。
1.3 统计学处理应用SPSS 18.0统计学软件对获得数据进行统计学分析,计量资料以均数±标准差表示。组间比较采用单因素方差分析,组间两两比较采用LSD。P < 0.05为差异有统计学意义。
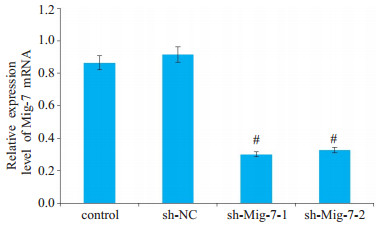
2 结果 2.1 Mig-7基因沉默效率的鉴定病毒感染96 h后,荧光显微镜下观察sh-Mig-7-1组和sh-Mig-7-2组U251细胞中GFP荧光的表达情况,结果显示两组感染效率达90%,成功获得了高效、稳定的sh-Mig-7的U251细胞(图 1)。进一步采用实时荧光定量-PCR法进行检测,结果显示,与空白对照组和阴性对照组相比,sh-Mig-7-1组和sh-Mig-7-2组U251细胞中Mig-7 mRNA的相对表达量显著下调(P均 < 0.05),成功构建的sh-Mig-7慢病毒载体能够有效抑制U251细胞Mig-7基因的转录水平(图 2)。

|
图 1 光镜和荧光显微镜下观察重组慢病毒在U251细胞中的感染效率 Fig.1 Infection efficiency of the recombinant lentiviruses in U251 cells observed under light microscope and fluorescence microscope. A1: sh- Mig-7-1 group (light microscope); A2: sh-Mig-7-1 group (fluorescence microscope); B1: sh-Mig- 7-2 group (light microscope); B2: sh-Mig-7-2 group (fluorescence microscope) |
|
图 2 sh-Mig-7慢病毒载体能够有效抑制U251细胞Mig-7基因的转录水平 Fig.2 Lentiviral vector carrying sh-Mig-7 effectively inhibits Mig-7 gene transcription in U251 cells; #P < 0.05 vs control |
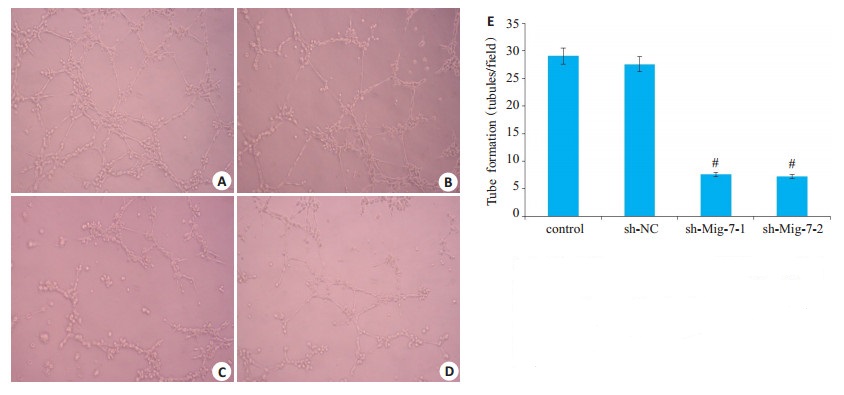
感染24 h后发现,对照组和Sh-NC对照组中胶质瘤细胞互相融合,互相连接形成血管样结构,sh-Mig-7- 1组和Sh-Mig-7-2组中血管样结构明显减少(图 3)。在U251胶质瘤细胞中对照组和Sh-NC对照组每视野管状数目分别为29.21±4.34,28.24±3.35;sh-Mig-7-1组和sh-Mig-7-2组分别为7.21±3.25,6.87±3.67;沉默Mig-7基因后能明显抑制U251胶质瘤细胞体外VM的能力(P < 0.05)。
|
图 3 Mig-7基因抑制后对U251细胞血管生成拟态的影响 Fig.3 Mig-7 gene silencing inhibits vasculogenic mimicry in U251 cells. A: Control group; B: sh-NC group; C: sh-Mig-7-1 group; D: sh-Mig-7-2 group; E: Tube formation; #P < 0.05 vs control |
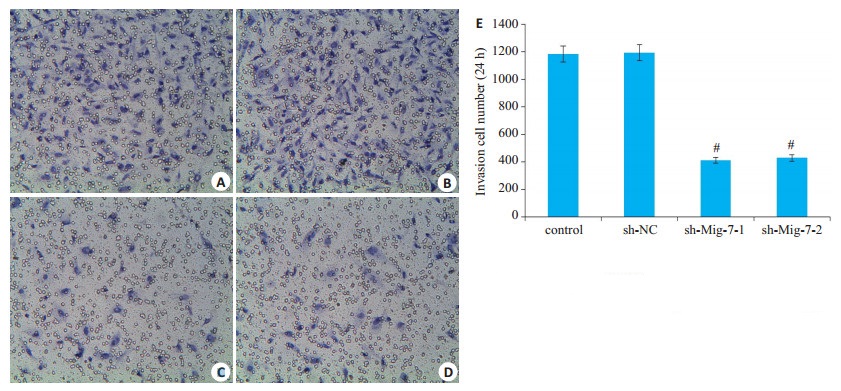
Transwell小室检测结果显示,sh-Mig-7-1组和shMig-7-2组U251细胞穿过Matrigel的细胞数较空白对照组1183.30±125.86与阴性对照组明显减少,差异有统计学意义(P < 0.01,图 4)。
|
图 4 Mig-7基因抑制后对U251细胞侵袭能力的影响 Fig.4 Mig-7 gene silencing inhibits invasive ability of U251 cells. A: Control group; B: sh-NC group; C: sh-Mig- 7-1 group; D: sh-Mig-7-2 group; E: Invasion cell number; #P < 0.05 vs control |
sh-Mig-7-1组和sh-Mig-7-2组U251细胞的MEK、ERK蛋白表达水平较空白对照组与阴性对照组明显下调,差异有统计学意义(P < 0.05,图 5)。

|
图 5 Western blot检测Mig-7基因抑制后MEK和ERK的蛋白表达情况 Fig.5 Mig-7 gene silencing inhibits protein expressions of MEK and ERK in U251 cells. A: Western blotting of MEK and ERK expressions; B: Relative expression levels of the protein. #P < 0.05 vs control |
血管生成拟态在大多数侵袭力强的肿瘤均有发现,包括卵巢癌、肺癌、肝癌等等[17-19]。血管生成拟态的提出,从肿瘤微环境学[20]、说这一领域重新认识肿瘤的发生,发展过程,提出肿瘤血管从无内皮细胞-马赛克血管-内皮依赖血管学说的成立[21]。由于脑组织结构的特点,迁移、侵袭一直是胶质瘤研究的重点[22]。Mig-7是肿瘤细胞中迁移和循环的早期标志物,是肿瘤早期转移的标志之一。我们前期的研究提示Mig-7在胶质瘤级别和血管生成拟态是密切相关的。但是,具体Mig-7通过什么相关通路影响胶质瘤VM的进程尚未报道,因此我们通过胶质瘤细胞系的相关研究,具体探讨Mig-7能否抑制肿瘤的侵袭、VM的形成及相关信号通路的探讨。
本研究中,通过RNA干扰技术沉默Mig-7基因表达后,重新建立起稳定传代的U251细胞株,与感染sh-NC慢病毒和未感染病毒的的细胞相比,Sh-Mig-7感染组中U251细胞中Mig-7的表达水平以显著降低,提示我们成功建立稳定细胞系;通过细胞系的传代培养,与空白对照组和sh-NC感染组相比,sh-Mig-7感染组U251细胞的侵袭能力明显下降,并且sh-Mig-7感染组U251细胞VM形成能力明显下降。研究表明,VM形成的与肿瘤侵袭密切相关,VM为肿瘤侵袭提供相应的结构基础[23];本研究中,Mig-7抑制后能减慢U251的VM和侵袭,这一结果与其他肿瘤的表达及其相似[24-26]。因此,本结果进一步明确Mig-7参与胶质瘤VM和侵袭,为相关研究提供依据。
大量研究表明[27-28]MEK/ERK信号转导通路与神经胶质瘤的发病机制、发生发展以及相关生物学行为存在密切的关系。其中MEK/ERK信号通路调控细胞生长和分化,是将胞外的生长和神经营养信号传到核内,进而导致胶质瘤的侵袭及生长。有研究指出[29]ERK信号通路抑制后血管生成拟态的生成受到抑制,因此MEK/ ERK参与血管生成拟态的形成。本研究指出当Mig-7干扰后,MEK/ERK的表达受到影响,差异具有统计学意义(P < 0.05);因此可以肯定的是Mig-7参与MEK/ ERK的信号通路转导,从而抑制血管生成拟态的形成,本实验也首次证明了在人脑胶质瘤细胞中Mig-7可能通过MEK/ERK信号转导通路最终影响到胶质瘤细胞VM的形成及侵袭性。
总之Mig-7抑制后导致肿瘤细胞迁移侵袭的改变,同时导致肿瘤细胞VM形成能力减弱;但Mig-7通过什么信号传导通路影响肿瘤细胞的一系列细胞生物演变仍然是一个未知之数,揭示Mig-7信号间的Crosstalking才是细胞研究的重中之重,后期我们将持续开展Mig-7的信号转导并开展动物实验,进一步展示VM形成过程与Mig-7的生物特性。
| [1] |
Nishikawa M, Inoue A, Ohnishi T, et al. Significance of glioma stemlike cells in the tumor periphery that express high levels of CD44 in tumor invasion, early progression, and poor prognosis in glioblastoma[J]. Stem Cells, 2018, 2018: 5387041. |
| [2] |
Choi D, Montermini L, Kim DK, et al. The impact of oncogenic EGFRvIII on the proteome of extracellular vesicles released from glioblastoma cells[J]. Mol Cell Proteomics, 2018, 17(10): 1948-64. DOI:10.1074/mcp.RA118.000644 |
| [3] |
Angara K, Rashid MH, Shankar A, et al. Vascular mimicry in glioblastoma following anti-angiogenic and anti-20-HETE therapies[J]. Histol Histopathol, 2017, 32(9): 917-28. |
| [4] |
Wu HB, Yang S, Weng HY, et al. Autophagy-induced KDR/VEGFR- 2activation promotes the formation of vasculogenic mimicry by glioma stem cells[J]. Autophagy, 2017, 13(9): 1528-42. DOI:10.1080/15548627.2017.1336277 |
| [5] |
Ho MY, Liang CM, Liang SM. MIG-7 and phosphorylated prohibitin coordinately regulate lung cancer invasion/metastasis[J]. Oncotarget, 2015, 6(1): 381-93. |
| [6] |
王帆, 陈祥荣, 王春华, 等. Mig-7与血管生成拟态在胶质瘤中的表达及其临床意义[J]. 肿瘤, 2015, 35(2): 214-20. |
| [7] |
Schnegg CI, Yang MH, Ghosh SK, et al. Induction of vasculogenic mimicry overrides VEGF-A silencing and enriches stem-like cancer cells in melanoma[J]. Cancer Res, 2015, 75(8): 1682-90. |
| [8] |
Fish JE, Gutierrez MC, Dang LT, et al. Dynamic regulation of VEGFinducible genes by an ERK/ERG/p300 transcriptional network[J]. Development, 2017, 144(13): 2428-44. |
| [9] |
Wu YZ, Meitzler JL, Antony S, et al. Dual oxidase2 and pancreatic adenocarcinoma: IFN-gamma-mediated dual oxidase2 overexpression results in H2O2-induced, ERKassociated up-regulation of HIF-1 alpha and VEGF-A[J]. Oncotarget, 2016, 7(42): 68412-33. |
| [10] |
Shao LG, Wang MC, Fan XL, et al. Correlation between Raf/MEK/ ERK signaling pathway and clinicopathological features and prognosis for patients with breast cancer having axillary lymph node metastasis[J]. Technol Cancer Res Treat, 2018, 17: 1533034617754024. |
| [11] |
Mccubrey JA, Steelman LS, Chappell WH, et al. Ras/Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascade inhibitors: how mutations can result in therapy resistance and how to overcome resistance[J]. Oncotarget, 2012, 3(10): 1068-111. |
| [12] |
Li L, Zhao GD, Shi Z, et al. The Ras/Raf/MEK/ERK signaling pathway and its role in the occurrence and development of HCC[J]. Oncol Lett, 2016, 12(5): 3045-50. DOI:10.3892/ol.2016.5110 |
| [13] |
Favre G. Future targeting of the RAS/RAF/MEK/ERK signaling pathway in oncology: the example of melanoma[J]. Bull Acad Natl Med, 2014, 198(2): 321-36. |
| [14] |
胡昌建, 陈祥荣, 胡伟鹏. 沉默Mig-7基因的表达可抑制人脑胶质瘤U87细胞的体外血管生成拟态形成能力及侵袭能力[J]. 肿瘤, 2016, 36(5): 530-7. DOI:10.3760/cma.j.issn.1004-4221.2016.05.024 |
| [15] |
Huang D, Zhang S, Zhong T, et al. Multi-targeting NGR-modified liposomes recognizing glioma tumor cells and vasculogenic mimicry for improving anti-glioma therapy[J]. Oncotarget, 2016, 7(28): 43616-28. |
| [16] |
屈波, 盛冠男, 余飞, 等. 逆转录病毒介导shRNA抑制Mig-7基因对人肝癌细胞血管生成拟态及体外侵袭转移的抑制作用[J]. 南方医科大学学报, 2016, 36(11): 1482-8. DOI:10.3969/j.issn.1673-4254.2016.11.06 |
| [17] |
Czekierdowski A, Czekierdowska S, Stachowicz N, et al. Mig- 7 expression and vasculogenic mimicry in malignant ovarian tumors[J]. Ginekol Pol, 2017, 88(10): 552-61. |
| [18] |
李明玉, 贾喜花, 等. 结肠癌组织血管生成抑制素结合蛋白, 迁移诱导蛋白-7, MMP-2表达及其与血管生成拟态的相关性[J]. 山东医药, 1994, 59(6): 51-2. |
| [19] |
廖世平, 高青. 血管生成拟态及相关蛋白Mig-7、MMP-2在胃癌组织中的表达及临床意义[J]. 细胞与分子免疫学杂志, 2013, 29(2): 194-6. |
| [20] |
Angara K, Borin TF, Rashid MH, et al. Corrigendum to"CXCR2- expressing tumor cells drive vascular mimicry in antiangiogenic therapy-resistant glioblastoma"neoplasia, October 2018, volume 20, issue 10, Pages 1070-82[J]. Neoplasia, 2019, 21(1): 156-7. DOI:10.1016/j.neo.2018.11.001 |
| [21] |
Yang WY, Tan ZF, Dong DW, et al. Association of aquaporin1 with tumor migration, invasion and vasculogenic mimicry in glioblastoma multiforme[J]. Mol Med Rep, 2018, 17(2): 3206-11. |
| [22] |
韩亮, 周海霞, 田男, 等. HOXA4基因抑制对胶质瘤细胞U251的影响[J]. 中国微侵袭神经外科杂志, 2016, 21(7): 321-4. |
| [23] |
Duan SJ. Silencing the autophagy-specific gene Beclin-1 contributes to attenuated hypoxia- induced vasculogenic mimicry formation in glioma[J]. Cancer Biomark, 2018, 21(3): 565-74. DOI:10.3233/CBM-170444 |
| [24] |
Wang F, Li XK, Xu HY, et al. N-cadherin participated in invasion and metastasis of human esophageal squamous cell carcinoma via taking part in the formation of vasculogenic mimicry[J]. Med Oncol, 2015, 32(2): 480. |
| [25] |
Cheng R, Cai XR, Ke K, et al. Notch4 inhibition suppresses invasion and vasculogenic mimicry formation of hepatocellular carcinoma cells[J]. J Huazhong Univ Sci Technolog Med Sci, 2017, 37(5): 719-25. |
| [26] |
Wang SS, Gao XL, Liu X, et al. CD133(+) cancer stem-like cells promote migration and invasion of salivary adenoid cystic carcinoma by inducing vasculogenic mimicry formation[J]. Oncotarget, 2016, 7(20): 29051-62. |
| [27] |
金戈, 石琼, 张道为, 等. FRK通过抑制ERK信号通路对脑胶质瘤细胞增殖作用的研究[J]. 临床神经外科杂志, 2016, 13(6): 428-31. DOI:10.3969/j.issn.1672-7770.2016.06.008 |
| [28] |
郭春梅. miR-429靶向作用于CRKL通过调控Raf/MEK/ERK-EMT通路抑制HepG2细胞迁移, 侵袭[D].大连医科大学, 2017.
|
| [29] |
Delgado-Bellido D, Serrano-Saenz SA, Javier Oliver F, et al. Vasculogenic mimicry signaling revisited: focus on non-vascular VE-cadherin[J]. Mol Cancer, 2017, 16(1): 65. |
 2019, Vol. 39
2019, Vol. 39

