2. 南方医科大学深圳医院检验中心,广东 深圳 518000
2. Clinical Laboratory, Shenzhen Hospital of Southern Medical University, Shenzhen 518000, China
肾细胞癌(RCC)是成人中最常见的肾癌类型,占肾恶性肿瘤的80%~90% [1]。由于RCC病征的非特异性和隐匿症状,RCC经常与肾结石的症状伴发产生[2]。肾结石的主要临床表现与RCC相似[3],均为腰腹部绞痛、血尿,部分患者无症状;而肾积水与RCC患者的CT影像均为肾影增大,肾小盏杯口变钝,肾大盏与肾盂扩大或因压迫发生位移等[4]。根据临床表现及影像学图像难以鉴别诊断伴结石肾积水是否伴发肾细胞癌,从而导致对RCC的漏诊[5]。因此,准确有效的术前RCC和肾结石区分算法用来提高RCC的诊断率非常重要。
近年来,无监督的机器学习常常被用于数据挖掘[6-7]。相对于无监督学习,基于有监督机器学习的影像组学方法更能达到预期效果,常用于病灶分类和肿瘤分级方法[8-9]。如肉瘤样肾细胞癌的诊断[11-12]、RCC的纹理特征与肿瘤学结果相关性评估[13-15]。
尽管影像组学在很多医学肿瘤相关问题分析中取得良好的进展[16],非增强CT成像(NNCCT)在临床肾脏疾病诊断中具有广泛使用[17-18]。然而在泌尿系统,以往影像组学研究多集中在膀胱癌[19-21]、肾脏肿瘤[22-23]等肿瘤良恶性的分类,而针对伴结石肾积水是否伴发肾细胞癌的鉴别目前还未检索到相关报道,但是此病却在我们接触的病例中并不少见。因此,本文提出了基于大量量化的影像组学特征,利用有监督的机器学习方法对伴结石肾积水是否伴发肾细胞癌进行预测,尝试在术前更加准确有效地区分RCC和肾结石。
1 资料和方法 1.1 患者数据82例肾结石肾积水患者来自2005年1月~2017年12月在广东省南方医院确诊患者,其中非RCC组40例和RCC组42例。
入选标准:接受肾切除术并经病理证实为肾癌的患者;在肾切除术前不到30 d进行非造影CT(NCCT)扫描的患者;临床特征显著可用,肾癌无伴发转移;肾积水程度为中度及以上,即肾盏及肾盂明显扩张。
排除标准(符合任意一项标准即排除):进行手术前曾接受过治疗(经皮肾镜取石术或开腹和腹腔镜手术切除肾结石);同时患有其他肿瘤,存在成像伪影使得病变分析变得困难。
有16例病人被排除在研究范围外,因此,本实验对余下66例患者进行分析(平均年龄55.3岁),分别为RCC患者31人和非RCC患者35人。研究对象包括年龄、男女比重在内的基本资料经统计学检验无显著性差异(表 1)。对于每一位患者,使用64层多排CT扫描仪(Philips Brilliance 64,Best)扫描从而获取完整肾脏区域CT图像。
| 表 1 研究对象信息 Tab.1 General demographic data of the research subjects |
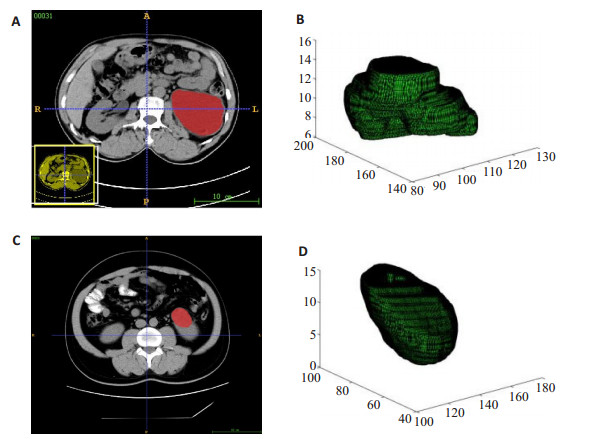
所有特征都是基于VOI提取的,每位病人的病灶轮廓线都是由具有5年放射学经验的放射科医生诊断。采用具有区域增长分段算法的ITK软件半手动逐层勾画[24-25],然后生成VOI [26]。在勾画病灶时,同时对照增强CT的图像,消除肾周脂肪和结石的影响,绘制出更为准确的病灶轮廓。绘制好后,由另外两位临床医生进行检查纠正,以确定整个病灶的正确区域(图 1)。
|
图 1 感兴趣区域分割例子 Fig.1 Two examples of region of interest (ROI) segmentation. A: ROI in RCC patients; B: VOI of RCC patients; C: ROI of RCC patients; D: VOI of patients without RCC |
基于人工分割得到的病灶VOI提取影像学特征时,不仅提取了344个纹理特征,同时提取了4个几何特征:体积(VOI中体素个数)、大小(VOI最长直径)、固态性(VOI中体素个数占包含肿瘤区域的三维凸包中体素个数的比值)、离心率(由拟合VOI的最佳椭圆计算得到);及14个统计特征(SUM_mean、SUM_median、SUM_std、SUM_var、SUM_sum、SUM_skewness、SUM_kurtosis、Major_al、Minor_al、Ecc、Ori、V_bound、peri、Elongation)。计算纹理特征之前,在不影响纹理特征的前提下把原图像的灰度级压缩到较小的范围,此过程应用量化算法和量化等级两个参数。
本实验用到了Equal-probability和Lloyd-Max两种量化算法,四个量化等级[8, 16, 31],从而得到8种组合。对应于这8种组合,实验共提取了8组纹理特征,每组包括43个纹理特征(表 2),分别为:一阶统计纹理特征(基于肿瘤区域的灰度直方图提取);高阶纹理特征[基于灰度共生矩阵(GLCM)、灰度游程矩阵(GLRLM)、灰度区域尺寸矩阵(GLSZM)和邻域灰度差分矩阵(NGTDM)提取]。
| 表 2 特征提取 Tab.2 Feature extraction from the abdominal CT data |
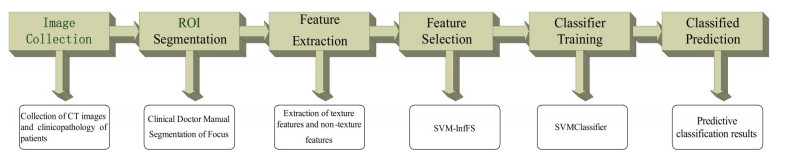
本预测模型的整体流程如图 2所示。基于三维感兴趣容积(VOI)提取特征后把所有数据随机分成训练集(45例)和测试集(21例),并使用SVM-InfFS模型进行特征选择,选出最优特征子集。最后基于最优特征子集,在训练集上训练SVM作为最后的分类器,并执行对测试集的预测。这里,我们选取径向基函数(RBF)作为SVM分类器的核函数,如公式(1)所示。
|
图 2 实验流程图 Fig.2 Experimental flow chart |
| $ \kappa \left( {{\chi _i}, {\chi _j}} \right) = {e^{ - \gamma {{\left\| {{x_i} - x} \right\|}^2}}}, \gamma > 0 $ | (1) |
用InfFS特征选择方法[27]结合SVM分类器来建立影像组学特征选择模型(SVM-InfFS),算法流程如下:
输入:训练样本集D及对应类别;输出:最佳特征子集FR。
(a)初始化FS = ∅,TFS = ∅,BestAUC = 0;
(b)利用SVM算法求出各个特征与类的相关性权值,特征按权值降序排列,排序后的特征集合用FI(FI={FI1, FI2, FI3…, FIN})表示;
(c)forA = 1toN,TFS = FS ⋃ FIi;
(d)如果AUC(TFS) > BestAUC,则BestAUC = AUC(TFS),FS = TFS;
(e)结束。
其中AUC(TFS)表示候选特征子集TFS在训练集上的十折交叉验证后的AUC平均值。最后选择出分类性能最好(AUC最大)时对应的特征子集。
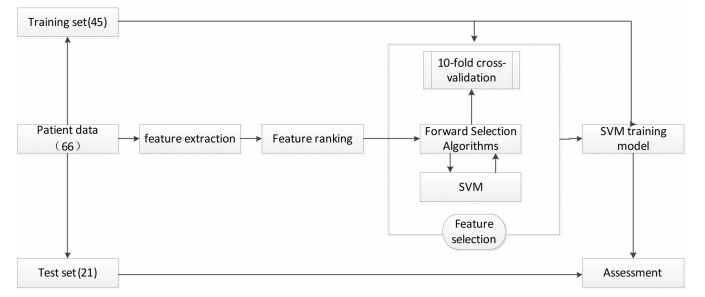
1.6 模型训练与评估模型训练与评估流程如图 3所示。我们首先把所有样本分成训练样本(45例)和测试样本(21例)。在训练集使用十折交叉验证方法,以AUC最大化为原则,执行SVM-InfFS特征选择方法选择最优特征子集和SVM分类器超参数,即径向基核参数γ和误分惩罚因子C。然后基于选出的最优特征子集及SVM超参数,用全部训练样本训练SVM分类器,然后执行对测试集的预测并对预测结果进行评估。
|
图 3 影像组学算法SVM-InfFS的流程图 Fig.3 Flow chart of the characteristic selection and model construction |
为了评估本文预测模型的表现,我们邀请四位有经验医生给出他们的诊断结果作为比较,其中三位仅凭借CT图像进行诊断,另一位同时参照临床其他信息进行诊断。使用曲线下面积(AUC)、敏感性、特异性,准确率,假阳性及假阴性五个定量指标评价我们的模型。假设TP,TN,FP,FN分别表示诊断的真阳性、真阴性、假阳性及假阴性病人数,则:
准确率= (TP + TN)/(TP + TN + FN + FP)
敏感性= TP/(TP + FN)
特异性= TN/(TN + FP)
假阳性= FP/(TN + FP)
假阴性= FN/(TP + FN)
2 结果 2.1 被选择的特征在使用SVM-InfFS的前向选择算法去除原始特征集中不相关和冗余的特征后,我们获得了12个最优特征,包括1个非纹理特征SUV-median;4个灰度共生矩阵特征GLCM-Homogeneity、GLCM-Variance、GLCMEntropy、GLCM-Correlation;1个灰度游程矩阵特征GLRLM-GLV;4个灰度区域尺寸矩阵特征GLSZMZSV、GLSZM-SZE、GLSZM-HGZE、GLSZM-SZLGM以及2个邻域灰度差分矩阵特征NGTDM-Contrast、NGTDM-Complexity。如表 3所示。
| 表 3 最佳特征子集 Tab.3 Best feature subset |
本文提出的算法对11位非RCC病人正确诊断10位,误诊了1位;对10位RCC病人正确诊断7位,漏诊了3位。与4位专业的临床医生的诊断情况如表 4。实验算法诊断出的真阴性及真阳性病人数量明显高于前3位仅凭借CT图像进行诊断的医生诊断结果,而与另1位参照影像组学模型分类结果进行诊断的医生诊断结果相近。
| 表 4 医生及影像组学方法分类详情 Tab.4 Classification details of the diagnoses made by 4 clinicians and by radiomics analysis |
本算法的正确率81.0%、敏感性70.0%、特异性90.9%、假阳性9.1%及假阴性30.0%。与4位医生的比较结果如表 5所示。算法的准确率、敏感性、特异性,假阳性及假阴性明显优于前3位医生诊断结果;而与另1位医生的诊断结果较为相近,但是仍有一定差距。
| 表 5 医生及影像组学方法分类结果 Tab.5 Classification results by the 4 clinicians and by radiomics analysis |
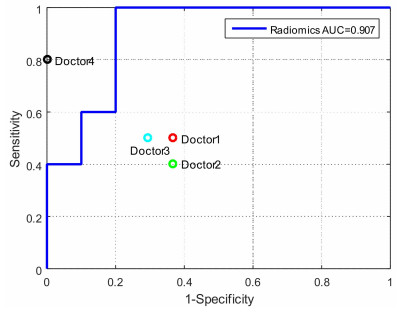
另外,SVM- InfFS模型的ROC曲线及AUC值(0.907)如图 4所示,在仅凭病人CT图像进行诊断情况下,3位医生的诊断结果都位于ROC曲线下,这说明我们的预测算法优于这3位医生的诊断结果。在结合影像组学模型分类结果下进行诊断的情况下,医生的诊断结果明显提高,优于本预测算法。
|
图 4 ROC曲线 Fig.4 ROC curve |
CT由于其具有无创、便捷等优点,是肾脏病变诊断过程中的重要影像学检查手段,但其受医疗水平、医疗环境、经济条件以及患者耐受性(如肾功能不全)等因素影响[5-6, 18]。为此,本实验尝试以无创、定量影像组学方法对肾积水伴肾结石患者是否伴发肾肿瘤进行分析,探讨影像组学标签应用于临床诊断的可行性。
在本文中,回顾性分析了经病理证实的66例伴结石肾积水患者的腹部CT扫描,其中35例患者并未伴发肾细胞癌,另31例患者伴发肾细胞癌。我们使用影像组学方法对每位患者的肿瘤区域提取了362个特征;并应用SVM-InfFS模型对初试特征集进行选择,获得含有12个特征的最优特征子集;然后利用最佳特征子集作为输入,使用SVM分类器对伴肾结石肾积水是否与肾细胞癌伴发进行分类预测。根据结果可知,由于肾积水与RCC影像学表现相近,仅凭借CT图像对病人进行诊断有较高的假阳性会导致对RCC的漏诊,以及较高的假阴性又会导致误诊,这无疑会对患者生命造成危害。而参考影像组学模型分类结果情况下,临床医生对患者诊断的准确率有了大幅度增加,其特异性及敏感性有明显提升,假阳性及假阴性明显降低,尤其是假阳性为0%,即针对本次实验的RCC患者不存在漏诊现象。因此,证明了本文所提出的基于影像组学方法建立的模型不仅是一种非入侵的检查手段,更是一种可以降低医疗成本,帮助医生对肾细胞癌患者进行术前诊断的辅助诊断工具。
本研究使用影像组学特征进行分析,一方面,其具有非创性、特异性和可重复性等特点,不受患者个体影响,且可连续观察肿瘤的变化和整体特征。另一方面,影像组学技术从临床CT影像中提取组织特征信息,并提供这些影像学特征与生物标志物之间的独特关系,这样可以为临床提供更有价值的信息,推动影像技术从诊断到指导个体化治疗方向发展。因此影像组学具有巨大的临床应用潜力,有较高的实用性,是精准医学的重要手段,亦是影像定量化的研究热点。
本文仍然存在局限性。首先,单中心,样本量少。本实验中,只回顾性的分析了66位病人的数据,存在研究样本量小等诸多不足,未来多中心合作,数据共享扩大样本量、规范影像组学研究方法将是主要的发展方向[28]。其次通过灰度量化参数的设置提取到了大量的纹理特征,这无疑会更加有利于分类结果,但是同样也使得特征选择时耗时较长,因此涉及运行速度快并且鲁棒性强的算法也将是未来主要进行探讨的工作之一。最后,针对不同疾病的分析软件及所使用的研究方法尚未标准化[29]。因图像采集与重建参数不同会直接影响研究结果[30],而不同机构之间使用的扫描仪不同,针对同一种疾病的检查采取的扫描方案也有差异,导致采集到的图像质量存在争议,因此如何建立和规范各种扫描仪扫描指南及共识,实现入组数据标准化,是目前需要解决的基础问题[31]。
| [1] |
赵子辰, 王文慧, 冯凤芝. 遗传性平滑肌瘤病及肾细胞癌综合征研究进展[J]. 实用妇产科杂志, 2018, 34(4): 23-6. |
| [2] |
王志超, 周建甫, 桂泽红, 等. 孤立肾肾结石并肾盂肾盏移行细胞癌漏诊分析并文献复习[J]. 临床误诊误治, 2017, 30(9): 27-9. DOI:10.3969/j.issn.1002-3429.2017.09.011 |
| [3] |
蔡炳, 高小建, 陈潭辉. 320排CT双期增强在肾细胞癌常见亚型的鉴别诊断价值[J]. 中国临床医学影像杂志, 2018, 29(10): 708-12. |
| [4] |
胡巍, 李思敏, 祝凤明, 等. 经皮肾穿刺造瘘联合输尿管镜钬激光碎石微创治疗输尿管结石伴肾积水[J]. 复旦学报:医学版, 2018, 45(6): 846-51. |
| [5] |
董凤林, 查月琴, 林和平, 等. 超声对肾细胞癌的临床诊断价值[J]. 苏州大学学报:医学版, 2007, 48(4): 640-1. |
| [6] |
Tanino M, Takizawa H, Yamamoto S, et al. A detection method of ground glass opacities in chest x-ray CT images using automatic clustering techniques[J]. SPIE, 2003, 5032: 1672-80. |
| [7] |
Polat K, Guenes S. Principles component analysis, fuzzy weighting pre-processing and artificial immune recognition system based diagnostic system for diagnosis of lung cancer[J]. Expert Syst Appl, 2008, 34(1): 214-21. DOI:10.1016/j.eswa.2006.09.001 |
| [8] |
Parmar C, Grossmann P, Bussink J, et al. Machine learning methods for quantitative radiomic biomarkers[J]. Sci Rep, 2015, 5: 13087. DOI:10.1038/srep13087 |
| [9] |
Zhang X, Yan LF, Hu YC, et al. Optimizing a machine learning based glioma grading system using multi-parametric MRI histogram and texture features[J]. Oncotarget, 2017, 8(29): 47816-30. |
| [10] |
Kumar V, Gu Y, Basu S, et al. Radiomics: the process and the challenges[J]. Magn Reson Imaging, 2012, 30(9): 1234-48. DOI:10.1016/j.mri.2012.06.010 |
| [11] |
Schieda N, Thornhill RE, Al-Subhi M, et al. Diagnosis of sarcomatoid renal cell carcinoma with CT: evaluation by qualitative imaging features and texture analysis[J]. AJR Am J Roentgenol, 2015, 204(5): 1013-23. DOI:10.2214/AJR.14.13279 |
| [12] |
简远熙, 朱黎, 韩磊, 等. 肉瘤样肝细胞癌的影像学表现[J]. 中国医学影像学杂志, 2018, 26(11): 853-6. DOI:10.3969/j.issn.1005-5185.2018.11.014 |
| [13] |
Lubner MG, Stabo N, Abel EJ, et al. CT textural analysis of large primary renal cell carcinomas: pretreatment tumor heterogeneity correlates with histologic findings and clinical outcomes[J]. AJR Am J Roentgenol, 2016, 207(1): 96-105. DOI:10.2214/AJR.15.15451 |
| [14] |
王绎忱, 张瑾, 张连宇, 等. 全病灶MRI纹理分析鉴别不同病理类型肾细胞癌[J]. 放射学实践, 2018, 33(8): 785-8. |
| [15] |
Zc F, Rong PF, Cao P, et al.基于机器学习法定量纹理分析肾脏小肿块的CT影像:乏脂肪血管平滑肌脂肪瘤与肾细胞癌的鉴别[J].国际医学放射学杂志, 2018, 41(3): 124.
|
| [16] |
闫梦梦, 王卫东, 郎锦义. 影像组学技术及其在肿瘤精准放疗中的应用[J]. 肿瘤预防与治疗, 2018, 31(5): 364-8. DOI:10.3969/j.issn.1674-0904.2018.05.011 |
| [17] |
韩冬冬, 葛华, 尚攀峰, 等. 非增强CT尿路成像与泌尿系X线联合静脉尿路造影检查诊断上尿路结石的比较研究[J]. 实用医学影像杂志, 2015, 16(5): 383-5. |
| [18] |
宋殿宾, 徐辉, 张晶晶, 等. 多层螺旋CT血管成像联合术中超声在小肾癌保留肾单位手术中的应用价值[J]. 中国医药导报, 2018, 15(27): 58-61. |
| [19] |
Zhang GM, Sun H, Shi B, et al. Quantitative CT texture analysis for evaluating histologic grade of urothelial carcinoma[J]. Abdominal radiology (New York), 2017, 42(2): 561-8. DOI:10.1007/s00261-016-0897-2 |
| [20] |
Mammen S, Krishna S, Quon M, et al. Diagnostic accuracy of qualitative and quantitative computed tomography analysis for diagnosis of pathological grade and stage in upper tract urothelial cell carcinoma[J]. J Comput Assist Tomogr, 2018, 42(2): 204-10. |
| [21] |
Xu XP, Zhang X, Liu Y, et al. Differentiating bladder carcinoma from bladder wall using 3D textural features: an initial study[C] //Spie Medical Imaging. 2016: COMPUTER-AIDED DIAGNOSIS, 9785, 2015: 9785.
|
| [22] |
Leng S, Takahashi N, Gomez Cardona D, et al. Subjective and objective heterogeneity scores for differentiating small renal masses using contrast-enhanced CT[J]. Abdom Radiol (New York), 2017, 42(5): 1485-92. DOI:10.1007/s00261-016-1014-2 |
| [23] |
Takahashi N, Takeuchi M, Sasaguri K, et al. CT negative attenuation pixel distribution and texture analysis for detection of fat in small angiomyolipoma on unenhanced CT[J]. Abdom Radiol (New York), 2016, 41(6): 1142-51. DOI:10.1007/s00261-016-0714-y |
| [24] |
聂秀玲, 刘任远, 陆加明, 等. 基于ITK多图谱配准的脑部皮质下核团的分割研究[J]. 中国生物医学工程学报, 2017, 36(5): 529-35. DOI:10.3969/j.issn.0258-8021.2017.05.003 |
| [25] |
宋静, 何启泠, 徐庆, 等. 基于ITK医学图像分割的应用[J]. 成都信息工程学院学报, 2015, 30(5): 458-64. DOI:10.3969/j.issn.1671-1742.2015.05.009 |
| [26] |
黄克敏, 冯彦林, 梁伟棠, 等. 部分容积效应对SPECT/CT定量计算结果的影响[J]. 中国医学影像学杂志, 2017, 25(11): 867-71. DOI:10.3969/j.issn.1005-5185.2017.11.019 |
| [27] |
Obertino S, Roffo G, Granziera C, et al. Infinite feature selection on shore-based biomarkers revealsconne ctivity modulation after stroke[C]. PRNI, 2016.
|
| [28] |
Elicker BM, Cypel YS, Weinreb JC. IV contrast administration for CT: a survey of practices for the screening and prevention of contrast nephropathy[J]. AJR Am J Roentgenol, 2006, 186(6): 1651-8. DOI:10.2214/AJR.05.0407 |
| [29] |
Tarin TV, Sonn G, Shinghal R. Estimating the risk of cancer associated with imaging related radiation during surveillance for stage I testicular cancer using computerized tomography[J]. J Urol, 2009, 181(2): 627-32. DOI:10.1016/j.juro.2008.10.005 |
| [30] |
苏会芳, 周国锋, 谢传淼, 等. 放射组学的兴起和研究进展[J]. 中华医学杂志, 2015, 95(7): 553-6. DOI:10.3760/cma.j.issn.0376-2491.2015.07.021 |
| [31] |
吴佩琪, 刘再毅, 何兰, 等. 影像组学与大数据结合的研究现状[J]. 中华放射学杂志, 2017, 51(7): 554-8. DOI:10.3760/cma.j.issn.1005-1201.2017.07.023 |
 2019, Vol. 39
2019, Vol. 39

