2. 燕山大学河北省应用化学重点实验室,河北 秦皇岛 066004;
3. 秦皇岛市功能核酸工程技术研究中心,河北 秦皇岛 066000;
4. 河北省秦皇岛市第一医院肿瘤科,河北 秦皇岛 066000;
5. 秦皇岛拜恩发生物技术有限公司,河北 秦皇岛 066000
2. Key Laboratory of Applied Chemistry of Hebei Province, Yanshan University, Qinhuangdao 066004, China;
3. Research Center of Functional Nucleic Acids Engineering in Qinhuangdao, Qinhuangdao 066004, China;
4. Department of Oncology, First Hospital of Qinhuangdao City, Qinhuangdao 066000, China;
5. Qinhuangdao Biopha Biotechnology co. LTD., Qinhuangdao 066000, China
结直肠癌(CRC)是世界上最常见的消化道恶性肿瘤之一,在西方发达国家,其发病率位居恶性肿瘤第二位[1]。近些年来随生活饮食习惯的改变,结直肠癌的发病率和死亡率在我国逐年升高,尤其在上海、北京和广州等大中城市,结直肠癌已成为消化道第一位的恶性肿瘤[2]。现有研究发现哺乳动物雷帕霉素蛋白(mTOR)信号通路的过度活化与结直肠肿瘤的发生、发展密切相关[3-5],是肿瘤治疗的一个重要靶点[6-7]。
作为mTORC2中一员,Rictor蛋白与裂殖酵母的STE20p和酿酒酵母的AVO3p等蛋白分子存在同源性[8-10]。在裂殖酵母中,STE20p可通过调节细胞周期来调控生物的生长及发育[11]。大量研究结果均表明,与mTORC1相比,Rictor在肿瘤的发生发展过程中起到更加重要的作用[12-13]。由于Rictor是新近发现的一个参与调节mTOR信号通路的蛋白,对Rictor蛋白结构及各结构域的作用尚不完全了解,其上、下游调节机制尚不明确。
microRNA (miRNA)属于非编码RNA家族,是一系列短的、由20~22个核苷酸组成的非编码的核酸,可以通过影响靶mRNA稳定性或者翻译过程而对靶基因转录后表达进行调节[14-15]。在多种人类肿瘤中,包括CRC,均发生了由于miRNAs的改变而对细胞增殖、分化和凋亡进行的调控[16-17],这表明microRNAs是一类新型的癌基因或肿瘤抑制基因。miRNA敲除模型出现表观异常的研究进一步表明该类小分子在基因表达调控中具有重要作用,生物信息学预测约1/3的mRNA受miRN A的调控,关于miRNA靶向调控mRNA的研究工作,近年来也逐渐成为基因调控研究的一个热点领域。
关于miRNAs对Rictor上游表达调控机制的研究,近些年来仅有零星报道且仅局限于某一种microRNA的作用效果,而Rictor mRNA具有较长的3'UTR序列,实际上为多种miRNA的结合提供可能,而且,关于Rictor转录后调控机制的研究,目前也尚未涉及结直肠癌领域[18-22]。本研究在结直肠癌细胞株中筛选出显著调控Rictor表达的两种miRNAs,即miR-152和miR-448,并进一步研究二者对Rictor表达的调控作用,进而检测二者协同对结直肠癌细胞生长和增殖的影响。
1 材料和方法 1.1 材料人胚肾细胞株HEK293T细胞和结直肠癌细胞株KM12SM细胞株、HCT116β/W为本研究室保存;psiCHECK2双荧光素酶报告质粒(Promega);DMEM培养液、胎牛血清(Invitrogen);miRNA mimics(上海吉玛制药);MutanBest定点突变试剂盒(Takara);LipoTM 2000(Promega),MTT(Sigma);双荧光素酶分析检测试剂盒(Promega);标准相对分子质量蛋白(Fermega);鼠抗Rictor单克隆抗体(Cell signaling);鼠抗GAPDH单克隆抗体(Santa cruz);辣根过氧化物酶标的羊抗鼠IgG、ECL发光试剂盒(Pierce);其他常规试剂(上海生工)。
1.2 细胞培养及转染HEK293T细胞株、KM12SM细胞株和HCT116β/ W细胞株均培养于含有10%胎牛血清的DMEM培养液中(含100 U/mL青霉素和100 U/mL链霉素),于37 ℃含5% CO2的恒温培养箱中培养,待细胞融合度大约为70%时,换为不含胎牛血清和抗生素的培养液后,将质粒DNA或miRNA mimic用LipoTM 2000进行转染,培养箱培养6 h后,添加胎牛血清、青霉素和链霉素继续培养细胞24 h或48 h。
1.3 RNA提取及实时定量PCR1×106/mL细胞接种于6孔板,常规过夜培养。采用RNeasy Mini试剂盒提取总RNA。Mini Drop定量后,取1 µg总RNA用无RNA酶的超纯水补至10 µL,加入预先配好的10 µL逆转录酶混合液中,上机25 ℃10 min、37 ℃ 120 min和85 ℃ 10 s,将总RNA逆转录生成cDNA。按Taqman基因表达检测方法检测Rictor的mRNA水平,其引物序列为:
正向链: 5'-CACTTACGGAGCCCAGTG TT-3';
反向链: 5'-CTGATTCCCCCGACATGCT T-3'
1.4 Western blot利用LipoTM 2000转染miRNA mimic或miRNA对照50 nmol/L至结直肠癌细胞株KM12SM细胞株,转染48 h后加入裂解液,细胞刮收集细胞,冰上裂解30 min,离心收集上清。样品经SDS-PAGE后,转膜于PVDF膜上,置于5%脱脂奶粉中封闭30 min,分别加入一抗(1:1500稀释),37 ℃孵育1 h,TBS洗膜,5 min×5次,加入辣根过氧化物酶标二抗(1:5000稀释),37 ℃孵育30 min,TBS洗膜,5 min×4次,PBS洗膜1次,ECL显色,拍照,灰度扫描软件进行分析。
1.5 psiCHECK2-Rictor 3'UTR双荧光素酶报告载体的构建从HEK293T细胞基因组DNA中扩增Rictor mRNA的3'UTR,将其克隆到pMD18-T载体上,进行序列测定。双酶切后分离正确的Rictor mRNA 3'UTR片段,插入用同样酶切后的psiCHECK2.0质粒载体,获得双报告基因载体psiCHECK2-Riptor 3'UTR,其中萤火虫荧光素酶基因(Firefly Luciferase)作为主报告基因,而海肾荧光素酶基因(Renilla Luciferase)作为内参报告基因。进一步将psiCHECK2-Rictor 3'UTR利用定点突变试剂盒将miR152或miR448预测结合位点进行删除,分别形成新的质粒psiCHECK2-Rictor3'UTR-Mut1和psiCHECK2-Rictor3'UTR-Mut2。
1.6 荧光素酶分析用LipoTM 2000分别转染psiCHECK2、psiCHECK2- Riptor 3'UTR、psiCHECK2-Rictor3'UTR-Mut1或psiCHECK2-Rictor3'UTR-Mut2报告质粒500 ng、miRNA mimic或miRNA对照20 nmol/L至KM12SM细胞株,转染24 h后,按Promega公司双荧光素酶检测试剂盒说明书操作,检测48孔板各孔细胞的荧光强度。各孔测定值=萤火虫荧光素酶活性值/海肾荧光素酶活性值。每组均设3个重复孔,每个转染实验重复3次。
1.7 生长曲线的绘制调整细胞密度,按1×104/mL的KM12SM细胞接种于12孔板,细胞融合度为40%~50 %时分别转染miRNA阴性对照(miR-NC)、miRNA mimic、miRNA抑制物对照(Inh NC)和miRNA抑制物(miR Inh)各50 nmol/L,分别继续培养细胞至24、48、72和96 h。0.25%胰酶消化细胞,台盼蓝染液染色,显微镜下计数各组活细胞数目。每组实验设3个重复孔,实验重复3次。
1.8 克隆形成实验调整细胞密度,按1×104/mL的KM12SM细胞接种于6孔板,按上述方法分别转染miRNA阴性对照(miRNC)、miRNA mimic、miRNA抑制物对照(Inh NC)和miRNA抑制物(miR Inh),24 h后,0.25%胰酶消化细胞,调整细胞密度,按400 cell/孔的密度接种于6孔板,于培养箱中继续培养,第5天按0.25 mg/mL培养液加入胎牛血清,于第15天终止培养。弃去细胞培养液,PBS洗2次,结晶紫室温下染色15~20 min,H2O洗2次,计数克隆形成数。
1.9 统计学分析应用GraphPad Prism version5.0(GraphPadsoftware, Inc., La Jolla, CA, USA)统计软件进行统计学处理,数据均用均数±标准差来表示,实验组与对照组比较采用t检验,以P < 0.05为差异有统计学意义。
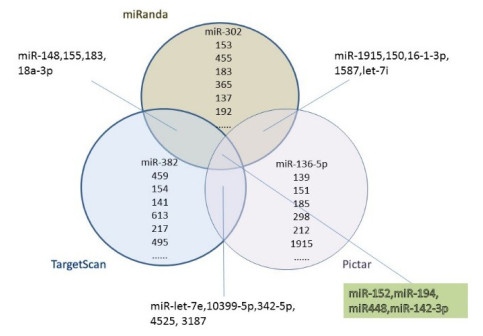
2 结果 2.1 预测调控Rictor表达的miRNAs为确定可能靶向调控Rictor表达的miRNAs,首先采用靶基因预测软件TargetScan、miRanda和PicTar分别进行miRNAs的预测,进一步为了减少后期筛选工作量,对三种预测软件预测结果进行整合,获得4种miRNAs作为备选miRNAs进行进一步筛选,分别为miR-152、miR-194、miR-448和miR-142-3p,软件筛选过程及4种miRNAs与Rictor mRNA结合序列及自由能分别见图 1和表 1。
|
图 1 TargetScan, miRanda和Pictar共同预测靶向于Victor基因的miRNAs维恩图 Fig.1 Venn diagram of TargetScan, Mianda and Pitar integrated predict the microRNAs targeting the Victor gene. |
| 表 1 预测的miRNAs与Rictor mRNA 3'UTR预测结合位点及结合自由能 Tab.1 Predicted consequential paring between Rictor 3'UTR and the predicted miRNAs and the binding free energy |
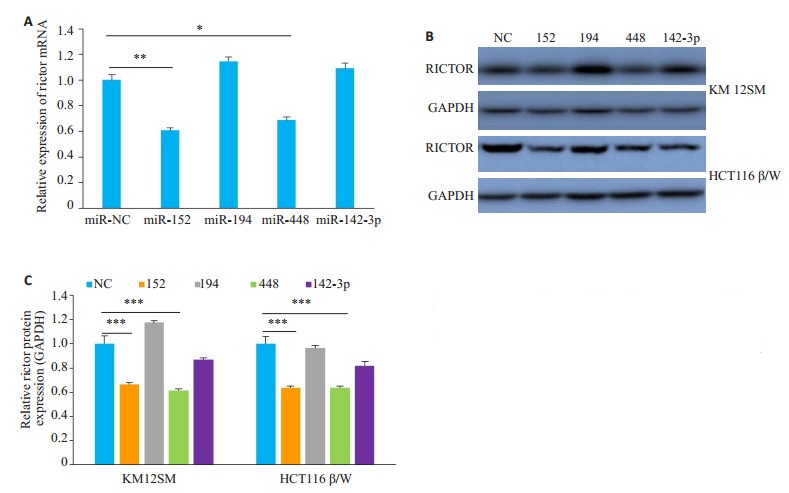
将miRNA NC、miR-152、miR-194、miR-448和miR-142-3p分别转染KM12SM细胞株,检测4种miRNA mimic是否会影响该细胞株中内源性Rictor mRNA的表达。实时定量PCR结果提示,与阴性对照组相比,miR-152和miR-448均可以使Rictor mRNA水平显著下调,而miR-194和miR-142-3p与阴性对照组相比差异不显著(P < 0.05),提示该2种miRNAs对Rictor mRNA表达无显著影响(图 2A)。
|
图 2 KM12SM细胞株和HCT116 β/W细胞株中预测的miRNAs对Rictor mRNA及蛋白表达的影响 Fig.2 Effects of the predicted microRNAs on Rictor mRNA (A) and protein (B) expressions in KM12SM and HCT116 β/W cell lines; C: Quantitative analysis of Rictor protein expressions. *P < 0.05, **P < 0.01, ***P < 0.001. |
将miRNA NC、miR-152、miR-194、miR-448和miR-142-3p分别转染KM12SM细胞株和HCT116β/W细胞株,检测4种miRNAmimic是否会影响该细胞株中内源性Rictor蛋白的表达。Western blot结果表明,miR-152和miR-448均可以显著下调Rictor蛋白表达,而miR-194和miR-142-3p与阴性对照组相比差异不显著(P < 0.05),提示该2种miRNAs对Rictor蛋白表达无显著影响(图 2B、C)。
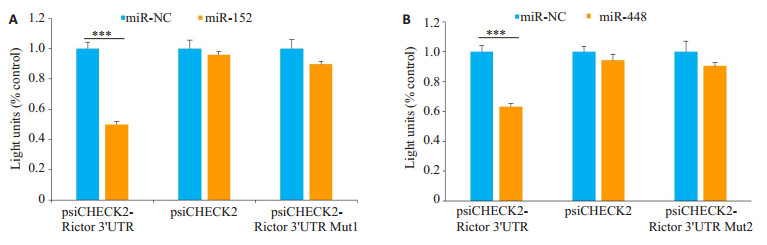
2.4 miRNAs对Rictor 3'UTR双荧光报告载体活性的影响为了进一步确定miR-152和miR-448是直接通过结合于Rictor mRNA 3'UTR上,进而对其表达进行调控,我们将Rictor 3'UTR插入psiCHECK2载体的萤火虫荧光素酶基因下游,获得报告载体psiCHECK2- Rictor 3'UTR。分别将miR-152和miR-448预测结合位点进行删除后,获得突变报告载体psiCHECK2-Rictor 3'UTR Mut1和psiCHECK2-Rictor 3'UTR Mut2。分别将这几种报告载体与miR-NC、miR-152和miR-448共转染HEK293细胞株中,24 h后测定荧光素酶活性变化。与miRNA NC相比,miR-152和miR-448能使psiCHECK2-Rictor 3'UTR的萤火虫荧光素酶表达水平分别下降至44%和62%,而对psiCHECK2的萤火虫荧光素酶表达水平无显著影响(P < 0.05)。该结果进一步肯定了miR-152和miR-448是通过与Rictor mRNA 3'UTR相结合,进而对该基因进行转录后调控。将miR- 152和miR-448预测结合位点进行删除后,psiCHECK2-Rictor 3'UTR的萤火虫荧光素酶表达得到恢复(图 3A、B)。
|
图 3 miR-152和miR-448直接靶向于Rictor mRNA Fig.3 Rictor mRNA is a direct target of miR152 (A) and miR448 (B). ***P < 0.001. |
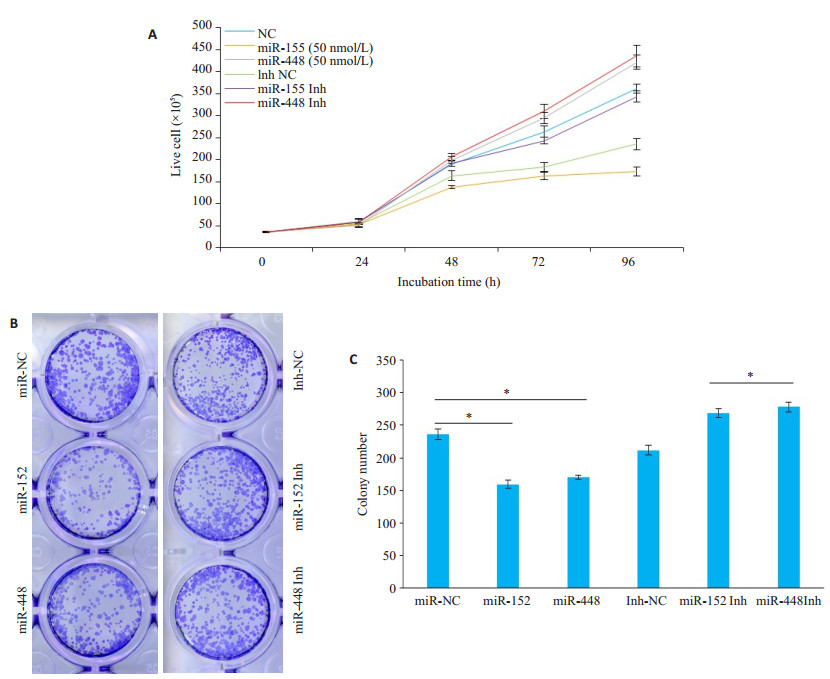
将miRNAs及miRNAs抑制物(miRNAs Inh)分别转染至KM12SM细胞株,于24、48、72和96 h收集并计数细胞。图 4(A)显示,与mimic对照转染组(NC)相比,miR-152和miR-448均可显著抑制该结直肠癌细胞的生长和增殖;与抑制物对照组(Inh NC)相比,miR-152 Inh和miR-448 Inh均可显著促进该结直肠癌细胞的生长和增殖。
|
图 4 miR-152或miR-448对KM12SM细胞的生长和克隆形成的调控作用 Fig.4 Inhibitory effect of miR-152 and miR-448 on the growth (A) and colony formation (B) in KM12SM cells; C: Quantitative analysis of colony formation in KM12SM cells. *P < 0.05. |
将转染完成后的KM12SM细胞株调整密度,以400个/孔的密度接种于6孔板进行克隆形成实验。与阴性对照(NC)组相比,miR-152和miR-448转染组所形成的细胞克隆数目显著减少(P < 0.05),提示这两种miRNA均可显著抑制KM12SM细胞形成克隆的能力;而与抑制物阴性对照处理组(Inh NC)相比,miR-152 Inh和miR-448均可显著促进KM12SM细胞克隆的形成(图 4B、C)。
3 讨论miRNA是一类21~23nt的非编码小分子RNA,它们通过与靶基因mRNA的3'UTR完全或者不完全互不配对,降解靶基因mRNA或抑制其mRNA的翻译,在转录后水平对靶基因的表达进行负调控调节[14]。近期研究发现,miRNA与多种疾病包括癌症的发生发展机制有关。多种miRNA在多种肿瘤细胞中特异表达,使得它们成为重要的肿瘤生物标志物[23-24];同时,miRNA可以通过靶向多个基因,从而调节细胞中的多条信号通路来影响肿瘤的发生、发展、增殖、分化和凋亡等。因此它们可能比基因自身更有潜力成为肿瘤治疗靶标。
Rictor是mTORC2的一个组分,可以直接调节Akt Ser-473的磷酸化[25]。近年来已有研究显示Rictor与肿瘤的增殖、侵袭、转移、EMT和预后密切相关[26-28]。例如敲除实验显示Rictor可以抑制结直肠癌肿瘤细胞在体外的增殖和体内肿瘤的形成[29];Rictor蛋白的高表达在恶性胶质瘤中与其高复发率密切相关[30];Rictor可作为miR-152的靶基因在子宫内膜癌中调控癌细胞的增殖等[30]。本研究通过生物信息学方法利用靶基因预测软件对靶向于Rictor mRNA的miRNAs进行预测,初步筛选出miR-152、miR-194、miR-448和miR-142-3p进行进一步的确证实验。Western blotting实验和qRT-PCR实验结果显示,miR-152和miR-448在KM12SM和HCT116 β/W结直肠癌细胞株中均对Rictor mRNA和蛋白的表达均有显著抑制作用。在此基础上,为了进一步探讨所筛选出来的miR-152和miR-448对Rictor的调控作用是直接通过直接结合并作用于其3'-UTR之上,我们进一步构建了psiCHECK2-Rictor 3'UTR-双荧光素酶报告载体及其所预测结合靶点突变载体psiCHECK2-Rictor 3'UTR-Mut1和psiCHECK2- Rictor 3'UTR-Mut2并进行双荧光素酶检测,结果发现与miRNA NC相比,miR-152和miR-448均能使psiCHECK2-Rictor 3'UTR的萤火虫荧光素酶表达水平均显著降低;而如果将所预测的miR-152和miR-448在Rictor mRNA 3'UTR结合位点进行删除后,该抑制作用均会消失,说明miR-152和miR-448对Rictor表达的抑制作用均是通过与Rictor mRNA 3'UTR相应结合位点相互结合而实现的。
前期报道显示,Rictor在多种肿瘤中存在过表达并且通过mTOR依赖性和mTOR非依赖性途径参与到结直肠癌发生的过程[8]。因此,我们进一步探讨了miR-152和miR-448对结直肠癌细胞株KM12SM生长和克隆形成的作用。结果也显示,miR-152和miR-448转染后可显著对该细胞株的生长和克隆形成具抑制作用,而miR-152和miR-448的抑制则会显著促进结直肠癌细胞株KM12SM细胞的生长和克隆的形成。综合上述实验结果,我们推测miR-152和miR-448有可能通过转录后调节对Rictor发挥抑制作用,降低Rictor蛋白的表达,进而对其生长和克隆形成发挥抑制作用。
总之,我们研究发现了miR-152和miR-448可以通过直接结合于Rictor的3'UTR区域,进而抑制Rictor蛋白的表达,并进一步抑制人结肠直肠癌的生长和克隆的形成。我们进一步研究将集中于miR152和miR448对Rictor及在结直肠癌发生过程中的调控网络,该研究将为全面而具体的揭示结直肠癌发生、发展机理奠定基础,同时为结直肠癌的诊疗提供新的思路。
| [1] |
张海勇, 姚根有. 结直肠癌伴神经内分泌分化的研究进展[J]. 国际病理科学与临床杂志, 2009, 29(6): 537-40. |
| [2] |
万晓娟, 宋锐锋, 陈玉龙, 等. KLF6和WWOX蛋白在结直肠癌组织中的表达及意义[J]. 世界华人消化杂志, 2011, 19(6): 602-7. |
| [3] |
Chiarini F, Evangelisti C, Mccubrey JA, et al. Current treatment strategies for inhibiting mTOR in cancer[J]. Trends Pharmacol Sci, 2015, 36(2): 124-35. DOI:10.1016/j.tips.2014.11.004 |
| [4] |
Cargnello M, Tcherkezian J. Roux. Expanding role of mTOR in cancer cell growth and proliferation[J]. Mutagenesis, 2015, 30(2): 169-76. DOI:10.1093/mutage/geu045 |
| [5] |
Gentilella A, Kozma SC, Thomas G. A liaison between mTOR signaling, ribosome biogenesis and cancer[J]. Biochim Biophys Acta, 2015, 1849(7, SI): 812-20. DOI:10.1016/j.bbagrm.2015.02.005 |
| [6] |
王利峰, 陈海金, 俞金龙, 等. Rictor和mTOR在结直肠癌中的表达及意义[J]. 南方医科大学学报, 2016, 36(3): 396-400. DOI:10.3969/j.issn.1673-4254.2016.03.19 |
| [7] |
李欣焱, 吴淑华, 孙晨博, 等. Raptor、Rictor与结直肠癌血管生成的相关性及其临床意义[J]. 临床与实验病理学杂志, 2017, 33(2): 129-34. |
| [8] |
Loewith R, Jacinto E, Wullschleger S, et al. Two TOR complexes, only one of which is rapamycin sensitive, have distinct roles in cell growth control[J]. Mol Cell, 2002, 10(3): 457-68. DOI:10.1016/S1097-2765(02)00636-6 |
| [9] |
Wedaman KP, Reinke A, Anderson S, et al. Tor kinases are in distinct membrane-associated protein complexes in saccharomyces cerevisiae[J]. Mol Biol Cell, 2003, 14(3): 1204-20. DOI:10.1091/mbc.e02-09-0609 |
| [10] |
Chen MY, Long Y, Devreotes PN. A novel cytosolic regulator, pianissimo, is required for chemoattractant receptor and G proteinmediated activation of the 12 transmembrane domain adenylyl cyclase in Dictyostelium[J]. Genes Dev, 1997, 11(23): 3218-31. DOI:10.1101/gad.11.23.3218 |
| [11] |
Hilti N, Baumann D, Schweingruber AM, et al. Gene ste20 controls amiloride sensitivity and fertility in schizosaccharomyces pombe[J]. Curr Genet, 1999, 35(6): 585-92. DOI:10.1007/s002940050456 |
| [12] |
Liu KD, Park C, Li SQ, et al. Aloe-emodin suppresses prostate cancer by targeting the mTOR complex 2[J]. Carcinogenesis, 2012, 33(7): 1406-11. DOI:10.1093/carcin/bgs156 |
| [13] |
Gulhati P, Bowen KA, Liu J, et al. mTORC1 and mTORC2 regulate EMT, motility, and metastasis of colorectal cancer via RhoA and Rac1 signaling pathways[J]. Cancer Res, 2011, 71(9): 3246-56. DOI:10.1158/0008-5472.CAN-10-4058 |
| [14] |
Calin GA, Croce CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6(11): 857-66. DOI:10.1038/nrc1997 |
| [15] |
Belge G, Dieckmann KP, Spiekermann M, et al. Serum levels of microRNAs miR371-3: a novel class of serum biomarkers for testicular germ cell tumors[J]. Eur Urol, 2012, 61(5): 1068-9. DOI:10.1016/j.eururo.2012.02.037 |
| [16] |
Hresko RC, Mueckler M. mTOR center dot RICTOR is the Ser (473) kinase for Akt/protein kinase B in 3T3-L1 adipocytes[J]. J Biol Chem, 2005, 280(49): 40406-16. DOI:10.1074/jbc.M508361200 |
| [17] |
Roulin D, Cerantola Y, Dormond-Meuwly AA, et al. Targeting mTORC2 inhibits colon cancer cell proliferation in vitro and tumor formation in vivo[J]. Mol Cancer, 2010, 9(12): 57-64. |
| [18] |
Cui Y, Zhao JZ, Yi L, et al. microRNA-153 targets mTORC2 component rictor to inhibit glioma cells[J]. PLoS One, 2016, 11(6): e0156915. DOI:10.1371/journal.pone.0156915 |
| [19] |
Fan H, Jiang M, Li B, et al. MicroRNA-let-7a regulates cell autophagy by targeting rictor in gastric cancer cell lines MGC-803 and SGC-7901[J]. Oncol Rep, 2018, 39(3): 1207-14. |
| [20] |
Zhou L, Liu S, Han M, et al. Micro-185 induces potent autophagy via AKT signaling in hepatocellular carcinoma[J]. Tumour Bio, 2017, 39(2): 4313. |
| [21] |
Guan B, Wu KJ, Zeng J, et al. Tumor- suppressive microRNA-218 inhibits tumor angiogenesis via targeting the mTOR component RICTOR in prostate Cancer[J]. Oncotarget, 2017, 8(5): 8162-72. |
| [22] |
Li J, Li XC, Wang JP, et al. MicroRNA-218 increases cellular sensitivity to Rapamycin via targeting Rictor in cervical Cancer[J]. APMIS, 2015, 123(7): 562-70. DOI:10.1111/apm.12387 |
| [23] |
Richie JP. Re: MicroRNA-371a-3p as informative biomarker for the follow-up of testicular germ cell Cancer patients editorial comment[J]. J Urol, 2019, 201(2): 229. |
| [24] |
Lo Russo G, Tessari A, Capece M, et al. MicroRNAs for the diagnosis and management of malignant pleural mesothelioma: a literature review[J]. Front Oncol, 2018, 8(8): 650. |
| [25] |
Hresko RC, Mueckler M. mTOR. RICTOR is the Ser473 kinase for Akt/protein kinase B in 3T3-L1 adipocytes[J]. J Biol Chem, 2015, 280(49): 40406-16. |
| [26] |
Verreault M, Weppler SA, Stegeman A, et al. Combined RNAimediated suppression of rictor and EGFR resulted in complete tumor regression in an orthotopic glioblastoma tumor model[J]. PLoS One, 2013, 8(3): e59597. DOI:10.1371/journal.pone.0059597 |
| [27] |
Agarwal NK, Chen CH, Cho H, et al. Rictor regulates cell migration by suppressing RhoGD12[J]. Oncogene, 2013, 32(20): 2521-6. DOI:10.1038/onc.2012.287 |
| [28] |
Serrano I, Mcdonald PC, Lock FE, et al. Role of the integrin-linked kinase (ILK)/Rictor complex in TGFbeta-1-induced epithelialmesenchymal transition (EMT)[J]. Oncogene, 2013, 32(1): 50-60. DOI:10.1038/onc.2012.30 |
| [29] |
Bashir T, Cloninger C, Artinian N, et al. Conditional astroglial rictor overexpression induces malignant glioma in mice[J]. PLoS One, 2012, 7(10): e47741. DOI:10.1371/journal.pone.0047741 |
| [30] |
Tsuruta T, Kozaki K, Uesugi A, et al. miR-152 is a tumor suppressor microRNA that is silenced by DNA hypermethylation in endometrial cancer[J]. Cancer Res, 2011, 71(20): 6450-62. DOI:10.1158/0008-5472.CAN-11-0364 |
 2019, Vol. 39
2019, Vol. 39

