2. 南方医科大学 生物医学工程学院//广东省医学图像处理重点实验室,广东 广州 510515;
3. 南方医科大学 精神健康研究教育 部重点实验室,广东 广州 510515
2. School of Biomedical Engineering, Guangdong Provincial Key Laboratory of Medical Image Processing, Southern Medical University, Guangzhou 510515, China;
3. Key Laboratory of Mental Health of the Ministry of Education, Southern Medical University, Guangzhou 510515, China
药物是导致急性和慢性肾损伤的常见原因,据报道,成年人药物相关肾损伤约为14%~26%,除食品药品管理局批准的药物外,中草药也是肾毒性物质的另一重要来源,其中包括马兜铃酸[1]。马兜铃酸(AA)存在于诸如马兜铃属及细辛属等马兜铃科植物中,曾被广泛应用治疗多种疾病,例如肝病、心血管疾病以及抗炎、抗病毒等。上世纪90年代初在比利时,一些服用了减肥药的女性发生了肾衰,而这些减肥药是含有马兜铃酸成分的中药[2],随后英国[3]、美国[4]、日本[5]、中国[6]等陆续有病例报道,从此马兜铃酸肾病(AAN)得到广泛重视。马兜铃酸肾病是指服用含有马兜铃酸类的药物或者被环境中马兜铃酸污染的食物(巴尔干肾病,BEN)导致的肾小管间质疾病。AAN主要分为3型:急性马兜铃酸肾病、慢性马兜铃酸肾病、肾小管功能障碍型马兜铃酸肾病。短时间大量服用含AA的药物可导致急性马兜铃酸肾病,临床表现为急性肾功能衰竭,其病理表现为急性肾小管损伤[7]。
AAN发病机制很多,目前普遍认为AA直接损伤肾小管上皮细胞是AAN的发病机制[8-10],同时有研究发现血管内皮生长因子(VEGF)表达下调导致管周毛细血管网减少及NO生物利用度下降、内皮素-1(ET-1)表达上调引起血管收缩,造成肾脏组织缺血缺氧,提示缺血缺氧可能参与AAN疾病的发生发展[11-13]。而肾脏持续缺氧可引起肾小管上皮细胞凋亡及肾脏的毛细血管损伤,缺氧时,细胞外基质生成的上调和胶原纤维转化的抑制促进了纤维化的产生,从而进展为慢性肾脏病。孙东等[14]发现AAN大鼠随着低氧加重,肾功能逐渐恶化。
因此,监测AAN肾内组织的氧合水平,及时发现肾脏缺氧,为临床治疗决策提供重要信息具有重要意义。目前监测肾内氧合情况的微电极、氧敏感光纤探针测量法[15-16]均是有创方法,对肾脏组织是一种损伤,且存在出血等风险,在临床应用中受到限制。血氧水平依赖(BOLD)磁共振(MRI)成像利用顺磁性的脱氧血红蛋白作为内源性对比剂测量肾脏氧合水平,是一种无创的方法,其定量参数R2*值与氧合水平呈负相关关系,BOLD MRI技术已应用于多种肾脏疾病中[17-21],而应用在AAN的报道较少。本研究利用7.0T小动物磁共振行BOLD技术,通过测量皮质及髓质R2*值无创评估急性AAN肾脏氧合水平变化,为临床治疗决策提供重要信息。
1 材料和方法 1.1 动物准备 1.1.1 实验动物动物实验方案经过南方医科大学实验动物伦理委员会的批准,24只雄性Wistar大鼠(由南方医科大学实验动物中心提供,实验动物许可证号SCXK(粤)2016-0041),体质量140~160 g,饲养于南方医科大学SPF级动物实验部(动物实验设施许可证号SYXK(粤)2016-0167),自由摄食和饮水,适应性饲养1周后开始实验。
1.1.2 实验方案随机分组法分为两组:(1)实验组(n= 18):腹腔注射马兜铃酸Ⅰ型溶液(Sigma),剂量为40 mg/(kg·d),共6 d,随机选取6只大鼠于注药前(baseline)及注药后第2、4、6天进行磁共振扫描,于上述时间点分别选取3只进行取材;(2)对照组(n=6):腹腔注射PEG400溶液,共6 d,于注药前及注药后第2、4、6天进行磁共振扫描,于注药后第6天取材。每次注药前均称体质量。
1.1.3 MRI扫描前准备各组动物磁共振扫描(实验组n=6,对照组n=6)扫描前放入麻醉诱导盒,5%异氟烷及氧气0.8 L/min进行麻醉,大鼠眼睑对光反应迟钝、脚趾收缩反应丧失后转移至无菌垫单进行插管,插管完毕立即转移至扫描床并连接呼吸机,呼吸频率为60次/min,给予3%异氟烷及氧气0.8 L/min维持麻醉,将37 ℃的加热垫放置于大鼠腹部表面进行保温。连接呼吸门控,并用医用胶布固定大鼠,待大鼠状态稳定后开始MRI扫描。
1.2 MRI扫描所有磁共振扫描均在7.0T小动物磁共振(PharmScan, Bruker, Germany)进行。采取仰卧位,头先进方式,发射线圈为容积线圈,接收线圈为四通道大鼠心脏表面线圈,行RARE-T2WI轴位进行定位,冠位BOLD扫描采用多回波GRE序列,为抑制呼吸运动伪影采取呼吸触发扫描方式,采集窗宽根据大鼠呼吸频率进行设置,基本维持在400~450 ms,其他具体扫描参数为:RARE-T2WI序列:重复时间(TR)=2500 ms,回波时间(TE)=44 ms,视野(FOV)=35 mm×50 mm,矩阵大小=100×100,层厚=1.5 mm;BOLD序列:TR=200 ms,TE= 3~31 ms,回波数=8,FOV=40 mm×55 mm,矩阵大小= 133×133,层厚=1.0 mm。
1.3 图像分析及数据测量基于Matlab2014平台对BOLD原始数据进行单指数拟合,生成R2*量化参数图像,两名经验丰富的放射科医师盲法阅片,选肾门水平1~2个层面,在Image J软件上进行皮质和髓质ROI的勾画,得到皮髓质相应的R2*值。
1.4 肾脏组织病理学大鼠处死后立即进行灌注,待流出液体为清亮生理盐水后取出右侧肾脏放于冰台上,迅速剥除肾脏周围脂肪及表面被膜,在肾门水平切取部分组织,置于4%多聚甲醛缓冲液内固定48 h,常规石蜡包埋,切片厚度为4 μm,常规脱蜡、水化后行HE染色,在光镜下观察肾脏病理变化情况。
1.5 统计分析测量结果均以均数±标准误表示,采用SPSS 22.0统计软件进行分析,统计学方法采用重复测量方差分析及两独立样本t检验,检验水准α=0.05,P < 0.05认为差异有统计学意义。
2 结果 2.1 一般情况AAN组大鼠第2天出现少动,体质量未见明显变化;第4天体质量开始下降,活动明显减少,精神状态差;第6天精神萎靡,黏膜及四肢皮肤苍白。对照组大鼠各个时间点未见明显异常。
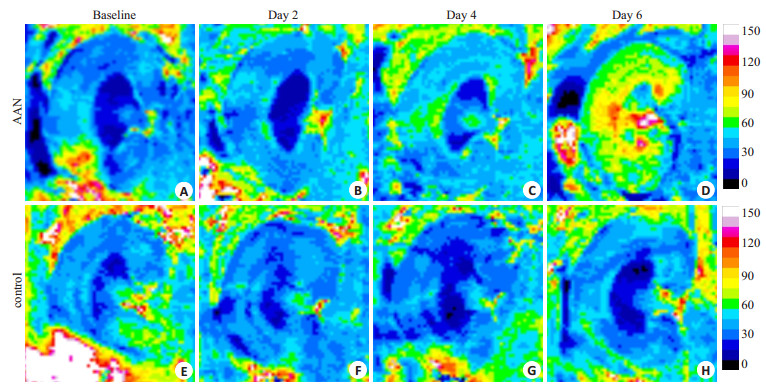
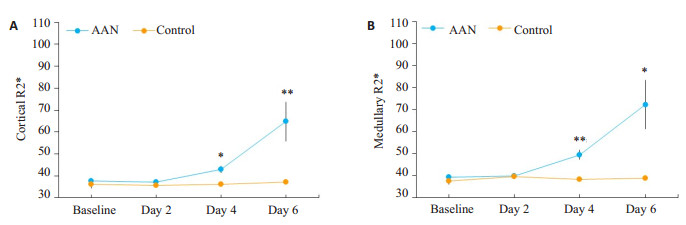
2.2 BOLD MRI结果AAN组及对照组baseline、第2天、第4天及第6天R2*伪彩图:可见AAN组(图 1A~D)第2天皮质及髓质信号较baseline变化不明显,第4天及第6天皮髓质信号增高,髓质信号增高更明显,对照组(图 1E~H)第2、4、6天较baseline皮质及髓质信号变化不明显。AAN组皮质及髓质各个时间点R2*值均比对照组高(表 1)。两组比较:baseline及第2天皮质及髓质两组间R2*值均无统计学差异,第4天及第6天AAN组皮质及髓质R2*值均较对照组升高(P < 0.05)。组内比较(图 2所示):(1)AAN组皮质:R2*值第2天较baseline变化不明显(P>0.05),第4天R2*值较baseline上升(P>0.05),第6天R2*值继续上升(P < 0.05);(2)AAN组髓质:R2*值随时间呈逐渐升高趋势,第2天R2*值较baseline无统计学差异(P>0.05),第4天R2*值继续升高(P < 0.05),在第6天最高,显著高于baseline(P < 0.05);(3)对照组:各个时间点皮质及髓质R2*值变化不大,较baseline均无统计学差异(P>0.05)。
|
图 1 AAN组及对照组R2*伪彩图 Fig.1 R2* map ofAAN group (A-D) and control group (E-H). |
| 表 1 AAN组及对照组皮质及髓质R2*值 Tab.1 Renal cortical and medullary R2* values inAAN group and control group |
|
图 2 AAN组及对照组皮质及髓质R2*值-时间曲线 Fig.2 Renal cortical (A) and medullary (B) R2* values-time curve. *P < 0.05, **P < 0.01 vs baseline |
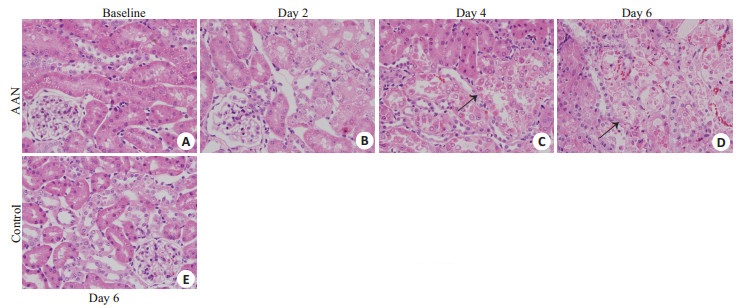
光镜下对照组第6天(图 3E)及AAN组baseline(图 3A)肾小球、肾小管结构清晰,形态学未见明显改变,AAN组第2天(图 3B)肾小管上皮细胞稍肿胀,可见空泡变性,第4天(图 3C)可见局灶性轻至中度肾小管管腔扩张,肾小管上皮细胞坏死、崩解,部分脱落,第6天(图 3D)可见肾小管结构紊乱,弥漫性肾小管上皮细胞坏死、脱落,肾小管刷状缘消失,基底膜裸露。
|
图 3 AAN组及对照组肾脏组织HE染色结果 Fig.3 HE staining of renal tissues in AAN group (A-D) and control group (E). (Original magnification: × 400). The black arrow indicates necrosis of tubular epithelial cells. |
本实验利用BOLD MRI技术研究腹腔注射AAI溶液建立的大鼠急性AAN模型,与对照组相比,AAN组大鼠皮质及髓质在第4天及第6天信号增高,在第6天升高最明显,病理结果显示AAN组大鼠第4天及第6天肾小管坏死、脱落,甚至出现基底膜裸露现象。以上结果提示,肾小管上皮细胞坏死虽然减少了主动重吸收钠离子等物质过程需要消耗的大量氧气,但R2*值依然升高,提示肾脏组织可能处于缺氧状态。原因可能与血管生成因子及血管活性物质的改变有关,包括VEGF表达的下调、NO生物利用度的降低以及缩血管物质ET-1表达增加,这些因素引起的管周毛细血管密度减少及血管收缩会导致肾脏组织缺氧[11],从而引起R2*值的升高。
早期出现且严重贫血是马兜铃酸肾病的临床表现之一,在动物和患者均有发现[22-28]。本实验过程中AAN组大鼠黏膜及四肢皮肤苍白,提示大鼠可能出现了贫血。这是因为AA可能直接作用于促红细胞生成素受体N-端,从而使EPO/EPOR信号通路出现缺陷,最终导致贫血[29]。贫血时由于血红蛋白数量减少,血液携氧能力降低,运送到肾脏组织的氧减少,引起肾脏组织缺氧,R2*值升高。
在本研究中所测得的髓质R2*值比皮质高。尽管肾脏血流非常丰富,为心输出量的25%,但供给髓质的血流量仅占10%,且髓质肾小管维持物质的重吸收、尿液的浓缩等生理功能耗氧较大,髓质内U形直小血管降支和升支并行且血流方向相反,这样的解剖结构特点使氧气易于经升支回流皮质,以上因素使髓质处于相对缺氧环境[30],所以对氧含量的减低非常敏感,R2*值相对皮质高。
目前收载于我国药典、部颁标准和地方药材标准的马兜铃科药材仍有24种,含马兜铃属药材的中成药口服剂仍有47种[31],短时间大量服用可导致急性AAN。AA除了直接损伤肾小管上皮细胞外,肾组织缺血缺氧也可能是致病机制之一[32],及早发现及干预髓质缺氧具有重要意义。测定肾脏组织是否缺氧主要依靠微电极和氧敏感光纤探针,均是有创方法,在临床上应用有限。BOLD磁共振技术是一种无创性测定组织氧合情况的方法,利用自旋去相位速率R2*(1/T2*)值作为定量参数反映肾脏氧合情况,在动物体内已经证实R2*值与有创的方法测得的肾内氧分压具有相关性[33]。当然BOLD MRI也存在一定的局限性,影响R2*值的因素除了上述因素外,磁场的均匀性、生理状态(温度、水化效应)等也是干扰因素[34],本实验扫描前大鼠禁食禁水至少6 h,扫描过程中通过缩小匀场范围、放置加热垫进行保温,减少以上因素对R2*值的干扰。此外本实验存在的不足之处是观察时间点仅到造模后的第6天,而对后续AAN大鼠肾脏氧合水平变化未继续动态观察,后期我们会对这方面工作补足。
综上所述,应用BOLD MRI技术测量皮质及髓质的R2*值评估急性AAN大鼠肾脏氧合水平变化,随着AAN大鼠肾脏损伤的进展,皮髓质R2*值升高,提示肾脏氧合水平降低,尤其是髓质,为临床医师提供AAN肾脏氧合水平变化过程信息,及时干预肾脏缺氧情况,延缓AAN疾病进一步发展。
| [1] |
Perazella MA. Pharmacology behind common drug nephrotoxicities[J]. Clin JAm Soc Nephrol, 2018, 13(12): 1897-908. DOI:10.2215/CJN.00150118 |
| [2] |
Vanherweghem JL, Depierreux M, Tielemans C, et al. Rapidly progressive interstitial renal fibrosis in young women: association with slimming regimen including Chinese herbs[J]. Lancet, 1993, 341(8842): 387-91. DOI:10.1016/0140-6736(93)92984-2 |
| [3] |
Lord GM, Tagore R, Cook T, et al. Nephropathy caused by Chinese herbs in the UK[J]. Lancet, 1999, 354(9177): 481-2. DOI:10.1016/S0140-6736(99)03380-2 |
| [4] |
Meyer MM, Chen TP, Wm B. Chinese herb nephropathy[J]. Proc (Bayl Univ Med Cent), 2000, 13(4): 334-7. DOI:10.1080/08998280.2000.11927699 |
| [5] |
Kazama I, Matsubara M, Michimata M, et al. Adult onset fanconi syndrome: extensive tubulo-interstitial lesions and glomerulopathy in the early stage of Chinese herbs nephropathy[J]. Clin Exp Nephrol, 2004, 8(3): 283-7. DOI:10.1007/s10157-004-0296-9 |
| [6] |
Lo SH, Mo KL, Wong KS, et al. Aristolochic acid nephropathy complicating a patient with focal segmental glomerulosclerosis[J]. Nephrol Dial Transplant, 2004, 19(7): 1913-5. DOI:10.1093/ndt/gfh159 |
| [7] |
涂玥, 万毅刚, 孙伟, 等. 马兜铃酸肾毒性的临床特征、分子机制及治疗策略[J]. 南京中医药大学学报, 2018, 34(1): 12-8. |
| [8] |
Pozdzik AA, Salmon IJ, Debelle FD, et al. Aristolochic acid induces proximal tubule apoptosis and epithelial to mesenchymal transformation[J]. Kidney Int, 2008, 73(5): 595-607. DOI:10.1038/sj.ki.5002714 |
| [9] |
Lebeau C, Debelle FD, Arlt VM, et al. Early proximal tubule injury in experimental aristolochic acid nephropathy: functional and histological studies[J]. Nephrol Dial Transplant, 2005, 20(11): 2321-32. DOI:10.1093/ndt/gfi042 |
| [10] |
Jadot I, Decleves AE, Nortier J, et al. An integrated view of aristolochic acid nephropathy: update of the literature[J]. Int J Mol Sci, 2017, 18(2): E297. DOI:10.3390/ijms18020297 |
| [11] |
Wen YJ, Qu L, Li XM. Ischemic injury underlies the pathogenesis of aristolochic acid-induced acute kidney injury[J]. Transl Res, 2008, 152(1): 38-46. |
| [12] |
Sun D, Feng JM, Dai C, et al. Role of peritubular capillary loss and hypoxia in progressive tubulointerstitial fibrosis in a rat model of aristolochic acid nephropathy[J]. Am J Nephrol, 2006, 26(4): 363-71. DOI:10.1159/000094778 |
| [13] |
Yang L, Li XM, Wang HY. Possible mechanisms explaining the tendency towards interstitial fibrosis in aristolochic acid-induced acute tubular necrosis[J]. Nephrol Dial Transplant, 2007, 22(2): 445-56. |
| [14] |
孙东, 冯江敏, 戴春, 等. 管周毛细血管损害引起的低氧对大鼠慢性马兜铃酸肾病进展的影响[J]. 中华医学杂志, 2006, 86(21): 1464-9. DOI:10.3760/j:issn:0376-2491.2006.21.007 |
| [15] |
Warner L, Glockner JF, Woollard J, et al. Determinations of renal cortical and medullary oxygenation using blood oxygen leveldependent magnetic resonance imaging and selective diuretics[J]. Invest Radiol, 2011, 46(1): 41-7. DOI:10.1097/RLI.0b013e3181f0213f |
| [16] |
Hansell P, Welch WJ, Blantz RC, et al. Determinants of kidney oxygen consumption and their relationship to tissue oxygen tension in diabetes and hypertension[J]. Clin Exp Pharmacol Physiol, 2013, 40(2): 123-37. DOI:10.1111/1440-1681.12034 |
| [17] |
Herrmann SM, Saad A, Eirin A, et al. Differences in GFR and tissue oxygenation, and interactions between stenotic and contralateral kidneys in unilateral atherosclerotic renovascular disease[J]. Clin J Am Soc Nephrol, 2016, 11(3): 458-69. DOI:10.2215/CJN.03620415 |
| [18] |
Min JH, Kim CK, Park BK, et al. Assessment of renal lesions with blood oxygenation level-dependent MRI at 3 T: preliminary experience[J]. AJRAm J Roentgenol, 2011, 197(3): W489-94. DOI:10.2214/AJR.10.6319 |
| [19] |
石会兰, 郑振峰, 张云亭. 钆对比剂对肾脏缺血缺氧改变的初步研究[J]. 临床放射学杂志, 2014, 33(8): 1260-4. |
| [20] |
Tholking G, Schuette-Nuetgen K, Kentrup D, et al. Imaging-based diagnosis of acute renal allograft rejection[J]. World J Transplant, 2016, 6(1): 174-82. DOI:10.5500/wjt.v6.i1.174 |
| [21] |
Yin WJ, Liu F, Li XM, et al. Noninvasive evaluation of renal oxygenation in diabetic nephropathy by BOLD-MRI[J]. Eur J Radiol, 2012, 81(7): 1426-31. DOI:10.1016/j.ejrad.2011.03.045 |
| [22] |
Chang CH, Wang YM, Yang AH, et al. Rapidly progressive interstitial renal fibrosis associated with Chinese herbal medications[J]. Am J Nephrol, 2001, 21(6): 441-8. DOI:10.1159/000046647 |
| [23] |
Yang CS, Lin CH, Chang SH, et al. Rapidly progressive fibrosing interstitial nephritis associated with Chinese herbal drugs[J]. Am J Kidney Dis, 2000, 35(2): 313-8. DOI:10.1016/S0272-6386(00)70343-X |
| [24] |
Cosyns JP, Dehoux JP, Guiot Y, et al. Chronic aristolochic acid toxicity in rabbits: A model of Chinese herbs nephropathy?[J]. Kidney Int, 2001, 59(6): 2164-73. DOI:10.1046/j.1523-1755.2001.00731.x |
| [25] |
Nephropathy' CH. A review of the evidence to date[J]. Drug Safety, 2003, 26(1): 33-48. DOI:10.2165/00002018-200326010-00004 |
| [26] |
Hong YT, Fu LS, Chung LH, et al. Fanconi's syndrome, interstitial fibrosis and renal failure by aristolochic acid in Chinese herbs[J]. Pediatr Nephrol, 2006, 21(4): 577-9. DOI:10.1007/s00467-006-0017-6 |
| [27] |
Hamano Y, Aoki T, Shirai R, et al. Low-Dose darbepoetin alpha attenuates progression of a mouse model of aristolochic acid nephropathy through early tubular protection[J]. Nephron Exp Nephrol, 2010, 114(2): E69-81. DOI:10.1159/000256569 |
| [28] |
Chen DM, Tang Z, Luo CL, et al. Clinical and pathological spectrums of aristolochic acid nephropathy[J]. Clin Nephrol, 2012, 78(1): 54-60. |
| [29] |
Chen YH, Chou CY, Sun CY. Impairment of the cellular distribution and stability of the erythropoietin receptor through the direct targeting of aristolochic acid[J]. Toxicol Sci, 2015, 147(1): 246-54. DOI:10.1093/toxsci/kfv125 |
| [30] |
石会兰, 郑振峰, 马慧, 等. 正常肾脏血氧依赖磁共振成像特点及与生理指标相关性研究[J]. 天津医药, 2014, 42(6): 619-21, 630. DOI:10.3969/j.issn.0253-9896.2014.06.031 |
| [31] |
薛寿征, 曾广先. 马兜铃酸肾病:研究及启示[J]. 科学, 2018, 70(4): 27-31. |
| [32] |
曹菊, 杨学东, 王霄英, 等. 马兜铃酸和庆大霉素对大鼠急性肾小管坏死模型肾组织氧合水平的影响[J]. 中华医学杂志, 2010, 90(17): 1208-12. DOI:10.3760/cma.j.issn.0376-2491.2010.17.015 |
| [33] |
Pedersen M, Dissing TH, Morkenborg J, et al. Validation of quantitative BOLD MRI measurements in kidney: Application to unilateral ureteral obstruction[J]. Kidney Int, 2005, 67(6): 2305-12. DOI:10.1111/j.1523-1755.2005.00334.x |
| [34] |
黄海波. 肾脏血氧水平依赖性成像研究进展[J]. 磁共振成像, 2017, 8(8): 636-40. |
 2019, Vol. 39
2019, Vol. 39

