2. 蚌埠医学院 生理学教研室,安徽 蚌埠 233030;
3. 蚌埠医学院 心血管病研究中心,安徽 蚌埠 233030
2. Department of Physiology Cardiovascular Research Center of BengBu Medical College, Bengbu 233030, China;
3. Department of Physiology Bengbu Medical College, Bengbu 233030, China
糖尿病心肌病(DCM)是一种独立的糖尿病并发症,高血糖致心肌病变主要特点是以心肌结构改变为主[1-2],包括心肌纤维化(MF)是其中主要改变之一,MF是以成纤维细胞产生的细胞外基质过量堆积和其本身表型改变分化成纤维母细胞为主要特点。心室肌纤维化室早期主要以心室肌顺应性显著降低、充盈受限和舒张末期容积下降,晚期收缩功能也会降低,最终会引起心力衰竭。因此关于心肌纤维化机制研究具有重要意义。自噬作为一种进化保守的溶酶体依赖性分解代谢途径,在维持细胞内环境稳态发挥着重要作用,当细胞处于多种应激下可引起的胞质成分改变和细胞器损伤,而自噬途径就能够消化并循环利用这些“多余的物质”以维持胞内环境动态平衡[3],因此基础水平的自噬是细胞维持自稳态的重要机制之一。但目前关于自噬活动利弊还存在很大争议。既往研究发现心血管疾病的发生与自噬水平的降低有着密切的关系,如心力衰竭、心肌肥大和扩张型心肌病等[4-5],而在糖尿病心肌病中自噬途径的活化程度与心肌损伤程度存在相关性[6],也有研究发现在糖尿病心肌病中自噬水平升高并促进机体糖代谢[7],可改善心肌预后。
线粒体乙醛脱氢酶(ALDH)2是一种位于线粒体内重要的醛类氧化酶,其抗氧化应激作用研究广泛,在细胞凋亡研究方面证实,ALDH2具有抑制细胞凋亡作用。ALDH2对高糖诱导的心肌成纤维细胞增殖活化有抑制作用[8],既往研究也发现自噬活动与心肌纤维化有很强相关性[9-10],但自噬所发挥的作用利弊仍具有争议。我们研究发现在糖尿病心肌病模型中可以观察到自噬活化程度与心肌损伤程度成正相关[11],但在心肌成纤维细胞中自噬水平变化情况未得到验证,自噬在心肌成纤维细胞中的作用也没有明确定论。因此我们通过高糖处理的乳鼠心肌成纤维细胞,探讨ALDH2对自噬水平影响及其可能机制。
1 材料和方法 1.1 动物和试剂SD大鼠(蚌埠医学院实验动物中心);胰酶消化液(碧云天);DNA酶Ⅰ(索莱宝);胶原酶2(索莱宝);Hanks液(碧云天);胎牛血清(四季青);DMEM低糖、高糖培养基(HyClone);Daidzin、Alda-1(sigma);抗ALDH2、LC3B、Beclin-1抗体(abcam);β-actin(Biosharp);BCA试剂盒(碧云天);羟脯胺酸试剂盒(南京建成);CCK8试剂盒(贝博);DAPI(ZSGB,北京);羊抗小鼠荧光标记二抗(武汉博士德)。
1.2 方法 1.2.1 心肌成纤维细胞原代培养出生3 d内乳鼠数若干只,无菌条件取出心脏,具体方法参照文献[12],差速贴壁后继续培养心肌成纤维细胞,当细胞传至3代时则为较稳定的心肌成纤维细胞可进行实验。
1.2.2 心肌成纤维细胞鉴定用免疫荧光对培养心肌成纤维细胞进行鉴定。具体方法参照文献[12],其中抗波形蛋白(Vimentin 1:300)孵育细胞。
1.2.3 Western blot检测ALDH2、LC3B、Beclin-1蛋白表达情况各组细胞处理48 h后,用全细胞裂解液提取细胞总蛋白。按照BCA试剂盒说明测蛋白浓度,制备10% SDS-PAGE分离胶和5%浓缩胶,采取30 µg上样量。电泳分离出蛋白后,电转到PVDF膜上;室温条件下各条带用5%脱脂奶粉孵育2 h;低温条件下一抗孵育后二抗中37 ℃孵育1 h,然后进行化学发光法进行曝光。
1.2.4 细胞培养液中羟脯胺酸含量测定取各组细胞培养液,按试剂盒步骤说明进行实验操作,结果根据试剂盒所给计算公式进行计算。
1.2.5 各组细胞增殖测定将培养皿中细胞用胰酶消化后,用细胞计数板进行计数,以计数结果按2000,4000,8000,16 000,32 000,128 000等比例接种到96孔板中,待细胞贴壁生长后,每孔加入CCK8试剂反应2.5 h后用酶标仪波长450 nm处测量各孔A值;根据每孔细胞数量和对应A值,绘制细胞数量与A值关系曲线;同时按计数板计数结果以细胞数2000/孔按分组接种到96孔板中,待细胞完全贴壁后进行处理;当每组细胞干预时间足够后每孔加入CCK8试剂反应2.5 h后进行A值测定;此时所得A值代入之前所得细胞数量与A值关系曲线中得到每组细胞数量。
1.3 统计学处理采用GraphPad prism 6进行数据分析并用以均数±标准差表示,多组均数间比较采用单因素方差分析,各组均数比较采用HolmSidak(recommended)校正的t检验,以P < 0.05为差异有统计学意义。
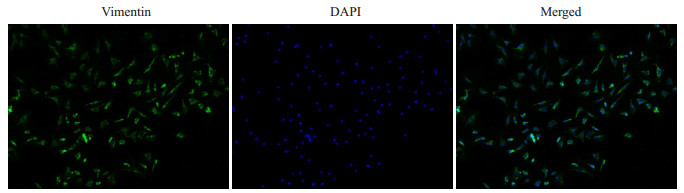
2 结果 2.1 原代心肌成纤维细胞鉴定结果通过对特异性表达于心肌成纤维细胞Vimentin蛋白进行免疫荧光染色,绿色为位于心肌成纤维细胞胞浆内Vimentin蛋白染色结果,蓝色为细胞核染色结果(图 1)。
|
图 1 心肌成纤维细胞免疫荧光鉴定 Fig.1 Immunofluorescence identification of neonatal rat cardiac fibroblasts (Original magnification: ×100). |
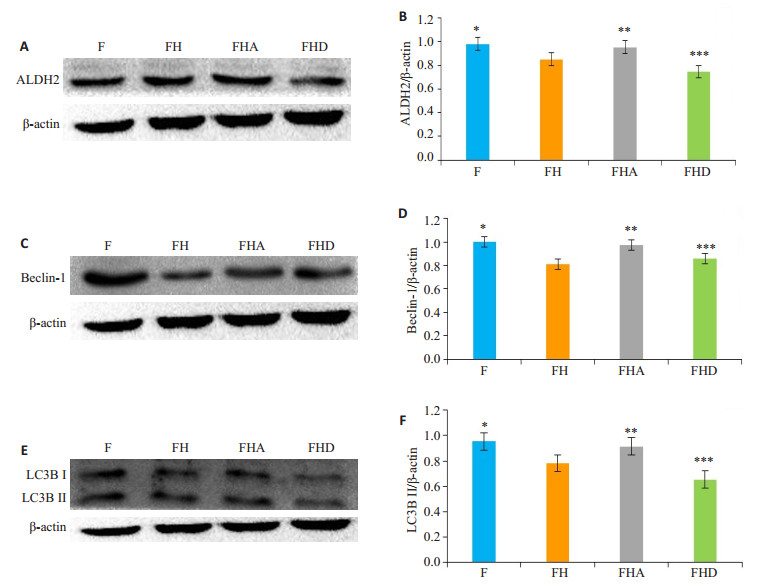
通过Image-J分析条带,结果显示:对各组细胞予以相应处理48 h后,对比于F组,ALDH2、Beclin-1、LC3B表达降低在FH组;相比FH组,FHA组ALDH2、Beclin-1、LC3B蛋白表达量增多,FHD组ALDH2、LC3B进一步降低(图 2)。
|
图 2 Western blot检测各组ALDH2、Beclin-、LC3B蛋白表达 Fig.2 Western blotting for detecting ALDH2, LC3B, and Beclin-1 protein expressions in primary cultures of neonatal rat cardiac fibroblast after the treatments (n=3). A: Western blotting of ALDH2; B: ALDH2 protein levels normalized by β- actin (*P < 0.05 vs FH, **P < 0.05 vs FH, ***P < 0.05 vs FH); C: Western blotting of Beclin-1; D: Beclin-1 protein levels normalized by and β-actin (*P < 0.05 vs FH, **P < 0.05 vs FH, ***P>0.05 vs FH); E: Western blotting of LC3B; F: LC3BII protein levels normalized by β-actin (*P < 0.05 vs FH, **P < 0.05 vs FH, ***P < 0.05 vs FH). |
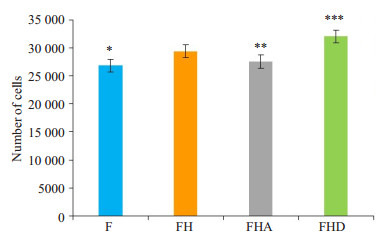
细胞相应条件下培育48 h后:F组细胞数目最少,在高糖诱导下细胞数目显著增多,给予Alda-1处理的FHA组细胞数目有所降低,FHD组细胞数目较FH组增多显著(图 3)。
|
图 3 不同处理组细胞数目 Fig.3 Number of viable cells in the primary cultures of neonatal rat cardiac fibroblasts in each group (n=3). *P < 0.01 vs FH, **P < 0.05 vs FH, ***P < 0.01 vs FH. |
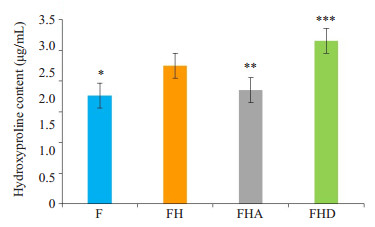
细胞相应条件下培育48 h后:F组中细胞培养液中羟脯胺酸含量最低,FHA组较FH组细胞培养液中羟脯胺酸含量有所降低,而FHD组较FH组中培养液中羟脯胺酸含量进一步增多(图 4)。
|
图 4 各组细胞培养液中羟脯胺酸含量 Fig.4 Content of hydroxyproline in the primary cultures of neonatal rat cardiac fibroblasts in each group (n=3). *P < 0.01 vs FH, **P < 0.05 vs FH, ***P < 0.05 vs FH. |
机体内长期高血糖能够促进心肌纤维化的发生,使心肌成纤维细胞过度增殖,进而心肌成纤维细胞合成并分泌胶原导致胶原在细胞外间质大量积累,心肌纤维化可致心室重构,并可致心功能下降,但其中具体机制仍不明确。本实验发现ALDH2可以表达于心肌成纤维细胞中,高糖可降低心肌成纤维细胞中ALDH2、自噬标志物LC3B蛋白表达水平,而当激动或抑制ALDH2对自噬水平都有显著影响,这就提示了:ALDH2可能通过调节自噬水平影响着心肌成纤维细胞活性及分泌胶原纤维。近年来研究发现自噬参与着多种心血管疾病发生发展[13-15]。生理状态下自噬可消化降解细胞内受损的组分并回收利用,维持细胞内环境稳态。心肌成纤维细胞通过产生胶原蛋白,纤维蛋白等,使细胞外基质保持完整性[16]。以往研究发现自噬活动与AMPKmTORC1-ULK1信号通路有着密切关系[17-18]。在自噬期间,LC3的羧基末端脂质修饰是自噬体形成所需的充分表征现象,并且可以通过检测LC3-Ⅱ观察到自噬水平[19],Kim等研究发现,葡萄糖饥饿通过AMPK依赖性磷酸化激活Ulk1蛋白激酶,并同时检测到较高水平的LC3-Ⅱ[18],进一步研究发现AMPK作用于ULK1de Ser317和Ser777两个磷酸化位点使其活化,而作为自噬起始激酶,Ulk1调节的机制对于理解自噬调节至关重要。TORC1是最重要的自噬调节因子之一,mTORC1可通过磷酸化Ulk1 Ser 757磷酸化位点抑制Ulk1活化并破坏其与AMPK的相互作用。正常或饥饿状态下,AMPK处于激活状态,蛋白激酶ULK1 Ser317和Ser777磷酸化,进一步形成ULK1-Atg13-FIP200复合体,促使着自噬发生;而当高糖等能量充足时,mTOR通过ULK-1的Ser757干扰AMPK与ULK1结合,抑制自噬[20]。就目前研究来看,自噬在糖尿病心肌病究竟是保护作用还是损伤作用存在很大争议。在T1D和T2D中自噬所发挥作用也是不同,研究提示,T1D小鼠AMPK活性降低,而雷帕霉素靶蛋白(mTORC1)则相对激活[21],Beclin-1-Bcl-2复合体结合增强,最终抑制了自噬的发生。通过心脏成纤维细胞培养,采取饥饿或β2肾上腺素能刺激使自噬活性增强,使Ⅰ型胶原蛋白降解加速[22]。自噬可以清除错误折叠的三聚体形式的Ⅰ型前胶原蛋白,其在Hsp47-/-成纤维细胞的内质网中聚集成聚集体[23]。缺乏Beclin 1的小鼠的肾脏表现出促纤维化表型,其中Ⅰ型胶原蛋白沉积增加[24],有研究发现TGF-β1可通过TAK1-MKK3-p38信号传导通路诱导Beclin-1水平升高[25],可减少肾系膜细胞Ⅰ型胶原蛋白的产生,这说明自噬在纤维化过程中起重要作用。这些数据表明,自噬可以通过其在细胞内胶原蛋白降解中的作用部分地影响心脏重塑,缓解心脏纤维化,且与我们目前结果比较相符。研究证实糖尿病或者高糖环境下均可诱导心肌纤维化的发生[26-27]。本实验通过高糖诱导原代培养的心肌成纤维细胞,并以Beclin-1、LC3B作为自噬标志物可反映机体内自噬水平[28-30],结果发现高糖作用下的心肌成纤维细胞内自噬水平较正常糖浓度组显著降低,同时高糖组心肌成纤维细胞细胞数目显著增加并产生更多的羟脯胺酸,这些发现与既往研究相符[16, 22-23],这就提示了自噬水平的降低可能促进心肌纤维化的发生发展,而这种结果和T1D自噬变化趋势相似,而自噬在T2D中则存在较大争议,T1D与体外建造的糖尿病细胞模型都存在胰岛素缺乏这一共性,那么是不是胰岛素存在与否导致的差异性还需进一步实验论证。
ALDH2对糖尿病致心血管疾病中具有保护作用[31],我们前期研究发现在糖尿病大鼠模型中[32],低浓度酒精激活的ALDH2通过降低Bax/Bcl-2比例,激活PI3K/ Akt并抑制mitoPTP开放缓解高糖环境对心肌细胞损伤作用,并可抑制心肌纤维化发生发展。有研究发现在小鼠肝脏中PI3K/Akt/mTOR信号通路在乌头碱诱导的自噬活动中发挥着重要作用[33],在链脲佐菌素诱导的糖尿病模型中发现,激动ALDH2可使AMPK活性升高,同时作为自噬标志物的LC3Ⅱ蛋白水平显著升高[34]。这就提示了ALDH2与自噬活性可能有着密切联系,且可能是通过调节AMPK-mTORC1-ULK1完成的。本实验发现:高糖环境下ALDH2表达水平显著降低,通过ALDH2特异性激动剂Alda-1可使ALDH2表达水平升高,同时自噬标志物Beclin-1、LC3B表达水平也显著升高,而心肌成纤维细胞数目及其所产生的羟脯胺酸都减少,而当运用ALDH2特异性抑制剂Daidzin后则会发生相反的结果,这就提示了ALDH2可能对高糖诱导的心肌成纤维细胞中自噬水平有调节作用,而同时ALDH2可对心肌成纤维细胞增殖及羟脯胺酸分泌也具有调节作用,这与我们既往研究结果相符[8]。
总之,我们实验发现:ALDH2能够调节高糖处理的心肌成纤维细胞增殖及分泌活性,同时能够使其内自噬水平发生相应改变。因此ALDH2可能通过调节高糖处理的心肌成纤维细胞内自噬水平抑制心肌成纤维细胞增殖及分泌活性,但其具体机制仍需进一步研究。
| [1] |
Aydemir M, Ozturk N, Dogan S, et al. Sodium tungstate administration ameliorated diabetes-induced electrical and contractile remodeling of rat heart without normalization of hyperglycemia[J]. Biol Trace E lem Res, 2012, 148(2): 216-23. DOI:10.1007/s12011-012-9350-8 |
| [2] |
Thackeray JT, Radziuk J, Harper ME, et al. Sympathetic nervous dysregulation in the absence of systolic left ventricular dysfunctionin a rat model of insulin resistance with hyperglycemia[J]. Cardiovasc Diabetol, 2011, 10: 75. DOI:10.1186/1475-2840-10-75 |
| [3] |
Hale AN, Ledbetter DJ, Gawriluk TR, et al. Autophagy: Regulation and role in development[J]. Autophagy, 2013, 9(7): 951-72. DOI:10.4161/auto.24273 |
| [4] |
Shirakabe A, Zhai P, Ikeda Y, et al. Drp1-dependent mitochondrial autophagy plays a protective role against pressure overload-induced mitochondrial dysfunction and heart failure[J]. Circulation, 2016, 133(13): 1249-63. DOI:10.1161/CIRCULATIONAHA.115.020502 |
| [5] |
Saito T, Asai K, Sato S, et al. Autophagic vacuoles in cardiomyocytes of dilatedcardiomyopathy with initially decompensated heartfailure predict improved prognosis[J]. Autophagy, 2016, 12(3): 579-87. DOI:10.1080/15548627.2016.1145326 |
| [6] |
Gupta SS, Zeglinski MR, Rattan SG, et al. Inhibition of autophagy inhibits the conversion of cardiac fibroblasts to cardiac myofibroblastss[J]. Oncotarget, 2016, 7(48): 78516-31. |
| [7] |
Zhou H, Chen Y, Huang SW, et al. Regulation of autophagy by tea polyphenols in diabetic cardiomyopathy[J]. J Zhejiang Univ Sci B, 2018, 19(5): 333-41. DOI:10.1631/jzus.B1700415 |
| [8] |
Gu X, Fang T, Kang P, et al. Effect of ALDH2 on high glucoseinduced cardiac fibroblast oxidative stress, apoptosis, and fibrosis[J]. Oxid Med Cell Longev, 2017, 2017: 9257967. |
| [9] |
Chen TH, Chen MR, Chen TY, et al. Cardiac fibrosis in mouse expressing DsRed tetramers involves chronic autophagy and proteasome degradation insufficiency[J]. Oncotarget, 2016, 7(34): 54274-89. |
| [10] |
Andrew J Boyle, Henry Shih, Joy Hwang, et al. Cardiomyopathy of aging in the mammalian heart is characterized by myocardial hypertrophy, fibrosis and a predisposition towards cardiomyocyte a poptosis and autophagy[J]. Exp Gerontol, 2011, 46(7): 549inks. DOI:10.1016/j.exger.2011.02.010 |
| [11] |
陶敏, 康品方, 郭建路, 等. 低浓度乙醇激活乙醛脱氢酶2抑制糖尿病大鼠心肌中自噬相关蛋白的上调[J]. 中国组织化学与细胞化学杂志, 2018, 4: 341-6. |
| [12] |
郭建路, 康品方, 朱磊, 等. 线粒体乙醛脱氢酶2通过下调拮抗高糖引起的乳鼠心肌细胞损伤[J]. 南方医科大学学报, 2018, 38(11): 1288-93. |
| [13] |
Ghavami S, Cunnington RH, Gupta S, et al. Autophagy is a regulator of TGF-is a w. ncbifibrogenesis in primary human atrial myofibroblasts[J]. Cell Death Dis, 2015, 6(3): e1696. DOI:10.1038/cddis.2015.36 |
| [14] |
Georgescu SP, Aronovitz MJ, Iovanna JL, et al. Decreased metalloprotease 9 induction, cardiac fibrosis, and higher autophagy after pressure overload in mice lacking the transcriptional regulator p8[J]. Am J Physiol Cell Physiol, 2011, 301(5): C1046-56. DOI:10.1152/ajpcell.00211.2011 |
| [15] |
Orogo AM, Gustafsson ÅB. Therapeutic targeting of autophagy: potential and concerns in treating cardiovascular disease[J]. Circ Res, 2015, 116(3): 489-503. DOI:10.1161/CIRCRESAHA.116.303791 |
| [16] |
Weber KT, Sun Y, Diez J, et al. Fibrosis: a living tissue and the infarcted heart[J]. JAm Coll Cardiol, 2008, 52(24): 2029-31. DOI:10.1016/j.jacc.2008.09.012 |
| [17] |
Cai ZY, Yang B, Shi YX, et al. High glucose downregulates the effects of autophagy on osteoclastogenesis via the AMPK/mTOR/ ULK1 pathway[J]. Biochem Biophys Res Commun, 2018, 503(2): 428-35. DOI:10.1016/j.bbrc.2018.04.052 |
| [18] |
Ha J, Guan KL, Kim J. AMPK and autophagy in glucose/glycogen metabolism[J]. MolAspects Med, 2015, 46: 46-62. DOI:10.1016/j.mam.2015.08.002 |
| [19] |
Klionsky DJ, Abdalla FC, Abeliovich H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy in higher eukaryotes[J]. Autophag, 2012, 8(4): 445-544. DOI:10.4161/auto.19496 |
| [20] |
Kim J, Kundu M, Viollet B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol, 2011, 13(2): 132-41. DOI:10.1038/ncb2152 |
| [21] |
Xu X, Kobayashi S, Chen K, et al. Diminished autophagy limits cardiac injury in mouse models of type 1 diabetes[J]. J Biol Chem, 2013, 288(25): 18077-92. DOI:10.1074/jbc.M113.474650 |
| [22] |
Aránguiz-Urroz P, Canales J, Copaja M, et al. Beta(2)-adrenergic receptor regulates cardiac fibroblast autophagy and collagen degradation[J]. Biochim BiophysActa, 2011, 1812(1): 23-31. |
| [23] |
Ishida Y, Yamamoto A, Kitamura A, et al. Autophagic elimination of misfolded procollagen aggregates in the endoplasmic reticulum as a means of cell protection[J]. Mol Biol Cell, 2009, 20(11): 2744-54. DOI:10.1091/mbc.e08-11-1092 |
| [24] |
Kim SI, Na HJ, Ding Y, et al. Autophagy promotes intracellular degradation of type Ⅰ collagen induced by transforming growth factor (TGF)-ar degrad[J]. Biol Chem, 2012, 287(15): 11677-88. DOI:10.1074/jbc.M111.308460 |
| [25] |
Ding Y, Kim JK, Kim SI. TGF-β1 protects against mesangial cell apoptosis via induction of autophagy[J]. J Biol Chem, 2010, 285(48): 37909-19. DOI:10.1074/jbc.M109.093724 |
| [26] |
Yang F, Qin Y, Lv J, et al. Silencing long non-coding RNA Kcnq1ot1 alleviates pyroptosis and fibrosis in diabetic cardiomyopathy[J]. Cell Death Dis, 2018, 9(10): 1000. DOI:10.1038/s41419-018-1029-4 |
| [27] |
Wang X, Tan Y, Xu B, et al. GPR30 Attenuates myocardial fibrosis in diabetic ovariectomized female rats: role of iNOS signaling[J]. DNACell Biol, 2018, 37(10): 821-30. |
| [28] |
Siddiqui MA, Mukherjee S, Manivannan P, et al. RNase L cleavage products promote switch from autophagy to apoptosis by caspasemediated cleavageofbeclin-1[J]. IntJMolSci, 2015, 16(8): 17611-36. |
| [29] |
Satyavarapu EM, Das R, Mandal C, et al. Autophagy-independent induction of LC3B through oxidative stress reveals its noncanonical role in anoikis of ovarian cancer cells[J]. Cell Death Dis, 2018, 9(10): 934. DOI:10.1038/s41419-018-0989-8 |
| [30] |
Ramkumar A, Murthy D, Raja DA, et al. Classical autophagy proteins LC3B and ATG4B facilitate melanosome movement on cytoskeletal tracks[J]. Autophagy, 2017, 13(8): 1331-47. DOI:10.1080/15548627.2017.1327509 |
| [31] |
Pan G, Deshpande M, Thandavarayan RA, et al. ALDH2 inhibition potentiates high glucose stress-induced injury in cultured cardiomyocytes[J]. J Diabetes Res, 2016, 2016: 1390861. |
| [32] |
Kang PF, Wu WJ, Tang Y, et al. Activation of ALDH2 with low concentration of ethanol attenuates myocardial ischemia/reperfusion injury in diabetes rat model[J]. Oxid Med Cell Longev, 2016, 2016: 6190504. |
| [33] |
Yang H, Wang H, Liu Y, et al. The PI3K/Akt/mTOR signaling pathway plays a role in regulating aconitine-induced autophagy in mouse liver[J]. Res Vet Sci, 2019, 124: 317-20. DOI:10.1016/j.rvsc.2019.04.016 |
| [34] |
Guo Y, Yu W, Sun D, et al. A novel protective mechanism for mitochondrial aldehyde dehydrogenase (ALDH2) in type i diabetesinduced cardiac dysfunction: role of AMPK-regulated autophagy[J]. Biochim BiophysActa, 2015, 1852(2): 319-31. |
 2019, Vol. 39
2019, Vol. 39

