2. 宁夏医科大学总医院, 宁夏 银川 750004;
3. 宁夏医科大学, 宁夏 银川 750004;
4. 德州市第二人民医院, 山东 德州 253000
2. General hospital of ningxia Medical University, Yinchuan 750004, China;
3. Ningxia Medical University, Yinchuan 750004, China;
4. Dezhou Second People's Hospital, Dezhou 253000, China
目前在全球女性新发恶性肿瘤中, 乳腺癌新发病率约占25%, 已成为全球女性主要死亡原因; 在我国, 乳腺癌已成为威胁女性健康的主要恶性肿瘤[1-3]。乳腺癌的高发病率和死亡率主要原因是不能得到早期诊断及治疗。组蛋白甲基化转移酶参与多种生物学过程, 其中的一个类型为G9a, 称常染色质组蛋白赖氨酸N-甲基转移酶2, 为含有SET结构域的组蛋白甲基化转移酶成员之一, 主要催化组蛋白的位点是K9和K27[4-6]。G9a在多种恶性肿瘤中呈高表达, 其可能与肿瘤大小、浸润、转移、复发、患者预后情况等有密切关系[7]。G9a在乳腺癌的增殖及侵袭中起到不可忽视的作用[8-11], 有望成为乳腺癌诊断或治疗的靶点。但G9a在乳腺癌中表达情况及与乳腺癌发生发展的关系尚未明确, 本研究以此为切入点, 分析G9a在乳腺癌中表达情况及与其发生发展之间的关系。
1 资料和方法 1.1 材料 1.1.1 临床样本从宁夏医科大学总医院生物样本组织库中提取2016年10月~2017年10月收集的原发性乳腺癌组织122例和相对应的癌旁组织61例为研究对象, 122例患者均为女性, 平均年龄50岁。所有患者均经术后病理诊断确诊为原发性乳腺癌, 术前未行化疗、放射治疗或内分泌治疗。癌组织和癌旁组织均取自同一确诊乳腺癌患者, 留取的乳腺癌组织和癌旁组织(距肿瘤组织边缘大于5 cm)均在离体30 min内放入液氮保存, 收取标本时均告知患者留取标本将用于科研研究并签署知情同意书。
1.1.2 细胞株与主要试剂人乳腺正常上皮细胞MCF10A及乳腺癌细胞MCF7和MDA-MB-231细胞(美国ATCC细胞库)、转染试剂lipofectmin2000 (Invitrogen)、总RNA提取试剂盒、RNA反转录试剂盒和Real time PCR Taqman试剂(TaKaRa)均由国内试剂公司代购。G9a一抗(Abcam)、G9a二抗PV-9000 (中杉金桥)。
1.2 方法 1.2.1 免疫组织化学采用免疫组织化学PV-9000两步法, 所有组织标本常规用10%甲醛固定, 石蜡包埋, 制成3 μm切片, 按试剂盒说明书操作。选定一抗工作浓度为1:250。阳性结果判定:请两位病理学专家双盲法观察切片, 采用半定量[12-13]积分法判断结果:①按染色强度计分:无色为0分, 淡黄色为1分, 棕黄为2分, 黄褐色为3分; ②按阳性染色细胞百分率计分:阳性细胞数 < 10%为0分, 10%~25%为1分, >25%~50%为2分, >50%~75%为3分, >75%为4分[14]。将①×②的结果分为以下等级:0~3分为阴性(-), ≥ 4分为阳性(+)[15]。对照实验:以PBS代替一抗做空白对照, 用已知阳性切片作阳性对照。若两位专家结果相差3分则重新判定。
1.2.2 生物信息学方法分析乳腺癌组织中G9a的表达与患者预后的关系在肿瘤信息数据库Oncomine中, 对Breast Carcinoma数据集进行分析, 获取G9a在正常乳腺组织和乳腺癌组织中的表达差异, 将组间表达差异大2倍的样品资料纳入分析。在肿瘤预后分析数据库Kaplan-Meier Plotter中, 以mRNA表达为参考, 评价G9a mRNA表达水平与乳腺癌患者总生存率(OS)之间的关系。对G9a在乳腺癌组织中表达、预后相关性进行分析。
1.2.3 Real-time PCR检测G9a的表达按照RNA提取试剂盒说明书中步骤提取组织及细胞总RNA, 按RNA反转录试剂盒逆转录合成cDNA, 以cDNA为模板, 按照Real time PCR试剂盒说明书配制反应体系, 反应以U6为内参照, 在ABI-7300实时荧光定量仪上进行PCR扩增。反应条件为:95℃预变性3 min, 95℃变性12 s, 62℃退火40 s, 共40个循环。实验结果采用2-ΔΔCt法进行表达量相对定量分析。
1.2.4 MTT实验将经G9a抑制剂UNC0631处理后的乳腺癌细胞MDA-MB-231细胞和未经抑制剂处理的对照组细胞以85/mL的密度接种于96孔板中, 每孔加入200 μL细胞培养液置于37℃、5% CO2孵育箱中分别培养12、24、36和48 h后, 吸除培养液, 每孔加入10 μL的MTT后在37℃细胞培养箱内继续孵育, 1 h后每孔加DMSO 150 μL, 放置摇床慢速震荡30 min, 在酶标仪490 nm波长处测定各孔吸光度, 计算细胞增殖抑制率。每组平行重复6孔, 重复实验3次。
1.2.5 克隆形成实验收集对数生长期的乳腺癌细胞, 计数后铺于6孔板, 细胞密度为100/孔。将其置于细胞培养箱中正常培养, 2周后, 当细胞培养板中出现肉眼可见克隆时, 终止培养, 用PBS小心冲洗2次后, 用4%的中性甲醇固定细胞15 min后用瑞氏-吉姆萨复合染色液染色30 min, 流水缓慢洗涤后自然空气干燥。在显微镜下计数大于50个细胞的克隆数, 按照如下公式计算克隆形成率:克隆形成率=克隆数/接种细胞数×100%。
1.3 统计学分析采用Prism 7 (GraphPad)和SPSS 23.0统计软件进行分析, 所有实验至少3次重复。计数资料应用R×C列联表的χ2检验对统计结果进行检验分析, 计量资料以均数±标准差表示, 多组间比较采用单因素方差分析, 两组间比较时采用t检验。P < 0.05时差异有统计学意义。
2 结果 2.1 G9a在乳腺癌癌组织中的表达G9a主要表达于细胞核内, 以黄色、棕黄色着色为主(图 1)。G9a在人乳腺癌组织中的阳性表达明显高于其在癌旁组织中的表达, 阳性表达率分别为65.6% (80/122)和42.6% (26/61), 差异具有统计学意义(P < 0.05, 表 1)。
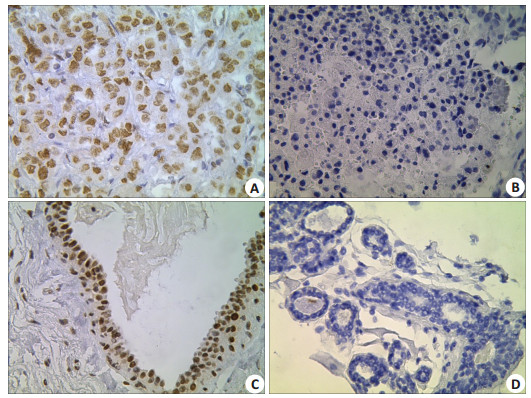
|
图 1 免疫组织化学检测G9a在人乳腺组织中的表达情况 Fig.1 Immunohistochemical detection of G9a expression in human breast tissue(PV × 400). A:Positive expression of G9a in breast cancer; B:Negative expression of G9a in breast cancer; C:Positive expression of G9a in paracancerous tissues; D:Nnegative expression of G9a in paracancerous tissues. |
| 表 1 G9a在乳腺癌组织和癌旁组织中的表达情况 Tab.1 Expression of G9a in breast cancer and adjacent tissue |
122例乳腺癌组织中, G9a表达与患者年龄、病理类型显著相关, 表达差异有统计学意义(P < 0.05);而在患者绝经状况、肿瘤家族史、肿瘤最大径、淋巴结转移、组织学分级、pTNM分期中等无统计学差异(P > 0.05, 表 2)。
| 表 2 G9a的表达与乳腺癌临床病理特征的关系 Tab.2 Relationship between G9a expression and clinicopathological features of breast |
在乳腺癌四种分子分型中, G9a在Luminal A型、Luminal B型、HER-2过表达型、三阴性中的阳性表达率差异具有统计学意义(P < 0.05, 表 3)。
| 表 3 G9a在乳腺癌不同分子分型中的表达情况 Tab.3 Expression of G9a in different molecular types of breast cancer |
在乳腺癌组织中, G9a的表达与Her-2、Ki-67及E-cadherin表达呈正相关, 差异均有统计学意义(P < 0.05)。而G9a的表达与ER、PR、AR、EGFR及CK5/6的表达无相关性, 差异均为统计学意义(P > 0.05, 表 4)。
| 表 4 G9a表达与免疫组化分子标记物的关系 Tab.4 Relationship between G9a expression and immunohistochemical molecular markers |
利用Oncomine肿瘤数据库分析网站对Breast Carcinoma数据集中G9a的表达水平进行分析, 结果(图 2A)显示:与对照组正常乳腺癌组织样品相比, 乳腺癌组织中G9a表达水平显著升高(P=0.0076)。在肿瘤预后评价数据库Kaplan-Meier Plotter中, 对G9a表达水平与预后相关性进行分析, 结果显示(图 2B):G9a表达水平与乳腺癌患者预后密切相关, 与低水平表达G9a的患者相比, 高水平表达G9a的患者其总生存率显著降低(P=0.026), 由此推测, G9a分子的高水平表达能够作为一项独立的乳腺癌预后测评因素。
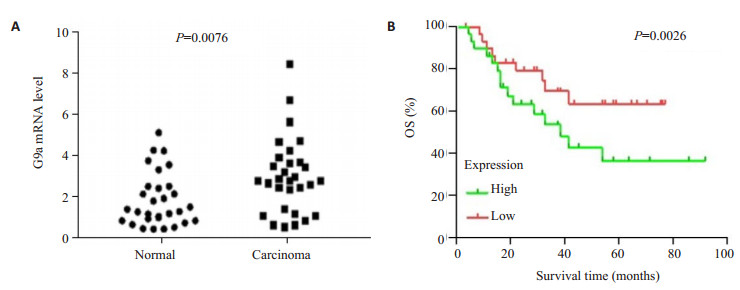
|
图 2 G9a在正常乳腺组织和乳腺恶性肿瘤组织中的表达情况及与乳腺恶性肿瘤患者预后的关系 Fig.2 Relative expression of G9a in normal tissues and breast cancer tissues and its correlation with the prognosis of breast cancer. A:G9a mRNA expression in breast cancer tissues and normal breast tissues; B:Survival rate of breast cancer patients with high or low G9a mRNA expression level. |
实时荧光定量PCR检测60例原发性乳腺癌患者癌组织和相匹配的癌旁组织及正常组织中miR-588的相对表达量。在乳腺癌组织中, 相对于管家基因U6, G9a相对的表达量明显高于癌旁及正常组织, 有显著性差异(P < 0.01, 图 3A)。其在乳腺癌细胞MCF7和MDA-MB-231中的相对表达量亦明显高于其在乳腺正常上皮细胞MCF10A中的相对表达量, 差异有统计学意义(P < 0.01, 图 3B)。
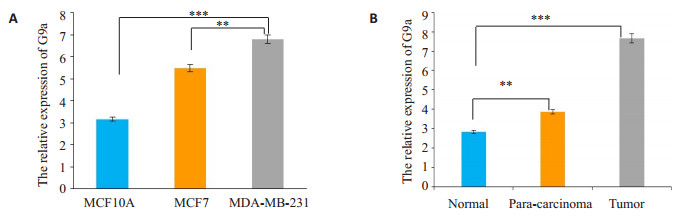
|
图 3 G9a在乳腺癌组织及细胞中的表达情况 Fig.3 Relative expression of G9a in breast cancer tissues and cells. G9a expression is significantly increased in breast cancer tissues (A) and breast cancer cell lines (B). Data are Mean±SD of 3 independent experiments. **P < 0.01, ***P < 0.001 by one-way ANOVA. |
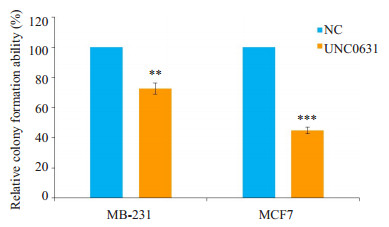
采用MTT实验检测G9a抑制剂UNC0631对乳腺癌MCF7和MDA-MB-231细胞增殖的影响。结果显示, 与阴性对照组相比, G9a抑制剂UNC0631抑制G9a活性后能明显抑制乳腺癌MCF7和MDA-MB-231细胞的体外增殖能力, 差异有统计学意义(P < 0.001, 图 4)。软琼脂克隆形成实验显示, G9a抑制剂UNC0631抑制G9a活性后能明显抑制MCF7和MDA-MB-231细胞克隆形成, 与阴性对照组相比, 差异有统计学意义(P < 0.01, 图 5)。
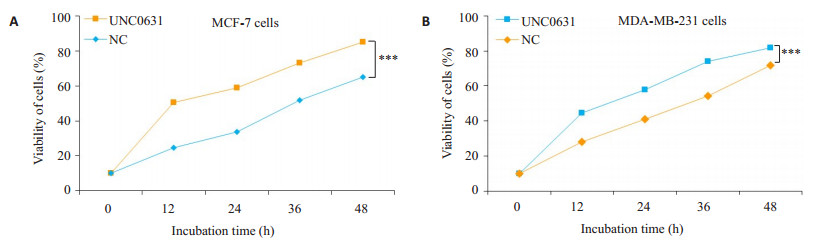
|
图 4 MTT实验检测G9a抑制剂UNC0631对乳腺癌细胞增殖的影响 Fig.4 Effect of UNC0631on the proliferation of breast cancer cells detected by MTT assay. A:MCF-7 cells; B:MDA-MB-231cells. Data are Mean±SD of 3 independent experiments. ***P < 0.001 by one-way ANOVA. |
|
图 5 克隆形成实验验证G9a抑制剂UNC0631对乳腺癌细胞增殖的影响 Fig.5 Effect of UNC0631 on proliferation of breast cancer cells detected by colony formation assay. G9a inhibitor UNC0631 dramatically reduced the number of surviving colonies from the MCF7 and MDA-MB-231 cells compared with the NC group. Data are the Mean±SD of three independent experiments. **P < 0.01, ***P < 0.001 by one-way ANOVA. |
乳腺癌已成为威胁全球女性健康的主要恶性肿瘤, 但目前乳腺癌的具体发病机制尚未明确。因此寻找有效诊疗靶点对于临床诊断和治疗以及预后有着重要的意义。随着研究的进展, 研究学者发现了一些与乳腺癌的诊断、预后和治疗新的相关基因, 并且获得了突破性的进展[16]。G9a因其参与了多种生物过程而日益受到重视, 越来越多的临床研究表明, G9a的表达在乳腺癌的形成及发展进程中有着不可忽视的作用, G9a可能会成为乳腺癌新的诊断或治疗靶点。
本验结果显示, G9a表达位于细胞核内, 在人乳腺癌组织中G9a的阳性表达率高于癌旁组织。相关研究表明, 在多种癌症组织中G9a呈高表达[17]。提示G9a的高表达在人乳腺癌的发生发展中可能起着肿瘤促进因子的作用。
为了进一步探讨G9a与乳腺癌的关系, 分析了G9a的表达与乳腺癌临床病理特征之间的关系。结果显示, G9a的表达与乳腺癌患者的年龄呈负相关性, G9a的阳性表达率在年龄≤ 35岁的乳腺癌的患者组中是最高的, 且随着年龄的增加, G9a的阳性表达率呈降低趋势。有研究显示, 乳腺癌患者在不同的年龄段, 其预后不同, 年龄小于35岁是乳腺癌一项独立预后因素, 年龄越小预后越差[18]。提示G9a可能与乳腺癌的发生发展以及乳腺癌的预后有关。
乳腺癌的病理类型很多, 按照国内采用的乳腺癌病理分型分类标准[1], 将纳入的病例按照乳腺原位癌、乳腺浸润性导管癌、乳腺浸润性小叶癌以及其他类型的乳腺癌进行比较分析, 结果显示G9a在不同的病理类型中表达具有差异性, 虽然在其他病理类型中G9a表达率最高, 但是其包含病理类型众多, 不易做出比较, 而G9a的阳性表达率在乳腺浸润性导管癌中为73.6%, 由此可以看出G9a在乳腺浸润性导管癌中的阳性表达较其他病理类型高。相关研究显示浸润性小叶癌具有较好的预后表型[19]。本研究显示G9a在浸润性小叶癌中的阳性表达率低于浸润性导管癌, 提示G9a可能与乳腺癌的预后不良有关。
相关研究表明乳腺癌的免疫组化检测指标对乳腺癌的诊疗以及分析其预后均具有重要意义[20]。为了更加深入的探究G9a在乳腺癌中作用, 进一步研究了G9a的表达与乳腺癌免疫组化的相关检测指标之间的关系。结果显示, G9a的表达与Her-2、Ki-67表达呈正相关性。相关研究报道Ki-67指标是乳腺癌预后不良的指标, 其阳性率越高, 肿瘤生长速度越快, 侵袭性越大, 转移的风险性越高[21-23]。另外Her-2也是判断乳腺癌预后的重要指标, Her-2阳性的乳腺癌的恶性程度高并且易发生复发和转移[24-25]。说明G9a在乳腺癌的发生发展中可能起着肿瘤促进因子作用, 并且可能与乳腺癌预后不良有关。另外实验显示, G9a的表达与E-cadherin表达明呈正相关性。研究表明E-cadherin表达位置位于细胞膜上, 在乳腺癌中其呈低表达或表达缺失, 起到抑癌基因的作用[26]。实验显示E-cadherin的阳性表达率为84.1%, 且以乳腺浸润性导管癌为主。实验显示G9a作用靶点位于细胞核内, 发挥其组蛋白甲基化转移酶的作用。G9a表达与E-cadherin表达呈正相关性可能是由于病理类型主要是浸润性导管癌的原因, 这与G9a在本研究中的浸润性导管癌中高表达相一致。或者有可能是由于在E-cadherin阳性表达的癌组织中高表达G9a, 以抑制E-cadherin的表达从而促进乳腺癌的发展。二者的关系需要进一步的基础实验研究进行验证。
根据ER、PR、Her-2及Ki-67增值指数的不同, 将乳腺癌按照分子分型分为4个亚型:Luminal A型、Luminal B型、Her-2过表达与三阴性[27]。且分子分型对于乳腺癌治疗十分关键[28]。本实验显示在四种乳腺癌分子分型中, G9a在Her-2过表达型乳腺癌中阳性表达率最高。这与实验中G9a表达与Her-2表达呈正相关是相一致的。相关研究发现在四种乳腺癌的分子分型中, Luminal A型乳腺癌是预后状况最好的类型, Her-2过表达型乳腺癌的恶性程度最高且预后较差[29-31]。提示G9a可能与乳腺癌的预后不良有关。
为了进一步研究G9a在乳腺癌组织中的表达及与预后相关性, 利用生物信息对其进行分析研究, 与此同时, 利用实时荧光定量PCR方法检测G9a的表达情况。结果显示, G9a在乳腺癌组织中呈高表达, 并且G9a的表达与乳腺癌的预后具有相关性, 在G9a高表达的乳腺癌组织中, 乳腺癌预后差。这与前面的免疫组化研究结果是相一致的。多项研究表明, G9a在多种癌症组织中是呈高表达, 并且与其预后具有密切相关性; 另外有研究表明G9a可作为卵巢癌转移的一项标志物[32]。由此推测, G9a的高表达可作为乳腺癌预后的一项独立预后因素。
肿瘤的发生发展是需要癌细胞不断增殖而逐渐发展的, 因此进行了G9a对乳腺癌细胞增殖影响的研究。采用MTT实验以及软琼脂克隆形成实验, 并利用G9a抑制剂UNC0631进行实验。结果显示, 对G9a活性进行抑制后, 可以明显抑制乳腺癌细胞的增殖能力。相关研究显示, 在结直肠癌中, 应用G9a抑制剂, 可以显著抑制结直肠癌的发展[33]由此推测, G9a对于乳腺癌发生发展具有重要作用, 其高表达可能促进乳腺癌的侵袭能力。
综上所述, 我们发现乳腺癌组织中G9a呈高表达, 且促进乳腺癌发生发展, 为乳腺癌预后不良的独立风险因素, 可为乳腺癌的早期诊断和治疗提供新的方向。本实验提示G9a在乳腺癌中起到不可忽视的作用, 但其具体作用机制尚未明确, 需后续实验进一步研究。
| [1] |
邵志敏, 沈镇宙, 徐兵河.
乳腺现代肿瘤学[M]. 上海: 复旦大学出版社, 2014: 20-7.
|
| [2] |
师金, 梁迪, 李道娟, 等. 全球女性乳腺癌流行情况研究[J].
中国肿瘤, 2017, 26(9): 683-90.
|
| [3] |
Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J].
Lancet Oncol, 2014, 15(7): e279-89.
DOI: 10.1016/S1470-2045(13)70567-9. |
| [4] |
Collins RE, Tachibana M, Tamaru H, et al. In vitro and in vivo analyses of a Phe/Tyr Switch controlling product specificity of histone lysine methyltransferases[J].
J Biol Chem, 2005, 280(7): 5563-70.
DOI: 10.1074/jbc.M410483200. |
| [5] |
马妮, 张昌军, 邓锴, 等. 常染色质组蛋白甲基化转移酶与哺乳动物生殖[J].
临床与病理杂志, 2017, 37(7): 1490-5.
|
| [6] |
Bittencourt D, Wu DY, Jeong KW, et al. G9a functions as a molecular scaffold for assembly of transcriptional coactivators on a subset of Glucocorticoid Receptor target genes[J].
Proc Natl Acad Sci USA, 2012, 109(48): 19673-8.
DOI: 10.1073/pnas.1211803109. |
| [7] |
袁芊芊, 贺鑫, 刘诗意, 等. 组蛋白甲基转移酶G9a的表观遗传调控在肿瘤发生中的作用[J].
中国组织化学与细胞化学杂志, 2017, 26(2): 191-6.
|
| [8] |
Chang CC, Wu MJ, Yang JY, et al. Leptin-STAT3-G9a signaling promotes Obesity-Mediated breast cancer progression[J].
Cancer Res, 2015, 75(11): 2375-86.
DOI: 10.1158/0008-5472.CAN-14-3076. |
| [9] |
Dong C, Wu Y, Yao J, et al. G9a interacts with Snail and is critical for Snail-mediated E-cadherin repression in human breast cancer[J].
J Clin Invest, 2012, 122(4): 1469-86.
DOI: 10.1172/JCI57349. |
| [10] |
Casciello F, Al-Ejeh F, Kelly G, et al. G9a drives hypoxia-mediated gene repression for breast cancer cell survival and tumorigenesis[J].
Proc Natl Acad Sci USA, 2017, 114(27): 7077-82.
DOI: 10.1073/pnas.1618706114. |
| [11] |
Huang J, Dorsey J, Chuikov S, et al. G9a and Glp methylate lysine 373 in the tumor suppressor p53[J].
J Biol Chem, 2010, 285(13): 9636-41.
DOI: 10.1074/jbc.M109.062588. |
| [12] |
郑荣辉, 管迅行, 张秀萍, 等. 乳腺癌PRL-R与ER、PR表达状况的关联性[J].
南方医科大学学报, 2010, 30(3): 596-8.
|
| [13] |
Nakashoji A, Matsui A, Nagayama A, et al. Clinical predictors of pathological complete response to eoadjuvant chemotherapy in triplenegative breast cancer[J].
Oncol Lett, 2017, 14(4): 4135-41.
DOI: 10.3892/ol.2017.6692. |
| [14] |
Hu L, Zang MD, Wang HX, et al. G9A promotes gastric cancer metastasis by upregulating ITGB3 in a SET domain-independent manner[J].
Cell Death Dis, 2018, 9(3): 278-92.
DOI: 10.1038/s41419-018-0322-6. |
| [15] |
许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J].
中国癌症杂志, 1996, 6(4): 229-31.
|
| [16] |
Ergün S, Ulasli M, Igci YZ, et al. The association of the expression of miR-122-5p and its target Adam10 with human breast cancer[J].
Mol Biol Rep, 2015, 42(2): 497-505.
DOI: 10.1007/s11033-014-3793-2. |
| [17] |
李淑芬, 李希. 组蛋白甲基转移酶G9a在表观遗传调控中的作用[J].
生命的化学, 2012, 32(4): 322-7.
|
| [18] |
Han W, Kim SW, Park IA, et al. Young age:an Independent risk factor for disease-free survival in women with operable breast cancer[J].
BMC Cancer, 2004, 4(1): 82.
DOI: 10.1186/1471-2407-4-82. |
| [19] |
刘思, 康宇娟, 宋健, 等. 乳腺浸润性小叶癌的诊断与治疗现状[J].
临床外科杂志, 2016, 24(3): 234-6.
DOI: 10.3969/j.issn.1005-6483.2016.03.025. |
| [20] |
刘红艳, 宋丰举, 雷蕾, 等. 1267例乳腺癌临床与免疫组化指标的相关性分析[J].
中国肿瘤临床, 2011, 38(11): 656-9.
DOI: 10.3969/j.issn.1000-8179.2011.11.015. |
| [21] |
Inwald EC, Klinkhammer-Schalke M, Hofstädter F, et al. Ki-67 is a prognostic parameter in breast cancer patients:results of a large population-based cohort of a cancer registry[J].
Breast Cancer Res Treat, 2013, 139(2): 539-52.
|
| [22] |
夏银娣, 朱慧庭, 王庆萍, 等. 乳腺癌患者Ki67指数的临床意义[J].
中国医刊, 2017, 52(1): 68-71.
DOI: 10.3969/j.issn.1008-1070.2017.01.022. |
| [23] |
Inari H, Suganuma N, Kawachi K, et al. Clinicopathological and prognostic significance of Ki-67 immunohistochemical expression of distant metastatic lesions in patients with metastatic breast cancer[J].
Breast Cancer, 2017, 24(6): 748-55.
DOI: 10.1007/s12282-017-0774-z. |
| [24] |
江泽飞, 邵志敏, 徐兵河. 人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识[J].
中华肿瘤杂志, 2010, 32(2): 158-60.
DOI: 10.3760/cma.j.issn.0253-3766.2010.02.018. |
| [25] |
Di Oto E, Brandes AA, Cucchi MC, et al. Prognostic impact of HER-2 Subclonal Amplification in breast cancer[J].
Virchows Archiv, 2017, 471(3): 313-9.
DOI: 10.1007/s00428-017-2151-x. |
| [26] |
邓淼, 刘江波, 刘起鹏, 等. E-钙黏蛋白在乳腺癌组织中的表达及其临床意义[J].
中华乳腺病杂志:电子版, 2015, 9(3): 182-7.
|
| [27] |
赵毅, 邓鑫. 乳腺癌分子分型与治疗策略[J].
中国实用外科杂志, 2015, 35(7): 704-8.
|
| [28] |
江泽飞, 许凤锐. 乳腺癌分子分型对治疗的影响[J].
中华普外科手术学杂志:电子版, 2015, 9(6): 12-5.
|
| [29] |
李双, 范红敏, 肖菲菲, 等. 不同分子分型及临床病理特征与乳腺癌术后患者预后的关系[J].
临床与实验病理学杂志, 2016, 32(1): 39-44.
|
| [30] |
刘钟芬, 陈创, 姚晓莉, 等. 乳腺癌不同分子分型的临床病理特点及预后分析[J].
中华医学杂志, 2016, 96(22): 1733-7.
DOI: 10.3760/cma.j.issn.0376-2491.2016.22.004. |
| [31] |
Hennigs A, Riedel F, Gondos A, et al. Prognosis of breast cancer molecular subtypes in routine clinical care:A large prospective cohort study[J].
BMC Cancer, 2016, 16(1): 734-43.
DOI: 10.1186/s12885-016-2766-3. |
| [32] |
Hua KT, Wang MY, Chen MW, et al. The H3K9 methyltransferase G9a is a marker of aggressive ovarian cancer that promotes peritoneal metastasis[J].
Mol Cancer, 2014, 13(1): 189-202.
DOI: 10.1186/1476-4598-13-189. |
| [33] |
Rao VK, Ow JR, Shankar SR, et al. G9a promotes proliferation and inhibits cell cycle exit during myogenic differentiation[J].
Nucleic Acids Res, 2016, 44(17): 8129-43.
DOI: 10.1093/nar/gkw483. |
 2019, Vol. 39
2019, Vol. 39

