2. 蚌埠医学院第一附属医院 肿瘤内科, 安徽 蚌埠 233000
2. Department of Medical Oncology, First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
急性冠脉综合征(ACS)是冠心病的一种严重类型, 也是临床常见的危重疾病, 主要包括不稳定型心绞痛(UAP)、非ST段抬高型心肌梗死(NSTEMI)和ST段抬高型心肌梗死(STEMI)。动脉粥样硬化(AS)是冠心病的共同病理改变, 而参与AS的发病机制非常复杂。近年来研究发现, 单核细胞与血管内皮细胞的粘附在AS的炎性发病过程中扮演着重要角色[1]。外周血单核细胞(PBMCs)粘附并活化血管内皮细胞, 同时释放大量炎性介质如C-反应蛋白(CRP)、白细胞介素(IL) -1β等, 介导局部或全身的慢性炎症反应, 参与AS的发生发展[2-3]。新近研究发现缝隙连接蛋白(Cx) 43在单核细胞与血管内皮细胞粘附这一过程中起重要作用[4], 提示Cx43可能参与AS的发生发展。然而目前关于Cx43与AS的相关性研究虽有报道, 但研究多针对心肌或内皮细胞上该蛋白表达水平的差异, 并且主要聚焦在AS的慢性进展阶段, 对于AS患者外周血单核细胞上, 尤其是AS不稳定或急性发病阶段患者外周血单核细胞上Cx43动态差异的关注较少。因此, 本研究拟以ACS中UAP和急性心肌梗死(AMI)患者为代表, 同时以健康体检非冠心病人群为对照, 检测3组人群血浆中IL-1β和hs-CRP的含量, 在明确UAP和AMI患者存在炎症激活的基础上, 观察3组受试者PBMCs中Cx43 mRNA和蛋白的表达水平变化, 以探讨Cx43与UAP和AMI的相关性并为冠心病的炎性发病机制研究提供新的理论基础。
1 资料和方法 1.1 研究对象选取2018年1月~2018年6月经门诊或急诊收住院的初诊ACS患者40例, 其中UAP患者20例, AMI患者20例, 以上患者入院后均经冠脉造影证实并成功实施冠脉内支架植入术。同时选取同期健康体检者20例, 均无冠心病病史及心绞痛相关症状, 标记为对照组。UAP诊断参考2011年美国心脏病学会基金会/美国心脏协会(ACCF/AHA)的诊断标准[5]。AMI诊断标准参考2012年ESC的诊断标准[6]。排除标准包括:(1)有明确的恶性肿瘤病史; (2)严重肝肾功能不全; (3)有明确的血液系统疾病; (4)有明确的免疫性疾病等炎性疾病; (5)有明确的甲亢等甲状腺疾病; (6)有其他引起胸痛的原因如肺栓塞、心肌病、主动脉瘤、心脏瓣膜病及充血性心力衰竭等; (7)上呼吸道、肝脏、肾脏等感染性疾病; (8)糖尿病等慢性代谢性疾病。研究经蚌埠医学院第一附属医院伦理委员会批准, 入选对象均签署了知情同意书。
1.2 样本制备清晨或急诊冠脉介入术前采集受试者空腹外周静脉血共约12 mL, 分为10 mL及2 mL两份, 肝素抗凝, 其中10 mmL采用Ficoll密度梯度离心法分离外周血单个核细胞, 用含2% FBS的PBS洗液洗涤, 悬浮细胞并计数, 取2.0×108单核细胞加入200 μL EasySep抗体正选试剂盒(Stemcell), 用移液器轻轻上下吹打均匀, 室温孵育15 min, 后加入100 μL EasySep纳米磁珠, 充分混匀后室温孵育10 min, 轻轻混匀后将试管放入专用磁极中静置5 min, 将磁极及试管一并取出并弃掉上清。用洗液重新混匀后重复以上过程2次。取约5×105个分选所得的CD14+单核细胞, 加入2.5 μL人CD14-PE抗体(eBioscience), 用抗鼠IgG单克隆抗体做同型对照, 4℃避光孵育30 min, 洗涤后用洗液悬浮细胞, 流式细胞仪检测, 计算CD14阳性率。另一份2 mL外周静脉血经2500×g离心5 min后收集上层血浆, -80℃冻存备用。
1.3 ELISA法检测外周血浆中IL-1β含量严格按照ELISA试剂盒说明书的步骤进行操作, 待检测样品及标准品均为复孔上样, 最后在酶标仪上读取450 nm处吸光值, 求平均值并建立标准曲线, 按照得出的公式计算出对应样品血浆中的IL-1β含量。
1.4 免疫比浊法检测外周血浆中hs-CRP含量使用Beckman Coulter AU5800型全自动生化分析仪检测血浆中hs-CRP的活性。检测采用免疫比浊法, hs-CRP检测试剂盒为宁波瑞源生物科技有限公司提供。
1.5 RNA提取和qRT-PCR采用Trizol法提取PBMCs总RNA, 提取后的RNA A260/A280均在1.8~2.0, 取1 μg RNA进行逆转录, 反应条件为:42℃ 1 h, 70℃ 5 min, 获得的cDNA按照试剂盒(TaKaRa)说明进行qRT-PCR反应。反应体系为: SYBR Green PCR Master Mix(2×) 10 μL, cDNA模板2 μL, 上、下游引物(10 μmol/L)各0.5 μL, ddH2O 7 μL, 反应总体积为20 μL。反应条件为:95℃预变性3 min, 循环参数95℃变性30 s, 55℃退火30 s, 72℃延伸30 s, 共40个循环, 72℃ 5 min终止反应。引物由上海生工合成, 以人β-actin为内参。Cx43引物序列为5'-GGCG TGAGGAAAGTACCAAA-3 ' (上游), 5'-ACGCCAAG TGATTGAACTCC-3 ' (下游), 产物大小为117 bps; β- actin引物序列为5'-CCTTCCTGGGCATGGAGTCCT G-3 ' (上游), 5'-GGAGCAATGATCTTGATCTTC-3 ' (下游), 产物大小为202 bps。qRT-PCR反应结束后取扩增产物进行2%琼脂糖凝胶电泳验证目的条带, 扩增结果采用2-ΔΔCt法分析。
1.6 Western blot提取PBMCs总蛋白, 采用BCA法测定蛋白含量, 每孔取20 μg蛋白95℃变性后上样, 十二烷基硫酸钠-聚丙烯酰胺凝胶100 V、200 mA电泳分离样品蛋白, 转印至PVDF膜, 用脱脂奶粉室温封闭1 h, 加入Cx43一抗(1:1000, Sigma), 置摇床4℃孵育过夜, 经PBST洗膜3次后加入HRP标记二抗(1:5000, Amersham), 37℃孵育, 室温振摇2 h。洗膜后取5 mL BCIP/NBT显色液(Invitrogen)按照显色试剂说明书进行显色。用Quality图像分析系统对蛋白条带进行灰度分析。β-actin的表达水平作为内参。
1.7 统计学方法实验结果用均数±标准差表示, 数据使用SPSS 17.0软件进行分析, 统计分析采用单因素方差分析和卡方检验, 各项检测两两比较采用Bonferroni检验, P < 0.05表示差异有统计学意义。
2 结果 2.1 一般临床资料比较各组年龄、性别、BMI、吸烟史、单核细胞计数、总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、载脂蛋白A、载脂蛋白B、尿酸水平等比较差异无明显统计学意义(P > 0.05);而UAP组和AMI组脂蛋白A较对照组明显升高(P < 0.05); AMI组白细胞计数、谷草转氨酶、谷丙转氨酶、肌酸激酶、肌酸激酶同工酶、乳酸脱氢酶、肌钙蛋白I较UAP组和对照组明显升高(P < 0.05, 表 1)。
| 表 1 患者基本临床资料 Tab.1 General clinical data of the patients in different groups (Mean±SD) |
与对照组相比, UAP组和AMI组患者血浆IL-1β水平升高(P < 0.001);且AMI组较UAP组IL-1β水平进一步升高(P < 0.001, 图 1A)。另外血浆中hs-CRP的含量与IL-1β变化趋势相一致, UAP组和AMI组患者血浆中hs-CRP水平较对照组升高(P < 0.001); AMI组血浆中hs-CRP水平较UAP组明显升高(P < 0.01, 图 1B)。
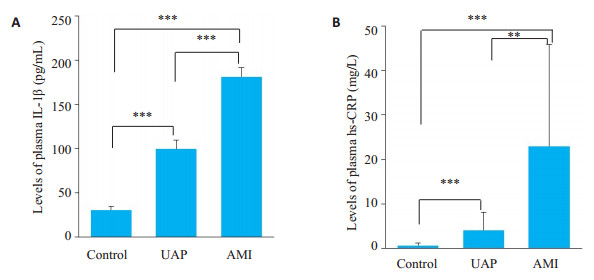
|
图 1 各组血浆IL-1β和hs-CRP含量比较 Fig.1 Plasma levels of IL-1β and hs-CRP in each group, **P < 0.01, ***P < 0.001. |
外周血单核细胞经CD14-抗体结合珠提纯并经流式鉴定, 结果显示各组CD14阳性细胞数均大于95% (图 2)。
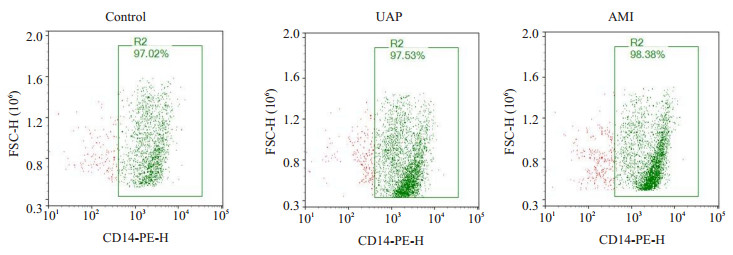
|
图 2 各组CD14+单核细胞流式鉴定结果 Fig.2 Flow cytometric identification of CD14+ monocytes in each group. |
RT-PCR结果显示UAP组Cx43 mRNA表达量较对照组明显升高(P < 0.001)。而AMI组Cx43 mRNA表达量较UAP组降低(P < 0.001), 且表达量低至对照组水平以下(P < 0.05, 图 3A)。此外蛋白表达与基因层面较为一致, 表现为UAP组Cx43蛋白表达量较对照组也明显升高(P < 0.001);但无论与对照组还是UAP组相比, AMI组Cx43蛋白表达量均有不同程度降低(P < 0.001, 图 3B)。
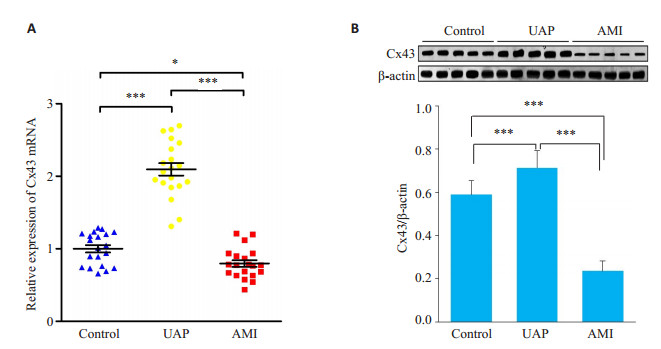
|
图 3 各组Cx43 mRNA和蛋白表达水平比较 Fig.3 mRNA and protein expression levels of Cx43 in each group, *P < 0.05, ***P < 0.001. |
冠心病在我国的发病率正逐年攀升, 并呈现年轻化趋势, 包括慢性冠脉疾病(CAD)和ACS。其中ACS包括UAP和AMI, 是冠状动脉粥样硬化病变急性进展期的临床表现。AS是冠心病共同的病理基础, 近年来越来越多的证据表明AS不仅仅是简单的脂质沉积, 也是一种慢性炎症性疾病, 且炎症参与AS斑块损伤、糜烂破溃、冠状动脉内血栓形成等过程[7]。
既往有临床资料显示, 血清中的炎症介质如hsCRP升高是心血管事件的重要预测因子[8]。此外, 近期一项临床研究显示, 给予AS患者抗IL-1β治疗后, CRP等炎症介质有不同程度降低, 心血管事件明显减少[9]。同时也有研究指出, 循环中的白细胞计数升高的AMI患者30 d及远期死亡风险显著升高, 且容易再发急性心血管事件[10]。而Liang等[11]的研究结果也提示白细胞计数可能是AMI患者冠脉损伤严重程度的独立预测因子。本研究我们发现, 与对照组相比, UAP组患者外周血浆中炎性指标IL-1β和CRP的含量明显升高, 并且在AMI组上述两个指标的表达水平进一步升高。此外, AMI组受试者外周静脉血中白细胞计数较UAP组和对照组均有明显升高。我们的研究结果与这些文献报道结果一致, 共同证实了UAP和AMI患者体内可能处于一定程度的炎症激活状态, 并且其激活程度与疾病的严重程度相关。
研究报道单核细胞与血管壁黏附并移行到内皮下是AS发生的关键步骤[12]。诸多因素与细胞粘附这一起始反应有关, 比如血流动力学的改变, 内皮细胞的损伤等[13-14]。这些因素均可以引起血管内皮细胞上粘附分子的改变, 并与单核细胞表面的受体(如LFA-1、VLA-4)结合后从而促使单核细胞粘附于血管内皮细胞表面[15-16]。单核细胞粘附于血管内皮细胞表面后, 在多种因素的影响下迁移进入内皮下间隙, 被激活后分化成为组织巨噬细胞, 不断吞噬脂质形成泡沫样细胞, 最终形成AS斑块[17]。而Cx43参与循环中单核细胞与血管内皮细胞粘附这一重要过程[4]。该蛋白属于Cx蛋白家族成员, 广泛表达于人体各个系统[18-19], 其异常表达与包括心血管疾病在内的多种疾病的发生发展密切相关[20]。有鉴于此, 本研究旨在探讨与健康对照人群相比, UAP和AMI患者PBMCs上Cx43的表达变化和意义。研究结果发现与对照组比较, Cx43的基因和蛋白表达量在UAP组均有明显增加。这一发现得到既往研究结果的支持。如有资料显示, 在AS发生的早期阶段, Cx43在血管内皮细胞和平滑肌细胞上的表达明显上调, 而其表达的变化影响了单核细胞向血管内膜下的迁移[21-22]。由于Cx43蛋白的C末端与细胞骨架蛋白紧密连接在一起, 因此Cx43表达增加导致迁移进入血管内膜的单核细胞明显增加; 而在单核细胞在分化成为泡沫细胞的过程中, Cx43表达增加也大大加强其吞噬脂质的能力[23]。另外还有报道显示, 纤维帽的稳定性同样与Cx43的表达存在密切联系[24-25]。因此不难推测PBMCs上Cx43的表达增加将可能对AS的恶性进展和转归产生影响。
然而我们还发现一个有趣的现象, 即Cx43在AMI患者PBMCs中的表达量较对照组和UAP组明显降低。而这一变化是否与AMI独特的发病机制有关联, 目前仍不得而知。曾有报道指出, 致炎因子如肿瘤坏死因子(TNF-α)、干扰素-γ (IFN-γ)等可以通过c-Jun氨基端激酶途径减少脊髓星形胶质细胞中Cx43的表达[26]。也有研究显示, 心肌细胞在缺血状态下可以通过自噬作用加速Cx43的降解[27]。同时也有学者认为, 特异性阻断Cx43半通道可以有效减少心肌缺血再灌注损伤[28]。这些结果在一定程度上提示Cx43的降低在疾病的某些阶段可能作为一种"保护因素"发挥效应。目前Cx43该表达模式发生的机制尚不明确, 结合本研究结果我们初步推测在AMI急性发作阶段时, 有可能由于机体产生了大量的炎性介质如IL-1β、CRP等, 通过一系列机制导致Cx43的表达减少, 这可能是机体自身的一种保护性机制的体现, 然而这一推测尚需更多研究进一步证实。
综上所述, 本文以UAP和AMI为冠心病典型代表, 通过检测PBMCs中的Cx43和血浆中IL-1β、CRP的表达水平, 证实了ACS患者存在不同程度的炎症激活, 并发现了Cx43在ACS不同类型患者中的表达量不同, 提示其在UAP和AMI发病中可能存在不同的作用或调控机制。未来寻找或设计改变Cx43表达的方法或途径, 可能为冠心病的临床治疗提供新思路及策略。
| [1] |
Libby P. Inflammation in atherosclerosis[J].
Nature, 2002, 420(6917): 868-74.
DOI: 10.1038/nature01323. |
| [2] |
Szekely Y, Arbel Y. A Review of interleukin-1 in heart disease: where do we stand today[J].
? Cardiol Ther, 2018, 7(1): 25-44.
|
| [3] |
Ridker PM, Hennekens CH, Buring JE, et al. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women[J].
N Engl J Med, 2000, 342(12): 836-43.
DOI: 10.1056/NEJM200003233421202. |
| [4] |
Yuan D, Wang Q, Wu D, et al. Monocyte-endothelial adhesion is modulated by Cx43-stimulated ATP release from monocytes[J].
Biochem Biophys Res Commun, 2012, 420(3): 536-41.
DOI: 10.1016/j.bbrc.2012.03.027. |
| [5] |
Wright RS, Anderson JL, Adams CD, et al. 2011 ACCF/AHA focused update of the guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction (Updating the 2007 Guideline):a report of the american college of cardiology foundation/american heart association task force on practice guidelines[J].
Circulation, 2011, 123(18): 2022-60.
DOI: 10.1161/CIR.0b013e31820f2f3e. |
| [6] |
Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation[J].
Eur Heart J, 2012, 33(20): 2569-2619.
DOI: 10.1093/eurheartj/ehs215. |
| [7] |
孙宇飞, 郭大璘. 炎症因子与冠心病关系的研究进展[J].
中国当代医药, 2017, 24(1): 12-5.
|
| [8] |
郜珊珊, 舒珊, 王丽君, 等. 看似正常者"外周血单个核细胞炎症因子的表达变化[J].
南方医科大学学报, 2014, 34(11): 1589-93.
|
| [9] |
Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory therapy with canakinumab for atherosclerotic disease[J].
N Engl J Med, 2017, 377(12): 1119-31.
DOI: 10.1056/NEJMoa1707914. |
| [10] |
Cannon CP, McCabe CH, Wilcox RG, et al. Association of white blood cell count with increased mortality in acute myocardial infarction and unstable angina pectoris. OPUS-TIMI 16 Investigators[J].
Am J Cardiol, 2001, 87(5): 636-639.
DOI: 10.1016/S0002-9149(00)01444-2. |
| [11] |
Liang Y, Chen H, Wang P. Correlation of leukocyte and coronary lesion severity of acute myocardial infarction[J].
Angiology, 2018, 69(7): 591-9.
DOI: 10.1177/0003319717740782. |
| [12] |
Jang Y, Lincoff AM, Plow EF, et al. Cell adhesion molecules in coronary artery disease[J].
J Am CollCardiol, 1994, 24(7): 1591-1601.
DOI: 10.1016/0735-1097(94)90162-7. |
| [13] |
Binder CJ, Chang MK, Shaw PX, et al. Innate and acquired immunity in atherogenesis[J].
Nat Med, 2002, 8(11): 1218-26.
DOI: 10.1038/nm1102-1218. |
| [14] |
Kuhlmann MT, Cuhlmann S, Hoppe I, et al. Implantation of a carotid cuff for triggering shear-stress induced atherosclerosis in mice[J].
J Vis Exp, 2012, 13(59): 3308.
|
| [15] |
Fotis L, Agrogiannis G, Vlachos IS, et al. Intercellular adhesion molecule (ICAM)-1 and vascular cell adhesion molecule (VCAM)- 1 at the early stages of atherosclerosis in a rat model[J].
In Vivo, 2012, 26(2): 243-50.
|
| [16] |
Wang L, Shirure VS, Burdick MM, et al. UVB-irradiation regulates VLA-4-mediated melanoma cell adhesion to endothelial VCAM-1 under flow conditions[J].
MolCarcinog, 2011, 50(1): 58-65.
|
| [17] |
Allahverdian S, Pannu PS, Francis GA. Contribution of monocytederived macrophages and smooth muscle cells to arterial foam cell formation[J].
Cardiovasc Res, 2012, 95(2): 165-72.
DOI: 10.1093/cvr/cvs094. |
| [18] |
Harris AL. Emerging issues of connexin channels:biophysics fills the gap[J].
Q Rev Biophys, 2001, 34(3): 325-472.
DOI: 10.1017/S0033583501003705. |
| [19] |
Harris AL. Connexin channel permeability to cytoplasmic molecules[J].
Prog Biophys Mol Biol, 2007, 94(1-2): 120-43.
DOI: 10.1016/j.pbiomolbio.2007.03.011. |
| [20] |
Zu L, Wen N, Liu C, et al. Connexin43 and myocardial ischemiareperfusion injury[J].
Cardiovasc Hematol Disord Drug Targets, 2018, 18(1): 14-6.
DOI: 10.2174/1871529X16666161227143644. |
| [21] |
Hou CJ, Tsai CH, Yeh HI. Endothelial connexins are downregulated by atherogenic factors[J].
Front Biosci, 2008, 13: 3549-57.
|
| [22] |
Johnson TL, Nerem RM. Endothelial connexin 37, connexin 40, and connexin 43 respond uniquely to substrate and shear stress[J].
Endothelium, 2007, 14(4-5): 215-26.
DOI: 10.1080/10623320701617233. |
| [23] |
Yuan D, Sun G, Zhang R, et al. Connexin 43 expressed in endothelial cells modulates monocyte endothelial adhesion by regulating cell adhesion proteins[J].
Mol Med Rep, 2015, 12(5): 7146-52.
DOI: 10.3892/mmr.2015.4273. |
| [24] |
Morel S. Multiple roles of connexins in atherosclerosis-and restenosis-induced vascular remodelling[J].
J Vasc Res, 2014, 51(2): 149-61.
DOI: 10.1159/000362122. |
| [25] |
Rama A, Matsushita T, Charolidi N, et al. Up-regulation of connexin43 correlates with increased synthetic activity and enhanced contractile differentiation in TGF-beta-treated human aortic smooth muscle cells[J].
Eur J Cell Biol, 2006, 85(5): 375-86.
DOI: 10.1016/j.ejcb.2005.11.007. |
| [26] |
Zhang FF, Morioka N, Kitamura T, et al. Proinflammatory cytokines downregulate connexin 43-gap junctions via the ubiquitinproteasome system in rat spinal astrocytes[J].
Biochem Biophys Res Commun, 2015, 464(4): 1202-8.
DOI: 10.1016/j.bbrc.2015.07.105. |
| [27] |
Martins-Marques T, Catarino S, Zuzarte M, et al. Ischaemiainduced autophagy leads to degradation of gap junction protein connexin43 in cardiomyocytes[J].
Biochem J, 2015, 467(2): 231-45.
DOI: 10.1042/BJ20141370. |
| [28] |
Wang N, De Vuyst E, Ponsaerts R, et al. Selective inhibition of Cx43 hemichannels by Gap19 and its impact on myocardial ischemia/reperfusion injury[J].
Basic Res Cardiol, 2013, 108(1): 309.
DOI: 10.1007/s00395-012-0309-x. |
 2019, Vol. 39
2019, Vol. 39

