2. 重庆医科大学附属儿童医院泌尿外科,重庆 400014
2. Department of Urology, Children's Hospital of Chongqing Medical University, Chongqing 400014, China
尿道下裂是男性常见的先天性外生殖器畸形之一,表现为尿道开口从阴茎头部向近端阴茎干及阴囊移位,常伴腹侧包皮缺失和尿道下弯[1],其发病率较高,每200~300个新生男婴中可发现一例,且呈逐年增长的趋势[2]。手术是目前治疗尿道下裂的唯一方法,但术后并发症如尿瘘、尿道狭窄等常不能避免,严重者甚至可并发终生性排尿困难、性功能障碍及心理疾病[3]。尿道下裂的病因尚不明确,主流认为受基因、环境和内分泌等因素共同影响,环境内分泌干扰物是目前研究的热点[4]。邻苯二甲酸二已酯(DEHP)作为一种环境内分泌干扰物,已证实能够诱导大鼠尿道下裂的发生[5]。目前对DEHP致尿道下裂的发生机制研究有限,仅有部分基因报道与尿道下裂相关,如ATF3、TGF-β[6-7]。作为遗传信息载体基因和生物功能蛋白质组连接的纽带,转录组能够全面快速获取特定组织在特定状态下的几乎所有转录本及基因序列,提供最全面的转录组信息,在医学领域受到广泛应用[8-9],然而大鼠胎鼠阴茎组织的转录组测序未见报道。本研究对GD16组与GD19组大鼠胎鼠阴茎进行转录组测序能够初步筛选正常尿道发育发生过程中形成的关键性基因和一些重要的信号传导通路,这将为研究DEHP致尿道下裂的发生机制奠定基础,提供新的思路。
1 材料和方法 1.1 试剂和主要仪器设备DEHP(分析纯度,浓度>99%,16114C),玉米油(阿拉丁),MafB单克隆抗体(Abcam,ab66506),β-actin抗体(中杉金桥),β-catenin抗体(Invitrogen, 71-2700),DAPIz,Cy3-山羊抗兔二抗,解剖显微镜,扫描电镜,硝酸纤维素(PVDF)膜,蛋白分子marker,磷酸盐缓冲液(PBS),甲醇,TBS等试剂,缓冲液均用双蒸水(ddH2O)配制。
1.2 实验动物40只未妊娠过的成年SD雌鼠[10~12周龄,体质量(210±20 g)]和80只成年SD雄鼠[12~16周,体质量(250±20 g)]购于重庆医科大学实验动物中心,实验动物使用许可证号SYXK(渝)20017-0001,并饲养于重庆医科大学附属儿童医院动物中心,实验动物使用许可证号SYXK(渝)2017-0012,昼夜交替12 h,温度、湿度适宜,饮用水和饲料无限制。饲养1周后,成年SD大鼠按雌:雄=1:2合笼,合笼次日清晨寻找阴栓,发现阴栓当日清晨记为妊娠期第0天(GD 0),继续常规条件下饲养。动物建模可参见文献[10]。将孕鼠随机分为4组(n=10),前两组为空白对照,分别于GD16与GD19剖宫产取SD大鼠雄性胎鼠阴茎组织,将收集好的胎鼠阴茎组织部分进行转录组测序,部分固定于多聚甲醛中。另两组分别予以玉米油[750 mg/(kg·d)]、DEHP[750 mg/(kg·d)]于GD12-GD19进行灌胃处理,GD19剖宫产取出胎鼠。10%水合氯醛(4.5 mL/kg)腹腔注射麻醉妊娠大鼠,剖宫产取出胎鼠后以有无睾丸组织判断雌雄,并取雄性胎鼠在解剖显微镜下判断有无尿道下裂。收集各组阴茎组织,将收集好的阴茎组织部分-80 ℃冻存,部分固定于4 ℃戊二醛中,部分固定于多聚甲醛中。
1.3 文库制备与测序提取各组阴茎组织样品总RNA,并使用DNase Ⅰ消化DNA后用带有Oligo(dT)的磁珠富集真核生物mRNA;在Themomixer中加入打断试剂将mRNA打断成短片段,以打断后的mRNA为模板合成一链cDNA,然后配制二链合成反应体系合成二链cDNA,并使用试剂盒纯化回收、粘性末端修复、cDNA的3'末端加上碱基“A”并连接接头,进行片段大小选择,然后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI SlepOnePlus Real-Time PCR System进行质量和产量检测,质检合格后送于深圳华大基因研究所使用lllumina HiSeqTM 2000平台进行测序。
1.4 转录重测序信息分析测序所得的数据raw reads进行质控(QC),通过质控后,过滤可能包含低质量序列、接头序列的杂质raw reads。过滤后的clean reads数据用工具HISAT和Bowtie2与参考序列作比对,GD16组、GD19组比对结果为clean reads与参考基因的平均比对率分别为85.11%、83.48%。通过第二次质控后,对测序结果进行基因定量分析、基于基因表达水平的各项分析(主成分、相关性、条件特异性表达、差异基因筛选等),并对筛选出的样品间差异表达基因(DEG)进行差异基因功能(GO)、pathway显著性富集分析。
1.5 阴茎组织形态学检查各组阴茎组织生理盐水清洗后置于4 ℃戊二醛中固定48 h,然后经脱水,喷金处理后在扫描电镜下观察组织形态。各组阴茎组织制成4.5 μm石蜡切片后进行HE染色:组织在室温条件下于多聚甲醛中固定48 h,经常规脱水、石蜡包埋、切片,60 ℃烤箱中烘烤12 h,再经二甲苯30 min×2次,无水乙醇5 min,95%乙醇5 min,85%乙醇5 min,75%乙醇5 min,自来水冲洗3 min,苏木素2 min,自来水冲洗1 min,盐酸酒精2 s,自来水冲洗1 min,饱和碳酸锂2 s,伊红2 min,95%乙醇10 s,无水乙醇2 min,二甲苯3 min,中性树脂封片。室温条件完全干燥后在光学显微镜下观察组织形态。
1.6 免疫荧光组织染色免疫荧光检测正常组GD16、正常组GD19、对照组及DEHP暴露组中Mafb的表达情况:组织石蜡切片脱蜡至水后,0.01 mmol/L枸橼酸盐微波修复抗原15 min,室温冷却后PBS冲洗10 min,3%H2O2孵育15 min后PBS冲洗5 min,0.2% TRITON打孔15 min后PBS冲洗10 min×3次,0.5%牛血清蛋白37 ℃封闭1 h,切片标本上滴加抗Mafb抗体(1:200)4 ℃过夜孵育,次日PBS冲洗10 min×3次,山羊抗兔荧光二抗(1:200)37 ℃避光孵育1 h,PBS冲洗10 min×3次,DAPI染核1 h,PBS冲洗10 min×3次,抗荧光淬灭剂封片后置于荧光显微成像系统拍照。
1.7 Western blot验证提取对照组、DEHP暴露组胎鼠阴茎组织总蛋白,并将两组蛋白在10%的十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)中进行电泳,电转到PVDF膜上,室温下50 g/L脱脂奶粉的TBST缓冲液封闭1 h,然后加入mafb一抗(1:1000)、β-actin一抗(1:1000)、β-catenin(1:1000),4 ℃过夜。次日用TBST冲洗10 min×3次,加入山羊抗兔二抗(1:5000),1 h后用TBST冲洗10 min×3次,最后进行ECL发光、拍照。使用Image J软件测算以上指标的实验结果的灰度值,比去内参β-actin的灰度值得到相对浓度后,再用统计软件进行统计。
1.8 统计学方法采用Graphpad prism7.0软件对数据进行统计分析,计量资料使用均数±标准差,两组间比较采用t检验,P < 0.05为差异有统计学意义;显著DEGs筛选采用NOISeq方法,计算出每个基因的差异倍数,以及偏离概率值,然后按照差异倍数≥2、同时偏离概率值≥0.8的默认标准,筛选出DEGs;同一基因不同组间采用独立样本t检验,以P < 0.05为差异有统计学意义。
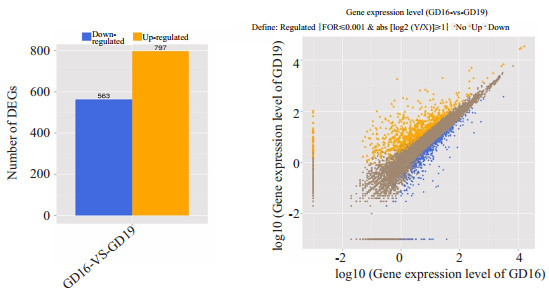
2 结果 2.1 DEGsGD19组较GD16组共1360个DEGs(其中上调797个,下调563个),显著差异表达基因统计图及差异对基因所有表达散点图(图 1)及部分差异表达基因(表 1)。
|
图 1 显著差异表达基因统计图及差异对所有基因表达散点图 Fig.1 Statistics and scatter plot of the differentially expressed genes (DEGs). |
| 表 1 部分上调和下调的差异基因(DEGs) Tab.1 Statistics of some of the up-regulated and down-regulated genes (DEGs) |
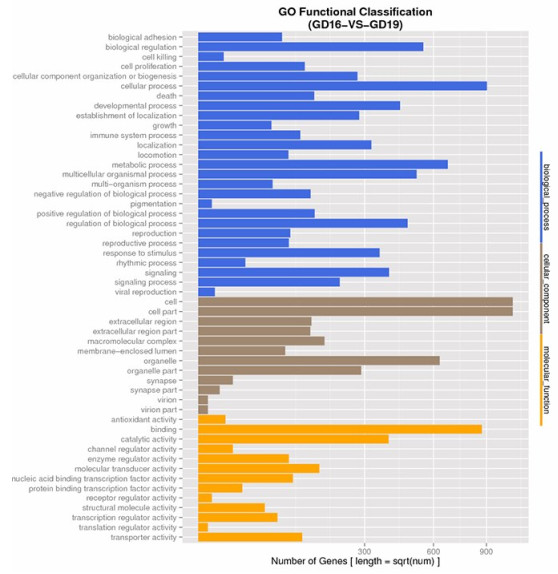
DEGs GO富集分析结果显示,DEGs功能涉及生物过程、细胞成分、分子功能多个方面,并主要富集于细胞过程、生物调节、细胞器成分、分子结合等方面(图 2)。
|
图 2 差异基因的GO功能显著性富集分析 Fig.2 GO functional classification of DEGs. |
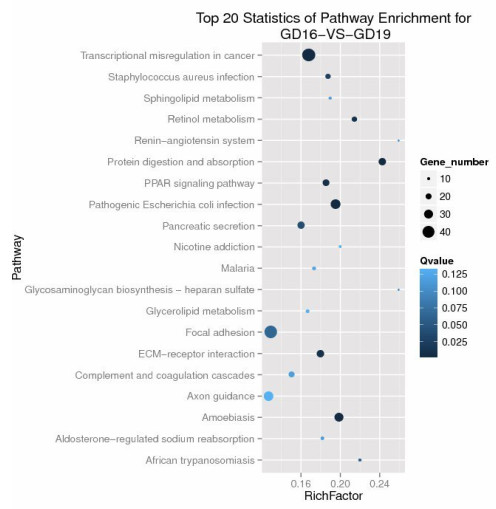
GD19组较GD16组进行通路显著性富集分析,可见DEGs参与多个信号通路,取前20条通路,差异基因基因显著富集可见于肾素-血管紧张素系统、细胞外基质受体相互作用、视黄醇代谢、粘着斑、蛋白质消化吸收和PPAR信号通路等方面(图 3)。
|
图 3 Pathway富集统计散点图 Fig.3 Statistics of pathway enrichment for GD16-vs-GD19 (top 20). |
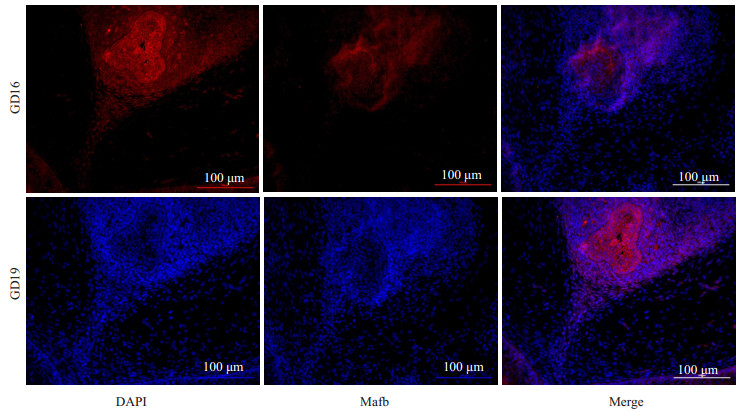
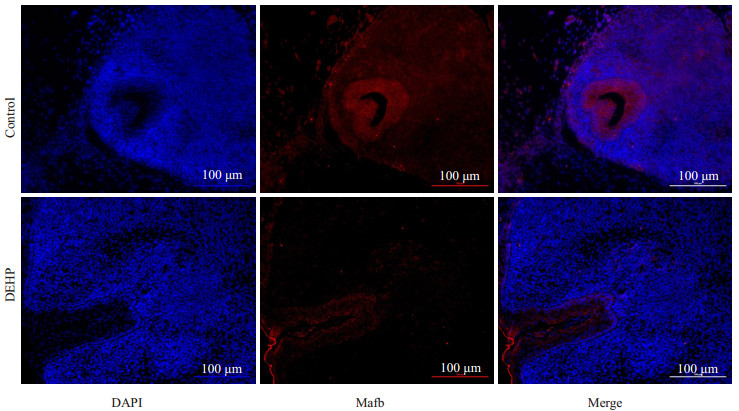
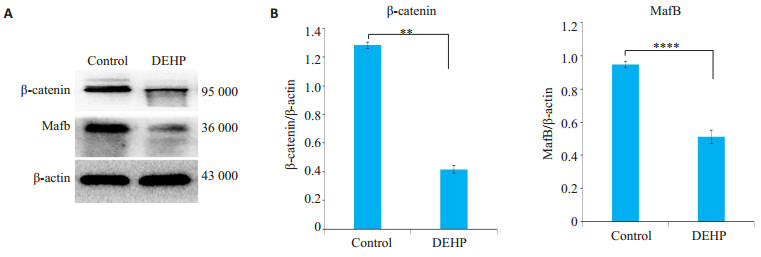
GD16与GD19组进行免疫荧光验证(图 4)。Control组与DEHP组进行免疫荧光验证(图 5)。对照组与DEHP暴露组胎鼠阴茎组织进行Western blot验证,DEHP暴露组Mafb较对照组表达显著降低(P < 0.01,图 6)。
|
图 4 GD 19组与GD 16组胎鼠阴茎组织尿道缝Mafb的免疫荧光 Fig.4 Immunofluorescence of Mafb in the urethral penis in GD16 group and GD19 group (Original magnification: ×200). |
|
图 5 DEHP暴露组与对照组胎鼠阴茎组织免疫荧光 Fig.5 Immunofluorescence of Mafb in the urethral penis in control group and DEHP group (×200). |
|
图 6 DEHP暴露组与对照组胎鼠阴茎组织Mafb和β-catenin western blot Fig.6 Western blotting of Mafb and β-catenin in fetal penis in control group and DEHP group. A: Western blotting of Mafb; B: Statistics of Mafb expression, **P < 0.01, ****P < 0.0001 |
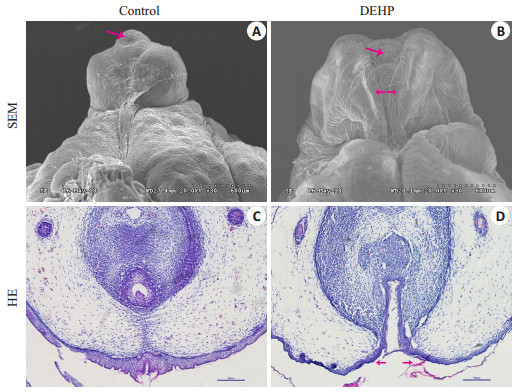
泌尿生殖系统发育在妊娠中晚期十分关键,妊娠19 d雄性SD大鼠阴茎组织已基本成型[11]。扫描电镜可见,正常对照组中,阴茎呈圆柱状,冠状沟清晰,阴茎头与阴茎体分界明显,龟头正中可见尿道开口(图 7A)。然而,在DEHP暴露组中,阴茎包皮发育障碍,腹侧呈现出深“V”结构,皱褶融合不能完全覆盖海绵体,尿道口位于阴茎腹侧(图 7B)。HE可见,正常组尿道板上皮已经在中线融合成尿道缝,中心尿道腔形成(图 7C),而DEHP暴露组尿道板上皮尚未在中线处接近融合,腹侧包皮发育障碍(图 7D)。
|
图 7 GD19雄性胎鼠阴茎形态学观察 Fig.7 Morphological observation of fetal penis at GD19. →: Urethral meatus; ← →: Failure of urethral fold fusion in DEHP exposed group. |
尿道下裂的发生受到环境和基因等方面因素共同影响[12-13],据文献报道,父母通过职业、环境接触环境内分泌干扰物能够增加胚胎患尿道下裂的风险[13-14]。在环境内分泌干扰物家族中,DEHP分布广、难降解。SD大鼠孕期在泌尿生殖发育的关键时期(GD12-19)暴露于DEHP其后代雄鼠可发生尿道下裂、隐睾、精子质量下降等障碍[15-16],但机制尚不清楚。本研究取GD16和GD19 SD大鼠胎鼠阴茎组织,采用转录组测序的方法,探究尿道正常发育过程中的差异基因,为进一步研究DEHP诱导尿道下裂的机制提供新的思路,同时构建对照组和DEHP暴露组SD大鼠模型,取GD19胎鼠阴茎组织,探究DEHP诱导尿道下裂的机制。
RNA-seq测序技术作为新一代的高通量测序,能够全面快速地获取某一物种某一功能状态下特定的细胞所能转录出来的所有转录本序列信息,从整体水平对特定生物学过程和疾病发生过程中的分子机制作出解释和说明[17]。在本课题组中,应用RNA-seq测序技术对GD16组和GD19组大鼠胎鼠阴茎组织进行转录组测序及数据分析,筛选DEHP致尿道下裂的相关基因。GD19组相较于GD16组检测中发现,上调差异基因有Il36g、Idi2、Defb4、Hsd17b14、Sprr3、Srd5a1、Serpinb2、Klk13、RGD1563060、Mafb、Sdr16c6、Serpinb13、Klk10、Defb1、Vsig8、Il36a等,下调差异基因有Fabp7、Sox11、Zic1、Wt1、Matn1、Zp2、Upk2、Matn3、Pnoc、Pnliprp1、Stmn3、Rit2、Zic4、Mab21l2、Clcnka等。这些差异基因主要富集于细胞过程、生物调节、细胞器成分、分子结合等方面。在对DGs的pathway显著富集性分析中,我们发现GD 19组胎鼠阴茎与GD16组胎鼠阴茎组织相比,差异基因主要涉及肾素-血管紧张素系统、细胞外基质受体相互作用、视黄醇代谢、粘着斑、蛋白质消化吸收和PPAR信号通路等方面。在这些信号通路中,已证实PPAR信号通路与尿道发育相关[18],视黄酸代谢信号通路可受具有生殖毒性的领苯二甲酸酯类破坏[19]。差异基因中部分已经得到了证实,如与Srd5a1同族的SRD5a2编码的5α-还原酶能够将睾酮转化为双氢睾酮,对正常尿道的发育发挥重要作用[20]。WT1基因的突变可导致尿道下裂在内的严重发育缺陷。Sox11同一家族的SRY、SOX9基因作为性别分化过程中起重要作用的因子,其缺失、突变将导致胎儿尿道融合过程提前终止,从而导致尿道下裂[21]。为了进一步验证测序结果的可靠性,我们选取了与雄激素相关的差异基因Mafb进行验证,发现Mafb的表达随着胚胎的发育而逐渐增加,与测序结果相符。然而在GD19胎鼠阴茎组织中,DEHP暴露较对照组Mafb表达显著降低。
孕期暴露于邻苯二甲酸酯致生殖异常的研究中发现雄激素及雄激素受体水平、雄激素信号通路是关键环节[22]。胚胎发育过程中,雄激素可诱导前列腺、阴茎等器官的形成[23],尿道下裂的发生也与雄激素及雄激素受体水平相关[1, 24],但其机制尚不明确。Mafb是一种基本的亮氨酸拉链(bZIP)转录因子,属于AP-1超家族[25-26]。文献报道Mafb表达于雄性生殖结节,受雄激素诱导调节,在雄激素受体敲除的小鼠中Mafb表达显著降低,Mafb敲除的雄性小鼠表现出与尿道下裂相似的尿道发育障碍[27]。此外也有研究报道Mafb与尿道下裂发生类似的唇腭裂相关[28-29]。然而,雄激素如何调控Mafb目前尚不清楚。有文献报道生殖结节区域同时表达Wnt信号和Mafb[30],我们在体内实验中首次发现,DEHP暴露组较正常对照组胎鼠阴茎组织β-catenin及Mafb表达显著降低(P < 0.0001),结合体外研究发现β-catenin的激活能够促进Mafb的表达[31],我们推测Wnt/β-catenin通路介导Mafb表达外生殖器的雄性化过程中发挥着重要作用,在DEHP干预的雄性胎鼠中,DEHP可能通过β-catenin通路影响Mafb表达发挥其抗雄激素效应,从而导致尿道下裂的发生。
本研究通过对SD大鼠胎鼠阴茎的转录组测序,发现了多个特异表达的基因,因而我们能可以从DEGs富集的信号通路来进一步研究正常尿道发育的相关机制,并为研究DEHP致尿道下裂的发生机制奠定基础。我们选取了差异基因Mafb进行验证,发现Mafb的表达随着胚胎的发育而逐渐增加。而在DEHP暴露致大鼠尿道下裂组中,Mafb及β-catenin表达较对照组显著下调,提示β-catenin通路影响Mafb表达可能在DEHP致大鼠尿道下裂发生中发挥重要作用。
| [1] |
Cunha GR, Sinclair A, Risbridger G, et al. Current understanding of hypospadias:relevance of animal models[J].
Nat Rev Urol, 2015, 12(5): 271-80.
DOI: 10.1038/nrurol.2015.57. |
| [2] |
Baskin LS, Ebbers MB. Hypospadias:anatomy,etiology,and technique[J].
J Pediatr Surg, 2006, 41(3): 463-72.
DOI: 10.1016/j.jpedsurg.2005.11.059. |
| [3] |
van der Horst HJ, de Wall LL. Hypospadias,all there is to know[J].
Eur J Pediatr, 2017, 176(4): 435-41.
DOI: 10.1007/s00431-017-2864-5. |
| [4] |
Kalfa N, Philibert P, Baskin LS, et al. Hypospadias:interactions between environment and genetics[J].
Mol Cell Endocrinol, 2011, 335(2): 89-95.
DOI: 10.1016/j.mce.2011.01.006. |
| [5] |
Thorup J, Nordenskjold A, Hutson JM. Genetic and environmental origins of hypospadias[J].
Curr Opin Endocrinol Diabetes Obes, 2014, 21(3): 227-32.
DOI: 10.1097/MED.0000000000000063. |
| [6] |
Liu X, Zhang DY, Li YS, et al. Di-(2-ethylhexyl) Phthalate Upregulates ATF3 Expression and Suppresses Apoptoisis in Mouse Genital Tubercle[J].
J Occup Health, 2009, 51(1): 57-63.
DOI: 10.1539/joh.L8091. |
| [7] |
Qian C, Dang X, Wang X, et al. Molecular mechanism of MicroRNA-200c regulating transforming growth factor-beta (TGFbeta)/SMAD family member 3(SMAD3) pathway by targeting Zinc finger E-Box binding homeobox 1(ZEB1) in hypospadias in rats[J].
Med Sci Monit, 2016, 22(2016): 4073-81.
|
| [8] |
Ren S, Peng Z, Mao JH, et al. RNA-seq analysis of prostate cancer in the Chinese population identifies recurrent gene fusions,cancerassociated long noncoding RNAs and aberrant alternative splicings[J].
Cell Res, 2012, 22(5): 806-21.
DOI: 10.1038/cr.2012.30. |
| [9] |
Barseghyan H, Symon A, Zadikyan M, et al. Identification of novel candidate genes for 46,XY disorders of sex development (DSD) using a C57BL/6J-Y-POS mouse model[J].
Biol Sex Differ, 2018, 9(1): 8.
DOI: 10.1186/s13293-018-0167-9. |
| [10] |
Li MY, Qiu L, Zhang YY, et al. Dose-related effect by maternal exposure to di-(2-ethylhexyl) phthalate plasticizer on inducing hypospadiac male rats[J].
Environ Toxicol Pharmacol, 2013, 35(1): 55-60.
DOI: 10.1016/j.etap.2012.10.006. |
| [11] |
Kluth D, Fiegel HC, Geyer C, et al. Embryology of the distal urethra and external genitals[J].
Semin Pediatr Surg, 2011, 20(3): 176-87.
DOI: 10.1053/j.sempedsurg.2011.03.003. |
| [12] |
Bouty A, Ayers KL, Pask A, et al. The genetic and environmental factors underlying hypospadias[J].
Sex Dev, 2015, 9(5): 239-59.
DOI: 10.1159/000441988. |
| [13] |
Kalfa N, Paris F, Philibert P, et al. Is hypospadias associated with prenatal exposure to endocrine disruptors?a French collaborative controlled study of a cohort of 300 consecutive children without genetic defect[J].
Eur Urol, 2015, 68(6): 1023-30.
DOI: 10.1016/j.eururo.2015.05.008. |
| [14] |
Giordano F, Abballe A, De Felip E, et al. Maternal exposures to endocrine disrupting chemicals and hypospadias in offspring[J].
Birth Defects Res A Clin Mol Teratol, 2010, 88(4): 241-50.
|
| [15] |
Wang YA, Liu W, Yang Q, et al. Di (2-ethylhexyl) phthalate exposure during pregnancy disturbs temporal sex determination regulation in mice offspring[J].
Toxicology, 2015, 336(2015): 10-6.
|
| [16] |
Foster PM. Disruption of reproductive development in male rat offspring following in utero exposure to phthalate esters[J].
Int J Androl, 2006, 29(1): 140-7.
DOI: 10.1111/ija.2006.29.issue-1. |
| [17] |
Hrdlickova R, Toloue M, Tian B. RNA-Seq methods for transcriptome analysis[J].
Wiley Interdiscip Rev RNA, 2017, 8(1): 10.
|
| [18] |
Mansour MM, Goyal HO, Braden TD, et al. Activation of penile proadipogenic peroxisome Proliferator-Activated receptor gamma with an estrogen:interaction with estrogen receptor alpha during postnatal development[J].
PPAR Res, 2008, 2008: 651419.
|
| [19] |
Chen Y, Reese DH. Disruption of Retinol (Vitamin A) Signaling by Phthalate Esters:SAR and Mechanism Studies[J].
PloS one, 2016, 11(8): e0161167.
DOI: 10.1371/journal.pone.0161167. |
| [20] |
Suzuki H, Matsushita S, Suzuki K, et al. 5alpha-Dihydrotestosterone negatively regulates cell proliferation of the periurethral ventral mesenchyme during urethral tube formation in the murine male genital tubercle[J].
Andrology, 2017, 5(1): 146-52.
DOI: 10.1111/andr.12241. |
| [21] |
Koehler B, Lin L, Mazen I, et al. The spectrum of phenotypes associated with mutations in steroidogenic factor 1(SF-1,NR5A1,Ad4BP) includes severe penoscrotal hypospadias in 46,XY males without adrenal insufficiency[J].
Eur J Endocrinol, 2009, 161(2): 237-42.
DOI: 10.1530/EJE-09-0067. |
| [22] |
Rider CV, Wilson VS, Howdeshell KL, et al. Cumulative effects of in utero administration of mixtures of "antiandrogens" on male rat reproductive development[J].
Toxicol Pathol, 2009, 37(1): 100-13.
DOI: 10.1177/0192623308329478. |
| [23] |
Murashima A, Kishigami S, Thomson A, et al. Androgens and mammalian male reproductive tract development[J].
Biochim Biophys Acta, 2015, 1849(2): 163-70.
DOI: 10.1016/j.bbagrm.2014.05.020. |
| [24] |
Wang MH, Baskin LS. Endocrine disruptors,genital development,and hypospadias[J].
J Androl, 2008, 29(5): 499-505.
DOI: 10.2164/jandrol.108.004945. |
| [25] |
Moriguchi T, Hamada M, Morito N, et al. MafB is essential for renal development and F4/80 expression in macrophages[J].
Mol Cell Biol, 2006, 26(15): 5715-27.
DOI: 10.1128/MCB.00001-06. |
| [26] |
Kataoka K, Fujiwara KT, Noda M, et al. MafB,a new Maf family transcription activator that can associate with Maf and Fos but not with Jun[J].
Mol Cell Biol, 1994, 14(11): 7581-91.
DOI: 10.1128/MCB.14.11.7581. |
| [27] |
Suzuki K, Numata T, Suzuki H, et al. Sexually dimorphic expression of Mafb regulates masculinization of the embryonic urethral formation[J].
Proc Natl Acad Sci USA, 2014, 111(46): 16407-12.
DOI: 10.1073/pnas.1413273111. |
| [28] |
Beaty TH, Murray JC, Marazita ML, et al. A genome-wide association study of cleft lip with and without cleft palate identifies risk variants near MAFB and ABCA4[J].
Nat Genet, 2010, 42(6): 525-9.
DOI: 10.1038/ng.580. |
| [29] |
Joss SK, Paterson W, Donaldson MD, et al. Cleft palate,hypotelorism,and hypospadias:Schilbach-Rott syndrome[J].
Am J Med Genet, 2002, 113(1): 105-7.
DOI: 10.1002/(ISSN)1096-8628. |
| [30] |
Miyagawa S, Satoh Y, Haraguchi R, et al. Genetic interactions of the androgen and Wnt/beta-Catenin pathways for the masculinization of external genitalia[J].
Mol Endocrinol, 2009, 23(6): 871-80.
DOI: 10.1210/me.2008-0478. |
| [31] |
Matsushita S, Suzuki K, Ogino Y, et al. Androgen regulates Mafb expression through its 3'UTR during mouse urethral masculinization[J].
Endocrinology, 2016, 157(2): 844-57.
DOI: 10.1210/en.2015-1586. |
 2019, Vol. 39
2019, Vol. 39

