2. 中南大学湘雅医院神经内科,湖南 长沙 410008
2. Department of Neurology, Xiangya Hospital, Central South University, Changsha 410008, China
肌萎缩侧索硬化(ALS)是运动神经元疾病中常见的类型,以上下运动神经元同时受累为特征。ALS根据起病部位不同,可分为肢体起病型和延髓起病型。ALS发病机制较为复杂,临床上缺乏ALS疾病诊断或疗效监测的特异性标志物,患者常被误诊为颈椎病、腰椎病、多灶性运动神经病等疾病而延误治疗,加重患者痛苦[1],因此,探寻ALS的发病机制并寻找诊断该疾病的标志物将有利于早期诊断和干预治疗。近年来研究发现,蛋白质的错误折叠和聚集是ALS的发病原因之一[2-3],其中还有研究显示,多种蛋白质在ALS患者体内存在异常表达,如过量表达、磷酸化以及免疫缺陷等,这些都可能导致神经细胞的代谢异常,进而导致神经元的退行性变。蛋白质组学是以蛋白质组为对象,研究细胞、组织或生物体蛋白质组成及其变化规律的科学[4-5]。随着高精度、高灵敏度的快速扫描质谱仪的出现及微量蛋白质组样品高效分离技术的进步,蛋白质组学迅速发展。串联质谱标签(TMT)是利用化学标签通过串联质谱对不同样品中的蛋白进行同时鉴定和定量的研究方法,已广泛应用于蛋白质组学研究。但是目前关于采用TMT从蛋白质组学层面研究ALS患者脑脊液(CSF)中的差异性表达蛋白较少,且以往研究仅揭示了ALS肌细胞基因变异和蛋白质合成的部分变化,不能反映ALS疾病的发生发展[6]。基于此本研究选取5例肢体起病ALS患者和5例延髓起病ALS患者为研究对象,并以5例健康者为对照,利用TMT技术联合LC-MS/MS对患者CSF蛋白质组学进行质谱检测,筛选延髓起病和肢体起病ALS患者CSF中的差异性表达蛋白,并进行GO富集、KEGG通路注释等生物信息学分析,探讨差异性表达蛋白参与的分子通路,为探索ALS的致病机制和寻找ALS诊断的标志物奠定基础。利用TMT技术对肢体起病、延髓起病肌萎缩侧索硬化(ALS)患者及健康对照脑脊液(CSF)进行蛋白表达谱分析,筛选差异表达蛋白,进而探寻肢体起病和延髓起病ALS的发病机制。
1 资料和方法 1.1 一般资料选取2017年11月~2018年4月于中国人民解放军联勤保障部队第928医院和中南大学湘雅医院神经内科就诊的10例ALS患者为研究对象,其中5例延髓起病ALS患者和5例肢体起病ALS患者。延髓起病ALS患者男性4人,女性1人,平均年龄60.2岁,平均病程9.0月,均无ALS家族史。肢体起病ALS患者男性4人,女性1人,平均年龄57.3岁,平均病程8.0月,均无ALS家族史。延髓起病ALS患者纳入标准:(1)ALS诊断标准符合世界神经病学联盟2000年修订的E1 Escorial标准[5];(2)以延髓症状起病。肢体起病ALS患者纳入标准:(1)ALS诊断标准符合世界神经病学联盟2000年修订的E1 Escorial标准;(2)以肢体症状起病。排除标准:(1)合并其他神经系统变性疾病患者;(2)合并脑外伤、肿瘤、副肿瘤综合征患者;(3)合并严重内科疾病者;(4)就诊前3个月内接受利鲁唑、抗炎等药物治疗患者。同时收集同时期在本院就诊的5例偏头痛及低颅压头痛的患者为健康对照,其中偏头痛患者3例,低颅压头痛患者2例,男性3人,女性2人,平均年龄58.4岁,平均病程6.0月。3组在年龄、性别和病程等方面无统计学差异。该研究通过中南大学湘雅医院伦理委员会批准,所有受试者均对本研究知情,并自愿签署了知情同意书。
1.2 实验试剂和仪器BCA试剂盒(碧云天);TMT试剂盒(Thermo);ProteoMiner protein enrichment试剂盒(Bio-Rad)。测序级胰蛋白酶(普洛麦格);白蛋白/IgG去除试剂盒(Pierce);TEBA(Sigma)。
水平旋转摇床(其林贝尔);水浴锅(泰坦);高速离心机,(Thermo);C18反相色谱柱(生科泰源);Orbitrap质谱仪(Thermo)。
1.3 蛋白提取、定量及SDS-PAGE电泳所有受试者利多卡因局部麻醉后行腰椎穿刺,留取3 mL CSF分装于1.5 mL EP管中,-80 ℃保存备用。按照ProteoMiner protein enrichment试剂盒操作说明去除高丰度蛋白质,然后BCA法测定蛋白浓度。每个样品取20 μg蛋白质至1.5 mL EP管中,再加入5 μL上样缓冲液(4×),加入2% SDS补充总体积为20 μL,100 ℃煮沸变性5 min,离心取上清液进行SDS-PAGE电泳。电泳结束后,考马斯亮蓝R250室温染色2h,脱色至背景无色,条带清晰。
1.4 蛋白酶解、TMT标记和HPLC分级蛋白溶液中加入终浓度为5 mmol/L的二硫苏糖醇,37 ℃孵育1 h。然后加入终浓度为11 mmol/L的碘代乙酰胺,室温避光孵育45 min。加入100 mmol/L的TEBA稀释蛋白质样品使其尿素浓度低于2 mol/L。按照质量比1:50(胰酶:蛋白)加入胰蛋白酶,37 ℃酶解过夜。酶解之后,再以质量比1:100(胰酶:蛋白)加入胰蛋白酶继续酶解4 h。
使用Strata X C18 SPE柱将酶解后的肽段脱盐,之后真空冷冻干燥。将肽段溶于0.5 mol/L的TEAB溶液中,严格依据TMT试剂盒操作说明对肽段进行标记。标记后的肽段混合去盐,真空冷冻干燥。使用高PH反向HPLC对肽段混合物分级。色谱柱为Agilent 300Extend C18(长度250 mm,内径4.6 mm,粒径5 μm)。肽段分级梯度:2%~60%乙腈,pH 10.0,80 min分离80个组分,随后肽段合并为18个组分,合并后的组分经真空冷冻干燥后保存备用。
1.5 液相色谱-质谱联用分析采用流动相A相(0.1%甲酸和2%乙腈混合的溶液)溶解肽段,EASY-nLC 1000超高效液相系统分离肽段。流动相B相为0.1%甲酸和90%乙腈混合溶液。液相梯度设置:0~26 min,6%~23%流动相B相;26~34 min,23%~36%流动相B相;34~37 min,36%~80%流动相B相;37~40 min,80%流动相B相,流速400 nL/min。
肽段被分离后注入NSI离子源中电离,再由Q ExactiveTM plus质谱分析。离子源电压阈值为2.0 kV,使用高分辨Obitrap对肽段母离子及其二级碎片进行检测和分析。其中,一级质谱扫描范围350~1800 m/z,分辨率70 000;二级质谱扫描范围恒定100 m/z,分辨率17 500。使用数据依赖型扫描程序采集数据:在一级扫描中筛选出信号强度最高的20肽段母离子依次进入HCD碰撞池进行碎裂(35%的碎裂能量),二级质谱分析方法与一级相同。为提高质谱分析效率和避免母离子重复扫描,设置自动增益控制为5E4,信号阈值5000离子/S,最大注入时间为200 ms,串联质谱扫描动态排除时间15 s。
1.6 数据库检索使用Maxquant(v1.5.2.8)进行二级质谱数据检索。采用Swissprot Homo sapiens数据库进行检索,同时增加反库用于计算随机匹配造成的假阳性率(FDR),添加常见的污染库用于消除污染蛋白对结果的影响。酶切方式为Trypsin/P,漏切位点数为2,肽段修饰数最大为5,肽段最小长度为7个氨基酸残基。一级质谱母离子的质量精度设置为10 ppm,二级碎片离子的质量精度为0.02 Da。定量方法为TMT-6plex,蛋白质、肽段和修饰位点的FDR阈值均为1%。
1.7 生物信息学分析使用Uniport-GOA数据库(www.http://www.ebi.ac.uk/GOA/)进行基因本体(Gene Ontology,GO)注释分析。先将可鉴定蛋白质ID转换为UniPot ID,之后与GO ID匹配,再根据GO ID获取相关信息。若UniProtGOA数据库未收录,使用InterProScan软件分析蛋白GO功能。从生物学过程、细胞组分和分子功能3个方面进行GO注释分析。蛋白质通路使用KEGG通路数据库进行注释:使用KEGG的在线服务工具KAAS对提交的蛋白进行注释,然后将注释后的蛋白通过KEGG mapper匹配到相应通路中。
2 结果 2.1 蛋白质谱鉴定结果在CSF中共鉴定出1732个蛋白质,其中1530种蛋白可以进行定量检测。设定某一蛋白相对于对照组比值变化大于倍数1.2(上调或下调)且P < 0.05为差异表达性蛋白。延髓起病ALS患者CSF中48种蛋白表达上调,6种蛋白表达下调。肢体起病ALS患者CSF中16种蛋白表达上调,19种蛋白表达下调。
2.2 差异性蛋白GO分析从生物过程、细胞组成、分子功能3个方面对延髓起病和肢体起病ALS患者CSF中蛋白进行GO分析(表 1~3)。
| 表 1 ALS患者CSF中蛋白参与生物过程的种类 Tab.1 Functional classification of the proteins involved in the biological processes in CSF of patients with ALS |
| 表 2 ALS患者CSF中蛋白在细胞组成中的分类 Tab.2 Distribution of the proteins detected in the CSF in ALS patients |
| 表 3 ALS患者CSF中蛋白在分子功能中的分类 Tab.3 Molecular functional classification of the proteins in CSF proteins in ALS patientss |
延髓起病ALS患者CSF中上调蛋白细胞成分富集在固有膜、细胞突触、溶酶体膜、液泡膜、树突和色素粒等部分。分子功能主要富集在糖苷酶活性、α-葡糖苷酶活性、神经营养因子受体活性、水解酶活性、未折叠蛋白结合及细胞支架的组成等。生物学进行富集在调节轴突的形成及运输、参与微管介导的运输、调节细胞分化的形态、调节神经系统的发生和发育、参与碳水化合物代谢过程、调节细胞分化和发育及参与摄食行为等(图 1A)。延髓起病ALS患者CSF中下调蛋白调蛋白生物进程主要富集在刺激反应和免疫反应(图 1B)。
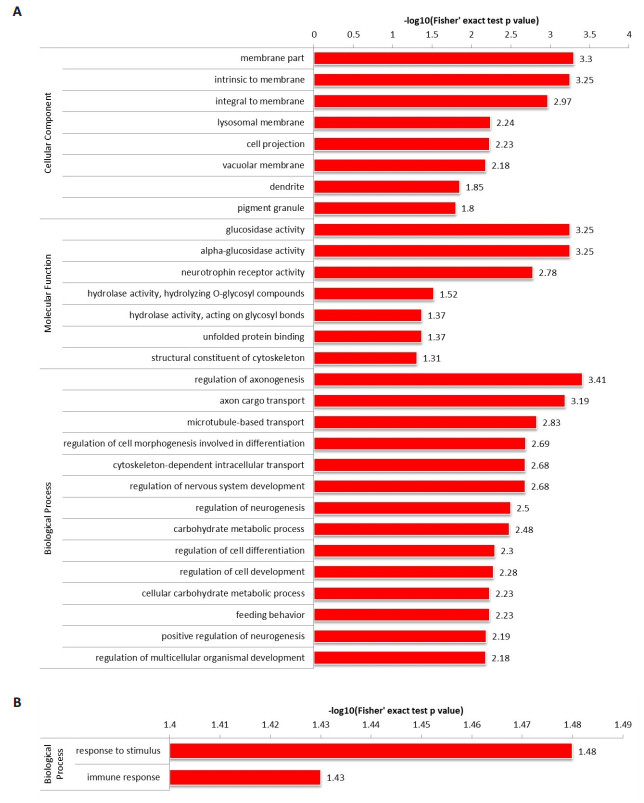
|
图 1 延髓起病ALS患者CSF中蛋白在GO二级注释中的分布情况 Fig.1 Distribution of the up-regulated (A) and down-regulated (B) proteins in GO secondary notes from the CSF of ALS patients with medullary onset disease. |
肢体起病ALS患者CSF中上调蛋白细胞成分主要富集在内膜系统、内质网膜、核外膜和囊泡膜上。生物过程富集在调节淋巴细胞的活性和离子的平衡、调节白细胞的活性、增强吞噬细胞的吞噬活性及内皮细胞的生长、调节轴突运输和微管介导的运输和正向调节脂质合成过程及炎性反应(图 2A)。肢体起病ALS患者CSF中下调蛋白细胞成分富集在胶质、溶酶体腔、胞外区和细胞外基质。分子功能富集在半胱氨酸内肽酶活性。生物过程富集在调节免疫应答、防御反应和固有免疫,正向调节免疫反应,促进补体激活,调节应激反应,激活蛋白级联反等(图 2B)。
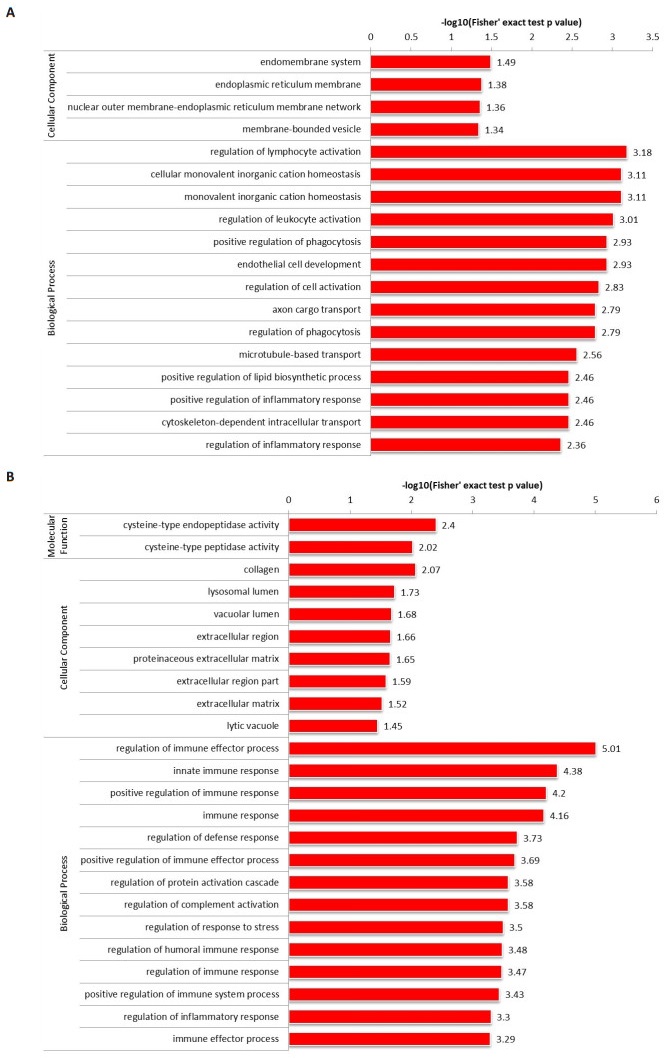
|
图 2 肢体起病ALS患者CSF中蛋白在GO二级注释中的分布情况 Fig.2 Distribution of the up-regulated (A) and down-regulated (B) proteins in GO secondary notes from the CSF of ALS patients with limb onset disease. |
对差异性表达蛋白KEGG通路分析发现,延髓起病ALS患者CSF中上调蛋白参与溶酶体途径、代谢途径和和麻疹3条有意义的KEGG通路。肢体起病ALS患者CSF中下调蛋白参与补体和凝血级联途径、系统性红斑狼疮、百日咳、朊病毒、南美锥虫病(美洲锥虫病)、金黄色葡萄球菌感染和单纯疱疹感染7条通路。延髓组中酸性α-葡萄糖苷酶(GAA)、IDS、溶酶体关联膜蛋白(LAMP)和sortilin参与了溶酶体途径;肢体组各通路均包含补体成分(图 3~5)。
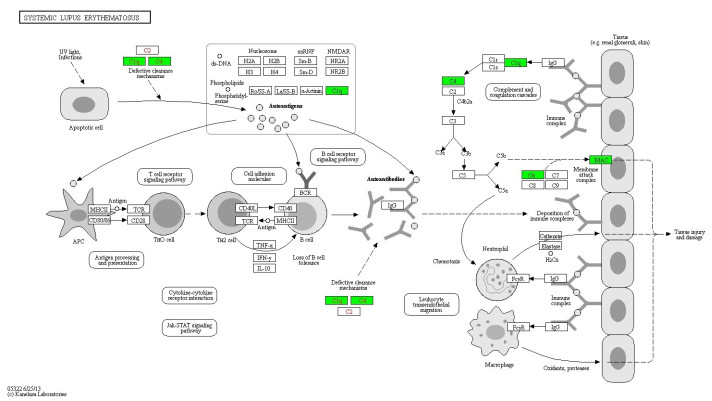
|
图 3 延髓组上调蛋白参与的溶酶体通路 Fig.3 Lysosomal pathway involving the up-regulated (red) proteins in the medullary onset group. |
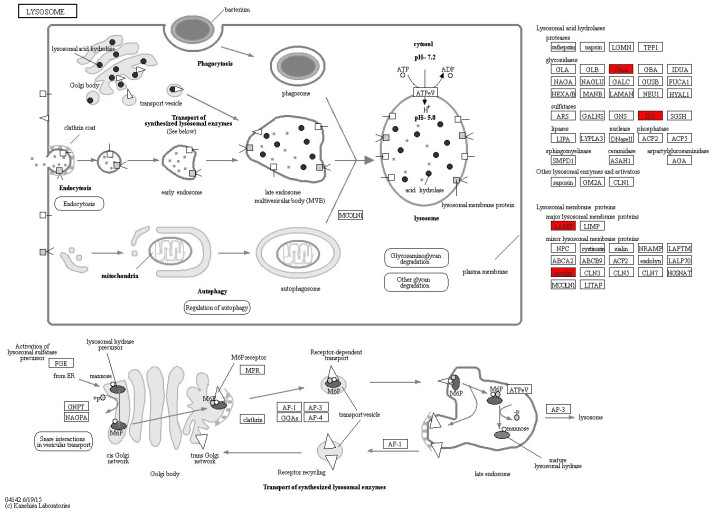
|
图 4 肢体组下调蛋白参与补体和凝血级联通路 Fig.4 Complement and coagulation cascade pathways involving the down-regulated (green) proteins in the limb onset group. |
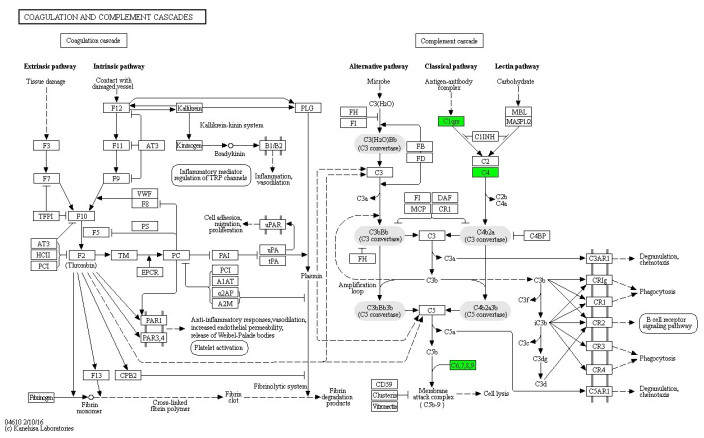
|
图 5 肢体组下调蛋白参与系统性红斑狼疮通路 Fig.5 Systemic lupus erythematosus pathway involving in the down-regulated (green) proteins in the limb onset group. |
ALS是常见的运动神经元疾病,发病机制十分复杂。研究发现,免疫炎症反应、基因突变、神经兴奋毒性、线粒体异常、氧化应激等均与ALS发病密切相关,且各机制之间相互联系、相互影响,但具体作用途径还不完全清楚[7-10]。本研究利用TMT联合LC-MS/MS技术对ALS患者CSF蛋白质组进行检测,鉴定出1732种蛋白,其中可定量蛋白为1530种。延髓起病组中48种蛋白表达上调,6种蛋白表达下调。在肢体起病组中6种蛋白表达上调,19种蛋白表达下调。这些蛋白均参与细胞生理过程、单器官过程和生物调节等过程,在细胞内和细胞外均有分布,且具有结合功能、催化活性和受体活性等。说明采用此种检测方法检测到的差异性蛋白数量多、分布均衡,且作用广泛。
溶酶体是分解生物大分子的细胞器,参与细胞周期、DNA修复、清除微生物、调节免疫和细胞凋亡等过程[11-13]。自噬-溶酶体途径是指双层膜性结构包裹蛋白质或受损细胞器形成自噬体,后者通过微管转运至溶酶体并与其融合形成自噬溶酶体,从而降解包裹内容物。GAA是常见溶酶体酶,其活性不足时可引起溶酶体功能缺陷,造成溶酶体内底物不能被消化,导致底物蓄积[14]。研究发现自噬-溶酶体途径在神经变性疾病中发挥起重要作用[15-17]。有报道称,ALS患者脊髓组织样品中GAA表达水平的变化与患者疾病程度相关[18]。本研究GO分类富集分析显示,延髓起病ALS患者CSF中上调蛋白分子功能主要富集在糖苷酶活性、GAA活性和水解酶活性,GAA表达较健康对照也上调,而肢体起病型ALS患者CSF中GAA的表达水平与健康对照无显著差异,因此推测GAA可能是延髓起病型ALS的诊断及疾病严重程度的标志物。LAMP是位于溶酶体膜上的一组跨膜蛋白,对维持溶酶体膜完整性发挥关键作用。LAMP2通过调节溶酶体通路在帕金森等疾病的发生发展中起重要作用[19],但目前尚无LAMP2与ALS疾病关系的报道。本研究通过质谱检测发现延髓起病ALS患者CSF中LAMP表达上调,KEGG通路分析发现延髓起病ALS患者CSF中上调蛋白参与溶酶体途径,提示LAMP可能通过溶酶体通路参与延髓起病ALS的发生发展。
免疫反应指机体对异己或者自体变异成分做出的防御反应,可分为非特异性免疫反应和特异性免疫反应两大类。补体是机体体液及细胞表面上经活化后可以产生生物活性的蛋白质,包括30余种可溶性蛋白,又被称为补体系统。补体首先发挥非特异性免疫的作用,当特异性免疫反应启动后,两者可相互配合,扩大免疫反应[20]。研究发现,缓慢进展型ALS患者脊髓及脑组织中C1q、C4、C3及C5b表达上调,且补体系统在ALS患者血液及CSF中表达也上调[21, 22]。本研究结果显示,肢体起病ALS患者CSF中下调蛋白富集在调节免疫应答、防御反应和固有免疫,参与补体和凝血级联途径、朊病毒、金黄色葡萄球菌感染和单纯疱疹感染等通路,各通路均包含补体成分,提示免疫反应参与肢体起病型ALS的发生和发展。
泛素羧基末端水解酶L1(UCH-L1)是泛素-蛋白酶体途径(UPS)中的关键蛋白,在清除异常蛋白中发挥重要作用[23-24]。研究表明,UCH-L1功能障碍可导致神经轴索变性、氧化应激反应及蛋白质的异常沉积,且与多种神经系统疾病相关[25-29]。Li等对5例AD患者、5例PD患者和5例健康对照脑组织进行蛋白质谱检测,发现UCH-L1在AD和PD患者脑组织中表达下调,且AD患者脑组织中UCH-L1的表达水平与神经元纤维缠结呈反比[30]。目前,UCH-L1在ALS中的研究较少。本研究结果显示,UCH-L1在延髓起病和肢体起病ALS患者CSF中均较健康对照表达上调,推测UCH-L1可能被氧自由基氧化发生功能障碍,并影响UPS通路,使得错误折叠的蛋白质无法被降解而在中枢神经系统沉积,引起ALS。
综上所述,参与延髓起病ALS和肢体起病ALS发生发展的途径或通路不同,溶酶体通路参与延髓起病ALS的发生的发展,免疫反应参与肢体起病ALS的发生和发展,初步了解了ALS疾病的发生发展可能涉及的信号通路,为深入研究ALS发病机制提供了一定的方向。
| [1] |
乔晶晶, 张金, 郭军红, 等. 山西省165例运动神经元病临床特征及误诊分析[J].
国际神经病学神经外科学杂志, 2014, 41(1): 23-6.
|
| [2] |
Sances S, Bruijn LI, Chandran S, et al. Modeling ALS with motor neurons derived from human induced pluripotent stem cells[J].
Nat Neurosci, 2016, 16(4): 542-53.
|
| [3] |
周益毅, 徐仁伵. 肌萎缩侧索硬化与变性蛋白关系的研究进展[J].
中国老年学杂志, 2014, 34(19): 5604-8.
DOI: 10.3969/j.issn.1005-9202.2014.19.141. |
| [4] |
李玉香, 戎浩, 胡群英, 等. 蛋白质组学在医学研究中的应用与进展[J].
中国组织工程研究, 2016, 20(33): 4985-92.
DOI: 10.3969/j.issn.2095-4344.2016.33.017. |
| [5] |
Brooks BR, Miller RG, Swash M, et al. El escorial revisited:revised criteria for the diagnosis of amyotrophic lateral sclerosis[J].
Amyotroph Lateral Scler Other Motor Neuron Disord, 2000, 1(5): 293-9.
DOI: 10.1080/146608200300079536. |
| [6] |
刘文超, 刘涛, 刘志辉, 等. 不同SOD1基因突变的肌萎缩侧索硬化患者皮肤成纤维细胞中突变蛋白表达及线粒体功能[J].
中华医学杂志, 2016, 96(25): 1982-6.
DOI: 10.3760/cma.j.issn.0376-2491.2016.25.005. |
| [7] |
郭永强, 李森, 张海鸿, 等. 肌萎缩侧索硬化发病机制的研究进展[J].
中国康复理论与实践, 2017, 23(6): 685-9.
DOI: 10.3969/j.issn.1006-9771.2017.06.014. |
| [8] |
Lopez-Gonzalez R, Lu YB, Gendron TF, et al. Poly (GR) in C9ORF72-Related ALS/FTD compromises mitochondrial function and increases oxidative stress and DNA damage in iPSC-derived motor neurons[J].
Neuron, 2016, 92(2): 383-91.
DOI: 10.1016/j.neuron.2016.09.015. |
| [9] |
Zufiria M, Gil-Bea FJ, Fernandez-Torron R, et al. ALS:A bucket of genes, environment, metabolism and unknown ingredients[J].
Prog Neurobiol, 2016, 142(5): 104-29.
|
| [10] |
程济玲. 肌萎缩侧索硬化中氧化应激与其他发病机制的关系[J].
华西医学, 2017, 32(6): 945-8.
|
| [11] |
Brisson L, Banski P, Sboarina M, et al. Lactate dehydrogenase B controls lysosome activity and autophagy in cancer[J].
Cancer Cell, 2016, 30(3): 418-31.
DOI: 10.1016/j.ccell.2016.08.005. |
| [12] |
Wolfson RL, Chantranupong L, Wyant GA, et al. KICSTOR recruits GATOR1 to the lysosome and is necessary for nutrients to regulate mTORC1[J].
Nature, 2017, 543(7645): 438.
DOI: 10.1038/nature21423. |
| [13] |
李磊, 赵连梅, 崔雯萱, 等. 香加皮杠柳苷通过溶酶体途径诱导胃癌MGC-803细胞凋亡[J].
肿瘤防治研究, 2016, 43(5): 335-9.
DOI: 10.3971/j.issn.1000-8578.2016.05.004. |
| [14] |
占霞, 顾学范, 琳娜, 等. 串联质谱检测干血滤纸片多种溶酶体酶活性方法的建立[J].
中华检验医学杂志, 2016, 39(10): 761-5.
DOI: 10.3760/cma.j.issn.1009-9158.2016.10.008. |
| [15] |
余沛豪, 马骏, 王述菊, 等. 自噬-溶酶体途径与帕金森病关系的研究进展[J].
辽宁中医杂志, 2017, 44(8): 1766-9.
|
| [16] |
邹利, 王云甫. 自噬及调控机制与神经变性疾病的关系[J].
中国神经免疫学和神经病学杂志, 2016, 23(2): 129-33.
DOI: 10.3969/j.issn.1006-2963.2016.02.012. |
| [17] |
吴秋艳, 陈琛, 宋国丽. 内溶酶体-自噬溶酶体对阿尔茨海默症病理进程的影响[J].
中国细胞生物学学报, 2015, 37(12): 1702-7.
|
| [18] |
Dodge JC, Treleaven CM, Fidler JA, et al. Metabolic signatures of amyotrophic lateral sclerosis reveal insights into disease pathogenesis[J].
Proc Natl Acad Sci USA, 2013, 110(26): 10812-7.
DOI: 10.1073/pnas.1308421110. |
| [19] |
马骏, 余沛豪, 王述菊, 等. 电针对帕金森病模型大鼠脑黑质内Lamp2a, Hsc70, α-syn表达的影响[J].
中华中医药学刊, 2018, 36(4): 859-62.
|
| [20] |
曹博, 赵怡霞, 江嫚, 等. 补体系统及其与自身免疫性疾病关系概述[J].
生物学教学, 2018, 43(3): 66-8.
DOI: 10.3969/j.issn.1004-7549.2018.03.034. |
| [21] |
Lobsiger CS, Boillã ES, Pozniak C, et al. C1q induction and global complement pathway activation do not contribute to ALS toxicity in mutant SOD1 mice[J].
Proc Natl Acad Sci USA, 2013, 110(46): E4385-92.
DOI: 10.1073/pnas.1318309110. |
| [22] |
Chen XE, Feng WH, Huang R, et al. Evidence for peripheral immune activation in amyotrophic lateral sclerosis[J].
J Neurol Sci, 2014, 347(1/2): 90-5.
|
| [23] |
Victoria R, Czesla M, Reichelt J, et al. Ubiquitin C-Terminal hydrolase L1 is required for regulated protein degradation through the ubiquitin proteasome system in kidney[J].
Kidney Int, 2017, 93(1): 110-27.
|
| [24] |
胡重灵, 杨新玲, 毛德强, 等. 急性脑梗死患者血清泛素羧基末端水解酶-1和胶质纤维酸性蛋白的表达及其临床意义[J].
中南大学学报:医学版, 2017, 42(3): 284-90.
|
| [25] |
丁惠, 王汉东, 朱林, 等. 小鼠脑外伤模型中Nrf2与泛素-蛋白酶体系统的关系[J].
医学研究生学报, 2016, 29(5): 475-9.
|
| [26] |
李娜, 任长虹, 吉训明. 脑梗死患者急性期血清泛素羧基末端水解酶-1及神经胶质原纤维酸性蛋白水平的变化[J].
中国脑血管病杂志, 2016, 13(7): 337-42.
DOI: 10.3969/j.issn.1672-5921.2016.07.001. |
| [27] |
李永军. 舒血宁注射液对脑梗死患者临床疗效及血浆Hcy、UCH-L1及血清fibulin-5水平的影响[J].
安徽医药, 2018, 22(1): 143-6.
DOI: 10.3969/j.issn.1009-6469.2018.01.037. |
| [28] |
黄玮玲, 卢红艳, 朱海涛, 等. 早产儿血清泛素羧基末端水解酶L1、神经胶质原纤维酸性蛋白与脑损伤的关系[J].
临床儿科杂志, 2018, 36(1): 44-7.
DOI: 10.3969/j.issn.1000-3606.2018.01.010. |
| [29] |
Zhang MM, Cai F, Zhang ST, et al. Overexpression of ubiquitin carboxyl-terminal hydrolase L1(UCHL1) delays Alzheimer's progression in vivo[J].
Sci Rep, 2014, 4: 7298.
|
| [30] |
Choi J, Levey AI, Weintraub ST, et al. Oxidative modifications and down-regulation of ubiquitin carboxyl-terminal hydrolase L1 associated with idiopathic Parkinson's and Alzheimer's diseases[J].
J Biol Chem, 2004, 279(13): 13256-64.
DOI: 10.1074/jbc.M314124200. |
 2019, Vol. 39
2019, Vol. 39

