2. 汉中市中心医院脊柱外科,陕西 汉中 723000
2. Department of Spine Surgery, Hanzhong Central Hospital, Hanzhong 723000, China
在颈前路椎体次全切植骨融合手术(ACCF)中,钛笼填充松质骨颗粒为目前最为常用的椎体重建方法之一[1-3]。然而,近年来临床长期随访发现术后钛笼下沉发生率较高,文献报道最高发生率为93.3%[4-9]。相关临床与生物力学研究认为过于简单的点状及平面钛笼尾端设计使得传统钛笼与终板之间的接触面积十分狭小,从而导致钛笼-终板界面的应力集中,进而引发钛笼下沉[10-11]。为克服上述传统钛笼的设计缺陷,本研究团队设计了一种新型解剖型钛笼(AA-TMC)。该钛笼上下两端通过模拟颈椎终板凹型弧度以及斜型角度以求与终板形态进行匹配,从而增大与终板接触面积。此外,AA-TMC两端支撑面积增大,以求进一步增大接触面积,从而降低应力集中现象,减少钛笼下沉的可能性。本研究的主要目的为验证AA-TMC是否能在单节段及双节段ACCF中与颈椎终板解剖形态匹配、重建颈椎手术节段曲度,以评估AA-TMC形态设计的合理性。并通过生物力学实验测量AA-TMC与终板界面的最大压缩强度,以评估AA-TMC在ACCF手术中应用能否降低植入物下沉发生的可能性。从而对AA-TMC在ACCF手术中的应用价值做出客观评价。
1 资料和方法 1.1 AA-TMC的设计与制造本次研究将AA-TMC设计为两种形态结构,以分别用于单节段ACCF及双节段ACCF的椎体重建(图 1)。AA-TMC上下两端在矢状面及冠状面设计为弧形,其弧度大小根据既往已发表颈椎终板形态学数据确定[12-15]。AA-TMC尾端设计为斜型,以适应颈椎上终板的斜型角度。单节段AA-TMC尾端斜型角度为12°,双节段AA-TMC尾端斜型角度为16°[10-11]。此外,AA-TMC上下两端增加环形支撑结构,以增大与终板的接触面积。上下两端环形支撑环的表面积为0.92 cm2。为了避免术中裁剪对钛笼尾端结构的破坏,本研究设计完成了多种高度及直径的AA-TMC,以供术中选择使用。单节段AA-TMC型号包括:21 mm×12 mm(高度×直径),23 mm× 12 mm,25 mm×12 mm,27 mm×12 mm,29 mm×12 mm,21 mm×14 mm,23 mm×14 mm,25 mm×14 mm,27 mm× 14 mm,29 mm×14 mm。双节段AA-TMC型号包括:41 mm×12 mm,43 mm×12 mm,45 mm×12 mm,47 mm× 12 mm,49 mm×12 mm,41 mm×14 mm,43 mm×14 mm,45 mm×14 mm,47 mm×14 mm,49 mm×14 mm。AA-TMC在水平面设计为近似方形,两侧为平面,前方及后方向前方稍突起。双节段AA-TMC矢状面上为弧形,以适应颈椎前曲生理曲度。所有AA-TMC在设计完成后使用激光选区熔融3D打印机进行加工制造(S200,西安铂力特增材技术股份有限公司)。

|
图 1 单节段及双节段AA-TMC示意图 Fig.1 Design of the one-and two-level AA-TMC. A: Sagittal view of one-level AA-TMC; B: Coronal view of one-level AA-TMC; C: Sagittal view of twolevel AA-TMC; D: Coronal view of two-level AA-TMC; E: Axial vie of the AATMC |
获取福尔马林浸泡颈椎尸体标本共12具,并随机分为3组:C4次全切组;C5次全切组;C6次全切组。每组标本完成相应颈椎节段的椎体次全切、上下相邻椎间盘切除以及软骨终板的刮除。随后,选取合适高度及直径的AA-TMC植入到植骨槽中,以重建手术节段的稳定性。术后,每具标本进行颈椎正侧位X线检查。测量AA-TMC两端与颈椎上下终板之间的最大间隙距离。最大间隙距离的测量方法为在颈椎侧位X线影像上寻找AA-TMC上下两端与相对应终板之间存在的最大空隙,并测量此处AA-TMC尾端与终板之间的距离(图 2)。在颈椎侧位X线影像中,完成单节段AA-TMC终板贴合验证试验后,将上述12具尸体标本分为C4-5次全切组和C5-6次全切组。原C4次全切组直接纳入C4-5次全切组,原C6次全切组直接纳入C5-6次全切组,原C5次全切组随机分配至C4-5和C5-6次全切组。在原手术节段基础上进一步完成相邻颈椎节段次全切、椎间盘切除以及软骨终板的刮除。选取合适大小的双节段AA-TMC植入到植骨槽中。术后,每具标本再次进行颈椎正侧位X线检查。测量双节段AA-TMC两端与颈椎上下终板之间的最大间隙距离。
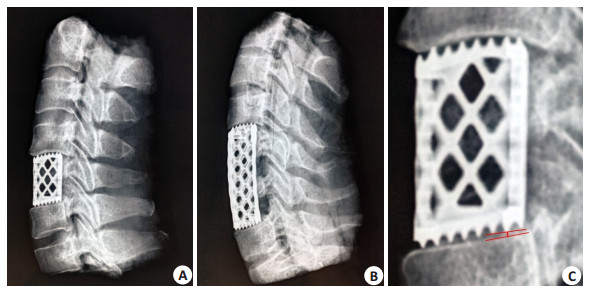
|
图 2 使用AA-TMC进行单节段及双节段ACCF椎体重建术后影像(A、B)及最大间隙测量方法(C) Fig.2 X-ray images of the cervical spine following one- level ACCF (A) and two- level ACCF (B) using AA-TMC and measurement of the maximum interval between the AA-TMC and the endplate |
在完成“1.2 AA-TMC与终板贴合性的形态学验证”的实验过程中,椎体次全切手术开始之前对12具颈椎尸体标本进行颈椎正侧位X线检查。测量C4、C5、C6、C4-5、C5-6手术节段角度及高度(图 3)。测量方法按照既往发表研究测量方法实施[16]。手术节段角度的测量方法为次全切椎体下位椎体的上终板与次全切椎体上位椎体的下终板之间的角度。手术节段高度的测量方法为次全切椎体下位椎体的上终板与次全切椎体上位椎体的下终板之间前缘及后缘高度的平均值。在椎体次全切AA-TMC植入后,完成颈椎正侧位X线检查,对比手术前后颈椎手术节段角度及高度的变化,以评价AA-TMC重建颈椎生理序列的效果。
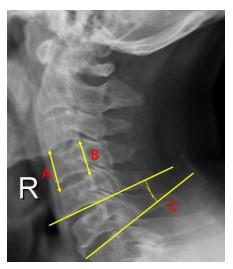
|
图 3 颈椎手术节段高度及角度测量方法 Fig.3 Methods of cervical parameter measurements. A: Anterior height of the surgical segment; B: Posterior height of the surgical segment; C: Angle of the surgical segment |
根据美国材料与实验学会(ASTM)F2267脊柱植入物沉陷试验标准开展AA-TMC与传统钛笼对于终板支撑强度的对比试验。首先获得48个15级聚氨酯4 cm× 4 cm×3 cm方块以模拟颈椎椎体及终板(Sawbone,美国)。其中,24个聚氨酯方块的表面存在一凹形槽以模拟上终板的弧度,剩余24个聚氨酯方块的表面凹形槽模拟下终板的弧度。凹槽弧度大小根据既往终板形态学测量数据确定(上终板:矢状面半径20 mm,冠状面半径30 mm;下终板:矢状面半径30 mm,冠状面半径40 mm)[12-15]。同时,设计完成两种具有不同斜型角度的夹具用于聚氨酯上终板的放置,以模拟手术节段角度。其中,12°夹具用于模拟单节段ACCF手术节段角度,16°夹具用于模拟双节段ACCF手术节段角度(图 4)。

|
图 4 沉陷试验实验材料以及试验方法 Fig.4 Materials and methods for compressive load test. A: Shape of the polyurethane interior endplate; B: Shape of the polyurethane superior endplate; C: Shape of the endplate holding cup for one-level ACCF; D: Shape of the endplate holding cup for two-level ACCF; E: Compressive load test for single-level AA-TMC; F: Compressive load test for single-level conventional cage; G: Compressive load test for two-level AA-TMC; H: Compressive load test for two-level conventional cage |
采用计算机控制伺服液压生物力学试验机(858 Mini-Bionix Testing Machine, MTS Systems, 美国)完成AA-TMC及传统钛笼的轴向压缩沉陷试验。总共24对聚氨酯上下终板随机分为4组:(1)单节段AA-TMC组;(2)单节段传统钛笼组;(3)双节段AA-TMC组;(4)双节段传统钛笼组。在每次沉陷实验中,将AA-TMC或传统钛笼置于上下聚氨酯终板之间。同时,在装配结构顶端加载6 mm/min的位移载荷。最大位移设置为10 mm,以足够破坏终板结构。载荷力的大小以及位移数据的采集频率设置为50 Hz。终板支撑强度定义为位移载荷曲线上的最大载荷力。
1.5 统计学分析所有计量资料数据以均数±标准差表示。使用SPSS 18.0进行统计学分析。手术前后手术节段角度及高度变化采用独立样本t检验进行比较。单一因素方差分析用于比较4组钛笼之间终板支撑强度的差异,并使用LSD检验进一步比较组内差异。P < 0.05时认为差异具有统计学意义。
2 结果颈椎尸体标本ACCF术后X线显示所有标本AA-TMC上下两端与颈椎终板之间贴合良好(图 3)。AA-TMC下端与上终板之间的最大间隙为0.37±0.3 mm(0~0.9 mm)。AA-TMC上端端与下终板之间的最大间隙为0.42±0.28 mm(0~1.2 mm)。
在单节段ACCF手术中,使用AA-TMC进行椎体重建手术节段角度为12.13±0.69°、手术节段高度为24.23±1.13 mm,与正常颈椎相比差异无统计学意义(P > 0.05)。在双节段ACCF中,使用AA-TMC进行椎体重建手术节段角度为16.16±1.05°、手术节段高度为43.04±1.70 mm,与正常颈椎相比差异无统计学意义(P > 0.05,表 1)。
| 表 1 单节段及双节段ACCF手术前后椎间高度及椎间角度对比 Tab.1 Preoperative and postoperative interbody angle and interbody height in single- and two-level ACCF |
沉陷试验结果表明,相比于传统钛笼,在单节段及双节段ACCF中使用AA-TMC可显著提高颈椎终板的支撑强度(图 5)。在单节段ACCF中,使用AA-TMC后终板支撑强度为875.8±5.2 N,显著高于使用传统钛笼(719.7±5.5 N),差异具有统计学意义(P < 0.05)。在双节段ACCF中,使用AA-TMC后终板支撑强度为873± 6.1 N,使用传统钛笼终板支撑强度为634.3±5.9 N,差异具有统计学意义(P < 0.05)。此外,在使用传统钛笼进行椎体重建的过程中,双节段ACCF的终板支撑强度为634.3±5.9 N,显著低于单节段ACCF(719.7±5.5 N),差异具有统计学意义(P < 0.05)。
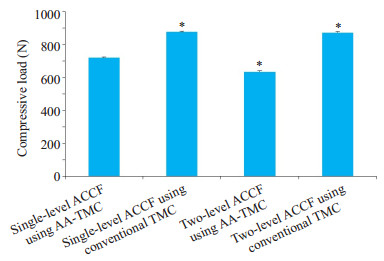
|
图 5 不同钛笼在单节段及双节段ACCF中对终板支撑强度的影响 Fig.5 Maximum load at the endplate in one- and two-level ACCF using different titanium mesh cages. *P < 0.05 vs Single-level ACCF using AA-TMC |
钛笼自身设计缺陷是引起ACCF术后钛笼下沉的重要原因[10-11]。颈椎椎体终板在矢状面及冠状面上均为弧形,下终板在矢状面上存在明显的斜型角度[8, 11]。传统钛笼由于上下两端为平面设计,从而导致钛笼仅前后缘部位与终板接触,导致钛笼-终板界面接触面积狭小[10-11]。此外,传统钛笼由于两端为点状设计,并且术中裁剪造成末端十分尖锐,导致与终板的接触面积进一步狭小,从而引起严重的应力集中现象,使得钛笼极易刺入终板引起下沉[7, 9, 17]。因此,本研究根据既往颈椎终板及生理序列解剖测量参数[10-15],对传统钛笼结构进行了系统优化,以求有效增加钛笼与终板的接触面积,从而降低应力集中现象,防止下沉。此外,AA-TMC下端通过模拟颈椎上终板斜型角度可有效恢复手术节段角度,维持颈椎生理前曲状态。通过将AA-TMC设计为不同型号大小,避免了因术中裁剪导致的末端尖锐,并且可以有效重建颈椎手术节段的高度。本试验结果表明在单节段及双节段ACCF中使用AA-TMC进行椎体重建可以获得良好的椎间角度及椎间高度的恢复,颈椎手术节段生理序列可达到正常状态。同时,AA-TMC上下两端与颈椎终板贴合良好,从而有效地增加了与终板的接触面积。相比于传统钛笼,AA-TMC可有效降低应力集中现象的发生,提高终板的支撑强度,从而有效降低了钛笼下沉发生的可能性。
在评价AA-TMC与终板贴合程度的过程中,我们使用AA-TMC与终板之间的存在的最大间隙作为主要评价指标。应用该指标进行评价的主要原因是由于该种方法能够间接反应AA-TMC与终板之间的接触面积。最大间隙距离与界面接触面积之间呈反向关联。当间隙距离降低时,AA-TMC与终板之间的接触面积进一步增加。只有当钛笼与终板之间接触无明显间隙才能保证能够保证界面的接触面积最大化。本研究结果显示,AA-TMC与上下终板之间的平均最大间隙距离为0.37±0.3 mm及0.42±0.28 mm。颈椎骨性终板平均厚度被报道为0.65~1.35 mm[18-19]。当AA-TMC与上下终板之间的最大间隙消失时,AA-TMC仅平均下沉0.37± 0.3 mm及0.42±0.28 mm,约占骨性终板厚度的1/3-1/2。此时,终板的完整性并未完全破坏[18-19],其对AA-TMC的支撑强度未受到明显影响[20-22]。并且,由于间隙的消失,AA-TMC尾端与终板之间的接触面积达到了最大化,使得接触界面应力分布更加均匀,进一步增加了界面抵抗下沉的能力[20-22]。所以,根据实验结果可以认为AA-TMC与终板贴合良好,可以在接触界面提供可观的接触面积。
另一个有效增加AA-TMC与终板接触面积的设计为AA-TMC两端的环形支撑结构。在设计过程中,环形支撑结构面积大小的确定应同时兼顾终板支撑强度以及植骨融合效果[23]。若支撑面积太大,AA-TMC内部的松质骨颗粒与终板的接触范围大大降低,影响术后植骨融合效果。若支撑面积太小,则会增加钛笼-终板界面的应力集中现象,引起钛笼下沉[23]。既往生物力学研究报道,当植入物与终板的接触面积达到终板面积的30%时,与具有更大接触面积的植入物相比对于终板压缩强度之间的差异无统计学意义[23-24]。根据作者既往颈椎解剖测量数据,颈椎终板面积平均为3.02 cm2[10]。本次设计中将AA-TMC尾端支撑面积设定为0.92 cm2,约占终板面积的30.5%。因此,AA-TMC的尾端支撑面积既能最大限度满足植骨融合的需求,又能为终板提供良好的支撑强度,防止钛笼下沉。
在本次沉陷实验中,为了模拟在ACCF手术中上下相邻椎体的真实位置关系,用于放置聚氨酯上终板的下夹具根据手术节段角度测量结果添加了斜型角度。其中,单节段ACCF手术节段角度为12°,双节段ACCF手术节段角度为16°。当传统钛笼放置在终板之间时可以观察到钛笼与下终板之间存在明显的间隙,仅钛笼后缘与上终板之间存在接触,导致钛笼与终板之间接触面积十分狭小。该现象与颈椎ACCF术后侧位X线传统钛笼的影响学表现基本吻合[23-24]。由于设计存在明显缺陷,传统钛笼的应用导致终板支撑强度显著降低,钛笼极易通过后下缘刺入椎体中,导致钛笼下沉[9-11]。此外,使用传统钛笼进行双节段ACCF椎体重建其终板支撑强度显著低于单节段ACCF终板支撑强度。作者认为导致该现象的主要原因是双节段ACCF相邻下位椎体的终板倾斜度增高,使得传统钛笼在下沉过程中与终板及内部松质骨的接触范围明显小于单节段ACCF。从而导致在同一下沉距离时双节段ACCF应力集中现象比单节段高,终板支撑强度降低。而使用AA-TMC时,由于尾部结构与终板贴合良好,手术节段大小不会引起AA-TMC与终板接触面积变化。从而使得AA-TMC在单节段及双节段ACCF中均均可获得终板支撑强度,可有效防止钛笼下沉的发生。
与传统圆柱形钛笼设计不同,AA-TMC在水平面设计为近似方形,且背侧结构向前方稍突起。作者认为该种设计具有以下优势。首先,既往生物力学实验证实终板支撑强度最强的部位位于后方,方形结构设计可增大AA-TMC两端与椎终板后方的接触面积,从而进一步提高最大支撑载荷[25-27]。第二,相比于同样直径的圆柱形钛笼,方形结构可有效增大两端与终板的接触面积,从而提高终板支撑强度[10]。第三,方形结构设计可提高内部植骨容积,有利于术后手术节段植骨融合[10-11]。第四,方形结构使得AA-TMC两侧面平面,增加了与次全切后剩余椎体的接触面积,进一步促进手术节段的植骨融合[10-11]。最后,AA-TMC的背侧结构设计为向前方稍突起,可有效增加后方脊髓的容纳空间,降低AA-TMC与脊髓接触的风险[10]。
综上所述,在单节段及双节段ACCF中,AA-TMC与颈椎终板接触良好,可有效降增大与终板接触面积并提升终板支撑强度,从而降低钛笼下沉的发生。此外,在ACCF术后,AA-TMC可有效重建颈椎手术节段高度及角度,对于颈椎ACCF术后生理序列的恢复起到重要作用。
| [1] |
Eck KR, Bridwell KH, Ungacta FF, et al. Analysis of titanium mesh cages in adults with minimum two-year follow-up[J].
Spine (Phila Pa 1976), 2000, 25(18): 2407-15.
DOI: 10.1097/00007632-200009150-00023. |
| [2] |
Riew KD, Rhee JM. The use of titanium mesh cages in the cervical spine[J].
Clin Orthop Rel Res, 2002(394): 47-54.
|
| [3] |
Dorai Z, Morgan H, Coimbra C. Titanium cage reconstruction after cervical corpectomy[J].
J Neurosurg, 2003, 99(1): 3-7.
DOI: 10.3171/jns.2003.99.1.0003. |
| [4] |
Jang JW, Lee JK, Lee JH, et al. Effect of posterior subsidence on cervical alignment after anterior cervical corpectomy and reconstruction using titanium mesh cages in degenerative cervical disease[J].
J Clin Neurosci, 2014, 21(10): 1779-85.
|
| [5] |
Bilbao G, Duart M, Aurrecoechea JJ, et al. Surgical results and complications in a series of 71 consecutive cervical spondylotic corpectomies[J].
Acta Neurochir, 2010, 152(7): 1155-63.
DOI: 10.1007/s00701-010-0660-3. |
| [6] |
Yu F, Miao J, Liao X, et al. Evaluation of a new type of titanium mesh cage versus the traditional titanium mesh cage for singlelevel, anterior cervical corpectomy and fusion[J].
Eur Spine J, 2013, 22(12): 2891-6.
DOI: 10.1007/s00586-013-2976-1. |
| [7] |
Yan D, Wang Z, Deng S, et al. Anterior corpectomy and reconstruction with titanium mesh cage and dynamic cervical plate for cervical spondylotic myelopathy in elderly osteoporosis patients[J].
Arch Orthop Trauma Surg, 2011, 131(10): 1369-74.
|
| [8] |
Wu J, Luo D, Ye X, et al. Anatomy-related risk factors for the subsidence of titanium mesh cage in cervical reconstruction after one-level corpectomy[J].
Int J Clin Exp Med, 2015, 8(5): 7405-11.
|
| [9] |
Chen Y, Chen D, Guo Y, et al. Subsidence of titanium mesh cage: a study based on 300 cases[J].
J Spinal Disord Tech, 2008, 21(7): 489-92.
DOI: 10.1097/BSD.0b013e318158de22. |
| [10] |
Lu T, Liang H, Liu C, et al. Effects of titanium mesh cage end structures on the compressive load at the endplate interface: a cadaveric biomechanical study[J].
Med Sci Monit, 2017, 23: 2863-70.
|
| [11] |
Lu T, Liu C, Yang BH, et al. Single-level anterior cervical corpectomy and fusion using a new 3D-printed anatomy-adaptive titanium mesh cage for treatment of cervical spondylotic myelopathy and ossification of the posterior longitudinal ligament: a retrospective case series study[J].
Med Sci Monit, 2017, 23: 3105-14.
DOI: 10.12659/MSM.901993. |
| [12] |
Feng H, Fang XY, Huang DG, et al. A morphometric study of the middle and lower cervical vertebral endplates and their components[J].
Medicine, 2017, 96(10): e6296.
DOI: 10.1097/MD.0000000000006296. |
| [13] |
Feng H, Fang X, Huang D, et al. Quantitative morphometric study of the subaxial cervical vertebrae end plate[J].
Spine J, 2017, 17(2): 269-76.
DOI: 10.1016/j.spinee.2016.09.019. |
| [14] |
Chen H, Zhong J, Tan J, et al. Sagittal geometry of the middle and lower cervical endplates[J].
Eur Spine J, 2013, 22(7): 1570-5.
|
| [15] |
Lou J, Liu H, Rong X, et al. Geometry of inferior endplates of the cervical spine[J].
Clin Neurol Neurosurg, 2016, 142: 132-6.
DOI: 10.1016/j.clineuro.2016.01.027. |
| [16] |
蒲志超, 马向阳, 杨进城, 等. 两种支撑体在脊髓型颈椎病椎体次全切减压融合术中应用的效果对比[J].
中国临床解剖学杂志, 2017, 35(1): 78-84.
|
| [17] |
Yang X, Chen Q, Liu L, et al. Comparison of anterior cervical fusion by titanium mesh cage versus nano-hydroxyapatite/ polyamide cage following single-level corpectomy[J].
Int Orthop, 2013, 37(12): 2421-7.
|
| [18] |
Pitzen T, Schmitz B, Georg T, et al. Variation of endplate thickness in the cervical spine[J].
Eur Spine J, 2004, 13(3): 235-40.
DOI: 10.1007/s00586-003-0648-2. |
| [19] |
Schmitz B, Pitzen T, Beuter T, et al. Regional variations in the thickness of cervical spine endplates as measured by computed tomography[J].
Acta Radiol, 2004, 45(1): 53-8.
DOI: 10.1080/02841850410000755. |
| [20] |
Hasegawa K, Abe M, Washio T, et al. An experimental study on the interface strength between titanium mesh cage and vertebra in reference to vertebral bone mineral density[J].
Spine (Phila Pa 1976), 2001, 26(8): 957-63.
DOI: 10.1097/00007632-200104150-00022. |
| [21] |
Lowe TG, Hashim S, Wilson LA, et al. A biomechanical study of regional endplate strength and cage morphology as it relates to structural interbody support[J].
Spine (Phila Pa 1976), 2004, 29(21): 2389-94.
DOI: 10.1097/01.brs.0000143623.18098.e5. |
| [22] |
Ordway NR, Rim BC, Tan R, et al. Anterior cervical interbody constructs: effect of a repetitive compressive force on the endplate[J].
J Orthop Res, 2012, 30(4): 587-92.
DOI: 10.1002/jor.21566. |
| [23] |
Steffen T, Tsantrizos A, Aebi M. Effect of implant design and endplate preparation on the compressive strength of interbody fusion constructs[J].
Spine (Phila Pa 1976), 2000, 25(9): 1077-84.
DOI: 10.1097/00007632-200005010-00007. |
| [24] |
Closkey RF, Parsons JR, Lee CK, et al. Mechanics of interbody spinal fusion. Analysis of critical bone graft area[J].
Spine (Phila Pa 1976), 1993, 18(8): 1011-5.
|
| [25] |
Lowe TG, Hashim S, Wilson LA, et al. A biomechanical study of regional endplate strength and cage morphology as it relates to structural interbody support[J].
Spine (Phila Pa 1976), 2004, 29(21): 2389-94.
DOI: 10.1097/01.brs.0000143623.18098.e5. |
| [26] |
Ordway NR, Lu Y-M, Zhang X, et al. Correlation of cervical endplate strength with CT measured subchondral bone density[J].
Eur Spine J, 2007, 16(12): 2104-9.
DOI: 10.1007/s00586-007-0482-z. |
| [27] |
Grant JP, Oxland TR, Dvorak MF, et al. The effects of bone density and disc degeneration on the structural property distributions in the lower lumbar vertebral endplates[J].
J Orthop Res, 2002, 20(5): 1115-20.
|
 2019, Vol. 39
2019, Vol. 39

