2. 重庆医科大学附属第二医院肝胆外科,重庆 400010
2. Department of Hepatobiliary Surgery, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
肝移植是目前治疗终末期肝病唯一有效的治疗方法,但由此引起的一系列副反应以及急性、慢性排斥反应的发生仍然是造成患者生存质量降低的主要因素,长期应用必然带来细菌、真菌和病毒感染以及恶性肿瘤的发生,阻碍了受体的长期生存[1-2]。因此,与急性排斥反应(AcR)相关的并发症仍是当前影响受体长期存活的重要障碍之一,如何有效诱导移植物免疫耐受进而减少甚至停用免疫抑制剂是肝移植研究领域的热点[3]。三七总皂苷(PNS)是从三七中提取的皂苷类化合物,也是一种天然雌激素受体激动剂,如既往研究证实PNS可以通过抑制活性氧以及调控MAPK缓解Aβ沉积所致的神经退行性改变[4];另外,PNS通过激活PI3K/AKT抗氧化信号通路改善了缺氧-葡萄糖缺乏/再灌注诱导的屏障功能障碍[5];通过减少细胞凋亡、抑制炎症反应治疗缺血再灌注所导致的心肾功能损伤[6-7];PNS诱导的PPAR-γ活化及其下游PI3K/Akt/eNOS通路可在体外抑制凝血酶诱导的血小板聚集,有效改善体内高凝状态[8]。这也说明了PNS在抗氧化、改善微循环、增强机体免疫力以及抗炎等发面发挥着重要作用。KCs是定居于肝血窦内的巨噬细胞,占全身单核-巨噬细胞总数80%以上,作为体内最大的抗原提呈细胞群,KCs也是调节肝移植免疫耐受微环境最重要的细胞之一[9]。目前PNS对于肝移植术后KCs的影响尚未报道,其具体机制也不明确。本研究通过探讨PNS对KCs功能状态以及肝移植术后免疫环境的影响,并探讨其相关机制,来阐明其对肝移植排斥反应的作用。
1 材料和方法 1.1 实验动物和主要试剂实验动物:鼠龄10~12周雄性LEWIS大鼠30只和鼠龄10~12周雄性BN大鼠30只,体质量均为200~240 g,均购自于重庆医科大学动物实验中心,饲养于重庆医科大学动物实验中心SPF级,予以正常光照饮食,术前8~ 12 h禁食。实验过程中所有操作遵守重庆医科大学伦理委员会发布的伦理及管理指南。主要试剂:PNS(曼思特);Ⅳ型胶原酶(Sigma);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(博谷生物);CD206、MCP-1、iNOS、CCL2、CXCL2、IRAK4、p-IKKα、IKKα、IκBα、pIκBα、p65、p-p65抗体(Abcam);Keap1、Nrf2、ARE、Bax、Bcl2、Caspase3抗体(CST);ELISA试剂盒(Active motif);总蛋白提取试剂盒以及MTT细胞增殖及细胞毒性试剂盒(碧云天)。所有实验操作均于重庆医科大学附属第二医院中心实验室完成。
1.2 大鼠原位肝移植模型建立及分组本研究选择国际上通用的Lewis(LEWIS)→ Brown Norway(BN)近交系大鼠,采用改良Kamada “二袖套管”法建立起了稳定的大鼠肝移植急性排斥反应模型。实验动物采用随机数字表法分为3组:SHAM组(n=10),大鼠开腹手术仅暴露门静脉;LT组(n=10),供体于术前1周每天注射PBS 2 mL,1周后行肝移植手术;PNS组(n=10),供体于术前1周每天注射PNS(200 mg/kg)[10]+PBS共2 mL,1周后行肝移植手术。上述各组受体大鼠术中均未出现死亡,以术后老鼠存活24 h为大鼠建模成功标准,建模成功率100%。并于术后7 d麻醉状态下开腹,下腔静脉穿刺取血2 mL,离心5 min,上清液-80 ℃保存。处死各组大鼠,取部分左叶组织液氮保存。余下部分固定包埋。记录各组剩余大鼠生存时间。
1.3 KCs分离纯化与活力检测参照Dai等[11]介绍的胶原酶肝脏原位灌注法分离KCs,培养于完全培养基中,每天换液冲洗7 d后,贴壁较紧的即为KCs,重悬上述细胞,并将浓度调整至1×106/mL。吞墨实验以及台盼蓝染色检测KCs吞噬功能以及细胞活力。细胞实验分为4组:LPS(-)组,没有进行任何处理,作为对照;LPS(+)+PNS(0μmol)组,向培养基中加入100 ng/mL LPS进行处理;LPS(+)+ PNS(10 μmol)组,向培养基中加入100 ng/mL LPS和10 μmol PNS进行处理;LPS(+)+PNS(20 μmol)组,向培养基中加入100 ng/mL LPS和20 μmol PNS进行处理。24 h后,收集上述各组细胞以及上清液保存备用。并根据MTT法试剂说明检测各组细胞存活情况。
1.4 肝功能、炎症因子以及氧化应激检测使用全自动生化分析仪检测大鼠血清谷草转氨酶(AST)、谷丙转氨酶(ALT)水平;根据ELISA检测试剂盒说明书检测细胞上清液白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、白介素10(IL-10)、丙二醛(MDA)、和超氧歧化酶(SOD)的表达水平以及大鼠肝组织匀浆单核细胞趋化蛋白-1(MCP-1)、白介素1β(IL-1β)、白介素10(IL-10)。每组实验重复3次。
1.5 免疫荧光检测KCs CD206表达上述各组KCs进行细胞爬片,用4%多聚甲醛固定10 min,PBS洗3次,爬片置于山羊血清封闭液中封闭1 h,PBS洗3次,加入一抗CD206工作液(1:200),4 ℃孵育过夜。PBS溶液洗3次×3 min,加入荧光标记的二抗工作液(1:50),室温避光孵育1 h,PBS溶液洗3次×3 min。向爬片滴加4', 6-二脒基-2-苯基吲哚(DAPI)染核,室温孵育5 min,PBS溶液洗3次×3 min,最后用抗荧光淬灭的封片剂进行封片。荧光显微镜下观察各组CD206表达情况。
1.6 肝组织病理检测各组肝组织切片脱蜡脱水,滴加苏木素,室温染色10 min。并用流水冲洗去苏木素精。将切片滴加0.5%伊红染液,室温染色1 h,流水冲洗数秒。然后依次将切片放入从低到高浓度的乙醇和二甲苯进行脱水,中性树胶封片,并在光学显微镜观察肝组织病变情况。然后根据Banff方案中急性排斥反应的分级标准进行评分[12]。排斥活动指数(RAI)总积分为9分:RAI < 3分为非确定性急性排斥反应;3~5分为轻度排斥反应;5~7分钟中度排斥反应;7~9分为重度排斥反应。
1.7 流式细胞仪检测向上述各组细胞悬液中加入荧光素标价的抗体(Annexin-FITC),室温避光孵育30 min;加PI,室温结合30 min;再加入2 mL含0.09%叠氮化钠的PBS,震荡混匀后1000 r /min,离心5 min,弃上清,PBS重悬细胞上流式细胞仪检测凋亡情况。
1.8 Western blot分析提取各组细胞以及肝组织蛋白,用BCA法测定蛋白浓度,并在100 ℃煮蛋白10 min至蛋白变性。蛋白变性后取40 μg加入上样孔进行电泳分离,至溴酚蓝燃料到达分离胶的底部。然后250 mA恒流转至PVDF膜上,并用5%脱脂奶粉室温摇床封闭1 h,加入1:1000稀释浓度的目的抗体,4 ℃过夜孵育。TBST清洗3次×3 min,加入1:8000稀释浓度的辣根过氧化酶(HRP)标记二抗,室温摇床孵育1 h,TBST清洗3次×3 min。加ECL发光液,X线曝光、显影、定影,然后用UVP凝胶图像处理系统软件分析目的条带的灰度值。
1.9 统计学分析应用SPSS 18.0统计软件分析,计量资料以均数±标准差表示,满足方差齐性时,组间比较用单因素方差分析,生存资料分析用Log-Rank方法,P < 0.05为差异有统计学意义。
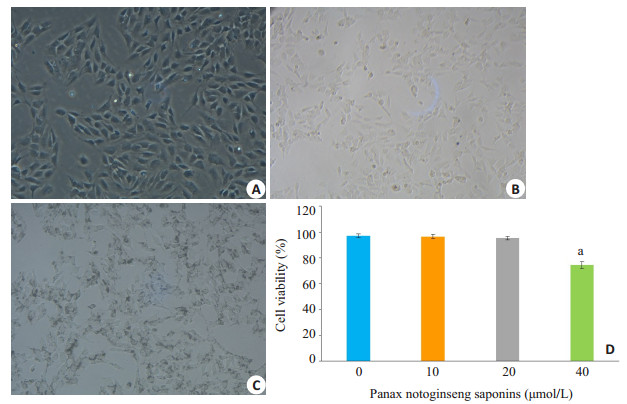
2 结果 2.1 不同浓度PNS对KCs活力影响分析刚分离得到的KCs呈小圆形,2 h后KCs开始贴壁,1 d后贴壁较为完全的细胞即是KCs,培养3 d后,KCs多为长梭形生长(图 1A)。台盼蓝染色后,光镜下观察计数,细胞活力 > 95%,并且细胞吞噬墨汁颗粒能力强(图 1B、C)。MTT法检测不同浓度PNS对KCs增殖能力的影响发现,PNS处理24 h后,40 μmol浓度组细胞活力明显下降至74.4±2.5%,与0、10、20 μmol组具有明显的统计学差异(图 1D,P < 0.05)。因此下面实验将选择0、10、20 μmol浓度的PNS进行进一步的研究。
|
图 1 KCs的吞噬功能和活力 Fig.1 Assessment of phagocytosis and viability of the isolated KCs. A: Morphology of KCs cultured for 3 days; B: Trypan blue staining; C: Phagocytosis of ink by the KCs; D: Effects of different concentrations of Panax notoginseng saponins on the viability of KCs. aP < 0.05 vs Panax notoginseng saponins (20 μmol/L) group. |
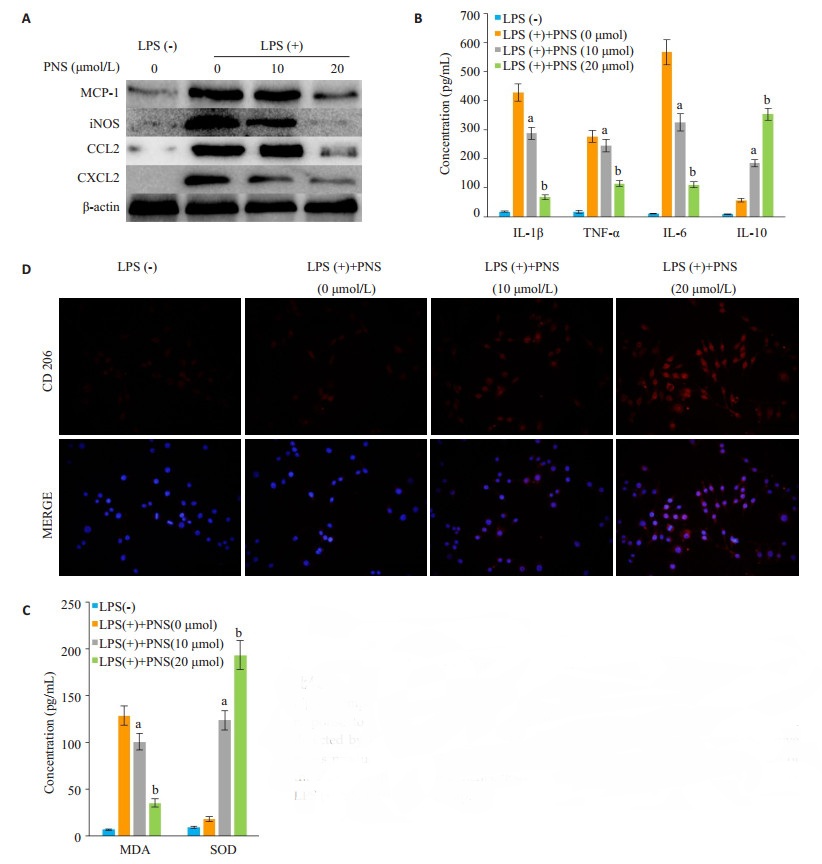
KCs经LPS活化后会分泌不同程度的炎症因子,通过加入不同浓度PNS处理后发现,随着PNS浓度的增加,KCs分泌促炎因子MCP-1、iNOS、CCL2、CXCL2、IL-1β、TNF-α、IL-6和氧化应激产物MDA水平逐渐降低,明显低于PNS(0 μmol)组,而抗炎因子IL-10以及抗氧化应激产物SOD水平逐渐升高,明显高于PNS(0 μmol)组,且差异具有统计学意义(图 2A~C,P < 0.05)。与此同时,PNS提高了KCs表型CD206的表达,促进KCs向免疫耐受的M2型极化(图 2D)。
|
图 2 不同浓度三七总皂苷对活化Kupffer细胞的炎症氧化反应以及M2极化的比较 Fig.2 Comparison of inflammatory reaction and M2 polarization of activated KCs in response to different concentrations of PNS. A: Inflammatory protein expressions detected by Western blotting; B, C: Detection of inflammatory factors and oxidative stress products by ELISA; D: Immunofluorescence assay of M2 type polarization of the KCs after different treatments. aP < 0.05 vs LPS (+)+PNS (0 μmol) group; bP < 0.05 vs LPS (+)+PNS (10 μmol) group. |
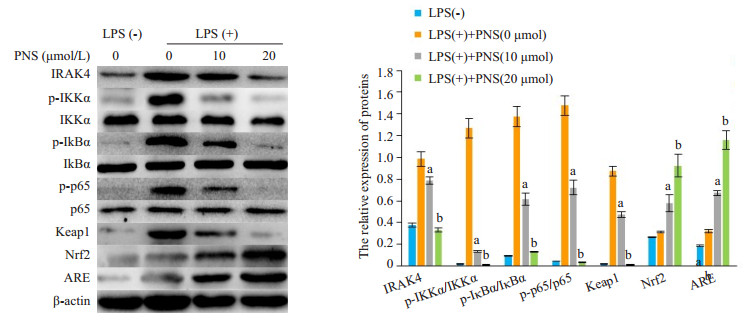
Western blot检测各组KCs NF-κB炎症通路关键蛋白和Keap1-Nrf2-ARE抗氧化应激通路蛋白发现,随着PNS浓度的增加,经LPS活化的KCs IRAK4、pIKKα、p-IκBα、p-p65、Keap1蛋白表达水平逐渐降低,而Nrf2、ARE蛋白表达水平逐渐升高,且与低PNS浓度组比具有统计学上的差异(图 3,P < 0.05)。这也提示了PNS能够抑制KCs NF-κB减少炎症反应以及促进Keap1-Nrf2-ARE减轻氧化应激反应。
|
图 3 各组Kupffer细胞表达NF-κB和Keap1-Nrf2-ARE通路蛋白比较 Fig.3 Expressions levels of NF-κB and Keap1-Nrf2-ARE pathway proteins in the KCs with different treatments. aP < 0.05 vs LPS(+)+PNS (0 μmol) group; bP < 0.05 vs LPS(+)+PNS (10 μmol) group. |
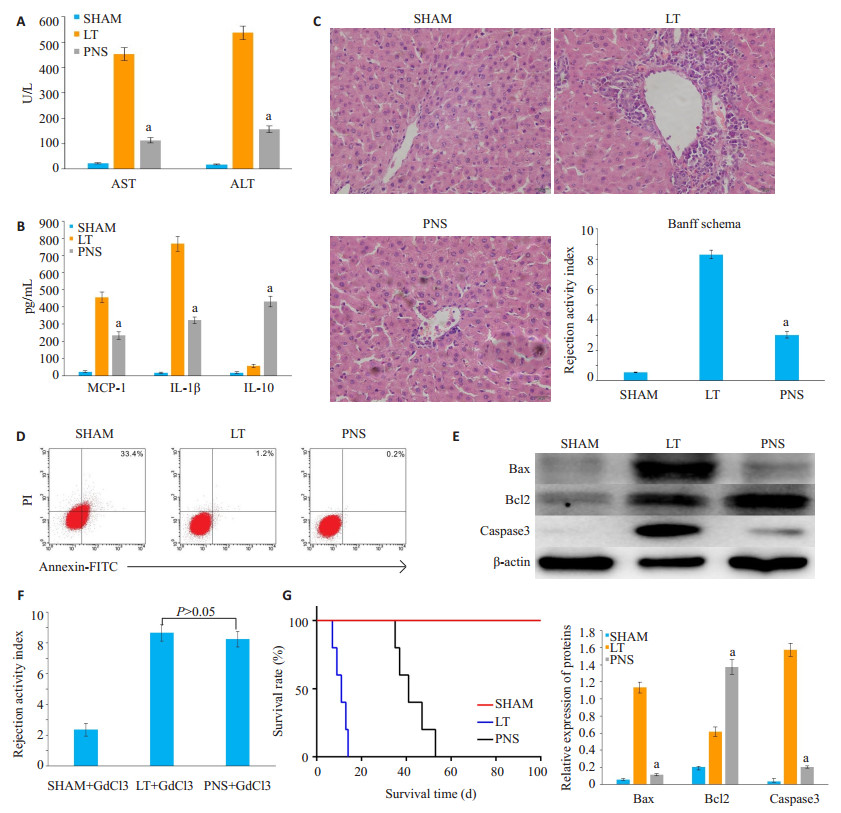
肝移植术后7 d,通过观察各组指标发现,与LT组相比,PNS组肝功能得到改善,促炎因子MCP-1、IL-1β表达水平减低,抗炎因子IL-10明显升高,并且肝组织病理学PNS组排斥活动评分(RAI)为3.01±0.21,明显低于LT组8.32±0.29,差异具有统计学意义(图 4A~C,P < 0.05)。流式细胞学检测肝内细胞凋亡情况发现,PNS组(1.3±0.2)%的细胞凋亡程度明显低于LT组(33.1± 0.7)%,Western blot检测PNS组肝组织促凋亡蛋白Bax、Caspase3表达降低,抗凋亡蛋白Bcl2表达升高,且与LT组比较差异具有统计学意义(图 4D、E,P < 0.05),这也提示PNS对肝细胞有一定程度的保护作用。另外,大鼠注射GdCl3封闭KCs功能发现,PNS组出现严重的急性排斥反应,与LT组比较无统计学上差异(图 4F,P >0.05),说明PNS对KCs的影响在移植排斥反应中发挥着重要作用。观察各组大鼠生存时间发现,PNS组大鼠存活时间(47±4.2 d)明显高于LT组(12.7±1.1 d)(图 4G,P < 0.05)。
|
图 4 肝移植术后7 d各组炎症免疫状态以及大鼠存活时间比较 Fig.4 Inflammatory status and survival time of the rats in different groups at 7 days after liver transplantation. A: Liver function test; B: Detection of expressions of inflammatory factors in liver tissue homogenate by ELISA; C: Detection of pathological changes in the liver tissue using HE staining; D: Detection of hepatocyte apoptosis by flow cytometry; E: Expressions of apoptosisrelated protein detected by Western blotting; F: Rejection activity index after blocking KCs function using GdCl3; G: Rat survival time in different groups. aP < 0.05 vs LT group. |
肝移植术后影响移植排斥反应的主要影响因素就是抗原呈细胞的功能状态,Kupffer细胞(KCs)作为体内最大的抗原提呈细胞群,在调节肝脏氧化应激以及免疫环境中发挥着重要的作用[13-14]。KCs在不同的微环境影响下可表现出明显的功能差异,其机制与KCs不同的表型有关[15-18],如何调控KCs向免疫抑制方向偏移,是诱导肝移植后免疫耐受的关键环节。PNS作为中药三七主要有效单体之一,具有降血脂、抗心律失常、抗炎、抗氧化、抗内质网应激、免疫调节等多种保护作用[19-21],目前就肝移植术后PNS对KCs功能状态的影响尚未见报道,本实验通过研究PNS对活化KCs的影响,发现PNS能诱导KCs向M2的极化,减轻肝移植后炎症反应,从而改善急性排斥反应损伤。
在本实验中,我们通过提取大鼠KCs,加入不同浓度PNS(0、10、20、40 μmol/L),观察活化KCs的免疫状态发现,PNS处理24 h后,40 μmol/L浓度组细胞活力明显下降至(74.4±2.5)%,因此接下来实验选择0、10、20 μmol/L浓度的PNS行进一步研究。肝移植术后AcR的实质是炎症反应的级联放大,通过用PNS处理活化KCs后发现,PNS能够明显减少KCs促炎因子MCP-1、iNOS、CCL2、CXCL2、IL-1β、TNF-α、IL-6和氧化应激产物MDA的分泌,提高抗炎因子IL-10以及抗氧化应激产物SOD的分泌,提示PNS能够抑制KCs的促炎以及氧化应激状态。KCs的极化状态会直接影响肝移植免疫微环境的形成,目前认为M1型和M2型是单个核细胞连续变化过程的两个极端[22-24]:M1主要是诱导Ⅰ型免疫反应在促进炎症反应中发挥重要功能,其表型包括iNOS、CD16/32;而M2通常参与Ⅱ型反应,在免疫调节和组织修复与重塑中发挥作用,其表型包括Arg-1、CD206。PNS处理后,KCs M2表型因子CD206的表达明显增高,这也说明了PNS能够促进KCs向免疫耐受的M2型极化。
NF-κB是一类转录因子,与炎症反应、免疫应答及细胞的增生、转化和凋亡等重要的病理生理过程密切相关,NF-κB的活化是KCs产生炎症因子必不可少的重要环节[25-27]。Keap1-Nrf2-ARE信号通路是抗氧化应激的主要承担着,当机体处于氧化应激状态可以促使Nrf2与Keap1解体,随后Nrf2转位进入细胞核,在各个功能区的密切配合下与ARE结合,促使下游Ⅱ相解毒酶和抗氧化酶基因的表达[28-30]。我们通过检测NF-κB以及Keap1-Nrf2-ARE信号通路相关蛋白发现,PNS能够降低KCs IRAK4、p-IKKα、p-IκBα、p-p65、Keap1蛋白的表达,而Nrf2、ARE蛋白表达水平升高,也就是说PNS能够抑制KCs NF-κB通路减少炎症反应以及促进Keap1- Nrf2-ARE通路减轻氧化应激反应。接下来,从动物实验我们也进一步证明了PNS预处理的大鼠肝移植后肝功能明显得到改善,促炎因子MCP-1、IL-1β表达水平减低,抗炎因子IL-10升高,并且肝组织病理排斥反应明显得到改善,肝细胞凋亡程度明显低于LT组的细胞凋亡,这也提示PNS对肝细胞有一定程度的保护作用。另外,生存分析发现PNS组大鼠平均存活时间(47±4.2 d)明显高于LT组(12.7±1.1 d),然而使用GdCl3抑制KCs功能发现,即使大鼠进行了PNS预处理,但受体还是出现严重的AcR,这也提示了PNS对KCs的影响在肝移植排斥反应中发挥着重要作用。
综上,本研究认为PNS能够通过抑制NF-κB和Keap1-Nrf2-ARE通路减少活化KCs的炎症和氧化应激反应,促进KCs向免疫耐受的M2型极化,并且对肝细胞有一定的保护作用,从而改善肝组织急性排斥病理改变,提高大鼠移植术后的生存时间。但对于其如何长期有效的诱导肝移植免疫耐受尚需进一步的研究。
| [1] |
Knechtle SJ, Kwun J. Unique aspects of rejection and tolerance in liver transplantation[J].
Semin Liver Dis, 2009, 29(1): 91-101.
|
| [2] |
Durand F, Levitsky J, Cauchy FA, et al. Age and liver transplantation[J].
J Hepatol, 2019, 70(4): 745-58.
DOI: 10.1016/j.jhep.2018.12.009. |
| [3] |
Barjaktarevic I, Lopez RC, Steadman RA, et al. Perioperative considerations in liver transplantation[J].
Semin Respir Crit Care Med, 2018, 39(5): 609-24.
DOI: 10.1055/s-0038-1675333. |
| [4] |
Du Y, Fu M, Wang YT, et al. Neuroprotective effects of ginsenoside Rf on amyloid-beta-induced neurotoxicity in vitro and in vivo[J].
J Alzheimers Dis, 2018, 64(1): 309-22.
DOI: 10.3233/JAD-180251. |
| [5] |
Hu SN, Wu YL, Zhao B, et al. Panax notoginseng saponins protect cerebral microvascular endothelial cells against oxygen-glucose deprivation/reperfusion-induced barrier dysfunction via activation of PI3K/Akt/Nrf2 antioxidant signaling pathway[J].
Molecules, 2018, 23(11): 10.
|
| [6] |
Fan C, Qiao Y, Tang M. Notoginsenoside R1 attenuates high glucose-induced endothelial damage in rat retinal capillary endothelial cells by modulating the intracellular redox state[J].
Drug Des Devel Ther, 2017, 11: 3343-54.
DOI: 10.2147/DDDT. |
| [7] |
Zhou Z, Wang J, Song Y, et al. Panax notoginseng saponins attenuate cardiomyocyte apoptosis through mitochondrial pathway in natural aging rats[J].
Phytother Res, 2018, 32(2): 243-50.
DOI: 10.1002/ptr.5961. |
| [8] |
Shen Q, Li J, Zhang CX, et al. Panax notoginseng saponins reduce high-risk factors for thrombosis through peroxisome proliferator-activated receptor-gamma pathway[J].
Biomed Pharmacother, 2017, 96: 1163-9.
DOI: 10.1016/j.biopha.2017.11.106. |
| [9] |
Chen Y, Liu Z, Liang S, et al. Role of Kupffer cells in the induction of tolerance of orthotopic liver transplantation in rats[J].
Liver Transpl, 2008, 14(6): 823-36.
DOI: 10.1002/(ISSN)1527-6473. |
| [10] |
Jiang QF, Huang MY, Wu KY, et al. Intervention effects of atorvastatin combined with Panax notoginseng saponins on rats with atherosclerosis complicated with hepatic injury[J].
Pharmacogn Mag, 2017, 13(51): 430-8.
|
| [11] |
Dai LL, Gong JP, Zuo GQ, et al. Synthesis of endotoxin receptor CD14 protein in Kupffer cells and its role in alcohol-induced liver disease[J].
World J Gastroenterol, 2003, 9(3): 622-6.
DOI: 10.3748/wjg.v9.i3.622. |
| [12] |
No authors listed. Banff schema for grading liver allograft rejection: An international consensus document[J].
Hepatology, 1994, 25(3): 51-2.
|
| [13] |
Li PZ, He K, Li JZ, et al. The role of Kupffer cells in hepatic diseases[J].
Mol Immunol, 2017, 85: 222-9.
DOI: 10.1016/j.molimm.2017.02.018. |
| [14] |
Sato K, Hall C, Glaser S, et al. Pathogenesis of kupffer cells in cholestatic liver injury[J].
Am J Pathol, 2016, 186(9): 2238-47.
DOI: 10.1016/j.ajpath.2016.06.003. |
| [15] |
Liu YM, Chen Y, Li JZ, et al. Up-regulation of Galectin-9 in vivo results in immunosuppressive effects and prolongs survival of liver allograft in rats[J].
Immunol Lett, 2014, 162(1 Pt A): 217-22.
|
| [16] |
Chen Y, Chen J, Liu ZJ, et al. Relationship between Th1/Th2 cytokines and immune tolerance in liver transplantation in rats[J].
Transplant Proc, 2008, 40(8): 2691-5.
DOI: 10.1016/j.transproceed.2008.08.014. |
| [17] |
Chen Y, Yao T, Shi LJ, et al. Knockdown of interleukin-2 by shRNA-mediated RNA interference prolongs liver allograft survival[J].
J Surg Res, 2008, 159(1): 582-7.
|
| [18] |
Liang S, Chen Y, Long F, et al. Correlation between augmenter of liver regeneration and IFN-γ expression in graft after rat orthotopic liver transplantation[J].
J Surg Res, 2012, 178(2): 968-73.
DOI: 10.1016/j.jss.2012.06.032. |
| [19] |
Xiao J, Zhe T, Yin YZ, et al. Notoginsenoside R1, a unique constituent of Panax notoginseng, blinds proinflammatory monocytes to protect against cardiac hypertrophy in ApoE(-/-) mice[J].
Eur J Pharmacol, 2018, 833: 441-50.
DOI: 10.1016/j.ejphar.2018.07.004. |
| [20] |
Zhao YN, Sun XH, Yu XL, et al. Saponins from Panax notoginseng leaves improve the symptoms of aplastic anemia and aberrant immunity in mice[J].
Biomed Pharmacother, 2018, 102: 959-65.
DOI: 10.1016/j.biopha.2018.03.175. |
| [21] |
Zhao H, Han Z, Li G, et al. Therapeutic potential and cellular mechanisms of panax notoginseng on prevention of aging and cell senescence-associated diseases[J].
Aging Dis, 2017, 8(6): 721-39.
DOI: 10.14336/AD.2017.0724. |
| [22] |
Feito MJ, Diez-Orejas R, Cicuéndez M, et al. Characterization of M1 and M2 polarization phenotypes in peritoneal macrophages after treatment with graphene oxide nanosheets[J].
Colloids Surf B Biointerfaces, 2019, 176: 96-105.
DOI: 10.1016/j.colsurfb.2018.12.063. |
| [23] |
Locati M, Mantovani A, Sica A. Macrophage activation and polarization as an adaptive component of innate immunity[J].
Adv Immunol, 2013, 120: 163-84.
DOI: 10.1016/B978-0-12-417028-5.00006-5. |
| [24] |
Murray PJ. Macrophage Polarization[J].
Annu Rev Physiol, 2017, 79: 541-66.
DOI: 10.1146/annurev-physiol-022516-034339. |
| [25] |
Gong XW, Xu YJ, Yang QH, et al. Effects of soothing liver and invigorating spleen recipes on the IKK beta-NF-kappa B signaling pathway in kupffer cells of nonalcoholic steatohepatitis rats[J].
Evid Based Complement Alternat Med, 2015, 2015: 687690.
|
| [26] |
Sun SC. The non-canonical NF-κB pathway in immunity and inflammation[J].
Nat Rev Immunol, 2017, 17(9): 545-58.
DOI: 10.1038/nri.2017.52. |
| [27] |
D'ignazio L. Bandarra D, rocha S. NF-κB and HIF crosstalk in immune responses[J].
FEBS J, 2016, 283(3): 413-24.
DOI: 10.1111/febs.13578. |
| [28] |
Smith RE, Tran K, Smith CC, et al. The role of the Nrf2/ARE antioxidant system in preventing cardiovascular diseases[J].
Diseases, 2016, 4(4): 10.
|
| [29] |
Silva MD, Pruccoli L, Morroni FA, et al. The Keap1/Nrf2-ARE pathway as a pharmacological target for chalcones[J].
Molecules, 2018, 23(7): 10.
|
| [30] |
Raghunath A, Nagarajan R, Sundarraj K, et al. Identification of compounds that inhibit the binding of Keap1a/Keap1b Kelch DGR domain with Nrf2 ETGE/DLG motifs in zebrafish[J].
Basic Clin Pharmacol Toxicol, 2019.
|
 2019, Vol. 39
2019, Vol. 39

