鼻咽癌(NPC)是头颈部最常见的恶性肿瘤之一[1]。早期NPC患者可通过单纯放疗获得满意的疗效;但晚期NPC患者常需采用放疗和化疗相结合的治疗方法[2]。目前,化疗药物的耐药性已成为NPC患者治疗的主要障碍之一[3]。长的非编码RNA(lncRNA)是一类长度超过200个核苷酸并缺乏编码蛋白潜力的RNA [4-5]。X失活特异性转录本(XIST)是一种lncRNA,其在多种肿瘤组织异常表达,并与肿瘤细胞的化疗耐药性密切相关[6]。例如,慢病毒介导的XIST上调可抑制卵巢癌CAOV3和OVCAR3细胞增殖和侵袭,并降低肿瘤细胞对顺铂(DDP)的耐药性[7],而敲除XIST可通过抑制自噬而降低非小细胞肺癌对DDP的耐药性[8]。然而,关于XIST在NPC细胞DDP耐药性中是否发挥调控作用尚未可知。故本研究从2014年3月开始以人NPC DDP耐药HNE1细胞株(HNE1/DDP)为模型,通过采用干扰和过表达技术观察下调和上调XIST后对HNE1/DDP细胞DDP耐药性的影响,并探讨其可能的分子机制。
1 材料和方法 1.1 材料人NPC细胞株(HNE1)和人NPC DDP耐药HNE1细胞株(HNE1/DDP)来源于中南大学湘雅三医院耳鼻喉头颈外科,促凋亡因子程序性细胞死亡4(PDCD4)和Fas配体(Fas-L)蛋白抗体来源于美国Abcam,XIST短发夹RNA(XIST shRNA)、shRNA阴性对照(shRNA control)、XIST过表达载体(XIST overexpressing vector)及对照载体(control vector)均来源于苏州GenePharma,3(- 4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)、二甲亚砜(DMSO)及顺铂(DDP)来源于美国Sigma-Aldrich,细胞凋亡试剂来源于美国BD Biosciences,EdU细胞增殖检测试剂来源于上海Beyotime Biotechnology,细胞培养试剂来源于美国HyClone,TRIzol试剂和Lipofetamine 2000来源于美国Thermo Scientific,引物、Reverse Transcription System Kit及SYBR Green PCR Master Mix来源于北京Takara。
1.2 细胞培养及转染HNE1和HNE1/DDP细胞均以RPMI 1640培养基和10%加热灭活的胎牛血清培养,并添加100 μg/mL青霉素和链霉素。细胞转染过程如下:将处于对数生长期的细胞接种到完全培养基中的六孔板中,待细胞生长至80%左右时,通过Lipofectamine 2000将50 nmol/L XIST shRNA和shRNA control或1 µg XIST过表达载体和对照载体瞬时转染至HNE1/DDP细胞。转染48 h后,通过荧光定量PCR检测XIST的表达水平。
1.3 RNA抽提、逆转录及荧光定量PCR按照制造商提供的说明书,用TRIzol试剂从细胞中提取总RNA,通过NanoDrop分光光度计检测提取的RNA的浓度和纯度,并使用Reverse Transcription System Kit以1 μg总RNA合成cDNA。使用SYBR Green PCR Master Mix在ABI7500实时荧光定量PCR仪上检测XIST表达水平。反应条件如下:95 ℃ 5 min(聚合酶活化),然后进行40个循环:95 ℃ 30 s(变性),55 ℃ 30 s(退火)和72 ℃ 45 s(延伸)。XIST引物为:5'-CGCTGA CTACCTGAGATTTA-3'和5'-CTCTGTTACGCAGAA CCATG-3'。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,GAPDH的引物序列是:5'-GGAGCGAGATCCCTCCA AAAT-3'和5'-GGCTGTTGTCATACTTCTCATGG-3'。
1.4 MTT试验通过3(- 4, 5-二甲基噻唑-2-基)-2, 5-二苯基四唑溴化物(MTT)测定HNE1/DDP细胞对DDP的耐药性性。将转染后的HNE1/DDP细胞接种到96孔板中,每孔6.5×103,每组设计3个重复孔,分别加入含DDP浓度为0、0.1、0.5、2.5、12.5及62.5 μg/mL的RPMI 1640培养基。培养细胞24 h,随后向每个孔中加入20 μL MTT(5 mg/mL),然后弃去培养基,将沉淀物溶于150 μL DMSO中,并使用Beckman酶标仪测量每个孔的光学密度A450 nm值。
1.5 EdU试验采用EdU试验观察细胞增殖过程。将转染后HNE1/DDP细胞接种到24孔板中,每孔5×104,每组设计3个重复孔,每孔加入含DDP浓度为30 μg/mL的RPMI 1640培养基。转染48 h后,根据制造商提供的说明书进行EdU染色,并使用荧光显微镜观察各组细胞增殖情况。
1.6 细胞凋亡试验采用流式细胞技术测定检测细胞凋亡。将转染后的HNE1/DDP细胞(2×105/孔)接种在6孔板中,每组设计3个重复孔,每孔加入含DDP浓度为30 μg/mL的RPMI 1640培养基。转染后48 h后,收集细胞,用PBS洗涤,并用10% RPMI 1640培养基重新悬浮细胞。然后用膜联蛋白V-FITC和碘化丙啶染色细胞,并使用FACSCalibur细胞分选系统分析细胞凋亡情况。
1.7 蛋白质印迹法收获转染的HNE1/DDP细胞并使用蛋白裂解液提取总蛋白。使用10% SDS-PAGE胶分离总蛋白(每个样本50 μg),并转移至硝酸纤维素膜。使用5%脱脂奶粉在37 ℃下封闭膜1 h,然后在4 ℃下与一抗孵育过夜。第2天用TBST洗涤液清洗膜3次,并将膜与二抗在室温下孵育1 h,随后根据制造商提供的说明书使用增强化学发光测定法观察蛋白质条带。
1.8 统计学分析计量资料表示为至少3个独立重复试验的平均数±标准差。所有统计分析均使用SPSS 16.0软件系统(SPSS, Chicago, IL)进行。两组之间的统计学差异采用t检验,多组之间的统计学差异采用单因素方差分析。P < 0.05认为差异具有统计学意义。
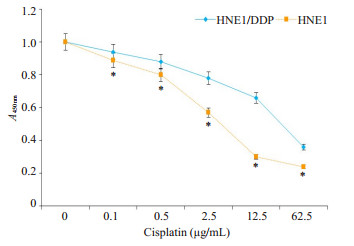
2 结果 2.1 HNE1和HNE1/DDP细胞对DDP的耐药性比较在相同DDP浓度下,与HNE1细胞相比,HNE1/ DDP细胞对DDP耐药性显著增加(图 1)。HNE1细胞DDP IC50为4.73 μg/mL,HNE1/DDP细胞DDP IC50为30.94 μg/mL,HNE1/DDP对HNE1的耐药指数为6.54。
|
图 1 HNE1和HNE1/DDP细胞对DDP的耐药性比较 Fig.1 Comparison of cisplatin resistance of HNE1 and HNE1/DDP cells. *P < 0.05 vs HNE1 cells |
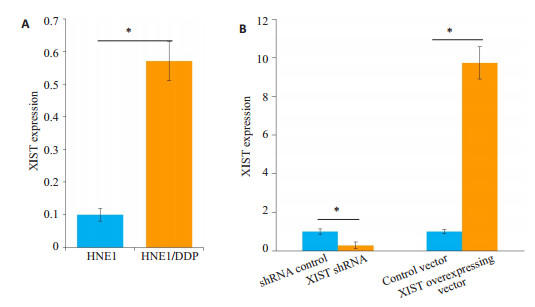
与HNE1细胞相比,XIST在HNE1/DDP细胞中的表达量显著升高(图 2A,P < 0.05)。与shRNAcontrol组相比,XIST shRNA组HNE1/DDP细胞中XIST的表达量显著降低(图 2B);与对照载体组相比,XIST过表达载体组HNE1/DDP细胞中XIST的表达量显著升高(图 2B)。
|
图 2 干扰(A)和过表达(B)XIST对HNE1/DDP细胞中XIST表达的影响 Fig.2 Effect of interference (A) and overexpression (B) of XIST on XIST expression in HNE1/cisplatin cells. *P < 0.05 |
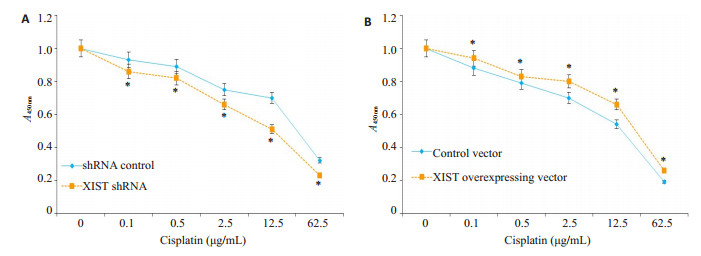
在相同DDP浓度下,与shRNA control组相比,XIST shRNA组HNE1/DDP细胞对DDP耐药性显著降低(图 3A);与对照载体组相比,XIST过表达载体组HNE1/DDP对DDP耐药性显著升高(图 3B)。
|
图 3 干扰(A)和过表达(B)XIST对HNE1/DDP细胞中XIST表达的影响 Fig.3 Effect of interference (A) and overexpression (B) of XIST on XIST expression in HNE1/cisplatin cells. *P < 0.05 |
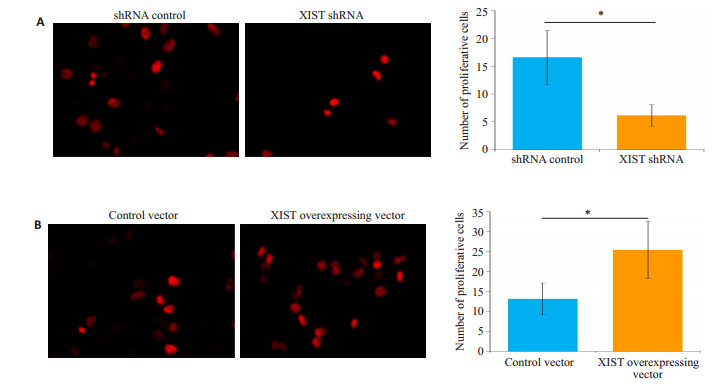
与shRNA control组相比,XIST shRNA组单个视野下增殖细胞数显著减少(图 4A);与对照载体组相比,XIST过表达载体组单个视野下增殖细胞数显著增加(图 4B)。
|
图 4 干扰(A)和过表达(B)XIST对HNE1/cisplatin细胞增殖的影响 Fig.4 Effect of interference (A) and overexpression (B) of XIST on proliferation of HNE1/cisplatin cells (Original magnification, × 400). *P < 0.05 |
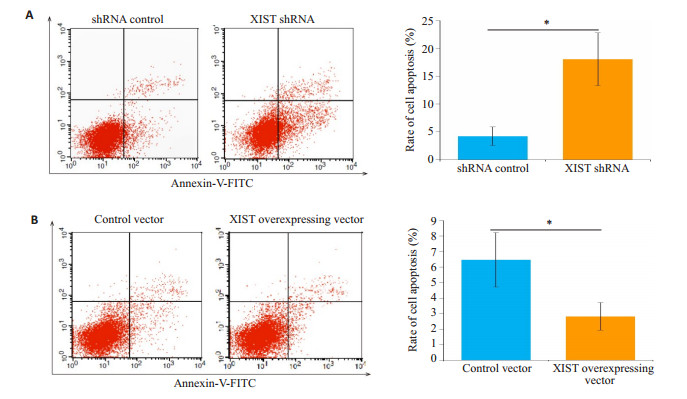
与shRNA control组相比,XIST shRNA组HNE1/ DDP细胞凋亡率显著增加(图 5A);与对照载体组相比,XIST过表达载体组HNE1/DDP细胞凋亡率减少(图 5B)。
|
图 5 干扰(A)和过表达(B)XIST对HNE1/cisplatin细胞凋亡的影响 Fig.5 Effect of interference (A) and overexpression (B) of XIST on apoptosis of HNE1/cisplatin cells. PI: Propidium iodide. *P < 0.05 |
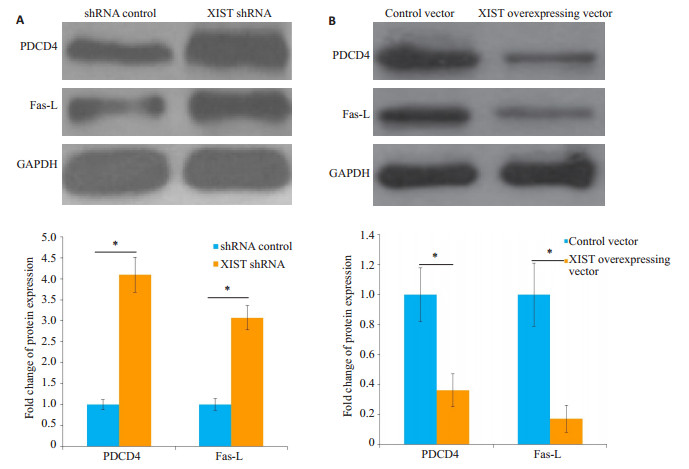
与shRNA control组相比,XIST shRNA组HNE1/ DDP细胞中PDCD4和Fas-L蛋白的表达量显著升高(图 6A);与对照载体组相比,XIST过表达载体组HNE1/DDP细胞凋亡率降低(图 6B)。
|
图 6 干扰(A)和过表达(B)XIST对HNE1/cisplatin细胞中PDCD4和Fas-L蛋白表达的影响 Fig.6 Effect of interference (A) and overexpression (B) of XIST on programmed cell death 4 (PDCD4) and Fas ligand (Fas-L) protein expressions in HNE1/cisplatin cells detected by Western blotting. *P < 0.05 |
DDP是NPC患者的常用的化疗药物之一,而肿瘤细胞对DDP耐药性是临床治疗NPC的主要障碍[9]。因此,阐明DDP的耐药机制对改善NPC的疗效具有重要的意义。近年来,越来越多的证据表明lncRNA在调节NPC的耐药性中起关键作用[10-11]。例如,lncRNA结肠癌相关转录物-1(CCAT1)的上调可导致NPC细胞对紫杉醇的化疗耐药性增加[12]。LncRNA ROR可通过p53途径促进NPC细胞化疗耐药性[13]。此外,n375709,一种新发现的lncRNA,亦被证实在NPC细胞中高表达,并参与肿瘤细胞对紫杉醇化疗耐药性的调节[14]。XIST基因位于X失活中心(XIC),其转录产物由无活性X染色体(Xi)转录获得。目前有证据表明,XIST在人类细胞的分化、增殖和基因组维持中发挥着重要作用[15-17]。最近研究还发现,XIST在肿瘤细胞化疗耐药性中亦具有重要调控作用。例如,Sun等[18]发现肺腺癌DDP耐药(A549/DDP)细胞中XIST表达较A549细胞显著升高,过表达XIST可通过保护细胞免于凋亡及促进增殖而增加A549/DDP细胞对DDP的耐药性。Zhu等[19]报道XIST在阿霉素耐药的结肠癌组织和细胞中表达上调,干扰XIST可降低结直肠癌细胞对阿霉素的耐药性。Du等[20]发现过表达XIST可增加胶质瘤细胞对替莫唑胺的耐药性。鉴于上述报道,我们推测XIST可能在调控HNE1/DDP细胞对DDP耐药中发挥重要作用。
本研究以HNE1/DDP为模型,通过采用干扰和过表达技术观察下调和上调XIST对HNE1/DDP细胞DDP耐药性的影响及可能的机制。结果发现,与HNE1相比,HNE1/DDP对DDP具有较高的耐药性,故HNE1/ DDP模型可用NPC DDP耐药性的研究。荧光定量PCR显示,XIST在HNE1/DDP细胞中的表达量较HNE1显著升高。该结果与Sun [18]和Zhu等[19]的研究结果一致,表明XIST在HNE1/DDP细胞中呈现高表达状态。随后MTT试验发现,下调XIST的表达可显著降低HNE1/DDP细胞对DDP的耐药性,而上调XIST增加对DDP的耐药性。该结果表明,高表达的XIST在HNE1/ DDP细胞DDP耐药中发挥重要作用,而人为调控XIST的表达可改变HNE1/DDP细胞对DDP的耐药性。
细胞增殖和凋亡与肿瘤细胞的化疗耐药性密切相关,且肿瘤细胞增殖升高和凋亡抑制是耐药性的潜在保护机制[21-22]。为了探究XIST在HNE1/DDP细胞耐药中的机制,本研究采用EdU试验和流式细胞技术观察XIST上调和下调对HNE1/DDP细胞增殖和凋亡的影响。结果发现,转染XIST shRNA可有效降低HNE1/ DDP细胞中XIST表达,而转染XIST过表达载体可显著增加XIST表达。更为重要的是,我们发现下调XIST的表达显著降低HNE1/DDP细胞增殖并诱导细胞凋亡,而上调XIST的表达显著增加HNE1/DDP细胞增殖并抑制细胞凋亡。该结果与Sun [18]和Zhu等[19]的研究结果一致,表明XIST主要通过调控细胞增殖和凋亡而影响HNE1/DDP细胞对DDP的耐药性。
细胞凋亡主要涉及外在受体和/或内在线粒体途径[23-24]。最近的研究表明,PDCD4可参与线粒体介导的细胞凋亡,而Fas/Fas-L参与受体介导的细胞凋亡[25-26]。DDP引起细胞毒性主要通过与DNA的相互作用形成DNA复合物,最终激活外在和内在的细胞凋亡途径[27-29]。DDP可通过激活Fas/Fas-L途径影响膜流动性,且Fas/Fas-L系统的失调可能是卵巢上皮癌细胞对DDP耐药性的重要决定因素[30-31]。因本研究已经发现XIST可影响HNE1/DDP细胞凋亡,故采用蛋白质印迹法检测XIST上调和下调对HNE1/DDP细胞中PDCD4和Fas-L蛋白表达的影响。结果发现,下调XIST的表达显著增加HNE1/DDP细胞中PDCD4和Fas-L蛋白的表达,而上调XIST降低PDCD4和Fas-L蛋白的表达。该结果表明,XIST对HNE1/DDP细胞DDP耐药性的调控作用可能与PDCD4和Fas-L蛋白表达改变相关。
总之,本研究发现XIST在HNE1/DDP细胞中表达升高,下调和上调XIST的表达可分别降低和增加HNE1/DDP细胞对DDP的耐药性,其机制可能与PDCD4和Fas-L蛋白表达改变相关。鉴于XIST在HNE1/DDP细胞DDP耐药中的关键作用,表明XIST可能作为治疗NPC DDP耐药新的分子靶点。
| [1] |
Tang LL, Chen WQ, Xue WQ, et al. Global trends in incidence and mortality of nasopharyngeal carcinoma[J].
Cancer Lett, 2016, 374(1): 22-30.
|
| [2] |
Kamran Sc RN, Lee N. Nasopharyngeal carcinoma[J].
Surg Oncol Clin NAm, 2015, 24(3): 547-61.
DOI: 10.1016/j.soc.2015.03.008. |
| [3] |
Kong M LY, Kim Y. Concurrent chemoradiotherapy for locoregionally advanced nasopharyngeal carcinoma: treatment outcomes and prognostic factors[J].
Asian Pac J Cancer Prev, 2018, 19(6): 1591-9.
|
| [4] |
Johnsson P, Morris KV. Expanding the functional role of long noncoding RNAs[J].
Cell Res, 2014, 24(11): 1284-5.
DOI: 10.1038/cr.2014.104. |
| [5] |
Bergmann JH, Spector DL. Long non-coding RNAs: modulators of nuclear structure and function[J].
Curr Opin Cell Biol, 2014, 26(2): 10-8.
|
| [6] |
Zhu JW, Kong FY, Xing L, et al. Prognostic and clinicopathological value of long noncoding RNA XIST in cancer[J].
Clin Chim Acta, 2018, 479(4): 43-7.
|
| [7] |
Wang CH, Qi S, Xie C, et al. Upregulation of long non-coding RNA XIST has anticancer effects on epithelial ovarian cancer cells through inverse downregulation of hsa-miR-214-3p[J].
J Gynecol Oncol, 2018, 29(6): e99.
DOI: 10.3802/jgo.2018.29.e99. |
| [8] |
Sun W, Zu YK, Fu XN, et al. Knockdown of lncRNA-XIST enhances the chemosensitivity of NSCLC cells via suppression of autophagy[J].
Oncol Rep, 2017, 38(6): 3347-54.
|
| [9] |
Peng YK, He GC, Tang D, et al. Lovastatin inhibits cancer stem cells and sensitizes to chemo- and photodynamic therapy in nasopharyngeal carcinoma[J].
J Cancer, 2017, 8(9): 1655-64.
DOI: 10.7150/jca.19100. |
| [10] |
Deng H, Zhang J, Shi J, et al. Role of long non-coding RNA in tumor drug resistance[J].
Tumour Biol, 2016, 37(9): 11623-31.
DOI: 10.1007/s13277-016-5125-8. |
| [11] |
Wu JJ, Hann SS. Functions and roles of Long-Non-Coding RNAs in human nasopharyngeal carcinoma[J].
Cell Physiol Biochem, 2018, 45(3): 1191-204.
DOI: 10.1159/000487451. |
| [12] |
Wang Q ZW, Hao S. LncRNA CCAT1 modulates the sensitivity of paclitaxel in nasopharynx cancers cells via miR-181a/CPEB2 axis[J].
Cell Cycle, 2017, 16(8): 795-801.
DOI: 10.1080/15384101.2017.1301334. |
| [13] |
Li L, Gu M, You B, et al. Long non-coding RNA ROR promotes proliferation, migration and chemoresistance of nasopharyngeal carcinoma[J].
Cancer Sci, 2016, 107(9): 1215-22.
DOI: 10.1111/cas.12989. |
| [14] |
Ren SL, Li G, Liu C, et al. Next Generation deep sequencing identified a novel lncRNA n375709 associated with paclitaxel resistance in nasopharyngeal carcinoma[J].
Oncol Rep, 2016, 36(4): 1861-7.
|
| [15] |
Cerase A, Pintacuda G, Tattermusch A, et al. Xist localization and function: new insights from multiple levels[J].
Genome Biol, 2015, 16(1): 166.
DOI: 10.1186/s13059-015-0733-y. |
| [16] |
Mira-Bontenbal H, Gribnau J. New Xist-Interacting proteins in XChromosome inactivation[J].
Curr Biol, 2016, 26(8): R338-42.
DOI: 10.1016/j.cub.2016.03.022. |
| [17] |
Chaligne R, Heard E. X-chromosome inactivation in development and cancer[J].
FEBS Lett, 2014, 588(15): 2514-22.
DOI: 10.1016/j.febslet.2014.06.023. |
| [18] |
Sun J, Pan LM, Chen LB, et al. LncRNA XIST promotes human lung adenocarcinoma cells to cisplatin resistance via let-7i/BAG-1 axis[J].
Cell Cycle, 2017, 16(21): 2100-7.
DOI: 10.1080/15384101.2017.1361071. |
| [19] |
Zhu J, Zhang R, Yang D, et al. Knockdown of long non-coding RNA XIST inhibited doxorubicin resistance in colorectal cancer by upregulation of miR-124 and downregulation of SGK1[J].
Cell Physiol Biochem, 2018, 51(1): 113-28.
DOI: 10.1159/000495168. |
| [20] |
Du P, Zhao H, Peng R, et al. LncRNA-XIST interacts with miR-29c to modulate the chemoresistance of glioma cell to TMZ through DNA mismatch repair pathway[J].
Biosci Rep, 2017, 37(5): BSR20170696.
DOI: 10.1042/BSR20170696. |
| [21] |
Mohammad RM, Muqbil I, Lowe L, et al. Broad targeting of resistance to apoptosis in cancer[J].
Semin Cancer Biol, 2015, 35(Suppl): S78-103.
|
| [22] |
Giussani P, Tringali C, Riboni L, et al. Sphingolipids: key regulators of apoptosis and pivotal players in cancer drug resistance[J].
Int J Mol Sci, 2014, 15(3): 4356-92.
DOI: 10.3390/ijms15034356. |
| [23] |
Green DR, Llambi F. Cell death signaling[J].
Cold Spring Harb Perspect Biol, 2015, 7(12): a006080.
DOI: 10.1101/cshperspect.a006080. |
| [24] |
Hathaichoti S, Visitnonthachai D, Ngamsiri P, et al. Paraquat induces extrinsic pathway of apoptosis in A549 cells by induction of Dr5 and repression of anti-apoptotic proteins, DDX3 and GSK3 expression[J].
Toxicol In Vitro, 2017, 42(8): 123-9.
|
| [25] |
Jo hn, Ze ng, Ho ng, et al. The clinical association of programmed celldeath protein 4(PDCD4) with solid tumors and its prognostic significance: a meta-analysis[J].
Chin J Cancer, 2016, 35(12): 683-98.
|
| [26] |
Yang GD, Huang TJ, Peng LX, et al. Epstein- Barr virus_encoded LMP1 upregulates microRNA-21 to promote the resistance of nasopharyngeal carcinoma cells to cisplatin-induced apoptosis by suppressing PDCD4 and Fas-L[J].
PLoS One, 2013, 8(10): e78355.
DOI: 10.1371/journal.pone.0078355. |
| [27] |
Groh T, Hrabeta J, Khalil M, et al. The synergistic effects of DNAdamaging drugs cisplatin and etoposide with a histone deacetylase inhibitor valproate in high-risk neuroblastoma cells[J].
Int J Oncol, 2015, 47(1): 343-52.
DOI: 10.3892/ijo.2015.2996. |
| [28] |
Wen Y, Guo Y, Huang Z, et al. Adiposederived mesenchymal stem cells attenuate cisplatininduced apoptosis in epithelial ovarian cancer cells[J].
Mol Med Rep, 2017, 16(6): 9587-92.
DOI: 10.3892/mmr.2017.7783. |
| [29] |
Li Y, He LR, Gao Y, et al. CHD1L contributes to cisplatin resistance by upregulating the ABCB1-NF-kappa B axis in human non-smallcell lung cancer[J].
Cell Death Dis, 2019, 10(2): 99.
DOI: 10.1038/s41419-019-1371-1. |
| [30] |
Topcu-Tarladacalisir Y S-, Karaca T. Curcumin counteracts cisplatininduced nephrotoxicity by preventing renal tubular cell apoptosis[J].
Ren Fail, 2016, 38(10): 1741-8.
DOI: 10.1080/0886022X.2016.1229996. |
| [31] |
Yang F, Long W, Xuechuan H, et al. Upregulation of Fas in epithelial ovarian cancer reverses the development of resistance to cisplatin[J].
BMB Rep, 2015, 48(1): 30-5.
DOI: 10.5483/BMBRep.2015.48.1.042. |
 2019, Vol. 39
2019, Vol. 39

