2. 锦州医科大学第一临床医学院,辽宁 锦州 121000
2. Department of Traditional Chinese Medicine and Acupuncture, First Clinical Medical College of Jinzhou Medical University, Jinzhou 121000, China
口腔癌是全球第六大常见恶性肿瘤, 每年约有25万人死于该病[1]。而舌鳞状细胞癌(TSCC)是口腔内诊断最常见的恶性肿瘤之一, 由于其区域复发和淋巴转移率高, 预后不良。目前, 治疗手段包括手术、放疗、化疗以及手术和化疗的组合, 经治疗后, 5年生存率仅为55% [2-3], 且各种治疗方法都有不同程度的不良反应。因此, 寻找安全有效的天然产物一直是人类舌癌治疗的重点。
巴西苏木素又称巴西红木素, 为中药苏木芯材的提取物, 是中药苏木的主要活性成分, 已被报道具有抗炎、抗菌和抗肿瘤等活性[4-7], 巴西苏木素是一种很有前景的预防性药物, 因为它通常是无毒的并可干扰癌变发生过程。几种合成类型的巴西苏木素类似物已经在MTT测定中证实了对多种人癌细胞系具有预防作用[8]。已有研究证实, 巴西苏木素对舌癌Tca8113细胞具有一定的抑制作用[9], 但其抑制Tca8113细胞的具体机制尚不完全清楚。因此, 本实验主要从凋亡和自噬两方面探索巴西苏木素对Tca8113细胞的影响, 为临床应用提供实验依据。
1 材料和方法 1.1 材料和仪器Tca8113口腔鳞状癌细胞株(中科院细胞库), 胎牛血清、DMEM培养基、青链霉素双抗(Hyclone), 巴西苏木素单体(维克奇), Compound C(Selleck), MTT (sigma), western及IP细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配置试剂盒、辣根过氧化物酶标记山羊抗兔IgG (H+L)(碧云天), AV-FITC/PI凋亡检测试剂盒(四正柏)、Bcl-2、Cleaved-Caspase3、LC3B (CST), β-actin、bax、p62、p-AMPK(博奥森), p-mTOR (Abcam)。
CO2培养箱(Thermo), 酶标仪(雷勃), 普通光学倒置显微镜(Olympus), 荧光显微镜(Olympus)。
1.2 方法 1.2.1 细胞培养舌癌细胞株TCA-8113用含10%胎牛血清及1%青链霉素的RPMI 1640培养基培养, 放置于37 ℃、5% CO2恒温培养箱中, 每3~4 d进行1次细胞传代, 取处于对数生长期细胞进行后续实验。
1.2.2 MTT法检测细胞存活率将处于对数生长期、生长状态良好的Tca8113细胞用胰酶消化、离心、重悬后, 按照6×103/孔均匀接种于96孔板内, 待24 h贴壁后, 将含巴西苏木素的培养基加入板内, 浓度分别为1、5、10、20、30、40、80、100、200 μmol/L, 每组设置5个平行复孔, 另外设置不加药的空白对照组。加药后继续培养24 h, 每孔加入20 μL 5 mg/mL的MTT染色液, 继续培养4 h后, 吸净培养基, 每孔加入150 μL DMSO溶液, 置于水平摇床室温摇匀, 待甲瓒结晶完全溶解, 用酶标仪测定490 nm处的吸光度值(A), 每组取各孔平均值, 并按照如下公式计算细胞生长抑制率:
抑制率(%) = (A空白对照组-A实验组) /A空白对照组×100%
1.2.3 Hoechst33342染色观察细胞凋亡形态将细胞按照10×104/孔均匀接种于6孔板中, 37°培养24 h后给药, 浓度分别为20、30、40 μmol/L, 空白对照组只更换培养基, 每组均设置1个复孔。继续培养24 h后, 加入Hoechst33342染色液, 37 ℃避光染色30 min后, 用PBS漂洗3次, 于倒置荧光显微镜下观察细胞核着色情况及细胞形态变化。
1.2.4 Annexin V/PI双染色检测细胞凋亡率将正常培养的细胞更换含巴西苏木素培养基, 浓度分别为20、30、40 μmol/L, 设置不含药空白对照组。继续培养24 h后, 收集各组细胞, 用不含EDTA胰酶消化并离心, 制成单细胞悬液, PBS洗2遍后, 加入500 μL Binding buffer、5 μL的AnnexinV FITC染液和10 μL PI染色液, 混匀后室温避光孵育15 min转移至流式管上机检测。
1.2.5 Western blot检测凋亡及自噬相关蛋白表达细胞分组及给药情况同上, 收集给药24 h细胞样, 用western及IP细胞裂解液提取各组细胞总蛋白, BCA蛋白浓度测定试剂盒测定蛋白浓度。SDS-PAGE电泳2 h, 恒流300 mA转膜1 h, 5%胎牛血清(BSA)室温封闭1.5 h, 一抗(bcl-2、bax、cleaved-Caspase3、LC3B、p62、p-AMPK、p-mTOR) 4°过夜, 洗膜后, 二抗室温孵育1 h, 洗膜、显色。
1.2.6 AMPK通路抑制剂Compound C处理Tca8113细胞将正常培养的细胞分为3组, 空白对照组(Control组)、巴西苏木素组(Brazilin组)、巴西苏木素和AMPK抑制剂组(Brazilin+Compound C组), 其中, 巴西苏木素浓度为40 μmol/L, Compound C为5 μmol/L。给药时, 巴西苏木素和AMPK抑制剂组中两种药物同时给作用于Tca8113细胞。收集各组给药后24 h细胞样品, 用于Western blot检测蛋白p-AMPK及p-mTOR表达。
1.2.7 统计学方法采用SPSS 17.0对数据进行统计学分析, 统计数据皆采用均数±标准差表示, 采用单因素方差分析进行不同组之间比较, SNK法两两比较。P< 0.05为差异有统计学意义。
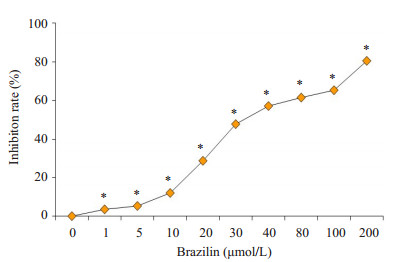
2 结果 2.1 巴西苏木素抑制Tca8113细胞增殖MTT结果显示, 经巴西苏木素处理后, Tca8113细胞增殖明显被抑制, 且该抑制作用随药物浓度的增大而增强(图 1, P< 0.05)。巴西苏木素作用于Tca8113细胞24 h时, 半数抑制浓度(IC50)为31.17 μmol/L。
|
图 1 巴西苏木素对Tca8113细胞增殖的影响 Fig.1 Inhibitory effect of brazilin at different concentrations on proliferation of Tca8113 cells. *P < 0.05 vs 0 μmol/L |
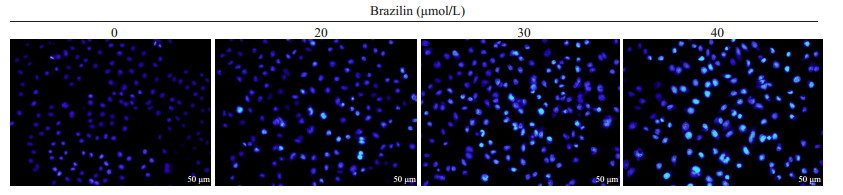
使用Hoechst33342染色后, 荧光显微镜下观察到, 空白对照组细胞形态规则, 胞核完整, 染色均匀, 经不同浓度药物作用24 h后, 细胞形态及细胞核发生不同程度改变。细胞扁圆, 核膜消失, 染色质皱缩, 胞核碎裂, 部分胞核呈"新月状"和"花瓣状", 且该形态变化随药物浓度增加而更加明显(图 2)。
|
图 2 巴西苏木素对Tca8113细胞形态学的影响 Fig.2 Effect of brazilin on the morphology of Tca8113 cells (Original magnification: ×200) |
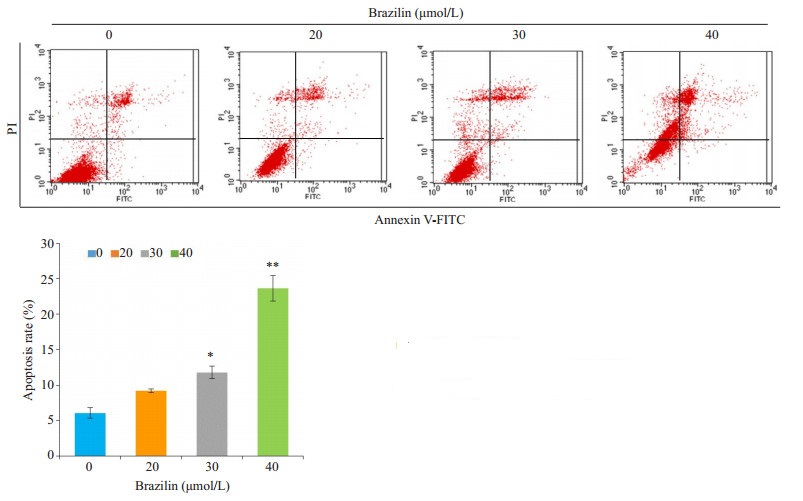
通过流式细胞仪检测各组凋亡情况, 结果显示:不同浓度巴西苏木素作用于Tca8113细胞24 h后, 细胞凋亡率随药物浓度增加而增加(图 3), 浓度为20、30、40 μmol/L时, Tca8113细胞存活率分别为8.48%、10.26%、25.54%, 均高出空白对照组7.06%。除20 μmol/L外, 另外两组与对照组相比, 差异均有统计学意义(P< 0.05)。
|
图 3 巴西苏木素对Tca8113细胞凋亡的影响 Fig.3 Effect of brazilin on apoptosis of Tca8113 cells. *P < 0.05, **P < 0.01 vs 0 μmol/L |
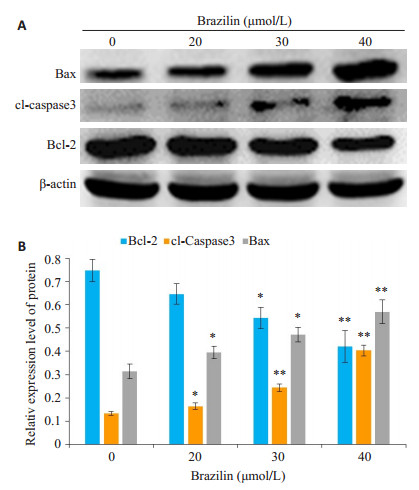
Western blot结果显示, 与空白对照组相比, 不同浓度的巴西苏木素作用24 h后, 凋亡相关蛋白Bax的表达量明显升高(P < 0.05), 而抗凋亡蛋白Bcl-2的表达量显著降低(P < 0.05);同时, 各实验组凋亡关键蛋白cleaved caspase3的表达水平均明显高于空白对照组的表达水平(P < 0.05, 图 3)。
3 讨论巴西苏木素作为中药苏木的主要活性成分之一, 其抗肿瘤作用已被广泛研究和报道, 包括胶质母细胞瘤[4]、膀胱癌[6]、头颈鳞状细胞癌[7]等。研究发现, 巴西苏木素能抑制舌癌细胞Tca8113细胞的增殖, 促进细胞凋亡[9], 但巴西苏木素对舌癌细胞的抑制作用的具体机制尚不清楚。
本实验采用MTT细胞活力检测法观察巴西苏木素对Tca8113细胞的抑制作用, 结果显示, 巴西苏木素对Tca8113细胞有明显的抑制作用, 且呈浓度依赖性, 表明巴西苏木素具有明显的抗肿瘤作用。随后, 采用Hoechst33342染色液检测巴西苏木素作用后Tca8113细胞的凋亡情况, 结果发现, 给药组细胞的细胞形态发生明显改变, 细胞扁圆, 核膜消失, 染色质皱缩, 部分胞核呈"新月状"和"花瓣状", 且这种凋亡形态改变随巴西苏木素浓度的增加而明显。我们进一步采用Annexin V/PI双染色法检测巴西苏木素作用于Tca8113细胞24h后细胞凋亡率, 结果表明, 巴西苏木素可诱导Tca8113细胞凋亡, 且该凋亡作用呈剂量依赖性。
|
图 4 巴西苏木素对Tca8113细胞Bax、Bcl-2和cl-caspase3蛋白表达量的影响 Fig.4 Effect of brazilin at different concentrations on the expressions of Bax, Bcl-2 and cleaved caspase-3 proteins in Tca8113 cells. A: Expression of bax, Bcl-2 and cleaved caspase-3 in Tca8113 detected by Western blotting; B: Analysis of relative expressions of the proteins. *P < 0.05, **P < 0.01 vs 0 μmol/L |
|
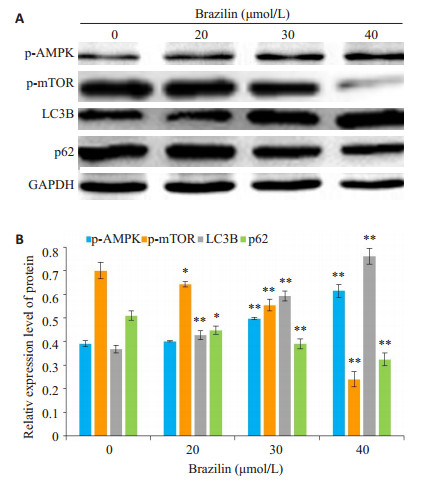
图 5 巴西苏木素对Tca8113细胞p-AMPK、p-mTOR、LC3B和p62蛋白表达量的影响 Fig.5 Effect of brazilin at different concentrations on the expressions of p-AMPK, p-mTOR, LC3B and p62 proteins in Tca8113 cells. A: Expression of p-AMPK, p-mTOR, LC3B and p62 in Tca8113 detected by Western blotting; B: Analysis of the relative expressions of the proteins. *P < 0.05, **P < 0.01 vs 0 μmol/L |
细胞凋亡是由基因调控的程序性细胞死亡, 凋亡过程主要包括DNA片段化和蛋白质降解, 分裂成凋亡小体。在肿瘤发展过程中, 肿瘤细胞通过逃避凋亡而促进肿瘤发展, 有诸多研究发现, 具有抗肿瘤特性的药物大多通过促进肿瘤细胞凋亡而抑制肿瘤发展, 例如顺铂、熊果酸、人参皂苷RG5等[10-12]。Bcl-2家族蛋白是一类与凋亡密切相关的蛋白, 其中, Bcl-2蛋白是Bcl-2家族中最关键的抗凋亡蛋白, 其过度表达时可抑制细胞的凋亡过程; bax则是关键的促凋亡蛋白。在线粒体凋亡途径中, 当线粒体凋亡程序被启动后, bax蛋白被激活, 线粒体膜通透性改变, 释放细胞色素C, 进而激活下游的半胱氨酸蛋白酶(caspases)。而caspase家族蛋白作为炎症和细胞凋亡的调节剂, 在许多细胞死亡途径中具有关键作用, 这些分子参与细胞凋亡的起始和发展[13-15]。参与凋亡的caspase家族蛋白分为起始相关性caspase (2, 8, 9, 10)蛋白和效应相关性caspase (3, 6, 7)蛋白, 而最终发挥效应的是caspase3蛋白。活化的caspase3 (cleaved-caspase3)的作用主要是催化聚(ADP-核糖)聚合酶裂解, 阻止DNA修复, 从而导致细胞凋亡[16-18]。本实验中, Tca8113细胞经巴西苏木素处理后cleavedcaspase3与bax的表达均明显上调, 抗凋亡蛋白Bcl-2的表达, 以上结果提示, 巴西苏木素可通过线粒体凋亡途径诱导舌癌Tca8113细胞凋亡。
自噬, 即"自我吞噬", 细胞利用溶酶体将功能失调或受损的细胞器分解并通过溶酶体再循环利用, 是细胞生长发育、成熟分化和死亡的重要调控机制, 与包括肿瘤在内的多种人类疾病的发生发展密切相关。自噬对肿瘤具有抑制和促进的双向调节作用, 当外界环境变化刺激细胞时, 为更好适应环境, 细胞自噬水平会迅速增高; 但若自噬水平过度失调, 又可以导致细胞凋亡[19-21]。LC3是自噬过程中最关键蛋白之一, 正常情况下, LC3前体被ATG4切掉C端120个氨基酸, 残片称为LC3Ⅰ。在自噬发生时, LC3Ⅰ被泛素化修饰为LC3Ⅱ并铆钉于自噬泡双层膜结构上, 进而参与细胞自噬。p62是聚集在自噬体上并能与LC3Ⅱ相互作用从而引导自噬体降解的蛋白, 是评价自噬体降解的指标。当自噬发生障碍或过度自噬时, 聚集在自噬体上的p62不能被降解, p62蛋白表达水平会增高[22-24]。本实验通过Western blot检测到, Tca8113细胞经巴西苏木素处理后, LC3蛋白表达量随巴西苏木素浓度的升高而增加, p62表达量则降低, 结果表明巴西苏木素可增加Tca8113细胞自噬。
|
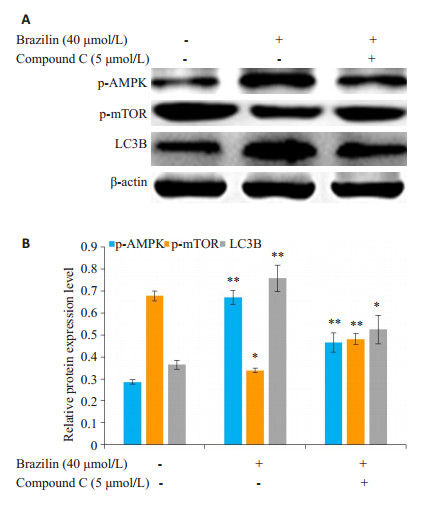
图 6 巴西苏木素与AMPK抑制剂同时作用于Tca8113细胞后p-AMPK、p-mTOR、LC3B蛋白表达量的影响 Fig.6 Effect of brazilin combined with AMPK inhibitor on the expressions of p-AMPK, p-mTOR and LC3B in Tca8113 cells. A: Expression of p-AMPK, p-mTOR and LC3B in Tca8113 detected by Western blotting; B: Analysis of the relative expressions of the proteins. *P < 0.05, **P < 0.01 vs 0 μmol/L |
腺苷酸活化蛋白激酶(AMPK)是细胞能量感受器, 调节细胞能量代谢, 是由α、β、γ亚基构成的异源三聚体。存在于α亚基N端的苏氨酸(Thr172)磷酸化位点活化后可促进细胞自噬[24-25]。乳动物雷帕霉素靶蛋白(mTOR)是一种重要的丝氨酸-苏氨酸蛋白激酶, 在自噬中具有重要作用[26-27]。Unc-51样激酶1 (ULK1)是细胞自噬过程的起始蛋白。正常情况下, mTOR可通过抑制ULK1的活性抑制细胞自噬的发生。当细胞能量缺乏时, AMPK感应激活, 活化的AMPK可直接磷酸化ULK1激活细胞自噬, 亦可通过AMPK的磷酸化抑制mTOR的活化, 解除mTOR对ULK1活性的抑制, 进而促进细胞自噬[28-29]。本研究发现, 巴西苏木素能够活化Tca8113细胞中的AMPK蛋白, 使p-AMPK表达增加, 同时抑制mTOR的活化, 降低p-mTOR的表达。为进一步探究巴西苏木素是否能通过AMPK/mTOR信号通路诱导Tca8113细胞自噬, 我们使用了AMPK通路抑制剂Compound C与巴西苏木素同时作用于Tc8113细胞, 并对细胞样品进行了Western blot蛋白检测。结果显示, 加入抑制剂后, 与单纯使用巴西苏木素相比, p-AMPK与LC3B表达量均明显降低, p-mTOR的表达升高。该结果提示, 巴西苏木素可通过AMPK/mTOR通路诱导细胞自噬。
综上所述, 本实验研究结果表明, 巴西苏木素可抑制Tca8113细胞的增殖, 激活线粒体凋亡途径促进细胞凋亡, 并可通过活化AMPK诱导细胞自噬, 为巴西苏木素应用于舌癌的治疗提供了一定的理论基础。
| [1] |
Kumar M, Nanavati R, Modi TG, et al. Oral cancer: Etiology and risk factors:Areview[J].
J Cancer Res Ther, 2016, 12(2): 458-63.
DOI: 10.4103/0973-1482.186696. |
| [2] |
Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J].
CACancer J Clin, 2005, 55(2): 74-108.
DOI: 10.3322/canjclin.55.2.74. |
| [3] |
Sano D, Myers JN. Metastasis of squamous cell carcinoma of the oral tongue[J].
Cancer Metastas Rev, 2007, 26(3/4): 645-62.
|
| [4] |
Lee DY, Lee MK, Kim GS, et al. Brazilin inhibits growth and induces apoptosis in human[J].
Molecules, 2013, 18(2): 2449-57.
DOI: 10.3390/molecules18022449. |
| [5] |
Kang K, Won M, Yuk JM, a l. LinQ attenuates systemic inflammatory responses via selectively impairing the Myddosome complex formation upon TLR4 ligation[J].
Biochem Pharmacol, 2016, 121: 52-66.
|
| [6] |
Zhang TT, Fan XP, Song LL, et al. c-Fos is involved in inhibition of human bladder carcinoma T24 cells by brazilin[J].
IUBMB Life, 2015, 67(3): 175-81.
DOI: 10.1002/iub.1357. |
| [7] |
He ZJ, Zhu FY, Li SS, et al. Inhibiting ROS-NF-kB-dependent autophagy enhanced brazilin-induced apoptosis in head and neck squamous cell carcinoma[J].
Food Chem Toxicol, 2017, 101: 55-66.
DOI: 10.1016/j.fct.2017.01.002. |
| [8] |
Lee DY, Lee MK, Kim GS, et al. Brazilin inhibits growth and induces apoptosis in human glioblastoma cells[J].
Molecules, 2013, 18(2): 2449-57.
DOI: 10.3390/molecules18022449. |
| [9] |
王飞.巴西苏木素联合平阳霉素对人舌癌细胞株(Tca8113)生长的影响[D].兰州: 兰州大学, 2013: 1-48.
|
| [10] |
石璐, 苏静. 顺铂对人舌鳞状细胞癌细胞Tca8113细胞凋亡与自噬的影响[J].
中国老年学杂志, 2013, 33(9): 2088-90.
DOI: 10.3969/j.issn.1005-9202.2013.09.045. |
| [11] |
Chen CF, Yang JS, Chen WK, et al. Ursolic acid elicits intrinsic apoptotic machinery by downregulating the phosphorylation of AKT/BAD signaling in human cisplatin-resistant oral cancer CAR cells[J].
Oncol Rep, 2018, 40(3): 1752-60.
|
| [12] |
李为, 刘伟, 邹君君. 人参皂苷Rg5对胃癌BGC-823细胞增殖, 凋亡及凋亡相关因子的影响[J].
中国中医急症, 2018, 27(6): 955-8.
DOI: 10.3969/j.issn.1004-745X.2018.06.005. |
| [13] |
Chai J, Du C, Wu JW, et al. Structural and biochemical basis of apoptotic activation by Smac/DIABLO[J].
Nature, 2000, 406(6798): 855-62.
DOI: 10.1038/35022514. |
| [14] |
Fan J, Li R, Zhang R, et al. Effect of Bcl-2 and Bax on survival of side population cells from hepatocellular carcinoma cells[J].
World JGastroenterol, 2007, 13(45): 6053-9.
DOI: 10.3748/wjg.v13.45.6053. |
| [15] |
Derakhshan A, Chen Z, Van Waes C. Therapeutic small molecules target inhibitor of apoptosis proteins in cancers with deregulation of extrinsic and intrinsic cell death pathways[J].
Clin Cancer Res, 2017, 23(6): 1379-87.
DOI: 10.1158/1078-0432.CCR-16-2172. |
| [16] |
Liu LS, Bai XQ, Gao Y, et al. PCSK9 promotes oxLDL-Induced PC12 cell apoptosis through the Bcl-2/Bax-Caspase 9/3 signaling pathway[J].
JAlzheimersDis, 2017, 57(3): 723-34.
|
| [17] |
Fulda S. Targeting apoptosis for anticancer therapy[J].
Semin CancerBiol, 2015, 31: 84-8.
DOI: 10.1016/j.semcancer.2014.05.002. |
| [18] |
Kuribayashi K, Mayes PA, El-Deiry WS. What are caspases 3 and 7 doing upstream of the mitochondria[J].
Cancer Biol Ther, 2006, 5(7): 763-5.
DOI: 10.4161/cbt.5.7.3228. |
| [19] |
Sun L, Liu N, Liu SS, et al. Beclin-1-independent autophagy mediates programmed cancer cell death through interplays with endoplasmic reticulum and/or mitochondria in colbat chloride inducedhypoxia[J].
AmJCancerRes, 2015, 5(9): 2626-42.
|
| [20] |
Rabinowitz JE. Autophagy and metabolism[J].
Science, 2010, 330(6009): 1344-8.
DOI: 10.1126/science.1193497. |
| [21] |
Zhou XT, Pu ZJ, Liu LX, et al. Inhibition of autophagy enhances adenosineinduced apoptosis in human hepatoblastoma HepG2 cells[J].
OncolRep, 2019, 41: 829-38.
|
| [22] |
Pankiv S, Clausen TH, Lamark T, et al. p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J].
JBiolChem, 2007, 282(33): 24131-45.
|
| [23] |
Velazquez AF, Jackson WT. So many roads: the multifaceted regulation of autophagy induction[J].
Mol Cell Biol, 2018, 38(21): 303-18.
|
| [24] |
郑庆委, 高淑娴, 吕杰, 等. 虫草素对人舌癌细胞凋亡, 自噬的影响及其分子机制[J].
南方医科大学学报, 2018, 38(4): 390-4.
DOI: 10.3969/j.issn.1673-4254.2018.04.04. |
| [25] |
Kim J, Guan KL. Regulation of the autophagy initiating kinase ULK1 by nutrients: roles of mTORC1 and AMPK[J].
Cell Cycle, 2011, 10(9): 1337-8.
DOI: 10.4161/cc.10.9.15291. |
| [26] |
Xu L, Brink M. mTOR, cardiomyocytes and inflammation in cardiac hypertrophy[J].
Biochim Biophys Acta, 2016, 1863(7, B, SI): 1894-903.
DOI: 10.1016/j.bbamcr.2016.01.003. |
| [27] |
Jung CH, Ro SH, Cao J, et al. mTOR regulation of autophagy[J].
FEBSLett, 2010, 584(7): 1287-95.
DOI: 10.1016/j.febslet.2010.01.017. |
| [28] |
Hsiao YT, Kuo CL, Chueh FH, et al. Curcuminoids induce reactive oxygen species and autophagy to enhance apoptosis in human oral cancercells[J].
AmJChinMed, 2018, 46(5): 1145-68.
|
| [29] |
Lin CY, Hsu SH, Lee HS, et al. Enhanced expression of glucose transporter-1 in vascular smooth muscle cells via the Akt/tuberous sclerosis complex subunit 2(TSC2)/mammalian target of rapamycin (mTOR)/ribosomal S6 protein kinase (S6K) pathway in experimental renal failure[J].
JVascSurg, 2013, 57(2): 475-85.
|
 2019, Vol. 39
2019, Vol. 39

