2. 深圳医院 药剂科, 广东 深圳 518100;
3. 深圳医院 呼吸科, 广东 深圳 518100
2. Department of Pharmacy, Shenzhen Hospital Affiliated to Southern Medical University, Shenzhen 518100, China;
3. Department of Respiratory, Shenzhen Hospital Affiliated to Southern Medical University, Shenzhen 518100, China
阿托伐他汀属第三代他汀类药物[1], 能可逆地抑制体内胆固醇合成的限速酶即HMG-CoA还原酶, 临床常用于治疗高胆固醇血症[2]。因其疗效和安全性俱佳, 目前在世界范围内已广泛应用于心血管疾病的初期和二级预防治疗[3-4], 并能有效降低冠心病患者心血管疾病的发病率和死亡率[5-6]。虽然阿托伐他汀的耐受性较好, 但接受该药物治疗的患者一般年龄较大, 常伴随其他疾病, 需服用多种药物[7-8]。并且他汀类药物需要长期使用, 联合用药的几率较高, 产生药物-药物相互作用的风险也增加。阿托伐他汀主要在肝脏经细胞色素P450酶3A4 (CYP3A4)代谢, 而临床上许多药物是CYP3A4的诱导剂或抑制剂, 因此, 在联合用药时需密切关注潜在的涉及CYP3A4的相互作用。早期的研究表明, 伊曲康唑等CYP3A4强抑制剂能显著增大阿托伐他汀的血药浓度-时间曲线下面积(AUC)[9], 在某些服用阿托伐他汀治疗高脂血症的患者中, 即使中等强度的CYP3A4抑制剂如氟康唑也能引起罕见的横纹肌溶解症[10]。据报道[11], 2001年10月~2002年9月使用阿托伐他汀等他汀类药物的病人中有1.5%的患者联合使用了三唑类药物。因此, 研究三唑类药物与阿托伐他汀的相互作用十分必要。
伏立康唑系新型三唑类抗真菌药, 是治疗曲霉病及耐氟康唑的念珠菌引起的严重真菌感染的一线药物[12], 多用于老年人群肺部真菌感染[13]。由于伏立康唑在体内呈现可变的药代动力学特征, 并且受CYP2C19的遗传多态性影响, 导致其血药浓度和药代动力学的个体间差异较大, 加上伏立康唑的治疗窗狭窄[14], 因此, 开展伏立康唑的治疗药物监测(TDM)至关重要。此外, 有研究指出伏立康唑是CYP3A4的抑制剂, 能有效抑制体外洛伐他汀(CYP3A4底物)的代谢[15], 而阿托伐他汀同为CYP3A4的底物, 与伏立康唑可能存在类似的相互作用。阿托伐他汀和伏立康唑在临床中存在联合使用, 但其潜在风险尚不明确, 建议谨慎合用[18]。因此, 两药合用或需对阿托伐他汀的剂量予以调整并对伏立康唑进行TDM。
目前关于同时检测阿托伐他汀和伏立康唑血药浓度的方法尚无文献报道, 而分别测定这两种药物因过程繁琐耗时, 难以满足临床需求。因此, 本研究旨在建立一种高效的HPLC-MS/MS方法同时测定大鼠血浆中阿托伐他汀和伏立康唑的浓度, 并应用该方法研究阿托伐他汀单独使用及与伏立康唑合并用药后, 大鼠血浆中阿托伐他汀的药动学变化及伏立康唑的浓度变化。
1 材料和方法 1.1 药品和试剂阿托伐他汀钙(纯度95.3%, 批号100590-201303)、伏立康唑标准对照品(纯度99.7%, 批号100862- 201402, 中国食品药品检定研究院), 兰索拉唑(纯度≥ 98%, 批号103577-45-3, 阿拉丁生化科技); 乙腈、甲醇(HPLC级, Merck), 甲酸(HPLC级, 麦克林), 甲基叔丁基醚(分析纯, 麦克林), 水为超纯水, 其余试剂为分析纯。
1.2 仪器Thermo ScientificTM TSQ QuantivaTM三重四级杆质谱仪, 配套Prelude SPLCTM System样品前处理(TurboFlowTM涡流净化技术)及Thermo Scientific液相系统; BSA224S万分之一电子天平(赛多利斯仪器系统); Eppendorf 5810R型高速冷冻离心机(Eppendorf); Millipore Elix 35型超纯水净化器(Millipore); XW-80A型旋涡混合器(其林贝尔); EYELA CVE-3000型旋转蒸发仪(东京理化器械)。
1.3 实验动物雄性SD大鼠, 200~220 g, 普通级, 购于南方医科大学南方医院实验动物研究中心。动物许可证号: SYXK (粤) 2015-0056, 合格证号: No.44002100015318, 饲养于南方医科大学南方医院实验动物研究中心。动物饲养室环境温度控制在24±2℃, 相对湿度为55%±10%, 期间喂食普通饲料, 自由饮水。
1.4 色谱条件色谱柱为Thermo Hypersil Gold(2.1 × 100 mm, 1.9 μm), TurboFlow柱为Thermo CycloneTM-P(0.5 × 50 mm), 流动相:乙腈(B) -0.1%甲酸水溶液(A), 梯度洗脱(0~0.43 min, 10% B; 0.43~1.18 min, 10% B→60% B; 1.18~3.85 min, 60% B; 3.85~4.52 min, 60% B→10% B; 4.52~5.5 min, 10% B), 柱温40℃:流速: 0.4 mL/min, 进样量: 2 µL。
1.5 质谱条件采用加热电喷雾离子源(H-ESI), 正离子模式检测; 离子源喷射电压为3000 V, 加热毛细管温度为350℃; 鞘气(N2)流速设为45 Arb; 辅助气(N2)设为流速10 Arb; 碰撞气(Ar)流速设为2 mTorr。选择反应监测模式(SRM)对各离子对进行扫描, 其中阿托伐他汀钙: m/z559.3→440.2, 碰撞能量为21 eV; 伏立康唑: m/z350.2→281, 碰撞能量为16 eV; 内标: m/z370.2→ 252, 碰撞能量为11 eV。
1.6 标准溶液的配制精密称取阿托伐他汀钙, 伏立康唑和内标对照品适量, 用甲醇溶解至浓度均为1 mg/mL的标准储备液, -20℃下保存备用。临用前用甲醇稀释至阿托伐他汀的浓度为0.1、0.5、1、5、10、50、100、500、1000 ng/mL, 伏立康唑的浓度为0.25、0.5、1、5、10、50、100、500、1000 ng/mL的系列混合标准溶液。
吸取上述标准储备液适量, 用甲醇稀释至阿托伐他汀、伏立康唑的低、中、高浓度均为0.5、50、800 ng/mL的质控混合标准溶液。
1.7 标准血浆样品与质控样品的配制精密吸取空白血浆450 µL, 加入50 µL系列混合标准溶液, 使标准血浆样品中阿托伐他汀的浓度为0.01、0.05、0.1、0.5、1、5、10、50、100 ng/mL, 伏立康唑的浓度为0.025、0.5、0.1、0.5、1、5、10、50、100 ng/mL。
另取450 µL空白血浆, 加入50 µL质控混合标准溶液, 即得阿托伐他汀、伏立康唑浓度均为0.05、5、80 ng/mL的低、中、高质控样品。
1.8 血浆样品预处理室温解冻血浆样品, 涡旋混匀。取40 µL血浆, 加入10 µL浓度为500 ng/mL的内标工作液及100 µL0.1 mol/L的CH3C00Na酸化, 涡旋30 s, 再加入1 mL甲基叔丁基醚, 充分混匀5 min, 3000 r/min离心10 min; 取上清液至另一10 mL锥形玻璃管中, 于旋转蒸发仪(45℃)中挥干, 残渣用100 µL甲醇复溶并涡旋振荡1 min使其完全溶解, 经0.22 μm微孔滤膜过滤后即可进样分析。
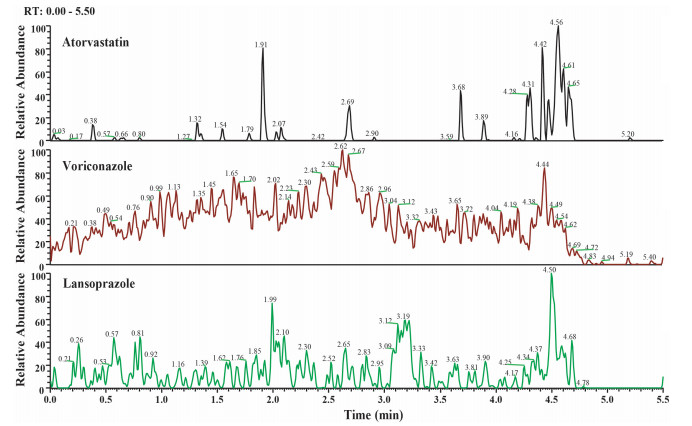
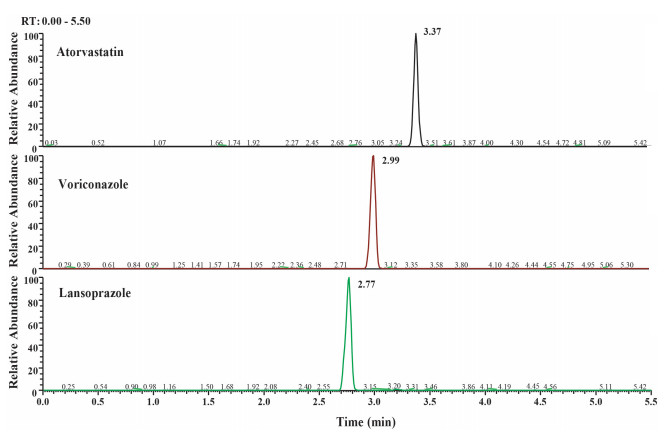
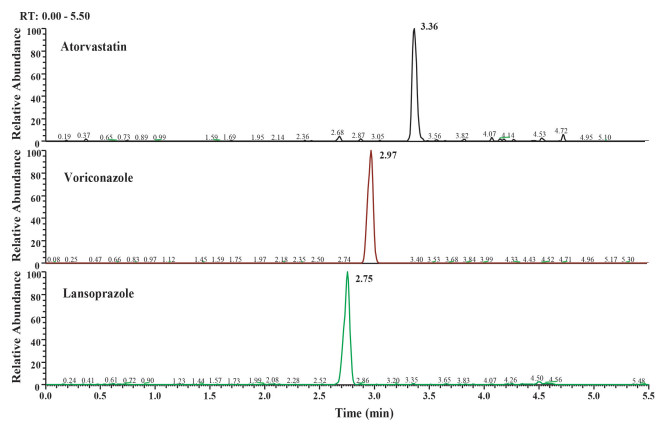
2 结果 2.1 专属性分析分别取大鼠空白血浆、含阿托伐他汀, 伏立康唑的标准血浆样品、灌胃给药2 h后的大鼠血浆样品, 按1.8方法处理, 进样分析, 得到相应的色谱图(图 1~3)。阿托伐他汀、伏立康唑和内标的保留时间分别为3.36 min、2.97 min、2.75 min, 各色谱峰的分离度良好, 且血浆内源性物质对待测物的测定无影响, 专属性符合要求。
|
图 1 大鼠空白血浆选择反应监测图 Fig.1 SRM chromatograms of blank plasma. |
|
图 2 加入阿托伐他汀, 伏立康唑和内标标准品的空白血浆选择反应监测图 Fig.2 SRM chromatograms of blank plasma spiked with atorvastatin, voriconazole and internal standard. |
|
图 3 灌胃给予阿托伐他汀和伏立康唑2 h后的大鼠血浆样品的选择反应监测图 Fig.3 SRM chromatograms of plasma samples from rats 2 h after intragastric administration of atorvastatin and voriconazole. |
精密吸取系列浓度的标准血浆样品, 按1.8方法处理, 进样测定并记录色谱图。以阿托伐他汀或伏立康唑的浓度为横坐标, 待测物与内标峰面积的比值为纵坐标, 依据加权最小二乘法进行回归分析。结果显示, 阿托伐他汀在0.01~100 ng/mL浓度范围线性关系良好, 标准曲线为Y=0.0206X+0.002735 (r=0.9957);伏立康唑在0.025~100 ng/mL浓度范围线性关系良好, 标准曲线为Y=0.04687X+0.05651 (r=0.9966)。
2.3 精密度与准确度实验取1.7的质控样品, 按1.8方法处理后进样分析, 每个浓度平行测定5份样品, 连续测定3 d, 根据当日的随行标准曲线探究该分析方法的日内、日间精密度和准确度(表 1)。该方法的精密度和准确度均满足实验要求。
| 表 1 大鼠血浆中阿托伐他汀和伏立康唑的精密度与准确度结果 Tab.1 Detection accuracy and precision of atorvastatin and voriconazole in rat plasma |
取1.7的质控样品, 按1.8方法处理, 每个浓度平行测定5份, 记录峰面积为A1;取大鼠空白血浆40 µL, 除加10 µL甲醇代替内标溶液外, 其余按1.8处理样品, 真空挥干后加入与A1相同理论浓度的混合标准溶液复溶, 得峰面积为A2;制备与A1相同理论浓度的混合标准溶液, 进样分析得峰面积为A3。基质效应(ME)按A2/A3比值的百分比为准, 提取回收率以A1/A2比值的百分比计算。两药的基质效应和提取回收率均达到测定要求(表 2)。
| 表 2 基质效应和提取回收率结果 Tab.2 Matrix effect and extraction recovery of the two analytes in rat plasma (Mean±SD, n=5) |
取低、中、高浓度的质控样品各3份, 分别于室温下放置2 h; 处理完于4℃进样器中放置24 h后进样测定; -80℃室温反复冻融3次后按1.8血浆样品处理后进样测定, 并代入当日随行标准曲线中计算样品浓度。结果表明, 两被测分析物的RE与RSD值均在15%范围, 说明经该方法处理的血浆样品的稳定性良好。
2.6 给药方案与血药浓度-时间曲线将10只体质量为200~220 g的雄性SD大鼠, 随机平均分成两组, 于给药前一晚禁食12 h, 自由饮水。按以下给药剂量灌胃含药生理盐水溶液1 mL, A组:阿托伐他汀10 mg/kg; B组:阿托伐他汀10 mg/kg与伏立康唑60 mg/kg联合给药。在给药前(0 h)及给药后0.17、0.34、0.5、1、2、3、4、6、8、12、24 h于眼眶静脉取血300 µL, 置于含肝素钠的EP管内, 3500 r/min离心5 min后吸取上层血浆到另一洁净EP管内, 保存在-80℃冰箱中待测。
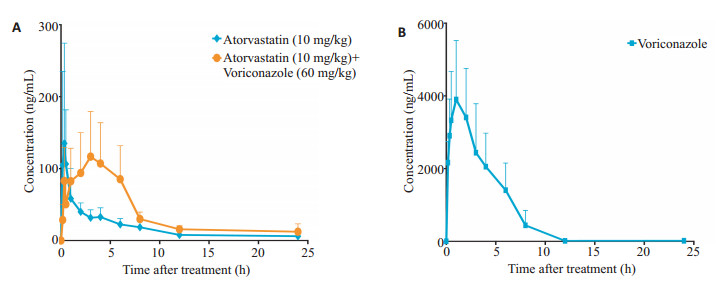
样品测定阶段, 除用甲醇稀释复溶外, 其余按1.8处理进样, 求得阿托伐他汀和伏立康唑的浓度, 并绘制出两药的血药浓度-时间曲线(图 4)。
|
图 4 大鼠单独灌胃阿托伐他汀及联合给予阿托伐他汀和伏立康唑后阿托伐他汀(A)和伏立康唑(B)的血药浓度-时间曲线 Fig.4 Plasma concentration-time curves of atorvastatin (A) and voriconazole (B) after intragastric administration of atorvastatin alone or in combination with voriconazole in rats. |
将上述所得血药浓度用DAS2.0药代动力学软件拟合计算药动学参数, 经GraphPad Prism 5.0对其进行配对t检验, 阿托伐他汀的主要药动学参数如表 3所示。结果表明, 与单独给药组相比, 联合给药组中阿托伐他汀的AUC0-24 h和AUC0-∞显著增大, CLz/F显著减小(P < 0.05), Tmax大于阿托伐他汀单独给药组, 差异具有统计学意义(P < 0.01), 其余药动学参数间均无显著性差异(P > 0.05, 表 4)。
| 表 3 大鼠单独灌胃阿托伐他汀及联合给予阿托伐他汀和伏立康唑后阿托伐他汀的主要药动学参数 Tab.3 Pharmacokinetics parameters of atorvastatin in rats after oral administration of atorvastatin (10 mg/kg) alone or in combination with 60 mg/kg voriconazole (Mean±SD, n=5) |
| 表 4 联合给药组中伏立康唑的主要药动学参数 Tab.4 Pharmacokinetics parameters of voriconazole in rat plasma after combined administration (n=5) |
阿托伐他汀和伏立康唑临床应用广泛, 但两药均受药物代谢酶遗传多态性及基于相同代谢酶的药物相互作用的影响[19-20], 导致阿托伐他汀和伏立康唑的血药浓度存在显著的个体差异, 进而引起疗效不佳或药物不良反应[21-22]。目前, 国内外关于测定阿托伐他汀和伏立康唑血药浓度的方法较多, 但同时检测两药的方法尚无文献报道。考虑到实际临床中联用两药的患者病情严重, 且其体内代谢复杂[23], 传统方法单独测定耗时长且检测效率低, 无法满足实际工作需要。本文建立的同时检测大鼠血浆中阿托伐他汀和伏立康唑的浓度的HPLCMS/MS法, 快速准确, 灵敏度高, 经方法学考察, 阿托伐他汀在0.01~100 ng/mL, 伏立康唑在0.025~100 ng/mL浓度范围内线性关系良好, 且两药的精密度与准确度、提取回收率、基质效应及样品的稳定性均符合本实验测定要求, 尤其适用于大批量生物样本的分析测定。
在色谱条件的优化过程中, 本实验考察了乙腈-甲酸水溶液、乙腈-醋酸铵水溶液作为流动相对两待测物色谱行为的影响, 发现水相中加入0.1%体积分数的甲酸后待测物的峰型较好, 保留时间适宜。本文采用液-液萃取法进行样品的提取纯化, 根据两药的极性不同, 分别比较经不同浓度的盐酸或醋酸钠酸化后再加入乙醚、二氯甲烷、乙酸乙酯、甲基叔丁基醚等萃取剂(单独或按比例联合用)的提取效率。最终发现用0.1 mol/L的醋酸钠(pH=3)酸化后再加入甲基叔丁基醚萃取, 相比其他提取剂, 两药的提取效率更高且稳定性好。本实验所用的新型三重四级杆质谱仪配套Turboflow涡流净化技术, 先从血样中分离得到待测物使其停滞在TurboFlow色谱柱中, 待基质成分被冲入废液后, 再将保留的待测物转移至分析色谱柱上作下一步色谱分析。最终实现涡流色谱分析, 有助于净化在线样品, 提高结果的重复性。
阿托伐他汀主要经肝脏代谢, 是CYP3A4和有机阴离子转运多肽(OATP)、P-糖蛋白(P-gp)等功能蛋白的底物[24-25], 其中CYP3A4调节剂对其药代动力学有着显著影响[26]。研究表明伏立康唑既是CYP3A4的底物, 也是其抑制剂[27], 能有效抑制肝脏以及肠道CYP3A4的活性, 使其底物的全身暴露产生重大变化[28]。因此, 临床工作中我们应当重视与阿托伐他汀有关的潜在的药物相互作用。本研究考察了单次合用伏立康唑后对阿托伐他汀药代动力学的影响, 结果显示, 阿托伐他汀的Tmax显著延长(P < 0.01), CLz/F显著减小(P < 0.05), 表明合并给药后阿托伐他汀在大鼠体内的吸收过程减慢, 消除率有所降低, 代谢转化受到抑制, 使药物暴露量出现明显增加(P < 0.05)。然而从实验数据中观察到, 阿托伐他汀的t1/2并没有发生明显改变(P > 0.05), 这可能是由于药物在大鼠体内的CLz/F和Vz/F同时减小, 两者的比值在联合用药前后(0.136与0.126)未产生显著变化所导致。同时有文献报道[29], 在人肝微粒体中伏立康唑抑制睾酮(CYP3A4特异底物)羟基化的IC50值为21.3± 15.3 µmol/L, 远高于其他几种三唑类抗真菌药(酮康唑为0.010±0.0025 µmol/L, 伊曲康唑为0.15±0.08 µmol/L), 表明伏立康唑是CYP3A4的中等抑制剂。此外, Vincent等[30]发现伏立康唑可能对P-gp等转运蛋白不存在显著的抑制作用, 因此在一定程度上对阿托伐他汀的抑制作用相对偏弱, 仅表现在改变其部分药代动力学参数。
本研究结果提示, 大鼠合用阿托伐他汀和伏立康唑后可能存在药物相互作用, 使阿托伐他汀的部分药代动力学参数发生改变, 应密切关注两药的血药浓度变化, 但阿托伐他汀和伏立康唑在临床中是否会发生药物间相互作用及其作用机制仍有待进一步研究。
| [1] |
Zhao Y, Peng R, Zhao W, et al. Zhibitai and low-dose atorvastatin reduce blood lipids and inflammation in patients with coronary artery disease[J].
Medicine (Baltimore), 2017, 96(7): e6104.
DOI: 10.1097/MD.0000000000006104. |
| [2] |
Dixit A, Abrudescu A. A case of atorvastatin-associated necrotizing autoimmune myopathy, mimicking idiopathic polymyositis[J].
Case Rep Rheumatol, 2018, 2018: 5931046.
|
| [3] |
Satoh M, Takahashi Y, Tabuchi T, et al. Cellular and molecular mechanisms of statins:an update on pleiotropic effects[J].
Clin Sci (Lond), 2015, 129(2): 93-105.
DOI: 10.1042/CS20150027. |
| [4] |
Nenna A, Lusini M, Spadaccio C, et al. Preoperative atorvastatin reduces bleeding and blood products use in patients undergoing onpump coronary artery bypass grafting[J].
J Cardiovasc Med, 2017, 18(12): 976-82.
DOI: 10.2459/JCM.0000000000000550. |
| [5] |
Indumathi C, Anusha N, Vinod KV, et al. Atorvastatin induced adverse drug reactions among south indian tamils[J].
J Clin Diagn Res, 2017, 11(7): FC01-5.
|
| [6] |
Grigoropoulou P, Tentolouris A, Eleftheriadou I, et al. Effect of 12-month intervention with low-dose atorvastatin on pulse wave velocity in subjects with type 2 diabetes and dyslipidaemia[J].
Diab Vasc Dis Res, 2019, 16(1): 38-46.
DOI: 10.1177/1479164118805320. |
| [7] |
Morival C, Westerlynck R, Bouzillé G, et al. Prevalence and nature of statin drug-drug interactions in a university hospital by electronic health record mining[J].
Eur J Clin Pharmacol, 2018, 74(4): 525-34.
DOI: 10.1007/s00228-017-2400-6. |
| [8] |
Stewart D, Mair A, Wilson M, et al. Guidance to manage inappropriate polypharmacy in older People:systematic review and future developments[J].
Expert Opin Drug Saf, 2017, 16(2): 203-13.
|
| [9] |
Dong J, Yu XE, Wang L, et al. Effects of cyclosporin A and itraconazole on the pharmacokinetics of atorvastatin in rats[J].
Acta Pharmacol Sin, 2008, 29(10): 1247-52.
DOI: 10.1111/aphs.2008.29.issue-10. |
| [10] |
Hsiao SH, Chang HJ, Hsieh TH, et al. Rhabdomyolysis caused by the moderate CYP3A4 inhibitor fluconazole in a patient on stable atorvastatin therapy:a case report and literature review[J].
J Clin Pharm Ther, 2016, 41(5): 575-8.
DOI: 10.1111/jcpt.2016.41.issue-5. |
| [11] |
Stang P, Morris L, Kempf J, et al. The coprescription of contraindicated drugs with statins:continuing potential for increased risk of adverse events[J].
Am J Ther, 2007, 14(1): 30-40.
DOI: 10.1097/01.mjt.0000208875.61480.c8. |
| [12] |
Van Der Linden JW, Arendrup MC, Melchers WJ, et al. Azole resistance of aspergillus fumigatus in immunocompromised patients with invasive aspergillosis[J].
Emerg Infect Dis, 2016, 22(1): 158-9.
DOI: 10.3201/eid2201.151308. |
| [13] |
梁芳, 赵会颖, 赵旭兰. 伏立康唑治疗老年肺部真菌感染分析[J].
河北医药, 2011, 33(16): 2451-2.
|
| [14] |
Al-Ghobashy MA, Kamal SM, El-Sayed GM, et al. Determination of voriconazole and co-administered drugs in plasma of pediatric cancer patients using UPLC-MS/MS:A key step towards personalized therapeutics[J].
J Chromatogr B Analyt Technol Biomed Life Sci, 2018, 1092: 489-98.
DOI: 10.1016/j.jchromb.2018.06.043. |
| [15] |
Donnelly JP, De Pauw BE. Voriconazole-a new therapeutic agent with an extended spectrum of antifungal activity[J].
Clin Microbiol Infect, 2004, 10(Suppl 1): 107-17.
|
| [16] |
Bellosta S, Corsini A. Statin drug interactions and related adverse reactions:an update[J].
Expert Opin Drug Saf, 2018, 17(1): 25-37.
DOI: 10.1080/14740338.2018.1394455. |
| [17] |
Gravatt LA, Flurie RW, Lajthia EA. Clinical guidance for managing statin and antimicrobial Drug-Drug interactions[J].
Curr Atheroscler Rep, 2017, 19(11): 46.
DOI: 10.1007/s11883-017-0682-x. |
| [18] |
Hisaka A, Kusama M, Ohno Y, et al. A proposal for a pharmacokinetic interaction significance classification system (PISCS) based on predicted drug exposure changes and its potential application to alert classifications in product labelling[J].
Clin Pharmacokinet, 2009, 48(10): 653-66.
DOI: 10.2165/11317220-000000000-00000. |
| [19] |
Peng C, Ding Y, Yi X, et al. Polymorphisms in CYP450 genes and the therapeutic effect of atorvastatin on ischemic stroke:a retrospective cohort study in Chinese population[J].
Clin Ther, 2018, 40(3): 469-77.
DOI: 10.1016/j.clinthera.2018.02.002. |
| [20] |
Lin XB, Li ZW, Yan M, et al. Population pharmacokinetics of voriconazole and CYP2C19 polymorphisms for optimizing dosing regimens in renal transplant recipients[J].
Br J Clin Pharmacol, 2018, 84(7): 1587-97.
DOI: 10.1111/bcp.13595. |
| [21] |
Park WB, Kim NH, Kim KH, et al. The effect of therapeutic drug monitoring on safety and efficacy of voriconazole in invasive fungal infections:a randomized controlled trial[J].
Clin Infect Dis, 2012, 55(8): 1080-7.
DOI: 10.1093/cid/cis599. |
| [22] |
Kadam P, Ashavaid TF, Ponde CK, et al. Genetic determinants of lipid-lowering response to atorvastatin therapy in an Indian population[J].
J Clin Pharm Ther, 2016, 41(3): 329-33.
DOI: 10.1111/jcpt.12369. |
| [23] |
Imamura CK, Furihata K, Okamoto S, et al. Impact of cytochrome P450 2C19 polymorphisms on the pharmacokinetics of tacrolimus when coadministered with voriconazole[J].
J Clin Pharmacol, 2016, 56(4): 408-13.
DOI: 10.1002/jcph.v56.4. |
| [24] |
Kellick KA, Bottorff M, Toth PP. A clinician's guide to statin drugdrug interactions[J].
J Clin Lipidol, 2014, 8(3, S): S30-46.
DOI: 10.1016/j.jacl.2014.02.010. |
| [25] |
Shin E, Shin N, Oh JH, et al. High-dose metformin may increase the concentration of atorvastatin in the liver by inhibition of multidrug resistance-associated protein 2[J].
J Pharm Sci, 2017, 106(4): 961-7.
DOI: 10.1016/j.xphs.2016.11.020. |
| [26] |
Khalilieh S, Yee KL, Sanchez RI, et al. Results of a doravirine-atorvastatin drug-drug interaction study[J].
Antimicrob Agents Chemother, 2017, 61(2): e01364-16.
|
| [27] |
Hohmann N, Kocheise F, Carls AA, et al. Dose-dependent bioavailability and CYP3A inhibition contribute to Non-Linear pharmacokinetics of voriconazole[J].
Clin Pharmacokinet, 2016, 55(12): 1535-45.
DOI: 10.1007/s40262-016-0416-1. |
| [28] |
Frechen S, Junge L, Saari TI, et al. A semiphysiological population pharmacokinetic model for dynamic inhibition of liver and gut wall cytochrome P450 3A by voriconazole[J].
Clin Pharmacokinet, 2013, 52(9): 763-81.
DOI: 10.1007/s40262-013-0070-9. |
| [29] |
Zhang SM, Pillai VC, Mada SR, et al. Effect of voriconazole and other azole antifungal agents on CYP3A activity and metabolism of tacrolimus in human liver microsomes[J].
Xenobiotica, 2012, 42(5): 409-16.
DOI: 10.3109/00498254.2011.631224. |
| [30] |
Lempers VJ, Van Den Heuvel JJ, Russel FG, et al. Inhibitory potential of antifungal drugs on ATP-Binding cassette transporters PGlycoprotein, MRP1 to MRP5, BCRP, and BSEP[J].
Antimicrob Agents Chemother, 2016, 60(6): 3372-9.
DOI: 10.1128/AAC.02931-15. |
 2019, Vol. 39
2019, Vol. 39

