2. 生物诊断治疗国家地方联合工程研究中心, 陕西 西安 710004
2. National & Local Joint Engineering Research Center of Biodiagnostics and Biotherapy, Xi'an 710004, China
多药耐药基因1 (MDR1)表达产物P-糖蛋白(P-gp)的高表达和活化是导致肿瘤原发和/或继发性多药耐药的主要原因和机制之一, 异黏蛋白(MTDH)可通过多种环节和途径直接上调MDR1的表达参与肿瘤耐药的发生[1-3]。钙离子抑制剂(CCB)属于已发现的7类P-gp抑制剂之一[4-6]。虽然, MDR1、MTDH、CCB已作为逆转肿瘤耐药的新靶点和辅助治疗药物用于恶性肿瘤的辅助治疗[7-8]。但是, 仍有研究认为长期应用CCB可能具有增加患者罹患肿瘤、缩短肿瘤患者生存期的风险[9-10]。深入研究CCB在肿瘤治疗中的作用机制, 客观评估其效果具有重要的临床应用价值。为此, 本研究拟采用钙离子阻滞剂地尔硫卓抑制P-gp功能, 分析其对肝癌细胞生物学行为和MTDH、P-gp蛋白表达的影响, 以评价CCB逆转肿瘤耐药的临床价值。
1 材料和方法 1.1 细胞株和主要试剂MHCC97H、7402肝癌细胞株(本院生物诊疗中心惠赠), RPMI 1640培养液、胰蛋白酶、胎牛血清(美国Gibco), 盐酸地尔硫卓注射液(10 mg/支)(田边三菱制药株式会社), 抗MTDH抗体、抗-MDR抗体、免疫组织化学检测试剂盒(迈新公司), 细胞RNA提取试剂盒、荧光定量PCR检测试剂盒(北京康为世纪生物科技有限公司), MTDH PCR引物由上海尼桑生物科技有限公司合成。
1.2 细胞培养肝癌MHCC97H、7402细胞株细胞常规复苏后置于含10%胎牛血清、0.1 mg/mL链霉素、100 U/mL青霉素的DMEM培养液, 于37℃、5% CO2的细胞培养箱进行培养。间隔1~2d换培养液1次, 细胞长至90%融合时, 0.25%胰酶消化, 以1: 3传代, 取对数生长期的细胞进行试验。
1.3 体外细胞划痕实验检测处理后肝癌细胞运动侵袭能力以1×105/孔接种肝癌细胞于六孔板, 使细胞融合率为70%~80%时, 用PBS洗涤3次, 去除脱落的细胞, 用200 μL无菌枪头垂直于培养孔底面划痕后, 加入不同浓度的盐酸地尔硫卓溶液(使其终浓度达到0、25、50、100、200、400 μmol/L), 并分别培养12、24、48 h, 每个浓度设2个复孔。采用倒置显微镜分别于0、12、24、48 h检测细胞生长、划痕愈合情况并拍照记录。
1.4 采用RT-PCR检测肝癌细胞中MTDH mRNA的表达利用Trizol试剂提取各组MHCC97H、7402肝癌细胞中总RNA, RT-PCR反应中MTDH和GAPDH (内参)的引物均由康维世纪公司设计合成。以cDNA为模板进行RT-PCR反应并对结果进行分析, 引物设计: MTDH, forward: 5'-AACGGGACCATGCACGGCTT- 3', reverse: 3'-TGTTGTGGTGGTTGCACGGC-5';GA PDH, forward: 5'-ACCACAGTCCATGCCATCAC-3', reverse: 3'-ATGTCGTTGTCC CACCACCT-5'。
1.5 免疫细胞化学检测肝癌细胞中MTDH、P-gp的表达取对数生长期的MHCC97H、7402肝癌细胞, 接种于24孔板, 细胞长至80%融合时按照终浓度(0、10、50、100、200、400 μmol/L)加入钙离子抑制剂盐酸地尔硫卓, 并分别培养12、24、48 h, 然后用10%的福尔马林固定30 min, 经SP法染色, 镜下观察MTDH、P-gp在肝癌细胞中的表达情况。
1.6 免疫细胞化学结果判定在免疫组化染色中MTDH呈胞浆型表达, P-gp呈膜/浆型表达, 因此, 均可按照胞浆型分子免疫组化结果判读方法进行判读[11]: (1) 0 (阴性):无着色; (2) + (弱阳性): ≤ 10%的细胞呈现不同程度的细胞质着色; (3) ++ (阳性): 10%~30%的细胞呈现强的棕褐着色的细胞质着色, 或≤ 70%的细胞呈现弱或中等强度的细胞质着色; (4) +++ (强阳性): >30%的细胞呈现强的棕褐着色的细胞质着色或>70%的中等强度细胞质着色。
1.7 统计学分析实验数据用SPSS18.0统计软件进行分析处理, 所有数据以均数±标准差表示, 组间均数比较采用单因素方差分析或者LSD法进行两两比较, P < 0.05为差异有统计学意义。
2 结果 2.1 地尔硫卓对MHCC97H、7402肝癌细胞运动能力的影响细胞划痕实验结果(图 1)显示不同剂量地尔硫卓均能在短时间内(< 12 h)抑制MHCC97H、7402肝癌细胞株细胞的运动爬行能力, 但是, 随着时间的延长(>24 h), 细胞爬行运动能力逐渐恢复。不同浓度地尔硫卓能在短时间内一过性抑制MHCC97H和7402肝癌细胞的爬行运动能力。

|
图 1 细胞划痕实验观察地尔硫卓对MHCC97H、7402肝癌细胞运动能力的影响 Fig.1 Effect of diltiazem on the mobility of MHCC97H and 7402 cells assessed by wound healing assay (Original magnification: ×100). 1-4: Growth and migration of MHCC97H cells at 0, 12, 24 and 48 h after application of diltiazem; 5-8: Control cells at the corresponding time points; 9-12: Growth and migration of 7402 cells at 0, 12, 24 and 48 h after application of diltiazem; 13-16: The corresponding control cells. |
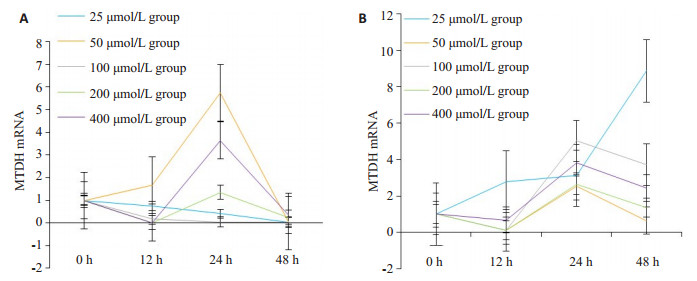
不同浓度钙离子抑制剂盐酸地尔硫卓(0、25、50、100、200、400 μmol/L)均能影响肝癌MHCC97H、7402细胞中MTDH mRNA的表达, 并呈短时(< 12 h)下降后的一过程升高, 并随着时间的延长(>24 h)恢复到基线水平, 且大部分时间点检测值与对照组相比具有统计学差异(P < 0.05, 表 1, 图 1、2)。
| 表 1 地尔硫卓对肝癌MHCC97H, 7402细胞MTDH mRNA表达的影响 Tab.1 Effect of diltiazem on expression of MTDH mRNA in MHCC97H and 7402 cells (n=3, Mean±SD) |
|
图 2 地尔硫卓对肝癌MHCC97H, 7402细胞MTDH mRNA表达的影响 Fig.2 Effect of diltiazem on expression of MTDH mRNAin MHCC97H and 7402 cells.A: MHCC97H cells; B: 7402 cells. |
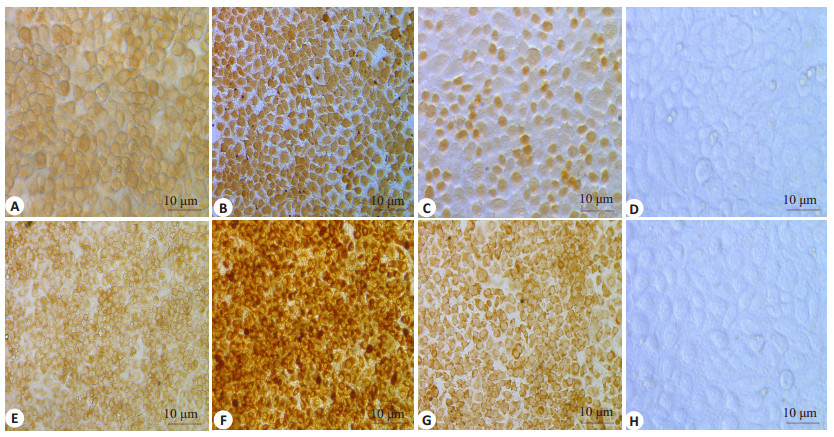
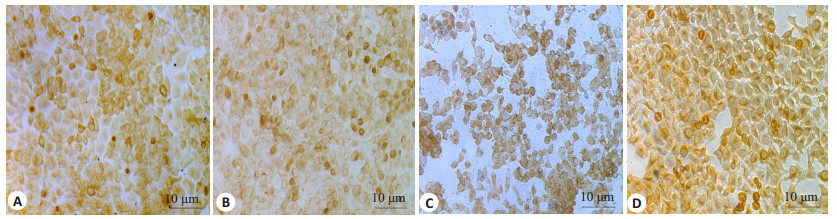
免疫细胞化学染色结果(图 3)显示不同浓度地尔硫卓(25、50、100、200、400 μmol/L)干预后, 随着时间的延长, MTDH蛋白在肝癌MHCC97H、7402细胞中的表达由中等强度阳性表达增强至强阳性表达, P-gp的表达并未见明显差异(图 4)。
|
图 3 地尔硫卓对MHCC97H、7402肝癌细胞中MTDH蛋白表达的影响 Fig.3 Effect of diltiazem on protein expression of MTDH in MHCC97H and 7402 cells (immunohistochemistry with SP method, ×200). A-C: MHCC97H cells treated with diltiazem at 50 μmol/L for 12 h, at 400 μmol/L for 24 h, and at 100 μmol/L for 48 h, respectively; D: Control group; E-G: 7402 cells treated with diltiazem at 200 μmol/L for 12 h, at 100 μmol/L for 24 h, and at 50 μmol/L for 48 h, respectively. H: Control group. |
|
图 4 地尔硫卓对MHCC97H、7402肝癌细胞中P-gp蛋白表达的影响 Fig.4 Effect of diltiazem on protein expression of P-gp in MHCC97H and 7402 cells (immunohistochemistry with SP method, ×200). A, B: MHCC97H cells treaed with diltiazem at 100 μmol/L for 12 h and at 400 μmol/L for 48 h, respectively; C, D: 7402 cells treated with diltiazem at 25 μmol/L for 48 h and at 200 μmol/L for 12 h, respectively. |
多药耐药是导致肿瘤治疗失败的主要原因[12-14], 采用钙离子抑制剂逆转肿瘤耐药已成为恶性肿瘤辅助治疗的重要手段[7-8, 15]。现有证据证实, 多种类型的抗心血管药物的长期使用有增加肿瘤的风险[16]。但是, 对于长期使用CCB会否会增加罹患肿瘤风险、缩短肿瘤患者生存期的认识并不一致[17-19]。对长期应用CCB的潜在风险仍有顾虑[20-21]。P-gp是肿瘤多药耐药的具体执行者和核心机制之一[22], 其在肝细胞癌等恶性肿瘤细胞中的普遍性高表达和功能活化必然受到上下游相关调节基因和因素的调节和影响。现已发现在肝癌等多种肿瘤中显著高表达的促癌基因AEG-1/MTDH/Lyric就是MDR1上游重要的调节基因[23-24], 不仅能通过激活H-ras、PI3K/Akt、NF-κB、Wnt/β-catenin等多个信号传导通路及RNAi途径促进肿瘤细胞的增殖、抗凋亡、血管生成和侵袭转移, 还能通过多靶点、多环节赋予肿瘤细胞针对包括阿霉素、顺铂、紫杉醇、过氧化氢、4-羟环磷酰胺、辐射等抗肿瘤药物的广谱耐药能力。例如, AEG-1/ MTDH/Lyric可上调人肝癌Hep3细胞中多种耐药相关基因, 如二氢嘧啶脱氢酶、P4502B6、多药耐药蛋白(MDR1/P-gp)、药耐药相关蛋白、有机阴离子转运蛋白、有机阴离子转运肽、有机阳离子转运蛋白、寡肽转运蛋白等的表达而增强其在药物吸收或重吸收、药物向组织细胞内转运的功能, 增强细胞在化疗下的生存能力[25-26]。
同时, 从分子结构上看, P-gp属于离子通道蛋白, 其活性和功能与细胞内钙信号密不可分, 而钙离子抑制剂也作为重要的P-gp抑制剂通过调节细胞内外钙离子的改变直接影响P-gp的功能[4-5]。由此可见, P-gp很可能是同时受MTDH和钙离子抑制剂调控或影响的中间环节: MTDH可通过上调多药耐药蛋白表达而增强肿瘤细胞的耐药性, 而钙离子通道抑制剂则可直接抑制P-gp的功能。那么, 采用钙离子抑制剂抑制P-gp功能逆转肿瘤耐药时, 是否会对MTDH的表达产生影响, 尚未可知。
为此, 本研究采用地尔硫卓作用于肝癌细胞, 观察其对肝癌细胞生物学行为和MTDH、P-gp的表达的影响, 以分析钙离子抑制剂逆转肝癌耐药的分子机制和临床价值。实验结果发现, 尽管不同来源的肝癌细胞对地尔硫卓反应的时间点和水平稍有差异, 但总体上, 不同浓度地尔硫卓均能在短时间内一过性抑制肝癌MHCC97H和7402细胞的迁徙运动, 同时, 地尔硫卓在抑制钙内流时并不能抑制P-gp在肝癌MHCC97H和7402细胞中的表达。已有研究证实多种CCB均可不同程度逆转P-gp高表达对阿霉素等的耐药, 并能够通过不同机制抑制细胞增殖[27-30]。甚至, 有研究发现, P-gp抑制剂抑制P-gp功能的同时能上调P-gp的表达水平[31-32]。此外, 本研究还发现, 不同浓度地尔硫卓均能在短时间内一过性上调MTDH mRNA和蛋白在肝癌MHCC97H、7402细胞中表达水平(P < 0.05)。这一结果并未见文献报道。此外, 本研究组前期研究还发现不同浓度地尔硫卓均能在短时间内一过性抑制肝癌MHCC97H和7402细胞的增殖和迁徙运动后, 随着时间的延长还能增强肝癌细胞的增殖能力[33]。
结合文献和本研究结果可知, 单次使用地尔硫卓能一过性抑制P-gp功能, 但并不抑制P-gp表达, 相反, 似乎还有上调P-gp表达的趋势; MTDH是MDR1/P-gp调控因子, 高表达的MTDH不仅能上调P-gp表达增强肿瘤耐药, 还能促进肿瘤生长; 至今为止, 尚未发现钙离子抑制剂地尔硫卓与MTDH相互作用的相关证据; 本研究证实单次使用地尔硫卓能能明确地一过性上调MTDH mRNA和蛋白的表达。
以此为依据, 本研究提出在"CCB-MDR1/P-gp- MTDH"的分子调控机制中, 地尔硫卓很有可能存在通过一过性抑制P-gp功能而反馈性上调促癌基因MTDH mRNA和蛋白的表达水平, 继而促进肿瘤进展的可能。显然, 就目前对MTDH在肿瘤耐药和进展中的作用机制的了解, 高表达的MTDH不仅可通过上调P-gp的表达以代偿钙离子阻滞剂对P-gp功能的抑制, 同时, 还有可能通过激活H-ras、PI3K/Akt、NF-κB、Wnt/ β-catenin等多个信号传导通路及RNAi途径增强肿瘤细胞增殖、血管生成、抗凋亡、侵袭转移能力及肿瘤进展。地尔硫卓能通过抑制P-gp功能而反馈性上调MTDH表达, 因而很有可能会具有促进肝细胞癌进展和继发耐药的风险。
综上所述, 本研究印证了此前学者提出的长期使用钙离子阻滞能增强肿瘤发生风险、缩短肿瘤患者生存期的观点[10, 22-23], 且发现钙离子抑制剂抑制P-gp功能的同时反馈性上调MTDH的表达可能是导致这一结果的分子机制。因此, 有必要对将钙离子抑制剂作为肿瘤辅助治疗药物的临床价值进行重新评估。本研究仅仅是通过细胞学实验发现了地尔硫卓能一过性通过抑制P-gp功能而反馈性上调MTDH表达, 并由此推测地尔硫卓具有促进肝细胞癌进展和继发耐药的潜在风险。显然, 对于这一推论仍需全面、系统的在体动物实验进行深入研究。
| [1] |
Galun D, Srdicrajic T, Bogdanovic A, et al. Targeted therapy and personalized medicine in hepatocellular carcinoma:drug resistance, mechanisms, and treatment strategies[J].
J Hepatocellul Carcinom, 2017, 4(1): 93-103.
|
| [2] |
Robertson CL, Srivastava J, Rajasekaran DA, et al. The role of AEG-1 in the development of liver cancer[J].
Hepatic Oncol, 2015, 2(3): 303-12.
DOI: 10.2217/hep.15.10. |
| [3] |
Meng X, Thiel KW, Leslie KK. Drug resistance mediated by AEG-1/MTDH/LYRIC[J].
Adv Cancer Res, 2013, 120(3): 135-57.
|
| [4] |
Bong A, Monteith GR. Calcium signaling and the therapeutic targeting of cancer cells[J].
Biochimica et Biophysica Acta (BBA)-Molec Cell Res, 2018, 113(18): 30103-4.
|
| [5] |
Büsselberg D, Florea AM. Targeting intracellular calcium signaling ([Ca2+]i) to overcome acquired multidrug resistance of cancer cells:a Mini-Overview[J].
Cancers (Basel), 2017, 9(5): 48-56.
|
| [6] |
Ledwitch KV, Roberts AG. Cardiovascular ion channel inhibitor drug-drug interactions with p-glycoprotein[J].
AAPS J, 2017, 19(2): 409-20.
DOI: 10.1208/s12248-016-0023-y. |
| [7] |
Frede J, Fraser SP, Oskay-Özcelik G, et al. Ovarian cancer:Ion channel and aquaporin expression as novel targets of clinical potential[J].
Eur J Cancer, 2013, 49(34): 2331-44.
|
| [8] |
Lastraioli E, Iorio J, Arcangeli A. Ion Channel expression as promising cancer biomarker[J].
Biochim Biophys Acta, 2015, 1848(10, B, SI): 2685-702.
DOI: 10.1016/j.bbamem.2014.12.016. |
| [9] |
Chae YK, Dimou A, Pierce S, et al. The effect of calcium channel blockers on the outcome of acute myeloid leukemia[J].
Leuk Lymphoma, 2014, 55(12): 2822-9.
DOI: 10.3109/10428194.2014.901513. |
| [10] |
Pahor M, Guralnik JM, Salive ME, et al. Do calcium channel blockers increase the risk of cancer[J].
Am J Hypertens, 1996, 9(7): 695-9.
DOI: 10.1016/0895-7061(96)00186-0. |
| [11] |
杨军, 康安静, 苏宝山, 等. 免疫组织化学检测结果判读进展[J].
中华临床医师杂志:电子版, 2014, 8(20): 3699-703.
|
| [12] |
Litan A, Langhans SA. Cancer as a channelopathy:ion channels and pumps in tumor development and progression[J].
Front Cell Neurosci, 2015, 9(1): 86-95.
|
| [13] |
Saraswathy M, Gong SQ. Different strategies to overcome multidrug resistance in cancer[J].
Biotechnol Adv, 2013, 31(8): 1397-407.
DOI: 10.1016/j.biotechadv.2013.06.004. |
| [14] |
Khan IU, Khan RU, Asif H, et al. Co-delivery strategies to overcome multidrug resistance in ovarian cancer[J].
Int J Pharm, 2017, 533(1): 111-24.
DOI: 10.1016/j.ijpharm.2017.09.060. |
| [15] |
Cui C, Merritt R, Fu L, et al. Targeting calcium signaling in cancer therapy[J].
Acta Pharm Sin B, 2017, 7(1): 3-17.
DOI: 10.1016/j.apsb.2016.11.001. |
| [16] |
Ocampo NV, Tafreshi J, Hauschild CL. Cardiovascular medications and risk of cancer[J].
Am J Cardiol, 2011, 108(7): 1045-51.
DOI: 10.1016/j.amjcard.2011.05.041. |
| [17] |
Wilson LE, D'aloisio AA, Sandler DP. Long-term use of calcium channel blocking drugs and breast cancer risk in a prospective cohort of US and puerto rican women[J].
Breast Cancer Res, 2016, 18(1): 1-8.
DOI: 10.1186/s13058-015-0660-6. |
| [18] |
Grimaldi-Bensouda L, Klungel O, Kurz X, et al. Calcium channel blockers and cancer:a risk analysis using the UK clinical practice research datalink (CPRD)[J].
BMJ Open, 2016, 6(1): e009147-56.
DOI: 10.1136/bmjopen-2015-009147. |
| [19] |
Rotshild V, Azoulay L, Zarifeh M, et al. The risk for lung cancer incidence with calcium channel blockers:a systematic review and meta-analysis of observational studies[J].
Drug Safety, 2018, 41(6): 1-10.
|
| [20] |
Kale VP, Amin SG, Pandey MK. Targeting ion channels for cancer therapy by repurposing the approved drugs[J].
Biochimica et Biophysica Acta-Biomembranes, 2015, 1848(10, B, SI): 2747-55.
DOI: 10.1016/j.bbamem.2015.03.034. |
| [21] |
Leanza L, Manago A, Zoratti M, et al. Pharmacological targeting of ion channels for cancer therapy:in vivo evidences[J].
Biochimica et Biophysica Acta-Molec cell Res, 2016, 1863(6, B, SI): 1385-97.
DOI: 10.1016/j.bbamcr.2015.11.032. |
| [22] |
Monteith GR, Mcandrew D, Faddy HM. Calcium and cancer:targeting Ca2+ transport[J].
Nat Rev Cancer, 2007, 7(7): 519-30.
DOI: 10.1038/nrc2171. |
| [23] |
Sarkar D. AEG-1/MTDH/LYRIC in liver cancer[J].
Adv Cancer Res, 2013, 120(2): 193-221.
|
| [24] |
Hu G, Chong RA, Yang Q, et al. MTDH activation by 8q22 genomic gain promotes chemoresistance and metastasis of poor-prognosis breast cancer[J].
Cancer Cell, 2009, 15(1): 9-20.
DOI: 10.1016/j.ccr.2008.11.013. |
| [25] |
张婷, 杨军. 星形细胞上调基因-1的研究进展[J].
基础医学与临床, 2014, 34(1): 125-9.
|
| [26] |
Xie Y, Zhong DW. AEG-1 is associated with hypoxia-induced hepatocellular carcinoma chemoresistance via regulating PI3K/AKT/HIF-1alpha/MDR-1 pathway[J].
Excl J, 2016, 15(7): 745-57.
|
| [27] |
Athukuri BL, Neerati P. Enhanced oral bioavailability of diltiazem by the influence of Gallic acid and ellagic acid in male wistar rats:involvement of CYP3A and P-gp inhibition[J].
Phytother Res, 2017, 31(9): 1441-8.
DOI: 10.1002/ptr.v31.9. |
| [28] |
Ruiz-Torres A, Lozano R, Melon J, et al. L-calcium Channel blockade induced by diltiazem inhibits proliferation, migration and F-actin membrane rearrangements in human vascular smooth muscle cells stimulate insulin and IGF-1 with[J].
Int J Clin Pharmacol Ther, 2003, 41(9): 386-91.
|
| [29] |
Viale M, Cordazzo C, de Totero DA, et al. Inhibition of MDR1 activity and induction of apoptosis by analogues of nifedipine and diltiazem:an in vitro analysis[J].
Invest New Drugs, 2011, 29(1): 98-109.
DOI: 10.1007/s10637-009-9340-7. |
| [30] |
Voisard R, Koschnick S, Baur R, et al. High-dose diltiazem prevents migration and proliferation of vascular smooth muscle cells in various in vitro models of human coronary restenosis[J].
Coron Artery Dis, 1997, 8(3/4): 189-201.
DOI: 10.1097/00019501-199703000-00011. |
| [31] |
Herzog CE, Tsokos M, Bates SE, et al. Increased mdr-1/Pglycoprotein expression after treatment of human colon carcinoma cells with P-glycoprotein antagonists[J].
J Biol Chem, 1993, 268(4): 2946-52.
|
| [32] |
Qiang F, Kang KW, Han HK. Repeated dosing of piperine induced gene expression of P-glycoprotein via stimulated pregnane-Xreceptor activity and altered pharmacokinetics of diltiazem in rats[J].
Biopharm Drug Dispos, 2012, 33(8): 446-54.
DOI: 10.1002/bdd.v33.8. |
| [33] |
郭睿, 黄小钟, 金雪媛, 等. 地尔硫卓通过下调钙激活氯离子通道抑制肝癌细胞增殖和运动[J].
南方医科大学学报, 2018, 38(7): 818-23.
|
 2019, Vol. 39
2019, Vol. 39

