2. 上海市静安区中心医院皮肤科,上海 200040;
3. 复旦大学附属华山医院 皮肤科,上海 200040
2. Department of Dermatology, Jing'an District Central Hospital, Shanghai 200040, China;
3. Department of Dermatology, Huashan Hospital Affiliated to Fudan University, Shanghai 200040, China
系统性硬化症(SSc)是一种典型的纤维化疾病[1],主要以局限性或弥漫性皮肤增厚和纤维化为特征[2-3],常伴有一个或多个脏器的受累(主要包括肺、消化道、心、肾等)。SSc皮损面积广泛,病变进展快,预后较差[4-5]。在美国,SSc的5年生存率约为50%,与肿瘤相当[6]。对于SSc,迄今没有任何美国食品药品管理局(FDA)及我国国家食品药品监督管理局批准用于治疗的药物。
SSc的发病机制复杂,至今仍未明确。相关研究报道认为,SSc是在遗传因素基础上,在环境因素促发下,导致血管病变,免疫系统紊乱,细胞外基质沉积(ECM)最终导致末端器官的病理性纤维化[7-9]。胶原蛋白是ECM的主要组成成分[10],而人体合成胶原的最主要场所是肌成纤维细胞,肌成纤维细胞是活性状态的成纤维细胞[11-12],故成纤维细胞的活性及数量在纤维化进程中发挥关键作用。本项目组前期研究显示,体外培养的SSc患者皮肤成纤维细胞较正常人皮肤成纤维细胞产生更多的胶原及促纤维化因子[13]。目前,SSc患者成纤维细胞异常活化的具体机制至今仍有待明确。阐明成纤维细胞活化及纤维化发生的机理,对于揭示SSc发病机制、探索有效的治疗方案具有重要意义。
碱性调宁蛋白(CNN1)是调宁蛋白的一种异构体,近年来多项研究表明CNN1在纤维化的发生发展中具有重要作用:调宁蛋白在人肺纤维化的肌成纤维细胞中和大鼠肾小球病的周围肌成纤维细胞中表达[14-15];大鼠肾间质纤维化程度与CNN1表达水平正相关[16];肺成纤维细胞和肝星状细胞在促纤维化因子TGF-β诱导下,纤维化标志物α-SMA和CNN1在蛋白质水平上的表达均上升[17-19]。综上可见,CNN1在纤维化进程中具有重要作用。然而,CNN1在SSc中的作用仍未明确。因此,本研究将通过检测SSc患者皮肤组织内CNN1的表达,进一步探索CNN1对成纤维细胞增殖及纤维化相关基因表达的影响,探讨其在SSc发病中的作用,进一步揭示成纤维细胞活化及SSc的发病机制。
1 资料和方法 1.1 资料19例SSc患者的皮肤组织样本来自于2009年1月~2014年12月在复旦大学附属华山医院皮肤科门诊就诊或者住院的硬皮病患者,这些患者均符合美国风湿病学会制定的SSc评判标准,采样部位为患病部位,主要为四肢和腹部;21例正常对照的皮肤组织样本来自于无自身免疫性疾病及其他任何皮肤疾病病史的正常人,所有正常人均来源于该医院的外伤、色素痣等手术患者,采样部位为手术切除部位的边缘,且与SSc患者采样部位对应。所有志愿者均签署了知情同意书。本实验获得了复旦大学生命科学学院伦理审查委员会的同意。原代皮肤成纤维细胞为本实验室前期从皮肤活检组织中培养获得。
1.2 主要仪器及试剂4 ℃冷冻离心机(5415R),0~2.5、1~20、20~100、100~1000 μL移液器(Eppendorf);Milli-Q纯水仪、CNN1抗体、I型胶原抗体(Millipore);高通量组织研磨仪(上海万柏);ND-1000 NanoDrop紫外分光光度计(Thermo Scientific);Prism 7900 Detector System,RNA逆转录试剂(High Capacity cDNA Reverse Transcription Kit)(Applied Biosystems);0~10、10~ 200、100~1000 μL枪头,1.5 mL EP管(Axygen);MCO-18AIC CO2细胞培养箱(三洋);细胞培养板(Thermo Scientific);DM1L倒置显微镜(Leica);PCR仪(Veriti 96 well Thermal cycler)(ABI);细胞实时分析检测系统(xCELLigence系统)(Roche);10 × PBS(上海双螺旋);Trizol,DEPC(sigma);RNase Zap,(Ambion);氯仿、异丙醇、无水乙醇(上海试剂),DNase free且RNase free的水、丙烯酰胺/双丙烯酰胺、APS、20% Tween20(上海生工);SYBR Premix ExTaq(Takara);DMEM、胎牛血清、0.25% EDTA-Trypsin(Gibco);Lipofectamine RNAiMAX(Invitrogen);siCNN1(上海吉玛制药技术);RIPA及PMSF、BCA protein assay kit、抗兔二抗、抗鼠二抗,购自(上海碧云天);Western blot电泳仪、电泳槽、转膜槽(Bio-Rad);TEMED, Bio Basic Inc.;Tris-HCl(pH=6.8、8.8)(上海双螺旋);Tris(上海伯奥);甘氨酸(江苏强盛功能化学);SDS、甲醇(国药集团);鼠源GAPDH抗体(Cell Signaling Technology);显影液(Thermo Scientific)。
1.3 方法 1.3.1 皮肤组织免疫组织化学染色采用免疫组化的方法检测SSc患者及正常组织的皮肤组织切片中CNN1蛋白表达的高低。具体方法为:皮肤组织切片经过二甲苯、无水乙醇和95%乙醇等试剂处理后,用0.01 mol/L柠檬酸缓冲液(pH 6.0,99.0 ℃,20 min)进行抗原修复;3%的过氧化氢阻断内源性过氧化物酶(10 min),水洗及PBS溶液冲洗;滴加抗体至切片上,4 ℃孵育过夜;PBS洗3次,5 min/次;Envision工作液,室温孵育30 min;PBS洗3次,5 min/次;DAB显色,苏木精复染,各级梯度酒精脱水,二甲苯透明,中性树脂封片。
1.3.2 细胞培养原代皮肤成纤维细胞生长在含10%胎牛血清(FBS)的DMEM培养基中,在37 ℃、5% CO2的培养箱中进行培养。
1.3.3 总RNA提取(1)组织:称取冻存的约10 mg皮肤组织于研磨仪专用2 mL EP管中,加入1粒研磨钢珠,1 mL Trizol,放入高通量组织研磨仪中,设定60 Hz研磨60 s,研磨3次,取出研磨好的组织,室温放置5 min;细胞:向12孔板每孔加入1 mL Trizol,室温放置20 min后,对应吸取至EP管中;(2)向EP管中加入200 μL氯仿,振荡混匀后室温放置5 min;4 ℃ 12 000 r/min离心10 min,吸取上层水相至另一1.5 mL离心管中;加入同体积异丙醇混匀,室温放置5 min;4 ℃ 12 000 r/min离心15 min;弃上清,RNA沉于管底;加入1 mL 75%乙醇,温和振荡离心管,悬浮沉淀;4 ℃ 12 000 r/min离心5 min,弃上清;重复上2步;用移液器吸取残留的乙醇,室温晾干3~5 min;用50 μL DNase free且RNase free的水溶解RNA;用NanoDrop进行RNA浓度测定。
1.3.4 实时荧光定量PCR反应(Real-time PCR)检测基因表达水平(1)反转录:按试剂盒说明,将RNA用MultiScribeTM Reverse Transcriptas经反转录合成cDNA,保存于-20 ℃备用;(2)Real-time PCR:按照SYBR Premix ExTaq(Takara)说明书所述的步骤配制10 μL Real-time PCR反应体系,反应体系如表 1所示,反应程序如表 2所示,引物序列如表 3所示。使用Prism 7900 Detector System检测,用相对定量的方法进行统计分析。
| 表 1 Real-time PCR反应体系 Tab.1 Reaction system of real-time PCR |
| 表 2 Real-time PCR反应程序 Tab.2 Reaction program of real-time PCR |
| 表 3 引物序列(5'到3') Tab.3 Sequences of primers |
实验分为NC、siCNN1两组,每组3个重复,将细胞以1×105/孔接种于12孔培养板中的6孔,待细胞长至50%融合时,其中3孔转染siCNN1作为实验组siCNN1组,3孔转染negative control siRNA(NC)作为对照组NC组,转染试剂选择Lipofectamine RNAiMAX,转染过程如下:(1)在50 μL无血清培养基中加入1 μL浓度为10 pmol/uL的siCNN1或NC,轻轻混匀,静置5 min;(2)在50 μL无血清培养基中加入1.5 μL RNAiMAX,轻轻混匀,静置5 min;(3)将上两步试剂混合,室温孵育20 min后,加入孔板;(4)转染24 h后,收集RNA。
1.3.6 细胞增殖检测利用xCELLigence系统对细胞增殖进行无损伤地实时定量检测[20]。实验分为NC、siCNN1、NC+TGF-β、siCNN1+TGF-β四组,每组三个重复,具体步骤如下:(1)16孔E-plate板中每孔中加入50 μL新鲜完全培养基,将滴定板放入仪器中,按说明书设好相应程序后开始检测接触是否良好及消除背景误差;(2)对细胞计数后从仪器上取下E-plate板,每孔加入50 μL细胞液,使每孔中最终细胞数为10 000个;(3)仪器原有设定程序保持不变,将加完细胞培养液的E-plate板放回仪器中,运行程序,当生长曲线的CI值接近1.0时,取下E-plate板,吸去孔中的旧培养基,siCNN1和siCNN1+TGF-β组转染siCNN1,NC和NC+TGF-β组转染NC作为对照;(4)利用含1%FBS的培养基配置TGF-β溶液(终浓度10 ng/mL),于转染24 h后向E-plate中NC+TGF-β和siCNN1+TGF-β组加入100 μL的TGF-β稀释液,NC和siCNN1组加入100 μL无血清培养基做阴性对照,放入仪器中进行检测;(5)实验结果用RTCA software进行分析。
1.3.7 Western blot提取三株细胞的总蛋白,用BCA法测蛋白浓度,取15 μg蛋白样品用配制10%的变性PAGE胶进行电泳,完成后将胶转至PVDF膜,将膜放入含5%脱脂奶粉的TBST溶液中室温脱色摇床上摇动封闭2 h;1: 1000稀释一抗,将膜放入一抗稀释液中,4 ℃孵育过夜;次日用TBST溶液洗膜3次,10 min/次;1: 5000稀释二抗,将膜放入二抗稀释液中,室温摇床上摇动孵育2 h;再用TBST溶液洗膜3次,10 min/次;显影。1.3.8数据处理实验数据采用SPSS和GraphPad Prism 6.01对数据进行常规计算及统计处理,数据采用均数±标准差。基因表达的差异通过独立样本t检验进行分析,通过Pearson相关系数进行相关性分析。当P < 0.05时,认为结果具有统计学意义。
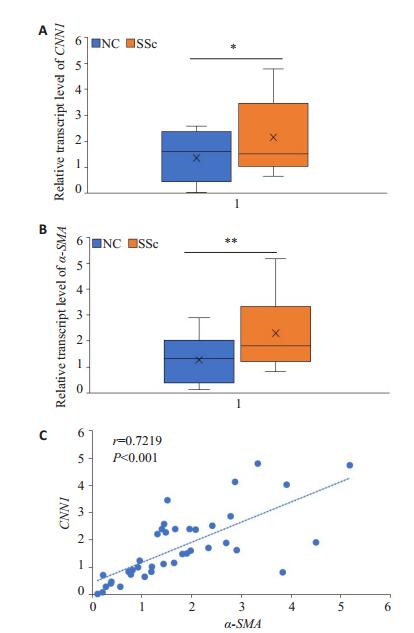
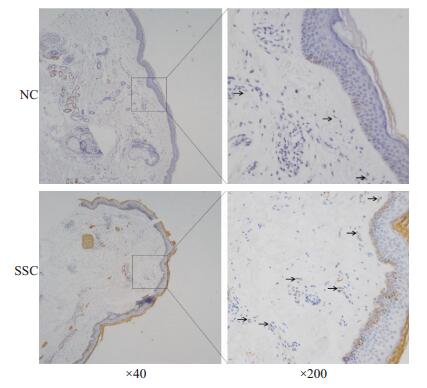
2 结果 2.1 SSc患者皮肤组织中CNN1表达升高,且与α-SMA表达呈正相关SSc患者皮肤组织中CNN1基因表达水平(1.36± 0.20)较正常对照组(2.15±0.32)上升0.58倍,具有统计学意义(P < 0.05,图 1A);SSc患者皮肤组织中肌成纤维细胞标记物α-SMA的基因表达水平(2.30±0.30)较正常对照组(1.28±0.20)上升0.80倍,具有统计学意义(P < 0.01,图 1B)。SSc患者皮肤组织中CNN1和α-SMA的基因表达水平均升高,提示CNN1可能与纤维化密切相关。为进一步探究CNN1在纤维化发生发展中的重要性,本研究对CNN1的表达与纤维化关键标志物α-SMA的表达进行了相关性分析,发现SSc患者及正常对照的皮肤组织中CNN1的基因表达水平与α-SMA的表达水平成正相关关系,r=0.7219,R2=0.5211,具有统计学意义(P < 0.0001,图 1C)。进一步通过免疫组化检测表明CNN1蛋白在SSc患者皮肤组织成纤维细胞中表达升高(图 2)。
|
图 1 人皮肤组织中CNN1和α-SMA的基因表达水平及其相关性 Fig.1 Expression levels of CNN1 and α-SMA mRNAs in human skin tissue and their correlation.A: CNN1 mRNA expression in human skin tissue; B: α-SMA mRNA expression in human skin tissue; C: Correlation between CNN1 and α-SMA mRNA expressions in human skin tissue. *P < 0.05; **P < 0.01. |
|
图 2 人皮肤组织中CNN1蛋白表达水平 Fig.2 Protein expression level of CNN1 in human skin tissue (Immunohistochemistry). |
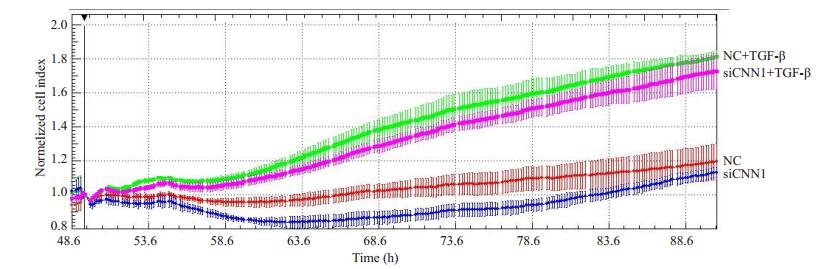
为探究CNN1在纤维化发生发展中的作用,本研究利用xCELLigence系统基检测了干扰CNN1对成纤维细胞增殖的影响。在原代皮肤成纤维细胞干扰CNN1,细胞增殖被抑制。进一步利用外源促纤维化因子TGF-β处理细胞,TGF-β显著促进细胞增殖,但是干扰CNN1的细胞增殖仍被抑制,这说明干扰CNN1可抑制皮肤成纤维细胞增殖(图 3)。
|
图 3 干扰CNN1对原代皮肤成纤维细胞增殖的影响 Fig.3 Effect of CNN1 interference on proliferation of cultured primary human dermal fibroblasts. |
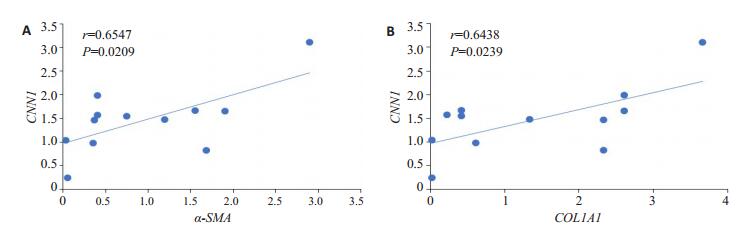
SSc患者及正常对照的原代皮肤成纤维细胞中CNN1的基因表达水平与α-SMA的表达水平成正相关关系,r=0.6547,R2=0.4287,具有统计学意义(P < 0.05,图 4A);SSc患者及正常对照的原代皮肤成纤维细胞中CNN1的基因表达水平与胶原蛋白基因COL1A1的表达水平成正相关关系,r=0.6438,R2=0.4144,具有统计学意义(P < 0.05,图 4B)。
|
图 4 原代皮肤成纤维细胞中CNN1与纤维化相关基因表达水平相关性 Fig.4 Correlation of CNN1 expression with the expression levels of fibrosis-related genes in primary dermal fibroblasts.A: Correlation between CNN1 and α-SMA mRNA expressions; B: Correlation between CNN1 and COL1A1 mRNAexpressions. |
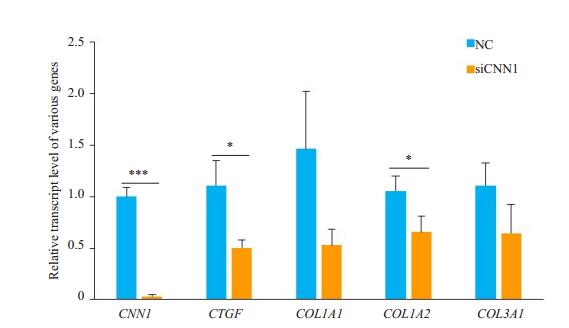
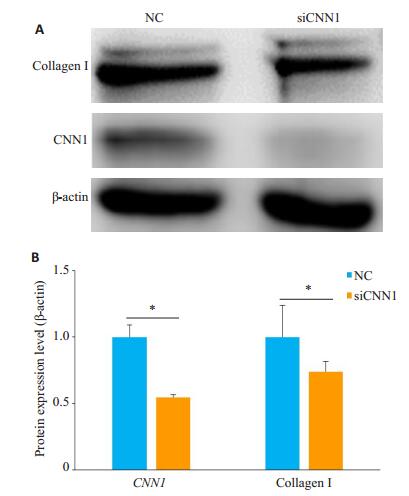
为进一步探究CNN1对成纤维细胞活性的影响,本研究利用RNA干扰方法降低原代皮肤成纤维细胞中CNN1的基因表达。干扰CNN1能够降低成纤维细胞中纤维化相关基因的表达,其中结缔组织生长因子CTGF、胶原基因COL1A2的差异具有统计学意义(P < 0.05,图 5)。进一步通过western blot检测蛋白表达,发现干扰CNN1后,CNN1蛋白表达水平显著降低(P < 0.05),能够显著降低成纤维细胞中胶原蛋白的表达(P < 0.05,图 6)。
|
图 5 干扰CNN1对纤维化相关基因的影响 Fig.5 Effect of CNN1 interference on fibrosis-related genes in primary dermal fibroblasts (*P < 0.05; ****P < 0.0001). |
|
图 6 干扰CNN1对胶原蛋白表达的影响 Fig.6 Effect of CNN1 interference on the protein expression of collagen in primary dermal fibroblasts (*P < 0.05).A: Western blotting of the related proteins; B: Quantitative analysis of the results. |
成纤维细胞活化及细胞收缩张力在SSc纤维化发生发展中具有重要作用,而CNN1在纤维化、细胞收缩中具有一定功能[14-19],因此本研究应用临床样本检测了CNN1在SSc患者中的表达情况,并且进行了细胞实验研究CNN1对成纤维细胞的作用,旨在了解CNN1在SSc皮肤纤维化中的作用。
本研究发现,SSc患者的皮肤组织中CNN1的表达显著高于正常人,上述结果提示它可能在SSc中具有重要作用。2002年Tomasek等提出,α-平滑肌肌动蛋白(α-SMA)是鉴定肌成纤维细胞最可靠的特异性指标[21],α-SMA被认为是纤维化的关键标志物。因此本研究进一步发现,在皮肤组织和原代皮肤成纤维细胞中,CNN1和α-SMA的基因表达水平成显著正相关关系,这说明CNN1与纤维化相关。此外,本研究还发现在原代皮肤成纤维细胞中,CNN1和胶原基因COL1A1的基因表达水平也成显著正相关关系,这进一步说明CNN1与纤维化相关。基于临床样本检测结果,本研究进一步通过细胞实验探索了CNN1对成纤维细胞活性的影响。
在SSc中,皮肤纤维化与内脏器官纤维化是其典型特征,它们的最终机制均为成纤维细胞过度活化,向肌成纤维细胞转化增强,纤连蛋白、胶原等细胞外基质过度表达和沉积[22]。因此,成纤维细胞的增殖和活化等在SSc纤维化的发生发展中至关重要。多种细胞因子在成纤维细胞活化中具有重要调节作用,如转化生长因子β(TGF-β)、结缔组织生长因子(CTGF)等[23]。TGF-β是公认的促纤维化因子,在硬皮病等纤维化疾病中发挥关键作用[24-25]。在原代皮肤成纤维细胞中干扰CNN1后,细胞增殖明显被抑制,在促纤维化因子TGF-β的刺激下,虽然细胞增殖加快,但是干扰CNN1的细胞增殖仍然被抑制,这说明干扰CNN1可抑制成纤维细胞细胞增殖,而且这种抑制作用在外界刺激下依然存在。胶原蛋白中Ⅰ型胶原与纤维化密切相关,主要分布于皮肤、肌腱等组织,由基因COL1A1、COL1A2表达[26]。CTGF具有促成纤维细胞增殖、胶原及细胞外基质合成等作用,它的过度表达在人体多种脏器的纤维化病变过程中起着至关重要的作用[27-28],有研究表明CTGF与多种皮肤纤维化疾病有关[29-30],因此本研究中检测了COL1A1、COL1A2、CTGF等基因的表达。本研究发现在原代皮肤成纤维细胞中干扰CNN1后,纤维化相关基因的表达降低,包括CTGF、COL1A2等,胶原的蛋白表达也降低,这说明干扰CNN1可抑制纤维化相关基因的表达及胶原蛋白表达。
本研究首先研究发现CNN1在SSc患者皮肤组织中的表达显著高于正常人,而且CNN1的表达与α-SMA、COL1A1均显著正相关,相关结果显示CNN1与SSc纤维化密切相关。进一步通过细胞实验结果显示,干扰CNN1可显著抑制成纤维细胞的增殖并降低纤维化相关基因的表达。综上可见,CNN1可通过影响成纤维细胞活性在SSc纤维化中发挥重要作用。然而,CNN1的具体作用机制还需要通过更深入的细胞实验和动物模型研究,从而进一步探究将其作为临床诊断SSc的标志物的可能,同时还可探究其作为干预靶点的潜力,设计降低CNN1表达的药物,以期为疾病的治疗提供新思路。
| [1] |
Topal AA, Dhurat RS. Scleroderma therapy: clinical overview of current trends and future perspective[J].
Rheumatol Int, 2013, 33(1): 1-18.
DOI: 10.1007/s00296-012-2486-1. |
| [2] |
Leroy EC, Medsger TA. Criteria for the classification of early Systemic Sclerosis[J].
J Rheumatol, 2001, 28(7): 1573-6.
|
| [3] |
Varga J, Abraham D. Systemic sclerosis: a prototypic multisystem fibrotic disorder[J].
J Clin Invest, 2007, 117(3): 557-67.
DOI: 10.1172/JCI31139. |
| [4] |
Brunasso A, Massone C. Update on the pathogenesis of Scleroderma: focus on circulating progenitor cells[J].
F1000Res, 2016, 25(4): 723.
|
| [5] |
Chifflot H, Fautrel B, Sordet C, et al. Incidence and prevalence of systemic sclerosis: A systematic literature review[J].
Semin Arthritis Rheum, 2008, 37(4): 223-35.
DOI: 10.1016/j.semarthrit.2007.05.003. |
| [6] |
Wells AU. Antioxidant therapy in idiopathic pulmonary fibrosis: hope is kindled[J].
Eur Respir J, 2006, 27(4): 664-6.
DOI: 10.1183/09031936.06.00010006. |
| [7] |
Katsumoto TR. Whitfield ML and connolly Mk. The pathogenesis of systemic sclerosis[J].
Annu Rev Pathol Mech Dis, 2011, 6(6): 509-37.
|
| [8] |
Gabrielli A. Avvedimento EV and krieg T. scleroderma[J].
N Engl J Med, 2009, 360(19): 1989-2003.
DOI: 10.1056/NEJMra0806188. |
| [9] |
Denton CP, Black CM, Abraham DJ. Mechanisms and consequences of fibrosis in systemic sclerosis[J].
Nat Clin Pract Rheumatol, 2006, 2(3): 134-44.
DOI: 10.1038/ncprheum0115. |
| [10] |
Varga J, Bashey RI. Regulation of connective tissue synthesis in systemic sclerosis[J].
Int Rev Immunol, 1995, 12(2/4): 187-99.
|
| [11] |
Abraham DJ, Eckes B, Rajkumar V, et al. New developments in fibroblast and myofibroblast biology: implications for fibrosis and scleroderma[J].
Curr Rheumatol Rep, 2007, 9(2): 136-43.
DOI: 10.1007/s11926-007-0008-z. |
| [12] |
Balbir-Gurman A, Braun-Moscovici Y. Scleroderma-new aspects in pathogenesis and treatment[J].
Best Pract Res Clin Rheumatol, 2012, 26(1): 13-24.
DOI: 10.1016/j.berh.2012.01.011. |
| [13] |
Wu T, Chu H, Tu W, et al. Dissection of the mechanism of traditional Chinese medical prescription-Yiqihuoxue formula as an effective anti-fibrotic treatment for systemic sclerosis[J].
BMC Complement Altern Med, 2014, 14(1): 224.
DOI: 10.1186/1472-6882-14-224. |
| [14] |
Kulkarni AA, Thatcher TH, Olsen KC, et al. PPAR-γ ligands repress TGFR-induced myofibroblast differentiation by targeting the PI3K/ Akt pathway: implications for therapy of fibrosis[J].
PLoS One, 2011, 6(1): e15909.
DOI: 10.1371/journal.pone.0015909. |
| [15] |
Lee SY, Jy C, Jin DC, et al. Expression of calponin in periglomerular myofibroblasts of rat kidney with experimental chronic injuries[J].
Anat Cell Biol, 2010, 43(2): 132-9.
DOI: 10.5115/acb.2010.43.2.132. |
| [16] |
Yuasa T, Yano R, Izawa T, et al. Calponin expression in renal tubulointerstitial fibrosis induced in rats by cisplatin[J].
J Toxicol Pathol, 2014, 27(1): 97-103.
DOI: 10.1293/tox.2013-0048. |
| [17] |
Ueki N, Ohkawa T, Yamamura H, et al. Induction of calponin-h1 by transforming growth factor-beta1 in cultured human ito cells, LI90[J].
Biochim Biophys Acta, 1998, 1403(1): 28-36.
DOI: 10.1016/S0167-4889(98)00015-9. |
| [18] |
Malmstrom J, Lindberg H, Lindberg C, et al. Transforming growth factor-beta(1) specifically induce proteins involved in the myofibroblast contractile apparatus[J].
Mol Cell Proteomics, 2004, 3(5): 466-77.
DOI: 10.1074/mcp.M300108-MCP200. |
| [19] |
李慧, 蒋涛, 杨静, 等. 大鼠系膜细胞中碱性调宁蛋白h1和转化生长因子β1的表达及其相互关系[J].
中华肾脏病杂志, 2005, 21(4): 43-7.
|
| [20] |
Sun M, Fu H, Cheng H, et al. A dynamic real-time method for monitoring epithelial barrier function in vitro[J].
Anal Biochem, 2012, 425(2): 96-103.
DOI: 10.1016/j.ab.2012.03.010. |
| [21] |
Tomasek JJ, Gabbiani G, Hinz B, et al. Myofibroblasts and mechano regulation of connective tissue remodelling[J].
Nat Rev Mol Cell Biol, 2002, 3(5): 349-63.
DOI: 10.1038/nrm809. |
| [22] |
Onuora S. Connective tissue diseases: Adipocyte-myofibroblast transition: linking intradermal fat loss to skin fibrosis in SSc[J].
Nat Rev Rheumatol, 2015, 11(2): 63.
|
| [23] |
Verrecchia F MA, Farge D. Transforming growth factor-beta signaling through the Smad proteins: role in systemic sclerosis[J].
Autoimmun Rev, 2006, 5(8): 563-9.
DOI: 10.1016/j.autrev.2006.06.001. |
| [24] |
Lafyatis R. Transforming growth factor beta-at the centre of systemic sclerosis[J].
Nat Rev Rheumatol, 2014, 10(12): 706-19.
DOI: 10.1038/nrrheum.2014.137. |
| [25] |
Baron M. Targeted therapy in systemic sclerosis[J]. Rambam Maimonides Med J, 2016, 7(4): doi10.504.
|
| [26] |
高春芳. 胶原基因转录调控与纤维化[J].
世界华人消化杂志, 2005, 13(2): 16-21.
|
| [27] |
Brigstock DR. The CCN family: a new stimulus package[J].
Journal of Endocrinology, 2003, 178(2): 169-75.
|
| [28] |
谢永鹏, 臧秀贤, 吴扬, 等. 结缔组织生长因子与肝脏纤维化[J].
临床肝胆病杂志, 2011, 27(01): 103-6.
DOI: 10.3969/j.issn.1001-5256.2011.01.027. |
| [29] |
Igarashi A, Nashiro K, Kikuchi K. Connective tissue growth factor gene expression in tissue sections from localized scleroderma, keloid, and other fibrotic skin disorders[J].
Invest Dermatol, 2004, 106(4): 729-33.
|
| [30] |
Dessein A, Chevillard C, Arnaud V, et al. Variants of CTGF are associated with hepatic fibrosis in Chinese, Sudanese, and Brazilians infected with Schistosomes[J].
J Exp Med, 2009, 206(11): 2321-8.
DOI: 10.1084/jem.20090383. |
 2019, Vol. 39
2019, Vol. 39

