2. 南方医科大学南方医院检验科,广东 广州 510515
2. Department of Clinical Laboratory, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
B细胞连接蛋白(BLNK)又称SLP-65或BASH,典型的BLNK的基本结构包括N-末端亮氨酸拉链,其后是“酸性”区域,富含脯氨酸和关键区域Src同源结构域2(SH2)[1],亮氨酸拉链因其卷曲螺旋的特性,能与膜蛋白相互作用,使BLNK定位于质膜。BLNK具有多个受体酪氨酸激酶磷酸化位点,磷酸化的BLNK可以招募多种效应蛋白(包括Grb2、Sos、PLCγ和Nck),进而活化PLC-γ2、Ras和Rac1-JNK信号通路[2-3]。然而关于BLNK结构的文献报道较少,对蛋白质亚基组成、折叠方式等方面的认识尚且不足,也是今后BLNK结构研究亟待解决的问题。
1 BLNK生物学作用 1.1 BLNK在B细胞发育过程中的作用BLNK在祖B细胞向前B细胞转化的进程中起关键作用。BLNK在骨髓细胞发育早期表达水平较高,而随着B细胞的发育成熟其表达水平逐渐降低。BLNK调控祖B细胞的发育依赖于B细胞受体(BCR)通路的活化[4]。BCR前体产生过程中发生μ重链基因重排、细胞表面标记物改变等事件,而BLNK在协调上述过程中发挥了巨大作用,其作为“衔接蛋白”将BCR相关激酶与多种信号蛋白连接起来,组成B细胞信号通路,影响着B细胞的发育成熟及功能调节。BCR前体和BLNK的缺陷,将导致B细胞的发育停滞在前B细胞阶段。研究表明,BLNK在整个B细胞个体发育过程中表达,并在B细胞发育周期中具有潜在的重要作用[5],而前B细胞分化为早期幼稚B细胞的过程同样需要BLNK的调控[6]。
1.2 BLNK在BCR信号通路中作用BCR是B细胞表面重要的免疫球蛋白。高水平BLNK表达量与BCR的活化密切相关[7]。当BCR活化发生偶联后,激活至少3种蛋白酪氨酸激酶(包括Src-PTK、SYK、BTK)以调节下游因子的活化[8-9]。BCR的ITAM基序与蛋白酪氨酸激酶结合,使蛋白酪氨酸激酶发生酪氨酸磷酸化,磷酸化的蛋白酪氨酸激酶继而与BLNK相互作用,促进BLNK的酪氨酸磷酸化。磷酸化的BLNK可以招募下游的多个效应蛋白,激活相应信号通路(图 1)。BLNK的活性对BCR信号通路的关闭同样重要:激酶PI3K介导了下游AKT/PKB的激活,从而引起BTK(S51/T495)和SYK(S295/S297)的丝氨酸/苏氨酸位点磷酸化;同时,AKT和HPK1共同使BLNK的S285和T152发生磷酸化,导致BLNK蛋白发生泛素化降解,从而终止了BCR信号通路的传递[10-11]。
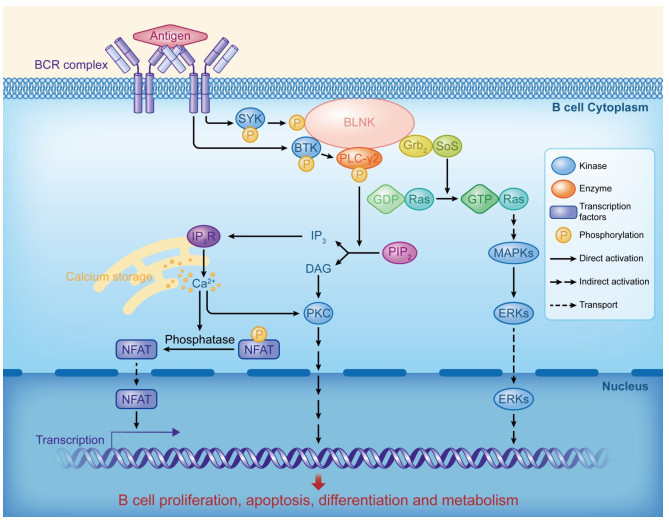
|
图 1 BLNK在BCR信号通路中的作用机制 Fig.1 Mechanism of BLNK in the BCR signaling pathway. |
除了BCR通路外,BLNK的活性还与NOTCH通路的激活密切相关。在正常B细胞中,NOTCH通路的激活可以增强BCR对胞外信号的应答并提高BLNK的表达水平;利用特异性抗体封闭NOTCH受体后,NOTCH和BCR通路的活性同时显著降低,进而影响了NOTCH通路相关转录调控分子的表达以及B细胞的成熟[12]。
1.2.1 BLNK调控PLC-γ的活性BLNK和PLC-γ是激活Ca2+信号介导的BCR信号通路的关键组分。BLNK通过结合SYK和BTK参与PLC-γ2分子的活化[13]。过表达BLNK促进PLC-γ的酪氨酸磷酸化、受体介导的Ca2+应答及NFAT的转录活化;反之,BLNK显性负突变体抑制PLC-γ磷酸化、Ca2+应答及NFAT的转录活化进程。PLC-γ磷酸化的具体机制如下:BCR复合物耦联后激活下游的SYK,SYK使BLNK发生酪氨酸磷酸化并促进BLNK从细胞质向细胞膜跃迁,BLNK与PLC-γ的SH2结构域结合并促进其磷酸化,同时将PIP2切割成三磷酸肌醇和二酰基甘油,导致游离Ca2+浓度增加和PKC的活化。三磷酸肌醇与其受体在内质网结合后,向细胞质释放Ca2+,游离的Ca2+可激活丝氨酸/苏氨酸、磷酸酶、钙调磷酸酶等多种钙依赖性酶,从而使NFAT发生去磷酸化,促进NFAT从细胞质转移到细胞核参与转录调控,进而促进B细胞的活化[14]。
E3泛素连接酶Cbl参与了SYK负调控PLC-γ2的生物学进程。BCR复合物的偶联活化能够促进Cbl的SH2结构域与BLNK结合,抑制BLNK与PLC-γ的结合,从而抑制PLC-γ2信号通路的激活;同时,Cbl的SH2结构域还能与SYK结合,抑制SYK的活化,进而抑制PLC-γ的磷酸化[15]。受体酪氨酸激酶BTK也参与了PLC-γ2通路的激活。BTK的PH结构域与Ptd Ins-3, 4, 5-P3结合,促进BTK向细胞膜迁移,随后,BTK的SH2结构域与BLNK结合,使BLNK发生磷酸化,磷酸化的BLNK为BTK和PLC-γ提供结合位点,从而激活PLC-γ2[16]。
1.2.2 BLNK参与Ras通路的激活BLNK能够与Grb2的SH2及SH3结构域结合,使Grb2被招募到细胞膜上,同时Grb2的SH3结构域也能够与鸟苷释放蛋白Sos的脯氨酸富集区结合,Sos促进Ras释放GDP,结合GTP,使Ras蛋白由非性状态转变为活性状态;激活的Ras通过诱发酶促级联反应而激活MAPK/ERK信号通路[17-18]。
2 BLNK与B细胞相关疾病BLNK与B细胞相关疾病的发生发展关系极为密切,是B细胞病变与疾病发生过程中的关键作用分子,BLNK在B细胞成熟的不同阶段可能发生功能性突变,破坏B细胞稳态并导致B细胞发育成熟障碍,从而导致B细胞相关疾病的发生。近年来人们对BLNK在各种B细胞相关疾病中的作用机制进行了诸多探索。
2.1 BLNK与过敏性疾病的关系IgE抗体的异常产生会导致过敏性疾病的发生。正常情况下,IgE+B细胞极少分化为记忆B细胞或长寿命浆细胞,因为它们只是短暂地参与生发中心的合成。但膜IgE可通过BLNK-JNK/p38通路而触发浆细胞的快速分化和凋亡,并且这种浆细胞分化不依赖抗原和细胞外环境,反应涉及多个IgE结构域和SYK、BTK等关键分子。在BLNK-/-小鼠中生发中心IgE+B细胞增殖的抑制解除和IgE过度产生的进程被延长[19-20]。可见BLNK与过敏性疾病有密切关系。
2.2 BLNK与多发性硬化症的关系多发性硬化症是中枢神经系统慢性炎症性脱髓鞘疾病。研究表明,B淋巴细胞去除药物利妥昔单抗在治疗复发-缓解型多发性硬化症患者时具有良好的临床效果,证实B细胞参与多发性硬化症的发病进程,实验性自身免疫性脑脊髓炎(EAE)是研究多发性硬化症的理想动物模型[21]。金桂花等[22]利用MOG 35-55多肽抗原配剂分别免疫野生型C57BL/6鼠与BLNK-/-鼠制备动物EAE模型,发现BLNK表达缺失可加重EAE反应,使EAE病程延长,提示BLNK参与了EAE的发生发展。该课题组还发现BLNK-/-鼠脾脏中调节性T细胞(Treg)数量较C57BL/6鼠显著减少[22],表明在EAE中,B细胞可能通过促进Treg的增殖维持其数量,使得Treg细胞发挥抑制EAE的作用,而BLNK的功能性缺失可能通过影响B细胞的生物学状态从而调节Treg在EAE中的作用。Ray等[23]认为B细胞依靠GITR配体与Treg表面表达的GITR结合,从而促进EAE中Treg的增殖以维持调节免疫的稳态;该课题组检测了EAE小鼠血清中的抗MOG 35-55特异性抗体,发现无论在发病的高峰期还是恢复期,BLNK-/-小鼠血清中的MOG特异性IgM和IgG水平始终较低,表明BLNK缺失能够显著抑制MOG特异性抗体的产生;另外,在BLNK-/-小鼠中,B细胞分泌的IL-10明显降低,而IL-2的表达增高,由B细胞分泌的IL-10可抑制巨噬细胞和树突状细胞分泌IL-12,并抑制T细胞增殖及分化,从而抑制由Th1型T细胞介导的疾病,提示BLNK可能通过调控B细胞分泌的Th1/Th2细胞因子而影响EAE炎症反应。T细胞的活化、抗体的升高、细胞因子的异常调控等事件的共同作用导致了EAE的发生。
2.3 BLNK与染色体组非整倍体的关系染色体组的非整倍体特性是恶性肿瘤的典型标志。非整倍体可能是恶性肿瘤发生的主要原因。BLNK通过调控胞质分裂,参与调控p53基因的转录活性,从而维护染色体的完整性,阻止非整倍体的产生。p53基因在50%以上的人类癌症中均发生突变,是肿瘤复杂信号传导网络中的中枢调控分子。p53基因是BLNK的转录调控靶点,过表达BLNK能够增强p53基因的表达,从而促进p53介导的DNA损伤修复;另一方面,外源BLNK的异位表达能够抑制细胞分裂,通过调控p53稳定性而维持基因组的完整性,从而阻止了非整倍体的发生[24]。
2.4 BLNK与无丙种球蛋白血症的关系先天性无丙种球蛋白血症是一种遗传性免疫系统紊乱疾病,主要由早期B细胞发育过程中的先天错误而导致机体无法正常产生抗体,临床表现为血液循环中B淋巴细胞数量减少,各类免疫球蛋白含量明显降低或缺乏。X-连锁无球蛋白血症是最主要的病理亚型,主要由BTK基因突变导致的B淋巴细胞分化发育障碍引起[25]。临床上还发现与X-连锁无球蛋白血症临床表现相似,但无X染色体关联性的疾病,称为非Btk基因突变的先天性无丙种球蛋白血症,它的发生可能由BLNK基因突变引起。Lagresle等[26]将BLNK基因进行移码突变,导致骨髓中的B细胞发育阻滞在pre-B1至pre-B2阶段。与健康B细胞相比,BLNK缺失突变细胞中的BLNK转录产物和蛋白质表达急剧减少,B淋巴细胞数量显著降低;另外,BLNK缺失突变还能破坏B细胞稳态并造成未成熟B细胞的异常扩增及B细胞分化发育异常,导致成熟B细胞和各种类型的免疫球蛋白缺乏[27-28]。
2.5 BLNK与B淋巴细胞白血病的关系前B细胞白血病与BCR前体信号通路密切相关,BLNK和BTK作为BCR前体信号通路的关键蛋白,是前B细胞白血病常见的治疗靶点[29]。在BLNK-/-小鼠中,大约15%的小鼠在出生6月后自发形成前B细胞白血病。在免疫缺陷小鼠体内注射BLNK-/-的前B细胞,3~5周后可引发小鼠白血病。从机理上解释:BTK与BLNK发挥协同作用,终止BCR前体介导的前B细胞增殖扩张,从而阻止B细胞白血病的发生。
除了B细胞白血病,儿童急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)细胞中也往往缺乏BLNK蛋白表达,BLNK的表达与ALL患者的预后显著相关,表明BLNK是B细胞相关肿瘤的关键抑癌基因[30]。JAK3/STAT5信号通路的激活是驱动前B细胞白血病细胞增殖的主要动力,而该通路的激活在一定程度上需要IL-7的参与。在ALL中,BLNK可以抑制JAK3/STAT5通路活性及IL-7R的表达,JAK3活性的降低增强了细胞周期抑制基因p27kip1的表达水平,造成细胞周期阻滞,从而促进ALL细胞凋亡。BLNK对JAK3的抑制作用依赖于BLNK与JAK3的直接相互作用。BLNK的体细胞丢失和伴随的JAK3/STAT 5通路激活是导致B细胞白血病发生的主要原因[31]。
PAX5基因是儿童和成人ALL体细胞突变最常见的基因,其突变频率在儿童和成人ALL体细胞中分别为38.9%和34%。PAX5是BLNK转录激活必需的转录因子。PAX5的融合蛋白(如PAX5-PML)已被证实对PAX5转录活性有明显的负调控作用,其在B淋巴细胞中可抑制PAX5基因的表达,导致BLNK的表达水平被选择性地抑制。Imoto等[32]将PAX5-PML融合基因转入正常的小鼠祖B细胞中,导致细胞发育停滞在祖B细胞阶段,且小鼠在长时间饲养后可自发形成ALL。PAX5基因的突变抑制BLNK的表达,BLNK的选择性抑制对ALL的发生具有重要意义[33]。
在慢性淋巴细胞白血病中,BLNK和CD5高表达,而二者在正常B或T细胞中不表达。BLNK和CD5是STAT 3磷酸化所必需的。敲低BLNK或CD5可显著降低慢性淋巴细胞白血病细胞中STAT 3的丝氨酸水平,可见BLNK是STAT 3磷酸化状态的重要调控因子[34]。
2.6 BLNK与淋巴瘤的关系致癌基因rel的持续性激活是许多肿瘤的标志事件之一。Gupta等[35]通过微阵列分析发现v-rel和c-rel是淋巴瘤细胞的关键转录因子,rel与BLNK基因的上游启动子结合,可负调控关键BCR元件及BLNK的转录活性。v-rel和c-rel的转录调控作用及BLNK的功能性抑制是淋巴细胞恶性转化的重要因素,且两者在多种淋巴瘤中的表达呈显著负相关。在原发性纵膈大B细胞淋巴瘤和霍奇金淋巴瘤中,c-rel蛋白发生明显的核积聚现象,导致BLNK及各种BCR通路信号分子表达下调;c-rel还可以诱导B细胞凋亡并增强B细胞肿瘤和其他肿瘤细胞对化疗的敏感性[35]。该课题组还发现,BLNK的过表达强烈拮抗由v-rel引起的淋巴细胞恶性转化,提示BLNK可能通过负反馈调控v-rel及其下游通路发挥抑癌基因作用[36]。
3 BLNK的研究前景BLNK在BCR信号通路中发挥重要作用,通过多条信号通路的级联传递,最终影响特定基因的转录表达,参与B细胞的增殖、分化、凋亡等生物学进程。随着对BLNK的结构、功能及分子作用机制认识的不断深入,人们越来越意识到BLNK作用方式的多效性、复杂性和重要性。多项研究已证实由BLNK基因突变或缺失引起的B细胞功能紊乱可导致自身免疫性疾病的发生。因此,平衡BLNK的表达水平和维持B细胞功能稳定被认为是多种自身免疫性疾病的潜在治疗方向[37]。BLNK在特定疾病中还可能以融合基因的方式发挥生物学作用。在费城染色体样急性淋巴细胞白血病中,检测到BLNK的5’端与DNTT基因发生融合,这种不常见的融合方式可能为研发靶向BLNK的功能性抑制剂提供新的思路[38]。作者一直致力于BLNK在恶性肿瘤中的机制研究,目前已发现BLNK能够在体内和体外促进乳腺癌的增殖和转移(未发表),然而BLNK促进乳腺癌转移的作用靶点尚不清楚。最后,围绕BLNK的作用机制尚有一些问题亟待解决:BLNK如何影响B细胞的发育?BLNK在BCR信号通路中还有哪些未知的功能机制?BLNK如何影响B细胞相关疾病的发生发展?这些研究方向也将为自身免疫性疾病的治疗方案提供新的思路。
| [1] |
Han Y, Xin L, Shi B, et al. Identification and characterisation of the immune response properties of Lampetra japonica BLNK[J].
Sci Rep, 2016, 5(6): 25308-16.
|
| [2] |
Seda V, Mraz M. B-cell receptor signalling and its crosstalk with other pathways in normal and malignant cells[J].
Eur J Haematol, 2015, 94(3): 193-205.
DOI: 10.1111/ejh.2015.94.issue-3. |
| [3] |
Kusuyama J, Ai K, Changhwan S, et al. Spleen tyrosine kinase influences the early stages of multilineage differentiation of bone marrow stromal cell lines by regulating phospholipase C gamma activities[J].
J Cell Physiol, 2018, 233(3): 118-29.
|
| [4] |
Szydlowski M, Jablonska E, Juszczynski P. FOXO1 transcription factor:a critical effector of the PI3K-AKT axis in B-Cell development[J].
Int Rev Immunol, 2014, 33(2): 146-57.
DOI: 10.3109/08830185.2014.885022. |
| [5] |
Bednarski JJ, Pandey R, Schulte E, et al. RAG-mediated DNA double-strand breaks activate a cell type-specific checkpoint to inhibit pre-B cell receptor signals[J].
J Experim Med, 2016, 213(2): 209-23.
DOI: 10.1084/jem.20151048. |
| [6] |
Abdelrasoul H, Werner M, Setz CS, et al. PI3K induces B-cell development and regulates B cell identity[J].
Sci Rep, 2018, 8(1): 1327-36.
|
| [7] |
Polgarova K, Vaskova M, Fronkova E, et al. Quantitative expression of regulatory and differentiation-related genes in the key steps of human hematopoiesis:The LeukoStage Database[J].
Differentiation, 2016, 91(1/3): 19-28.
|
| [8] |
Woyach JA, Ruppert AS, Guinn D, et al. BTKC481S-Mediated resistance to ibrutinib in chronic lymphocytic leukemia[J].
J Clin Oncol, 2017, 35(13): 1437-45.
DOI: 10.1200/JCO.2016.70.2282. |
| [9] |
Ndipagbornchi TG, Mauno V. Simulation of the dynamics of primary immunodeficiencies in B cells[J].
Front Immunol, 2018(9): 1785-93.
|
| [10] |
Budzyńska PM, Niemelä M, Sarapulov AV, et al. IRF4 deficiency leads to altered BCR signalling revealed by enhanced PI3K pathway, decreased SHIP expression and defected cytoskeletal responses[J].
Scand J Immunol, 2015, 82(5): 418-28.
DOI: 10.1111/sji.2015.82.issue-5. |
| [11] |
Mohammad DK, Nore BF, Gustafsson MO, et al. Protein kinase B (AKT) regulates SYK activity and shuttling through 14-3-3 and importin[J].
Intern J Biochem Cell Biol, 2016, 78(1): 63-74.
|
| [12] |
Poe JC, Jia W, Su H, et al. An aberrant NOTCH2-BCR signaling axis in B cells from patients with chronic GVHD[J].
Blood, 2017, 130(19): 2131-45.
DOI: 10.1182/blood-2017-05-782466. |
| [13] |
Wang J, Sohn H, Sun G, et al. The autoinhibitory C-terminal SH2 domain of phospholipase C-γ2 stabilizes B cell receptor signalosome assembly[J].
Sci Signal, 2014, 7(343): e89-95.
DOI: 10.1126/scisignal.2005392. |
| [14] |
Rao A, Luo C, Hogan PG. Transcription factors of the NFAT family:regulation and function[J].
Annu Rev Immunol, 1997, 15(15): 707-47.
|
| [15] |
Patterson HC, Kraus M, Kim Y, et al. The B cell receptor promotes B cell activation and proliferation through a non-ITAM tyrosine in the Ig alpha cytoplasmic domain[J].
Immunity, 2006, 25(1): 55-65.
DOI: 10.1016/j.immuni.2006.04.014. |
| [16] |
Tsukada S, Baba Y, Dai W. Btk and BLNK in B cell development[J].
Adv Immunol, 2001, 77(5): 123-37.
|
| [17] |
Imamura Y, Oda A, Katahira T, et al. BLNK binds active H-Ras to promote B cell receptor-mediated capping and ERK activation[J].
J Biol Chem, 2009, 284(15): 9804-13.
DOI: 10.1074/jbc.M809051200. |
| [18] |
Chuang HC, Wang X, Tan TH. MAP4K family kinases in immunity and inflammation[J].
Adv Immunol, 2016, 129(3): 277-314.
|
| [19] |
Haniuda K, Fukao S, Kodama T, et al. Autonomous membrane IgE signaling prevents IgE-memory formation[J].
Nat Immunol, 2016, 17(9): 1109-17.
DOI: 10.1038/ni.3508. |
| [20] |
Yang ZY, Robinson MJ, Chen XJ, et al. Regulation of B cell fate by chronic activity of the IgE B cell receptor[J].
Elife, 2016(5): 21238-46.
|
| [21] |
Hussain RZ, Hayardeny L, Cravens PC, et al. Immune surveillance of the central nervous system in multiple sclerosis-Relevance for therapy and experimental models[J].
J Neuroimmunol, 2014, 276(1/2): 9-17.
|
| [22] |
金桂花, 李雪, 藤本学, 等. B细胞连接蛋白的表达抑制小鼠实验性自身免疫性脑脊髓炎[J].
免疫学杂志, 2016(10): 848-52.
|
| [23] |
Ray A, Basu S, Williams CB, et al. A novel IL-10-independent regulatory role for B cells in suppressing autoimmunity by maintenance of regulatory T cells via GITR ligand[J].
J Immunol, 2012, 188(7): 3188-98.
DOI: 10.4049/jimmunol.1103354. |
| [24] |
Kamino H, Futamura M, Nakamura Y, et al. B-cell linker protein prevents aneuploidy by inhibiting cytokinesis[J].
Cancer Sci, 2008, 99(12): 2444-54.
DOI: 10.1111/cas.2008.99.issue-12. |
| [25] |
Abu-Arja RF, Chernin LR, Abusin G, et al. Successful hematopoietic cell transplantation in a patient with X-linked agammaglobulinemia and acute myeloid leukemia[J].
Pediatr Blood Cancer, 2015, 62(9): 1674-6.
DOI: 10.1002/pbc.25554. |
| [26] |
Lagresle PC, Millili M, Luce S, et al. The BLNK adaptor protein has a nonredundant role in human B-cell differentiation[J].
J Allergy Clin Immunol, 2014, 134(1): 145-56.
DOI: 10.1016/j.jaci.2013.12.1083. |
| [27] |
Nasereddin A, Shamriz O, Keller B, et al. Enteroviral infection in a patient with BLNK adaptor protein deficiency[J].
J Clin Immunol, 2015, 35(4): 356-60.
DOI: 10.1007/s10875-015-0164-2. |
| [28] |
Nasrullayeva GM, Mammadova VR, Khalilova AV, et al. The novel patient with BLNK gene type of agammaglobulinemia[J].
Open Access Library J, 2017, 4(11): 1-7.
|
| [29] |
Hiratsuka T, Takei Y, Ohmori R, et al. ZFP521 contributes to pre-Bcell lymphomagenesis through modulation of the pre-B-cell receptor signaling pathway[J].
Oncogene, 2016, 35(25): 3227-38.
DOI: 10.1038/onc.2015.385. |
| [30] |
Ez-Enrã EC, Rcenas-Lã RA, Hidalgo-Miranda A, et al. Gene expression profiling of acute lymphoblastic leukemia in children with very early relapse[J].
Arch Med Res, 2016, 47(8): 644-55.
DOI: 10.1016/j.arcmed.2016.12.005. |
| [31] |
Katerndahl CD, Heltemes-Harris LM, Willette MJ, et al. Antagonism of B cell enhancer networks by STAT5 drives leukemia and poor patient survival[J].
Nat Immunol, 2017, 18(6): 694-705.
DOI: 10.1038/ni.3716. |
| [32] |
Imoto N, Hayakawa F, Kurahashi S, et al. B cell linker protein (BLNK) is a selective target of repression by PAX5-PML protein in the differentiation block that leads to the development of acute lymphoblastic leukemia[J].
J Biol Chem, 2016, 291(9): 4723-31.
DOI: 10.1074/jbc.M115.637835. |
| [33] |
Xue K, Song JZ, Yang Y, et al. PAX5 promotes pre-B cell proliferation by regulating the expression of pre-B cell receptor and its downstream signaling[J].
Mol Immunol, 2016, 73(14): 1-9.
|
| [34] |
Rozovski U, Harris DM, Li P, et al. Constitutive phosphorylation of STAT3 by the CK2-BLNK-CD5 complex[J].
Molecul Cancer Res, 2017, 15(5): 610-8.
DOI: 10.1158/1541-7786.MCR-16-0291. |
| [35] |
Gupta N, Delrow J, Drawid A, et al. Repression of B-cell linker (BLNK) and B-cell adaptor for phosphoinositide 3-kinase (BCAP) is important for lymphocyte transformation by Rel proteins[J].
Cancer Res, 2008, 68(3): 808-14.
DOI: 10.1158/0008-5472.CAN-07-3169. |
| [36] |
Kuang ZX, Guo L, Li X. Identification of key genes and pathways associated with classical hodgkin lymphoma by bioinformatics analysis[J].
Mol Med Rep, 2017, 16(4): 4685-93.
DOI: 10.3892/mmr.2017.7158. |
| [37] |
Dilillo DJ, Matsushita T, Tedder TF. B10 cells and regulatory B cells balance immune responses during inflammation, autoimmunity, and cancer[J].
Ann NY Acad Sci, 2010, 1183(1): 38-57.
DOI: 10.1111/j.1749-6632.2009.05137.x. |
| [38] |
Tasian SK, Loh ML, Hunger SP. Philadelphia chromosome-like acute lymphoblastic leukemia[J].
Blood, 2017, 130(19): 2064-72.
DOI: 10.1182/blood-2017-06-743252. |
 2019, Vol. 39
2019, Vol. 39

