2. 南方医科大学珠江医院药剂科,广东 广州 510282;
3. 广州白云山潘高寿药业股份有限公司,广东 广州 511400
2. Department of Pharmacy, Zhujiang Hospital, Southern Medical University, Guangzhou 510282, China;
3. Guangzhou Baiyun Mountain Pangaoshou Pharmaceutical Co. Ltd., Guangzhou 511400, China
肝癌是我国高发的恶性肿瘤之一,肝细胞肝癌在原发性肝癌中所占比例已超过90%,具有恶性程度高、发生发展迅速、易转移、复发和预后生存期短的特点[1-3]。虽然现代医学对肝细胞肝癌的诊断和治疗均有较大成就,但由于其高复发转移率和强大的抗化疗药性,整体治疗效果并不乐观,尤其对并发症、术后复发及放化疗副作用等问题还没有很好的解决办法[4]。近年来,中医药在肝癌的手术、放疗后辅助治疗凸显出了独特的优势[5]。四君子汤被广泛应用于肿瘤的临床辅助治疗,特别是作为辅助治疗消化道恶性肿瘤晚期[6-7]、正气亏虚之时起到了独特的优势,但关于其在肝癌方面的研究报道尚不完善。
本研究在四君子汤的基础上添加具有清热解毒散结的半枝莲和益胃清热生津的石斛组成加味四君子汤,前期研究发现,加味四君子汤能够抑制肝癌Hep-G2细胞的增殖,诱导其凋亡,阻滞其于G0/G1期,其机制可能通过阻断PI3K/Akt/mTOR信号通路实现[8],但其体内抗肝癌药效研究及相关机制尚不明确。因此,为进一步确定加味四君子汤的体内抗肝癌药效影响,本研究在前期基础上,构建H22肝癌荷瘤小鼠模型,探讨加味四君子汤的体内抑瘤活性及对肝肾毒性、免疫系统的影响。
1 材料和方法 1.1 动物、细胞株及药物SPF雌性级昆明小鼠60只,6~8周龄,体质量20±2 g,由广东省南方医科大学动物中心提供;H22肝癌细胞株,由广东省中西医结合医院肿瘤中心提供;中药材人参、白术、茯苓、甘草、半枝莲、石斛均购自南方医科大学珠江医院,经南方医科大学中医药学院张宏伟教授鉴定均为正品;环磷酰胺(CTX),百特医疗用品贸易(上海)有限公司(批号:H20110407)。
1.2 主要试剂与仪器试剂:高糖DMEM培养基(美国BI,批号:0033617);胎牛血清(Gibco,批号:42Q7380K);胰酶(美国BI,批号:0010218);小鼠ELISA IL-2试剂盒(杭州联科生物,批号:A20280933);小鼠ELISA TNF-α试剂盒(杭州联科生物,批号:A20280745);柠檬酸(pH6.0)抗原修复液(Servicebio,批号:G1202);BSA(Servicebio,批号:G5001);一抗:Bax(Servicebio,稀释比:1:300)、bcl- 2(Servicebio,批号:GB12008,稀释比:1:400)、Caspase3(Servicebio,批号:GB11009,稀释比:1:300);二抗:HRP标记山羊抗兔IgG(Servicebio,批号:GB23303,稀释比:1:200)、HRP标记山羊抗小鼠IgG(Servicebio,批号:GB23301,稀释比:1:200)、HRP标记山羊抗兔IgG(Servicebio,批号:GB23303,稀释比:1:200);组化试剂盒DAB显色剂(Servicebio,批号:G1211)。
仪器:全自动血细胞分析仪(日本SYSMEX XN1000);细胞培养箱(Heraeus HERA cell 150);高速低温离心机(德国cppendorf Centrifuge5415R);分析天平(METTLER TOLEDO AB204-N);10%中性缓冲福尔马林固定液(广州维格斯生物技术有限公司);全自动生化检测仪(德国,BECKMAN COULTER DXC800);脱水机(武汉俊杰电子有限公司,JJ-12J);包埋机(武汉俊杰电子有限公司,JB-P5);病理切片机(上海徕卡仪器有限公司,RM2016)。
1.3 建立H22荷瘤小鼠模型小鼠肝癌细胞株H22复苏后,用含10%的胎牛血清与双抗(100 U/mL)的培养基、无菌培养瓶,在37 ℃、5% CO2培养箱中常规培养, 待细胞长至对数生长期时,H22悬浮透亮抱团成葡萄串,制备成细胞悬液,细胞计数后吸取0.2 mL接种于小鼠腹腔。7~10 d后可见腹部膨大,颈椎脱臼处死小鼠,无菌条件下抽取淡黄色腹水,经稀释计数后传代,传代3次后,计数H22腹水细胞,稀释至1×106/mL,以0.2 mL每只接种于小鼠右腋皮下,接种后36~48 h可触及肿瘤结节。
1.4 药物制备加味四君子汤方药组成:人参9 g、白术9 g、茯苓9 g、甘草6 g、半枝莲30 g、石斛15 g。按照人与小鼠体表面积换算成用药组小鼠所需药量,加味四君子汤低、中、高剂量组的给药量分别为11.83、23.66、47.32 g/kg。称重后加水浸泡1 h,煎煮2次各1 h混匀药液,过滤浓缩分别得含生药量0.5、1、2 g/mL的低、中、高剂量所需药液,4 ℃保存待用。环磷酰胺用生理盐水配置成所需浓度,0.2 mL/只(30 mg/kg)。
1.5 分组和给药60只SPF级雌性昆明小鼠适应性饲养1周,随机接种50只,接种后第2天,依据简单随机抽样法,将小鼠随机分成5组,即:模型组、阳性对照组(CTX)、加味四君子汤低(JW-L)、中(JW-M)、高(JW-H)剂量组。CTX采用腹腔注射给药方式,加味四君子汤采用灌胃方式给药,空白组和模型组以等量的生理盐水灌胃,2次/d,连续10 d,末次给药后禁食不禁水,24 h后称小鼠体质量,眼眶静脉采血,断颈处死,收集血液及组织做相关分析。
1.6 组织样品的处理小鼠采血后,颈椎脱臼处死,剥离肿瘤,剖取脾腺、胸腺,分析天平称重,记录各组织质量,计算各组抑瘤率、10 g体质量的胸腺指数和10 g体质量的脾腺指数。
| ${\rm{抑瘤率 = }}\left[ {1 - \left( {{\rm{给药组平均瘤重/模型组平均瘤重}}} \right)} \right] \times 100\% $ |
| ${\rm{胸腺指数 = 胸腺质量(mg)/体质量}}\left( {\rm{g}} \right) \times 10 $ |
| ${\rm{胸腺指数 = 脾腺质量(mg)/体质量}}\left( {\rm{g}} \right) \times 10 $ |
用福尔马林对肿瘤组织进行固定,石蜡包埋并切片,HE染色200×镜下观察各组肿瘤组织病理变化,免疫组化检测肿瘤组织中Bax、Bcl-2、活化的caspase-3水平,400×镜下拍照观察。
1.7 血液样品的处理眼眶静脉采血,取2滴用于全自动血细胞分析仪进行血常规检测,分析外周血白细胞(WBC)、红细胞(RBC)、血红蛋白(Hb)和血小板(BPC)含量,剩余血液室温静置1~2 h,4 ℃ 3000 r/min离心10 min,得血清上清液,用于生化检测肝肾功能指标Cr、BUN、AST、ALT水平,并依照试剂盒说明书利用酶联免疫法(ELISA)检测血清中IL-2、TNF-α水平。
1.8 统计学分析在400×视野中用image J分析软件计算各组肿瘤组织免疫组化Bax、Bcl-2、caspase-3的阳性表达,以平均光密度值代表蛋白相对表达量。采用SPSS 20.0进行统计分析,计量数据采用均数±标准差表示;多组间比较采用单因素方差分析;组间两两比较,方差齐时采用LSD检验,方差不齐时采用Dunntt's T3。以P < 0.05为差异具有统计学意义。
2 结果 2.1 对H22荷瘤小鼠肿瘤生长的影响给药10 d后,小鼠无死亡,各给药组的肿瘤质量均低于模型组,与模型组相比,CTX、中剂量、高剂量差异均有统计学意义(P < 0.05),加味四君子汤低、中、高剂量组的抑瘤率分别为45.46%、58.71%、77.61%,并呈一定的量效关系(表 1)。
| 表 1 加味四君子汤对H22荷瘤小鼠肿瘤生长的影响 Tab.1 Effect of Jiawei Sijunzi decoction on tumor growth in H22 tumor-bearing mice (n=10) |
肿瘤组织石蜡包埋、切片、HE染色后,200×镜下病理切片观察发现,模型组肿瘤细胞排列紧密,出血坏死较少,CTX的多数肿瘤细胞破裂,出现大片染红的肿瘤细胞,加味四君子汤低、中、高剂量组均出现肿瘤细胞破裂坏死,且呈浓度依赖性变化,其中,高剂量与CTX无明显差异(图 1)。
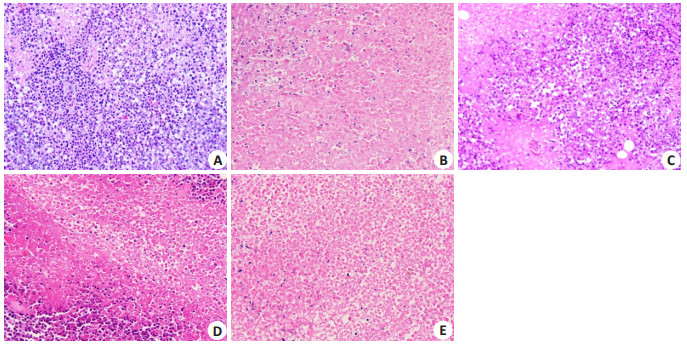
|
图 1 荷瘤小鼠肿瘤组织HE染色切片 Fig.1 HE staining of the tumor tissue in the tumor-bearing mice in different groups (HE staining, ×200). A: Model group; B: CTX group; C: JW-L group; D: JW-M group; E: JW-H group. |
Bax、Bcl-2蛋白阳性表达于细胞质中,细胞核被苏木素染成蓝色,核周胞质被DAB染色呈黄色或棕黄色。免疫组化结果显示,模型组Bax阳性表达最低,切片细胞核清晰紧密被染色蓝色,Bcl-2阳性表达最高,部分细胞质被染成棕黄色,Bax/Bcl-2的平均光密度比值最低。各给药组Bax阳性表达均有不同程度的升高,从高到低分别为:CTX >高剂量>中剂量>低剂量(图 2),与模型组相比,各组平均光密度值差异均具有统计学意义(P < 0.01,表 2);各给药组的Bcl-2阳性表达均比模型组低,从高到低依次为:低剂量>中剂量>CTX >高剂量(图 3),与模型组相比,高剂量组和CTX组差异具有统计学意义(P < 0.01,表 2);各给药组的Bax/Bcl-2的比值均比模型组大(P < 0.05,表 2)。
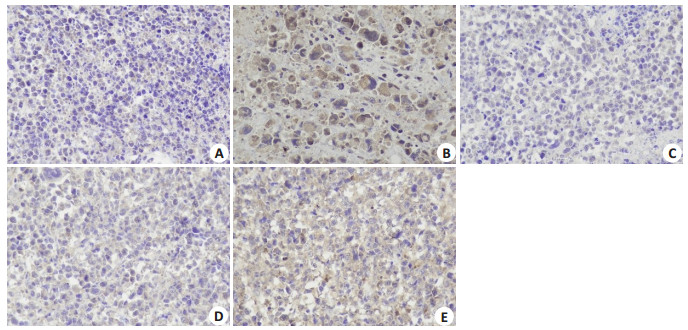
|
图 2 肿瘤组织免疫组化Bax表达 Fig.2 Immunohistochemical detection of Bax in the tumor tissues in different groups (DAB staining, × 400). A: Model group; B: CTX group; C: JW-L group; D: JW-M group; E: JW-H group. |
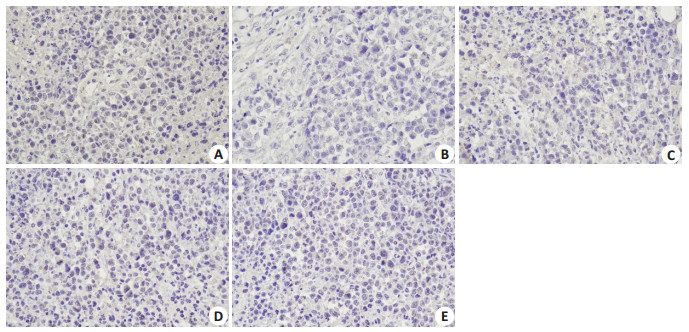
|
图 3 肿瘤组织免疫组化Bcl-2表达 Fig.3 Immunohistochemical detection of Bcl-2 expression in the tumor tissues in different groups (DAB staining, ×400). A: Model group; B: CTX group; C: JW-L group; D: JW-M group; E: JW-H group. |
| 表 2 荷瘤小鼠肿瘤组织免疫组化Bax、Bcl-2、caspase-3平均光密度值及Bax/Bcl-2的变化 Tab.2 Changes of mean optical density of Bax, Bcl-2 and caspase-3 and Bax/Bcl-2 ratio in the tumor tissues of tumor-bearing mice (Mean±SD, n=10) |
免疫组化检测中,caspase-3阳性也表达于细胞质中,呈黄色或棕黄色,细胞核呈蓝色。结果显示(图 4),模型组caspase-3阳性表达最低,而CTX组阳性表达最高,加味四君子汤给药组阳性表达增强,并有一定的剂量依赖性。与模型组相比,中剂量组、高剂量组和CTX组的caspase-3阳性表达差异具有统计学意义(P < 0.001,表 2)。
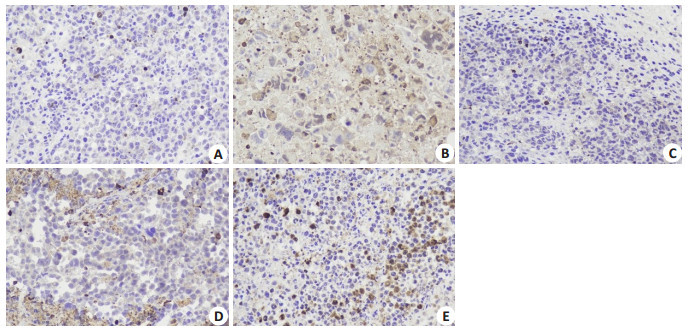
|
图 4 肿瘤组织免疫组化caspase-3表达 Fig.4 Immunohistochemical detection of caspase- 3 expression in the tumor tissues in different groups (DAB staining, ×400). A: Model group; B: CTX group; C: JW-L group; D: JW-M group; E: JW-H group. |
空白组的Cr、BUN、AST、ALT值均比其他组低,空白组与模型组的Cr、BUN、AST、ALT值差异均有统计学意义(P < 0.01)。与模型组相比,加味四君子汤低、中、高剂量组的Cr、BUN、AST、ALT值均明显下降,其中,高剂量组的各指标差异都有统计学意义(P < 0.05),CTX组的各指标均比模型组高(表 3)。
| 表 3 加味四君子汤对H22荷瘤小鼠肝肾功能的影响 Tab.3 Effect of Jiawei Sijunzi decoction on liver and renal function of H22 tumor-bearing mice (Mean±SD, n=10) |
与模型组相比,CTX组的胸腺、脾腺指数显著下降(P < 0.001),加味四君子汤的胸腺、脾腺指数均高于模型组,且有一定的剂量趋势,其中,加味四君子汤高剂量的胸腺和脾腺指数有统计学意义(P < 0.05,表 4)。
| 表 4 加味四君子汤对H22荷瘤小鼠脾胸、胸腺指数的影响 Tab.4 Effect of Jiawei Sijunzi decoction on spleen and thymus index of H22 tumor-bearing mice (Mean±SD, n=10) |
空白组与模型组的BPC差异有统计学意义(P < 0.01)。加味四君子汤给药后,小鼠WBC、RBC和Hb含量均比模型组较高,模型组与低剂量的WBC含量差异具有统计学意义(P < 0.05),而CTX组血常规各指标均比模型组含量低(P < 0.05,表 5)。
| 表 5 加味四君子汤对H22荷瘤小鼠血常规的影响 Tab.5 Effect of Jiawei Sijunzi decoction on blood routine of H22 tumor-bearing mice (Mean±SD, n=10) |
血清检测结果显示,与空白组相比,模型组的IL-2含量下降(P < 0.001),TNF-α含量也明显下降。与模型组相比,加味四君子汤低、中、高剂量组血清中TNF-α、IL-2含量均比模型组高,且有一定的剂量趋势,其中,中、高剂量组的TNF-α差异具有统计学意义(P < 0.01),高剂量组的IL-2也具有明显差异(P < 0.01);CTX组的TNF-α、IL-2的含量明显降低(P < 0.05,表 6)。
| 表 6 加味四君子汤对H22荷瘤小鼠血清TNF-a、L-2含量影响 Tab.6 Effect of Jiawei Sijunzi decoction on serum TNF-a and IL-2 levels in H22 tumor-bearing mice (Mean±SD, n=10) |
中医认为,肝癌本病在肝,而累积脾胃、胆等,以脏腑气血亏虚为本[9]。临床研究表明,四君子汤辅助治疗胃癌可提高化疗效果,减轻毒副反应,改善患者的营养状况及免疫功能[10],降低肿瘤标志物水平。实验研究表明,四君子汤可通过大鼠血清诱导胃癌侧群细胞凋亡,影响胃粘膜多胺及调控紧密连接和粘附连接蛋白表达来防治大鼠的胃粘膜损伤[11],促进肿瘤细胞凋亡抑制裸鼠人胃癌SGC-7901 SP细胞瘤体生长等[12]。前期研究发现,半枝莲提取物能明显抑制人胃癌上皮细胞的增殖[13],抑制血管生成[14],对移植性肿瘤小鼠的抑制作用非常显著,同时可促进小鼠脾细胞的增殖[15],其含药血清还能有效诱导肿瘤细胞凋亡[16]。石斛可抑制Akt激酶活性,下调Mcl-1蛋白表达,激活PARP活性,抑制HepG-2、SGC-7901、MCF-7、PC3细胞的增殖[17],其石斛多糖能明显提高T淋巴细胞转化、NK活性和巨噬细胞吞噬功能[18]。在中医药理论指导下,本研究在四君子汤的基础上加味半枝莲和石斛,在调补正气、扶正固本、适应原样的基础上加强败毒抗癌、祛瘀散结的作用以增强四君子汤的抑瘤活性,临床常用于四君子汤的加减验方对癌症患者的辅助治疗。
本研究显示,CTX和加味四君子汤中、高剂量组均具有明显的抗肿瘤活性(P < 0.05),且其抑瘤作用从强到弱依次为:CTX >高剂量>中剂量>低剂量,可有效抑制肝癌移植瘤的生长增殖。通过HE染色对肿瘤组织的细胞进行观察分析以检测细胞凋亡情况,研究结果显示,模型组细胞核清晰且排列紧密,肿瘤细胞凋亡较少,各给药组的细胞核都有不同程度的细胞核破裂被染成红色,破裂凋亡情况由强到弱依次为:CTX>高剂量>中剂量>低剂量,表明加味四君子汤的抑瘤活性有一定的剂量依赖性。现代研究认为,细胞凋亡是细胞在一定的生理或病理条件下,受多种基因精确调控主动的、程序化的死亡过程,是机体重要的自稳调节机制[19],其中,线粒体通路在细胞凋亡机制中起着至关重要的作用[20-21],在众多调控基因中,最受关注的当属Bcl-2蛋白家族和caspase家族,caspase-3是caspase级联反应下游最关键的凋亡执行者,而Bcl-2和Bax基因是目前已知的Bcl-2家族中最重要的调控基因[22-23],研究发现,Bcl-2、Bax不仅可作为caspase-3上游调控机制,参与对caspase-3活性的调节,还可作为caspase- 3的直接底物作用于caspase-3的下游[24-25],二者在细胞凋亡传导过程中相互联系又相互制约。为进一步研究加味四君子汤的抑瘤作用机制,对荷瘤小鼠的肿瘤组织进行免疫组化发现,各实验组能有效上调Bax和caspase-3蛋白表达,下调Bcl-2蛋白表达,从而提高Bax/Bcl-2比值,改变二者的平衡关系和上调caspase-3的表达起到促进凋亡的作用。研究结果与上述文献报道一致,初步认为,加味四君子汤能有效控制荷瘤小鼠移植瘤的增长速度,其抑瘤机制可能与调节Bcl-2、Bax和caspase-3的表达有关。
加味四君子汤除明显抑瘤作用外,本研究还发现,其对机体的免疫保护作用也非常的显著。为拟定加味四君子汤的安全剂量提供参考,为其质量控制和临床应用提供科学依据,本研究针对肝肾毒性对小鼠血清进行了相关的生化检测,Cr、BUN和AST、ALT是临床常用的肾功、肝功指标之一,检测结果显示,H22荷瘤小鼠模型组和CTX组对小鼠肾脏和肝脏均有一定的损伤作用,而加味四君子汤在一定程度内能改善荷瘤小鼠的肝肾功能,没有明显的肝肾毒性。通过对小鼠免疫器官和血常规的检测观察,发现加味四君子汤低、中、高剂量都能提高荷瘤小鼠的免疫器官指数,且有一定的剂量趋势,其低、中、高剂量组也能提高荷瘤小鼠WBC、RBC、Hb的含量。结果符合加味四君子汤中医基本理论“扶正固本”的理论依据。现代研究结果显示,抗肿瘤免疫抑制剂CTX在临床应用副作用明显,主要表现为免疫抑制、骨髓抑制[26],导致WBC和BPC减少甚至贫血,本实验结果也观察到CTX阳性对照组的免疫器官指数显著低于模型组(P < 0.001),其血常规各含量也明显低于模型组(P < 0.05),虽然表现出了最强的抑瘤活性,但也带来了免疫器官指数显著下降和杀伤WBC、RBC、Hb和BPC导致血常规结果异常等副作用,而加味四君子汤的免疫器官指数和血常规各指标不降反增,提示加味四君子汤的抑瘤固本作用机制之一可能是通过增加外周血WBC含量,保护免疫器官,从而抑制肿瘤生长,提高机体免疫力,达到抑瘤固本的目的。
为进一步确认加味四君子汤的抑瘤活性及免疫保护作用,本研究对各实验组的血清肿瘤坏死因子TNF-α和白介素IL-2的水平进行检测,TNF-α和IL-2是机体内重要的细胞因子,TNF-α是迄今为止所发现的直接抗肿瘤作用最强的生物活性因子之一[27],TNF通过与受体结合诱导肿瘤细胞凋亡,促进T细胞产生炎症因子,增强宿主免疫功能,作用肿瘤血管内皮细胞,导致血管功能紊乱[28-29],抑制肿瘤细胞的生长和增殖并促其溶解,引起肿瘤出血坏死等途径来发挥抗肿瘤作用,对正常的机体和组织无毒性。IL-2是免疫系统中一类细胞生长因子,参与细胞免疫,在机体复杂免疫系统中起到中心调节的作用,能刺激免疫细胞活化,促进T细胞的增殖和分化,促进IL-2的分泌,提高机体免疫机能,研究发现IL-2可促进淋巴细胞激活杀伤含有肿瘤抗原的细胞,对宿主正常细胞无影响[30-31]。因此,TNF-α和IL-2的水平可直接反映机体的抗肿瘤活性和免疫功能。检测结果表明,模型组的TNF-α、IL-2含量较空白组明显降低,H22荷瘤小鼠造模成功后,机体免疫力明显下降;加味四君子汤低、中、高剂量均能提高荷瘤小鼠的TNF-α、IL-2含量,抑制肿瘤细胞的增殖并促其溶解,同时提高了机体的免疫功能,而CTX的TNF-α、IL-2含量较模型组明显降低(P < 0.05),进一步也证明了CTX的免疫抑制副作用。
综上所述,本实验通过建立H22荷瘤小鼠模型,探讨加味四君子汤对H22荷瘤小鼠体内抑瘤活性及肝肾毒性、免疫系统的影响。发现加味四君子汤在体内有较好的抑瘤活性,并具有一定的肝肾保护作用,由此推测其抗肿瘤作用可能与上调Bax、caspase-3表达、TNF-α和IL-2水平,下调Bcl-2蛋白表达以及增强小鼠的非特异性免疫功能有关,包括调节免疫器官的生长、增加WBC含量,促进T淋巴细胞增殖和分化,从而达到抑瘤固本的作用。加味四君子汤在体内的抗肿瘤作用也可能还有其他作用机制,尚需进一步研究。
| [1] |
Shi JF, Huang HY, Guo LW, et al. Quality-of-life and health utility scores for common cancers in China:a multicentre cross-sectional survey[J].
Lancet, 2016, 388(1): 29-37.
|
| [2] |
Schmid I, von Schweinitz D. Pediatric hepatocellular carcinoma:challenges and solutions[J].
J Hepatocellul Carcinom, 2017, 4(10): 15-21.
|
| [3] |
Samonakis DN, Kouroumalis EA. Systemic treatment for hepatocellular carcinoma:Still unmet expectations[J].
World J Hepatol, 2017, 9(2): 80-90.
DOI: 10.4254/wjh.v9.i2.80. |
| [4] |
Jaferian S, Soleymaninejad M, Negahdari BA. Stem cell, biomaterials and growth factors therapy for hepatocellular carcinoma[J].
Biomed Pharmacoth, 2017, 88(9): 1046-53.
|
| [5] |
Gong YL. Therapy response of Chinese herbal medicine in primary liver cancer[J].
J Clin Oncol, 2015, 33(3, S): 327-35.
|
| [6] |
Qian J, Xie H, Guo CX, et al. Sijunzi Decoction Demolition Parties Inhibit Proliferation and Iinduce Apoptosis Human Gastric Cancer Bgc823 Side Population[J].
African J Tradit Complement Alternat Med, 2015, 12(6): 77-89.
DOI: 10.4314/ajtcam.v12i6.8. |
| [7] |
Jie Y, He W, Yang X, et al. Kruppel-like factor 4 acts as a potential therapeutic target of Sijunzi decoction for treatment of colorectal cancer[J].
Cancer Gene Ther, 2017, 24(9): 361-6.
DOI: 10.1038/cgt.2017.25. |
| [8] |
施胜英, 林海桢, 周溦, 等. 加味四君子汤含药血清对肝癌Hep-G2细胞的影响[J].
中国实验方剂学杂志, 2016, 22(18): 88-93.
|
| [9] |
Liu XN, Zhu XX.Stellera chamaejasme L.extract induces apoptosis of human lung cancer cells via activation of the death receptor-dependent pathway[J].Exp Ther Med, 2012, 4(4): 605-10.
|
| [10] |
Gan D, Xu A, Du H, et al. Chinese classical formula sijunzi decoction and chronic atrophic gastritis:evidence for treatment approach[J].
Evidence-Based Complement Alternat Med, 2017, 92(9): 1022-34.
|
| [11] |
Jia J, Qin Y, Zhang L, et al. Sijunzi decoction-treated rat serum induces apoptosis of side population cells in gastric carcinoma[J].
Exp Ther Med, 2018, 15(2): 1718-27.
|
| [12] |
Qian J, Li J, Jia J, et al. Diffrent concentrations of sijunzi decoction inhibit proliferation and induce apoptosis of human gastric cancer SGC-7901 side population[J].
African J Tradit Complement Alternat Med, 2016, 13(4): 145-56.
DOI: 10.21010/ajtcam. |
| [13] |
Shim JH, Gim H, Lee S, et al. .Inductions of caspase-, MAPK-and ROS-dependent apoptosis and chemotherapeutic effects caused by an ethanol extract of scutellaria barbata D.don in human gastric adenocarcinom cells[J].
J Pharmacopunct, 2016, 19(2): 129-36.
DOI: 10.3831/KPI.2016.19.014. |
| [14] |
Wang TS, Chen LJ, Wang ZY, et al. Purified alkaloid extract of Scutellaria barbata inhibits proliferation of hepatoma HepG-2 cells by inducing apoptosis and cell cycle arrest at G (2)/M phase[J].
Afican J Pharm Pharmacol, 2011, 5(8): 1046-53.
|
| [15] |
Kan XE, Zhang WL, You RX, et al. Scutellaria barbata D, don extract inhibits the tumor growth through down-regulating of Treg cells and manipulating Th1/Th17 immune response in hepatoma H22-bearing mice[J].
BMC Complement Altern Med, 2017, 17(41): 1330-43.
|
| [16] |
Jiang QQ, Li QY, Chen HW, et al.Scutellaria barbata D.Don inhibits growth and induces apoptosis by suppressing IL-6-inducible STAT3 pathway activation in human colorectal cancer cells[J].Exp Ther Med, 2015, 10(4): 1602-8.
|
| [17] |
Zheng QP, Qiu DS, Liu XJ, et al. Antiproliferative effect of Dendrobium catenatum Lindley polypeptides against human liver, gastric and breast cancer cell lines[J].
Food Funct, 2015, 6(5): 1489-95.
DOI: 10.1039/C5FO00060B. |
| [18] |
Prasad R, Koch B. Antitumor activity of ethanolic extract of dendrobium formosum in T-Cell lymphoma:an in vitro and in vivo study[J].
Biomed Res Int, 2014, 7534(51): 6102-14.
|
| [19] |
Meier P, Finch A, Evan G. Apoptosis in development[J].
Nature, 2000, 407(6805): 796-801.
DOI: 10.1038/35037734. |
| [20] |
Oberst A, Bender C, Green DR. Living with death:the evolution of the mitochondrial pathway of apoptosis in animals[J].
Cell Death Differ, 2008, 15(7): 1139-46.
DOI: 10.1038/cdd.2008.65. |
| [21] |
Peng C, Rao W, Zhang L, et al. Mitofusin 2 ameliorates hypoxiainduced apoptosis via mitochondrial function and signaling pathways title of article (vol 69, pg 29, 2015)[J].
Intern J Biochem Cell Biol, 2016, 73(2): 137-48.
|
| [22] |
Andreu-Fernandez V, Sancho M, Genoves A, et al. Bax transmembrane domain interacts with prosurvival Bcl-2 proteins in biological membranes (vol 114, pg 310, 2016)[J].
Proc Natl Acad Sci USA, 2017, 114(8): E1574-85.
DOI: 10.1073/pnas.1701233114. |
| [23] |
Reyna DE, Gavathiotis E. Self-regulation of BAX-induced cell death[J].
Oncotarget, 2016, 7(41): 66326-7.
|
| [24] |
Zhao H, Yenari MA, Cheng D, et al. Bcl-2 overexpression protects against neuron loss within the ischemic margin following experimental stroke and inhibits cytochrome c translocation and caspase-3 activity[J].
J Neurochem, 2003, 85(4): 1026-36.
DOI: 10.1046/j.1471-4159.2003.01756.x. |
| [25] |
Haddadi R, Nayebi AM, Brooshghalan SE. Silymarin prevents apoptosis through inhibiting the Bax/caspase-3 expression and suppresses toll like receptor-4 pathway in the SNc of 6-OHDA intoxicated rats[J].
Biomed Pharmacoth, 2018, 104(2): 127-36.
|
| [26] |
Garg AD, More S, Rufo N, et al. Trial watch:Immunogenic cell death induction by anticancer chemotherapeutics[J].
Oncoimmunol, 2017, 6(12): 139-44.
|
| [27] |
Josephs SF, Ichim TE, Prince SM, et al. Unleashing endogenous TNF-alpha as a cancer immunotherapeutic[J].
J Transl Med, 2018, 16(242): 497-506.
|
| [28] |
Coffin CS, Fraser HF, Panaccione R, et al. Liver diseases associated with Anti-Tumor necrosis factor-alpha (TNF-alpha) use for inflammatory bowel disease[J].
Inflamm Bowel Dis, 2011, 17(1): 479-84.
DOI: 10.1002/ibd.21336. |
| [29] |
Zhang HR, Park Y, Wu JX, et al. Role of TNF-alpha in vascular dysfunction[J].
Clin Sci, 2009, 116(3/4): 219-30.
|
| [30] |
Ito S, Bollard CM, Carlsten MA, et al. Ultra-low dose interleukin-2 promotes immune-m (o) dulating function of regulatory T cells and natural killer cells in healthy volunteers[J].
Molecul Therapy, 2014, 22(7): 1388-95.
DOI: 10.1038/mt.2014.50. |
| [31] |
Sockolosky JT, Trotta E, Parisi G, et al. Selective targeting of engineered T cells using orthogonal IL-2 cytokine-receptor complexes[J].
Science, 2018, 359(6379): 1037-57.
DOI: 10.1126/science.aar3246. |
 2019, Vol. 39
2019, Vol. 39

