2. 西安新通药物研究有限公司,陕西 西安 710077
2. Xi'an Xintong Drug Research Co., Ltd. Xi'an 710077, China
产前应激(PS)是指母亲在怀孕期间受到内外界环境、社会以及心理因素等刺激时所表现出的全身非特异性的适应反应[1]。随着妇女社会地位的提高和社会角色的转变,妊娠期妇女作为一个特殊群体,越来越受到人们的重视。大量的流行病学调查资料和实验研究已经证实PS能够增加焦虑样和抑郁样行为发生的风险[2-4]。近年来,谷氨酸能系统作用的异常也得到大家的广泛关注,包括谷氨酸的代谢、释放以及其受体功能的异常,谷氨酸神经能系统被认为在抑郁病理过程中扮演重要角色。抑郁的发病机制不清,现有的治疗药物也存在缺陷。因此,抑郁的发病机制和药物治疗的研究,一直是本研究领域的热点和难点。
新进的很多研究表明精神相关疾病如抑郁症、孤独症等都可能与Wnt信号通路的异常有关[5-6]。成年哺乳动物海马干细胞能表达Wnt受体及Wnt通路中的信号元件[7],对神经发育起重要作用,能促进神经元的轴突导向,树突生长,突触的形成和脑的发育[8-9]。海马结构修饰与母亲应激和情绪障碍有关[10-11],抑郁症海马功能的损伤包括海马体积的减小,抑制成年海马的神经形成,三突触回路棘突触的损失,抗抑郁药的治疗可以改善这些结构的损伤[12]。海马神经元的损伤是抑郁症的重要病理环节,抗抑郁药可能主要通过促进神经细胞的增殖、促进轴突生长发挥作用,即:抑郁状态有可能与神经细胞过少、神经轴突减少有关。另一方面,研究显示作为细胞增殖主要信号通路之一的WNT信号通路,与神经系统的发育有密切的关系。慢性应激可以导致抑郁症动物模型大脑海马区的神经细胞凋亡率上升,神经细胞数目显著减少[13]。因此,我们推测PS对子代焦虑、抑郁行为的影响与海马组织Wnt信号通路功能紊乱可能有关,尤其是Gsk-3β/β-catenin信号分子功能的改变。GSK-3β是一种多功能丝氨酸/苏氨酸激酶,参与调节Wnt/β-catenin、胰岛素/IGF1等多条细胞内信号通路,进而调控基因转录和细胞凋亡等[14-15]。而β-catenin是经典Wnt通路中非常重要的因子,将核外信号传递到核内,β-catenin的表达直接影响着Wnt信号通路的生物学效应,可见Wnt信号通路参与了抑郁症的发病。因此,我们假设:产前应激影响了Wnt/β-catenin信号通路,进一步影响神经系统的活性,使子代大鼠海马区的神经功能发生改变,导致子代大鼠产生抑郁和焦虑样行为。
1 材料和方法 1.1 实验动物与材料体质量为240~260 g的健康Sprague-Dawley(SD)雌性大鼠12只(西安交通大学医学院动物中心)。透明塑料圆柱形装置;Wnt1抗体、β-catenin抗体、Gsk-3β抗体(CST);β-actin抗体(先锋)。
1.2 实验动物分组及模型建立雌雄大鼠按3:1合笼,次日清晨用光学显微镜进行阴道涂片检查,精子阳性被认定为妊娠第0天。将孕鼠随机分为对照组及产前应激组,每组6只,参照Lemaire等的应激方法,产前应激组大鼠于妊娠晚期14~20 d给予产前慢性束缚应激,对照组不进行任何干预。应激时将大鼠置于一直径约为6 cm,长度可调,两端有通气孔的透明塑料圆柱形装置内,3次/d,45 min/次,为防止大鼠出现应激模式习惯化,每天随机给予束缚应激,应激时间间隔不少于2 h。随机从每窝中选取雌、雄子鼠各1~2只于实验,30 d进行行为学实验。实验期间自由饮水、饮食,室温22 ℃。
1.3 实验方法 1.3.1 旷场实验(OFT)[16]将大鼠放入规格为150 cm× 150 cm×49.5 cm的旷场箱中,底部和四壁均被涂成黑色,底部用白色线条分为25个(5×5)均等的方格,旷场箱的中央9个(3×3)方格被认定为中央格。实验开始时将大鼠放在旷场箱的最中间的方格中,让大鼠在旷场箱中自由活动,并用摄像机记录5 min内大鼠在旷场箱中的活动情况,计算大鼠的活动距离、穿越中央格的次数(至少有3只爪子进入中央区域)、在中央格停留时间、理毛次数及直立次数。实验完成后,用5%乙醇祛除气味后继续测试下一只老鼠,避免对下个旷场实验的大鼠造成影响。
1.3.2 强迫游泳(FST)[17]强迫游泳实验最早是在1977年Porsolt使用的一种测量动物抑郁状态的模型。强迫游泳装置是一圆柱形塑料桶,直径为20 cm,高度为50 cm。桶中水深40 cm左右,以保证大鼠在水中无法触及桶底而强迫挣扎游泳,水温保持在24 ℃左右。每只大鼠强迫游泳6 min,并用摄像机记录大鼠在水中的挣扎时间。
1.3.3 取材行为学实验完成后,用20%乌拉坦(1~ 2 mL/100 g)腹腔麻醉,迅速断头取脑,在冰上快速分离双侧海马和前额叶皮层,保存于-80 ℃冰箱。所有金属器械均需高温高压灭菌。
1.3.4 蛋白样品的制备称取约50 mg的组织置于研磨筛网中(冰上),加入1000 µL的RIPA裂解液(使用前加入蛋白酶抑制剂PMSF,使PMSF最终浓度为1 mmol)充分研磨组织约3~5 min,将组织充分裂解,14 000 r/min,4 ℃离心30 min。取上清液,即提取好的蛋白样品。通过核酸定量仪对提取蛋白的浓度及A280/A260值进行测定。根据提取的蛋白量,加入5×loading buffer,于沸水中变性3~5 min,-20 ℃保存。
1.3.5 Western blot根据SDS-PAGE制胶试剂盒配置凝胶,每孔加入等量的总蛋白。电泳结束后,根据maker指示裁剪出目的蛋白和内参β-actin所在区域的凝胶,将裁剪好的蛋白转到预先标记好的PVDF膜上,用脱脂奶粉封闭2 h,4 ℃过夜孵育一抗Wnt1,Gsk-3β,β-catenin。次日,孵育辣根过氧化物酶标记的二抗。用ECL发光液显色,自动曝光,凝胶成像系统拍照,使用Quantity One扫描目的蛋白条带灰度值,并以各条带与内参β-actin灰度值的比值为相对定量分析的基础。
1.4 统计方法本实验的数据用Mean±SD表示。所有数据进行独立样本t检验分析,以P<0.05表示差异有统计学意义。所用的统计学分析软件为SPSS18.0。
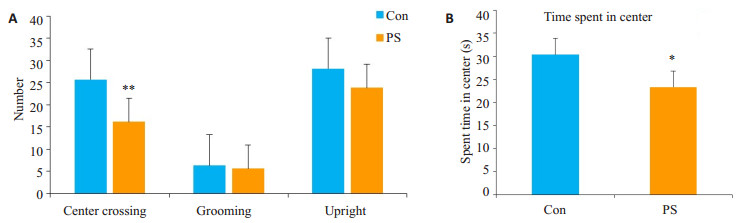
2 结果 2.1 旷场实验与对照组相比,产前应激组子代大鼠穿越中央格次数显著减少(P< 0.01),中央格停留时间明显减少(P< 0.05);产前应激也能使子代大鼠直立次数和理毛次数减少,但各组之间没有统计学差异(P>0.05,图 1)。
|
图 1 产前应激对子代大鼠在旷场实验中焦虑样行为的影响 Fig.1 Effect of prenatal stress (PS) on anxiety-like behavior of the offspring rats in open field test (Mean±SD, n=8). A: Numbers of center crossings, upright and grooming in the 2 groups. B: Time spent in the center in the 2 groups. CON: Control group. *P < 0.05, **P < 0.01 vs control group. |
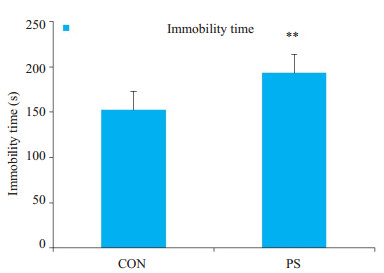
与对照组(不动时间:152.5±7.04 s)相比,产前应激组(不动时间:193.3±8.82 s)子代大鼠在强迫游泳中不动时间显著延长(P< 0.01,图 2)。
|
图 2 产前应激对子代大鼠在强迫游泳中不动时间的影响 Fig.2 Forced swimming test for assessing depression-like behaviors in the offspring rats with PS (Mean±SD, n=8). **P < 0.01 vs control group. |
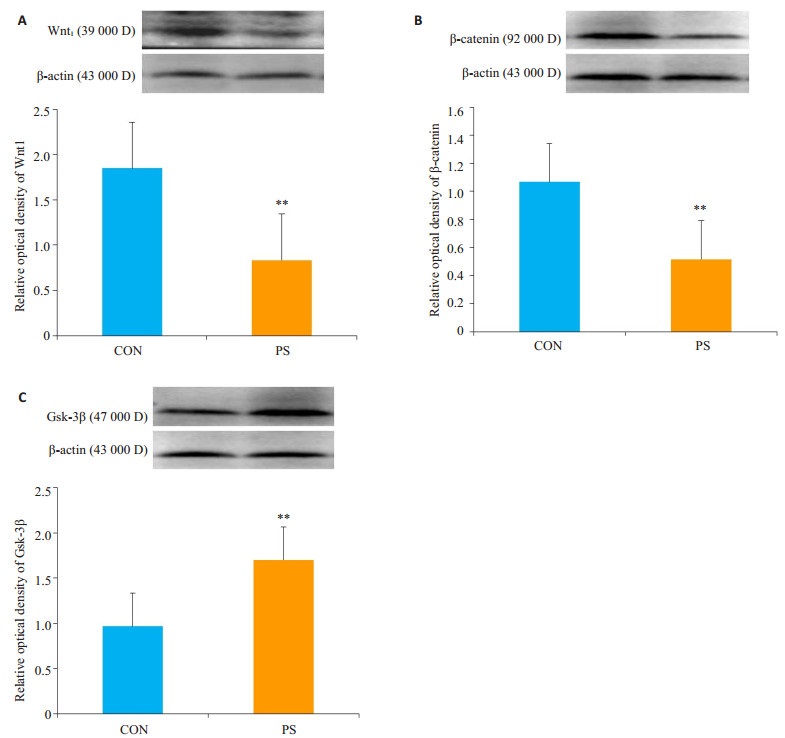
与对照组相比,产前应激可使大鼠子代海马Wnt1蛋白、β-catenin蛋白表达显著降低(P<0.01),Gsk-3β蛋白表达显著升高(P<0.01,图 3)。
|
图 3 子代大鼠海马相关1蛋白的表达 Fig.3 Protein expressions of Wnt1 (A), β-catenin (B) and Gsk-3β (C) in the hippocampus of the offspring rats in control and PS groups (Mean±SD, n=8). **P < 0.01 vs control group. |
本研究采用旷场实验用于啮齿类动物自发性运动水平及自发性焦虑水平的测量,在中央格停留的时间越短,穿越中央格次数与大鼠的焦虑行为为负相关关系,在中央格停留时间越短,穿越中央格次数越少,说明焦虑行为愈明显。结果显示,与对照组相比,产前应激组子代大鼠在旷场实验中的穿越中央格次数明显减少,中央格停留时间显著减少;强迫游泳实验是目前应用较广泛的一种检测抑郁样行为的动物模型,用于抗抑郁活性药物的筛选,是对动物行为绝望状态的一种分析和研究,其基本原理是当把大鼠或小鼠放进有限的一个空间游泳,刚开始努力游泳试图逃脱,但是迅速便变成不动状态漂浮着,只是露出鼻孔呼吸畅通,偶尔划动四肢可以保持身体不沉下去,即表现为“不动状态”,实际上是动物放弃希望逃脱,属于“行为绝望状态”,以不动时间作为表示,实验结果显示,产前应激组子代大鼠不动时间显著延长;行为学实验表明产前应激子代大鼠生活追求淡漠、悲观失望、探究能力减弱,这与抑郁症患者行为迟缓、情绪淡漠等症状较为类似。
抑郁的发生是一个十分复杂的过程,有很多假说,比如经典的5-羟色胺(5-HT)、去加肾上腺素(NE)、多巴胺(DA)等假说外,近年来,研究发现神经元信号传导通路的变化也被认为与抑郁症的发生密切相关。抑郁症发生的有关Wnt/β-catenin信号通路的机制尚不明确,但是有研究表明Wnt/β-catenin信号通路参与许多细胞复杂的生化反应,进而调节中枢神经系统,与情绪相关的精神疾病的发生有着密切关联[18-19]。有动物实验表明,心境稳定剂和抗抑郁药通过作用于Wnt信号通路提高神经元可塑性;抑郁症自杀患者的尸检结果显示,脑前额皮质β-catenin蛋白表达下降,Gsk-3β表达升高,两者呈负相关[20-21]。Gsk-3β在脑组织尤其是海马呈高表达,参与神经发生、突触可塑性及稳态的调控等过程。对抑郁症患者进行研究发现Gsk-3β介导的Wnt/β-catenin表达异常[22],体外研究还发现Gsk-3β/β-catenin信号通路激活可促进胚胎前体神经细胞增殖[23]。另外有体外实验发现,随着神经细胞分化的进行,β-catenin的表达量逐渐减少,而Gsk-3β的表达逐渐增加,显示Wnt信号通路由活化状态逐步走向抑制过程[24]。研究发现Gsk-3β与神经元可塑性密切相关,其活性增强可导致抑郁或抑郁相关行为[25],有抑郁样行为的大鼠Gsk-3β表达升高,表明Gsk-3β可能参与了抑郁的病理过程。Gsk-3抑制剂可明显改善抑郁症大鼠和小鼠的抑郁行为[26-27]。在强迫游泳模型中使用Gsk-3β抑制剂,可以迅速产生抗抑郁的作用,明显缩短不动时间[24]。上述研究表明Gsk-3β在抑郁的病理机制中起着至关重要的作用,可能是通过Gsk-3β磷酸化调节细胞内诸多蛋白和转录因子,包括β-catenin,进而影响神经元的存活及可塑性或导致其凋亡,导致抑郁的发生[25]。
本研究发现产前束缚应激诱导子代产生抑郁样和焦虑样行为后,子代大鼠海马Gsk-3β表达显著升高,使β-catenin和Wnt1表达明显降低,我们推测Gsk-3β的高活化表达,抑制β-catenin的表达水平,导致表明PS组子代大鼠海马组织Wnt/β-catenin信号通路被抑制,影响海马神经元的调控,而海马神经元的损伤是抑郁发病的重要原因。
生活压力、社会压力的不断增大,抑郁症的发病率逐年上升,世界卫生组织(WHO)估计到2030年抑郁症将成为主要的疾病负担[26]。随着妇女社会地位的提高和社会角色的转变,妊娠期妇女作为一个特殊群体,越来越受到人们的重视。妊娠期是对于外部刺激非常敏感的时期,当母亲接受如地震、洪水、战争等自然灾害或者来自家庭和社会的慢性长期的不利因素时,容易诱发对子代的发育、智力水平和语言功能产生深远的作用。因此,随着广大人民对健康水平要求的提升,改善抑郁症的治疗现状已成为了临床亟待解决的问题。
| [1] |
Walker SP, Wachs TD, Grantham-Mcgregor SA, et al. Child development 1 inequality in early childhood:risk and protective factors for early child development[J].
Lancet, 2011, 378(9799): 1325-38.
DOI: 10.1016/S0140-6736(11)60555-2. |
| [2] |
Adrover E, Eugenia Pallares M, Javier Baier C, et al. Glutamate neurotransmission is affected in prenatally stressed offspring[J].
Neurochem Int, 2015, 88: 73-87.
DOI: 10.1016/j.neuint.2015.05.005. |
| [3] |
Sun HL, Jia N, Guan LX, et al. Involvement of NR1, NR2A different expression in brain regions in anxiety-like behavior of prenatally stressed offspring[J].
Behav Brain Res, 2013, 257: 1-7.
DOI: 10.1016/j.bbr.2013.08.044. |
| [4] |
Sutherland S, Brunwasser SM. Sex differences in vulnerability to prenatal stress:a review of the recent literature[J].
Curr Psychiatry Rep, 2018, 20(11): 102.
DOI: 10.1007/s11920-018-0961-4. |
| [5] |
Chen MJ, Yu JF, Chai JX, et al. Changes of the expression of β-Catenin and Gsk-3β in prefrontal cortex, hippocampus and cerebellum in an autism model[J].
Chin J Neuroanat, 2009, 25: 361-8.
|
| [6] |
封文佳, 万娟, 王珊, 等. Wnt信号通路与精神疾病的研究进展[J].
生命的化学, 2016, 36(6): 891-6.
|
| [7] |
Lie DC, Colamarino SA, Song HJ, et al. Wnt signalling regulates adult hippocampal neurogenesis[J].
Nature, 2005, 437(763): 1370-5.
|
| [8] |
Davis EK, Zou Y, Ghosh A. Wnts acting through canonical and noncanonical signaling pathways exert opposite effects on hippocampus synapse formation[J].
Neural Dev, 2008, 3: 32.
DOI: 10.1186/1749-8104-3-32. |
| [9] |
Ciani L, Salinas PC. WNTs in the vertebrate nervous system:Form patterning to neuronal connectivity[J].
Nat Rev Neurosci, 2005, 6(5): 351-62.
|
| [10] |
Pawluski JL, Lambert KG, Kinsley CH. Neuroplasticity in the maternal hippocampus:Relation to cognition and effects of repeated stress[J].
Horm Behav, 2016, 77: 86-97.
DOI: 10.1016/j.yhbeh.2015.06.004. |
| [11] |
Green AD, Galea LA. Adult hippocampal cell proliferation is suppressed with estrogen withdrawal after a hormone-simulated pregnancy[J].
Horm Behav, 2008, 54(1): 203-11.
DOI: 10.1016/j.yhbeh.2008.02.023. |
| [12] |
Hajszan T, Dow A, Warner-Schmidt JL, et al. Remodeling of hippocampal spine synapses in the rat learned helplessness model of depression[J].
Biol Psychiatry, 2009, 65(5): 392-400.
DOI: 10.1016/j.biopsych.2008.09.031. |
| [13] |
常庚, 许晶, 张文娣, 等. 慢性应激对大鼠海马神经细胞氧化损伤及Gli1蛋白表达的影响[J].
中国老年学杂志, 2015, 19(19): 5403-4.
DOI: 10.3969/j.issn.1005-9202.2015.19.015. |
| [14] |
Oh DH, Park YC, Kim SH. Increased alycogen synthase kinase-3β mRNA level in the hippocampus of patients with major depression:a study using the Stanley neuropathology consortium integrative database[J].
Psychiatry Investig, 2010, 7(3): 202-7.
DOI: 10.4306/pi.2010.7.3.202. |
| [15] |
王明真.丽扎·满苏尔, 库木斯·巴雅合买提. 糖原合成激酶-3(GSK-3β)与抑郁症的研究进展[J].
临床精神医学杂志, 2015, 25(2): 127-8.
|
| [16] |
Rees SL, Steiner M, Fleming AS. Early deprivation, but not maternal separation, attenuates rise in corticosterone levels after exposure to a novel environment in both juvenile and adult female rats[J].
Behav Brain Res, 2006, 175(2): 383-91.
DOI: 10.1016/j.bbr.2006.09.013. |
| [17] |
Nylander I, Roman E. Is the rodent maternal separation model a valid and effective model for studies on the early-life impact on ethanol consumption?[J].
Psychopharmacology (Berl), 2013, 229(4): 555-69.
|
| [18] |
Mishra A, Singh S, Tiwari V, et al. Dopamine D1 receptor activation improves adult hippocampal neurogenesis and exerts anxiolytic and antidepressant-like effect via activation of Wnt/β-catenin pathways in rat model of Parkinson's disease[J].
Neurochem Int, 2019, 122: 170-86.
DOI: 10.1016/j.neuint.2018.11.020. |
| [19] |
Vidal R, Garro-Martínez E, Díaz Á, et al.Targeting β-Catenin in GLAST-Expressing cells: impact on anxiety and depression-related behavior and hippocampal proliferation[J].Mol Neruobiol, 2018, [Epub ahead of print].
|
| [20] |
Muzio L, Brambilla V, Calcaterra LA, et al. Increased neuroplasticity and hippocampal microglia activation in a mice model of rapid antidepressant treatment[J].
Behav Brain Res, 2016, 311: 392-402.
DOI: 10.1016/j.bbr.2016.05.063. |
| [21] |
Nishiya N. Screening for chemical supressors of the Wnt/β-Catenin signaling pathway[J].
Yakugaku Zasshi, 2017, 137: 133-6.
DOI: 10.1248/yakushi.16-00229-2. |
| [22] |
Inkster B, Nichols TE, Saemann PG, et al. Pathway-based approaches to imaging genetics association studies:Wnt signaling, GSK3beta substrates and major depression[J].
Neuroimage, 2010, 53(3): 908-17.
DOI: 10.1016/j.neuroimage.2010.02.065. |
| [23] |
Hui J, Zhang J, Kim H, et al. Fluoxetine regulates neurogenesis in vitro through modulation of GSK-3 beta/beta-Catenin signaling[J].
Int J Neuropsychopharmacol, 2015, 18(5): 1-125.
|
| [24] |
张建, 顾茵, 罗学胜, 等. Wnt信号通路分子在大鼠神经干细胞分化过程中的表达[J].
中华老年多器官疾病杂志, 2013, 12(12): 932-6.
|
| [25] |
Sachs BD, Rodriguiz RM, Siesser WB, et al. The effects of brain serotonin deficiency on behavioural disinhibition and anxiety-like behaviour following mild early Life stress[J].
Int J Neuropsychopharmacol, 2013, 16(9): 2081-94.
DOI: 10.1017/S1461145713000321. |
| [26] |
Kaidanovich-Beilin O, Milman A, Weizman A, et al. Rapid antidepressive-like activity of specific glycogen synthase kinase-3 inhibitor and its effect on beta-catenin in mouse hippocampus[J].
Biol Psychiatry, 2004, 55(8): 781-4.
DOI: 10.1016/j.biopsych.2004.01.008. |
| [27] |
Gould TD, Einat H, Bhat R, et al. AR-A014418, a selective GSK-3 inhibitor, produces antidepressant-like effects in the forced swim test[J].
Int J Neuropsychopharmacol, 2004, 7(4): 387-90.
DOI: 10.1017/S1461145704004535. |
| [28] |
宋宁, 王阳, 金魁和, 等. 慢性应激抑郁模型大鼠海马GSK-3β的表达[J].
中国神经精神疾病杂志, 2008, 2008(6): 363-5.
DOI: 10.3969/j.issn.1002-0152.2008.06.011. |
| [29] |
Bui L, Wei D, Miao JT, et al. Citalopram alleviates chronic stress induced depression-like behavior in rats by activating Gsk3β signaling in dorsal hippocampus[J].
Brain Res, 2012, 1467(27): 10-7.
|
| [30] |
Heo M, Murphy CF, Fontaine KR, et al. Population projection of US adults with lifetime experience of depressive disorder by age and sex from year 2005 to 2050[J].
Int J Geriatr Psychiatry, 2008, 23(12): 1266-70.
DOI: 10.1002/gps.v23:12. |
 2019, Vol. 39
2019, Vol. 39

