2. 南方医科大学南方医院 肿瘤科, 广东 广州 510515
2. Department of Oncology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
在全球范围内, 肺癌是发病率和死亡率最高的恶性肿瘤之一, 严重威胁着人类的健康和生存[1]。在很大程度上, 这是由于对肺癌患者的临床确诊时间延迟而导致患者失去了最佳的治疗时机所致。归根到底, 肺癌的复发率高和总体预后差与其缺少有效的早期诊断和筛查方式以及非特异性体征有关[2]。肺癌的发生发展是一个多阶段多因素参与的过程, 众多的细胞因子及信号通路在其中扮演重要角色, 因此, 寻找与肺癌早期诊断、治疗和预后密切相关的新靶点一直是近年来研究的热点。既往研究发现, 肿瘤组织中的细胞在细胞表型和生物学特性等诸多方面与干细胞有着相似之处, 他们都具有自我更新和无限增殖分化的能力, 因此, 有研究提出了肿瘤干细胞的理论[3]。在有关研究中发现肿瘤干细胞对肿瘤的存活、增殖、侵袭转移、术后复发、肿瘤耐药等方面起着重要的作用, 肿瘤干细胞可以长时间处于休眠状态并具有多种耐药分子而对传统的肿瘤治疗方法不敏感, 导致了肿瘤的易复发和转移[4-5]。
SOX(SRY box-containing)基因家族是一类与哺乳动物性别决定基因(SRY)相关的具有特征性HMG (high mobility group) DNA结合基序的转录因子, 它们已被发现在体内广泛分布, 同时在性别决定、早期胚胎发育、神经发育、血细胞的生成、晶状体的发育、骨组织的形成和多种肿瘤的发生发展等多种重要环节中起到关键作用[6-7]。SOX基因家族成员之一的SOX12已被发现表达于中枢神经系统和多种组织中, 且与多种细胞的增殖和分化成熟有着密切的关系[8], 而无限制的自我更新和增殖及多向分化潜能是肿瘤干细胞的主要特性, 提示转录因子SOX12可能参与肿瘤的发生发展。虽然有研究发现SOX12的表达与肺癌细胞的增殖和迁移相关[9], 但SOX12对肺腺癌病人的生存和预后是否有关却未被证实。本研究检测了肺腺癌组织中SOX12的表达情况, 并分析了其基因表达水平对肺腺癌患者生存和预后的影响。
1 资料和方法 1.1 分析SOX12在数据库中的表达水平为了确定SOX12基因在肺腺癌中的作用, 我们通过在大型数据库癌症基因组图谱(TCGA)和基因表达合集(GEO)中下载并分析SOX12基因的表达水平是否与肺腺癌有关。本研究中, 我们下载了TCGA(Lung adenocarcinoma)和GEO(GSE40419)样本集中的SOX12的表达水平, 并进行了差异分析。
1.2 纳入标准及排除标准纳入标准:年龄18~80岁; 病理确诊为原发性肺腺癌; 根据分期标准为Ⅰ~Ⅲ期; 首次治疗方案以手术治疗为主, 主要手术方式为肺叶切除术。排除标准:临床资料不完整的患者; 正在接受其他肿瘤治疗的患者; 孕妇或哺乳期患者。
1.3 标本收集收集本院2015年1月~2018年1月病理确诊的肺腺癌患者组织36例(肺癌组), 所有患者均为初次诊断, 手术前未行化疗、放疗及其他特殊治疗, 其中男性20例、女性16例, 年龄36~81岁(59.17±10.34岁)。另外, 还收集了15例距肿瘤边缘5 cm以上的癌旁正常组织和21例正常肺组织(正常对照组), 其中男性19例、女性17例, 年龄29~73岁(49.53±10.64岁)。两组患者均经过HE染色及光镜检查等病理检查核实, 且年龄、性别等一般资料差异无统计学意义(P > 0.05), 具有可比性。
1.4 主要试剂兔抗人SOX12多克隆抗体(Sigma), 二抗试剂盒与DAB显色试剂盒(中杉金桥), 总RNA提取试剂盒、逆转录试剂盒、PrimeSTAR MAX Premix试剂盒(Takara), GAPDH引物(F 5'-CCTGCACCACCAACTGCTTA-3'和R 5'-GGCCATCCACAGTCTTCTGAG-3) '和SOX12引物(F 5'-ACATCAAGAGGCCGATGAAC-3'和R 5'- GAACGGGATCTTCTCCGAGT-3)由苏州泓迅生物科技股份有限公司合成。
1.5 半定量PCR检测SOX12的mRNA水平使用总RNA提取试剂盒, 按照试剂盒说明书提取部分组织总RNA, 再使用逆转录试剂盒逆转录成cDNA模板, 使用PrimeSTAR MAX Premix试剂盒扩增SOX12和内参基因GAPDH。打开扩增仪, 按以下条件进行扩增:95℃ 10 min预变性, 95℃ 15 s变性, 60℃ 1 min退火/延伸(35×cycles), 随后通过琼脂糖凝胶电泳将PCR产物分离。最后, 使用凝胶成像系统Bio-Rad GelDoc XR获取条带图像, 并使用Image J软件分析条带灰度值。
1.6 免疫组织化学(IHC)检测SOX12的蛋白水平将组织切片进行常规二甲苯脱蜡, 梯度酒精脱水, 然后使用柠檬酸钠/柠檬酸二钠抗原修复液煮沸煮沸修复抗原20 min, 自然冷却, 后使用3%的过氧化氢灭活内源性的过氧化物酶, 滴加按照说明书比例配制SOX12的一抗在组织上, 放入4℃冰箱中过夜孵育, 后将IHC专用二抗加入在组织上, 孵育30 min, 按照说明书配制DAB显色液, 将DAB显色液滴加于切片上, 显微镜下控制组织中棕色染色程度, 清水终止显色, 苏木素染核, 染色成功后脱水透明, 中性树胶封片, 使用光学显微镜阅片并采集图像信息。
1.7 IHC结果判定IHC快速评分(Q)的方法:SOX12阳性反应是细胞中发现有黄色或褐色颗粒, 每例切片至少评价5个高倍镜视野, 根据以往报道[10-11], 分别评估出切片中的阳性细胞评分(P)和染色强度评分(I), P:按阳性细胞数占同类细胞数的百分比评估:0分, 阳性细胞 < 10%; 1分, 阳性细胞10%~25%; 2分, 阳性细胞25%~50%; 3分, 阳性细胞50%~75%; 4分, 阳性细胞>75%。(I按切片中细胞着色深浅评分):0分, 细胞不着色; 1分, 浅黄色; 2分, 棕黄色; 3分, 棕褐色。根据Q=P褐色计算IHC快速评分。
1.8 肺腺癌组织SOX12基因表达水平与肺腺癌预后关系的大数据分析方法利用Kaplan-Meier Plotter数据库(方法参考文献[12]), 对866例肺腺癌患者和675例肺鳞癌患者进行生存和预后分析。组织学分类为肺腺癌或肺鳞癌, 其余设置均为默认参数。
1.9 统计学分析应用SPSS 19.0统计学软件, 实验数据用均数±标准差表示, 两组间比较采用t检验, Kaplan-Meier法做生存分析, 以P < 0.05为差异有统计学意义。
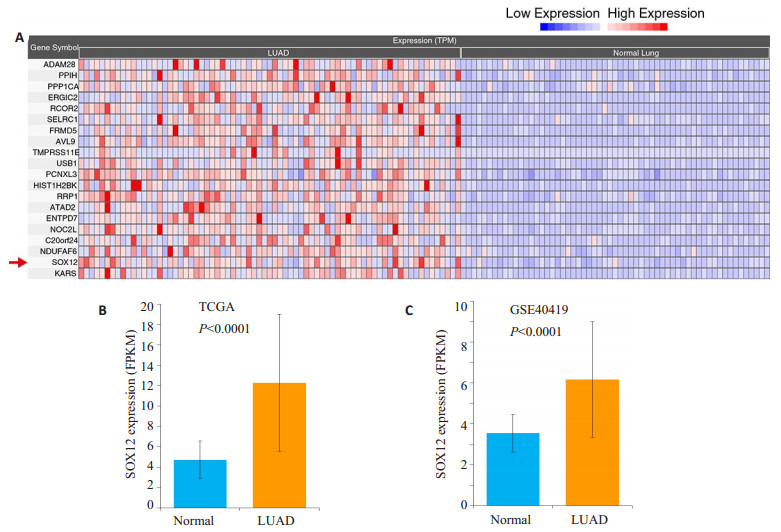
2 结果 2.1 SOX12基因在肺腺癌组织中明显高于癌旁正常组织通过分析TCGA数据库中肺腺癌组织和癌旁组织中SOX12的表达水平, 我们发现, SOX12高表达的样本中, 主要归集在肺腺癌(LUAD)组, 相反, 癌旁组中SOX12明显呈低表达水平(图 1A)。为了进一步确证这一结果, 我们将以上两组数据进行了差异分析, 发现SOX12的表达水平在肺腺癌组中明显高于癌旁组(图 1B), 差异具有统计学意义(P < 0.001)。另外, 我们还通过分析GSE40419数据集发现SOX12的表达水平在肺腺癌组中显著高于癌旁组(图 1B), 差异具有统计学意义(P < 0.001)。
|
图 1 通过TCGA和GEO数据库分析SOX12在肺腺癌组织中的表达 Fig.1 Analysis of TCGA and GEO databases for expression of SOX12 in lung adenocarcinoma. A:SOX12 expression in human lung adenocarcinoma expression profile generated from TCGA database; B:Statistical results of SOX12 expression in TCGA database; C:Statistical results of SOX12 expression level in GEO database. P values were calculated versus normal group. |
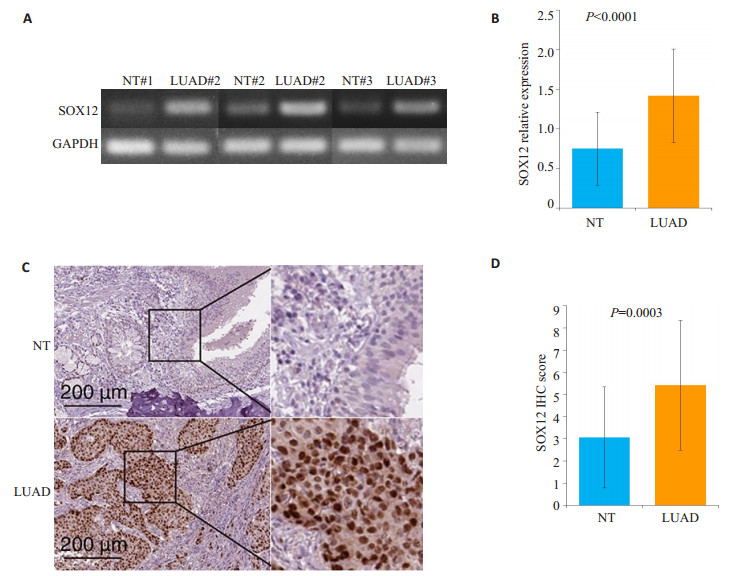
以GAPDH为内参, 半定量PCR结果显示SOX12基因在肺腺癌组织中的表达较癌旁正常组织和正常组织高(图 2A、B), 差异具有统计学意义(P < 0.001)。而IHC结果显示SOX12蛋白在癌旁正常组织和正常组织中无表达或微弱表达, 而在肺腺癌组织中SOX12蛋白阳性染色主要定位于细胞核, 阳性产物呈棕黄色颗粒(图 2C); 根据IHC快速评分, 结果显示在肺腺癌组织中IHC快速评分较癌旁正常组织和正常组织明显升高, 差异具有统计学意义(P < 0.001, 图 2D)。半定量PCR结果和IHC结果一致地证实了SOX12在肺腺癌组织中具有较高的表达水平。
|
图 2 半定量PCR和IHC检测SOX12在肺腺癌患者肺组织中的表达 Fig.2 Expression of SOX12 in lung tissues of patients with lung adenocarcinoma detected by semi-quantitative PCR and immunohistochemistry. A:Semi-quantitative PCR; B:Statistical analysis of the gray values of the bands by semi-quantitative PCR; C:Results of immunohistochemical staining (scale bar=200 µm); D:Statistical results of immunohistochemistry score. P values were calculated versus NT group. |
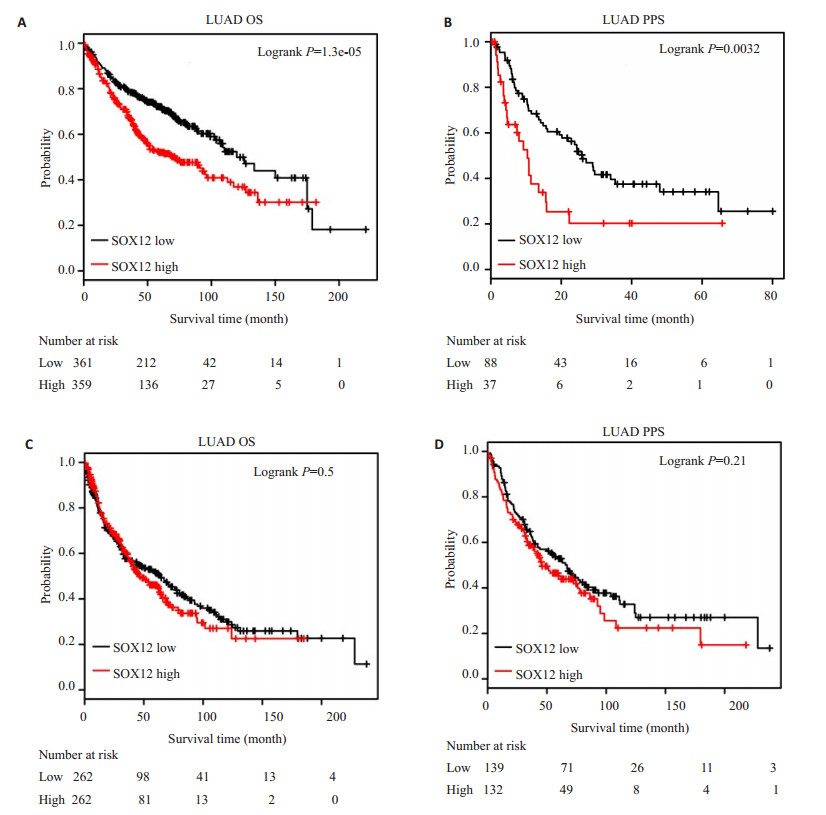
本研究通过Kaplan-Meier Plotter数据库获取了866例肺腺癌患者和675例肺鳞癌患者的生存数据, 以分析SOX12基因表达水平对生存和预后的影响。我们通过Kaplan-Meier Plotter分析, 发现SOX12基因表达水平高的肺腺癌患者较SOX12基因表达水平低的患者总生存率(OS)和后进展生存期(PPS)短, 差异具有统计学意义(P < 0.05, 图 3A、B); 然而, SOX12基因的表达水平对肺鳞癌患者的OS和PPS无明显影响(图 3C、D)。
|
图 3 通过Kaplan-Meier Plotter数据库分析SOX12的表达与肺腺癌和肺鳞癌患者预后的关系 Fig.3 Analysis of Kaplan-meier Plotter database for the relationship between SOX12 expression level and prognosis of patients with lung adenocarcinoma and lung squamous cell carcinoma. A:OS of patients with lung adenocarcinoma; B:PPS of patients with lung adenocarcinoma; C:OS of patients with lung squamous cell carcinoma; D:PPS of patients with lung squamous cell carcinoma. P values were calculated versus low SOX12 group. |
肺癌是对人群健康和生命造成威胁的最常见的恶性肿瘤之一, 而肺腺癌是肺癌的常见类型, 其患病率在肺癌中大约占40%, 并呈逐年升高的趋势[13]。肺腺癌发病隐匿, 早期缺乏特征性的临床表现, 不易察觉, 容易造成漏诊, 且临床进展迅速, 侵袭性强, 转移较快, 复发率高, 大多数患者往往在明确诊断时已为中晚期或远处转移, 而全身化疗对肺腺癌治疗效果差[14-15]。因此, 寻找与肺腺癌早期诊断、临床治疗密切相关的新的肿瘤靶点一直是大家的研究热点。在我们的研究中, 我们选取了本院病理确诊为原发性肺腺癌的36例肿瘤组织标本进行探究, 标本中可见腺腔结构、乳头状或小管样结构, 细胞较大, 核较大, 核浆比例较高, 胞浆内可见空泡。
转录因子SOX基因家族是一类新发现的编码转录因子的超基因家族, 主要特征是其产物具有一个HMGbox保守基序, 可以与DNA序列特异性结合, 调控其他基因的表达, 在动物的发育过程和细胞特征维持中发挥着重要的作用[16-17]。而近期的研究也表明SOX基因家族成员可能在细胞增殖甚至癌性转变和恶性肿瘤的分期转变过程中起着重要的作用, 而SOX基因的突变、缺失或过表达与多种恶性肿瘤的形成和发展密切相关[18-19]。Philippe等[5]首次在胚胎、胎儿和成人的多种器官和组织中发现了SOX12 mRNA的存在, 同时认为它在细胞的增殖和分化成熟过程中扮演重要角色, 是许多器官形成的标志。研究显示, SOX12与结肠癌、肝细胞癌、乳腺癌、肾癌、卵巢癌以及胰腺癌的发生发展有关系[20-23], 另外, SOX12也被报道参与肺癌细胞的增殖和迁移[9], 但SOX12对肺腺癌病人的生存和预后是否有关却未被证实。
本研究中, 我们在大型癌症基因组数据库TCGA和GEO中分析并发现了SOX12在肺腺癌组织中高表达, 这提示SOX12很大可能是肺腺癌的癌基因。接着, 我们采用半定量PCR检测了肺腺癌患者和正常患者肺组织中SOX12基因的表达, 发现肺腺癌患者肺组织中SOX12 mRNA表达水平明显高于癌旁正常组织和正常组织; 此外, IHC得到的结果也与半定量PCR相一致, 结果示肺腺癌患者肺组织中SOX12蛋白的表达水平也明显高于对照组, 因此, 我们的实验结果说明转录因子SOX12在肺腺癌患者肺组织中高表达, 在肺腺癌的发生发展过程中可能扮演着重要的角色, 提示SOX12可能是一个潜在的肺腺癌诊断生物学标志物。
Kaplan-Meier Plotter数据库包含了54675个基因的10461个癌症样本的生存数据, 其中包括2437个肺癌样本, 可以进行肺腺癌有关基因的临床预后相关数据的分析[24]。我们通过Kaplan-Meier Plotter数据库进行生存曲线分析结果显示肺腺癌组织SOX12基因高表达患者OS和PPS较低表达患者短, 提示SOX12基因高表达肺腺癌患者预后不良。有趣的是, SOX12基因的表达水平对肺鳞癌患者的OS和PPS没有明显的影响, 这提示SOX12不适合当作肺鳞癌患者的生存和预后指标。另外, 若能通过动物实验和细胞学实验加以佐证, 将更确切地发现SOX12基因在肺腺癌中的促癌以及判定生存和预后中的作用。
综上所述, SOX12可能作为潜在的诊断肺腺癌和预测其预后的肿瘤标记物, 其表达水平与肺腺癌的发生发展、侵袭与转移相关, 这为肺腺癌的早期诊断和治疗方案效果的评估提供了一个新的靶点。
| [1] |
Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics[J].
Adv Exp Med Biol, 2016, 893: 1-19.
DOI: 10.1007/978-3-319-24223-1. |
| [2] |
Liu TC, Jin X, Wang Y, et al. Role of epidermal growth factor receptor in lung cancer and targeted therapies[J].
Am J Cancer Res, 2017, 7(2): 187-202.
|
| [3] |
Singh A, Settleman JE. Cancer stem cells and drug resistance:an emerging axis of evil in the war on cancer[J].
Oncogene, 2010, 29(34): 4741-51.
DOI: 10.1038/onc.2010.215. |
| [4] |
解智慧, 何炜, 王峰, 等. 干细胞转录调控因子SOX2在食管鳞癌中的表达及其与临床预后的关系[J].
西安交通大学学报:医学版, 2013, 34(3): 361-5, 370.
|
| [5] |
陆思千, 贾舒婷, 罗瑛. 突变p53功能研究新进展与个性化的肿瘤治疗新策略[J].
遗传, 2011, 33(6): 539-48.
|
| [6] |
Jiang T, Hou CC, She ZY, et al. The SOX gene family:function and regulation in testis determination and male fertility maintenance[J].
Mol Biol Rep, 2013, 40(3): 2187-94.
DOI: 10.1007/s11033-012-2279-3. |
| [7] |
Zhu Y, Li Y, Jun Wei JW, et al. The role of Sox genes in lung morphogenesis and Cancer[J].
Int J Mol Sci, 2012, 13(12): 15767-83.
DOI: 10.3390/ijms131215767. |
| [8] |
Jay P, Sahly I, Goze C, et al. SOX22 is a new member of the SOX gene family, mainly expressed in human nervous tissue[J].
Hum Mol Genet, 1997, 6(7): 1069-77.
DOI: 10.1093/hmg/6.7.1069. |
| [9] |
Wang L, Hu FQ, Shen SE, et al. Knockdown of SOX12 expression inhibits the proliferation and metastasis of lung cancer cells[J].
Am J Transl Res, 2017, 9(9): 4003.
|
| [10] |
Shiao YH, Palli D, Caporaso NE, et al. Genetic and immunohistochemical analyses of p53 independently predict regional metastasis of gastric cancers[J].
Cancer Epidemiol Biomarkers Prev, 2000, 9(6): 631-3.
|
| [11] |
Charafe-Jauffret E, Tarpin C, Bardou VJ, et al. Immunophenotypic analysis of inflammatory breast cancers:identification of an'inflammatory signature[J].
J Pathol, 2010, 202(3): 265-73.
|
| [12] |
Gyorffy B, Surowiak P, Budczies J, et al. Online survival analysis software to assess the prognostic value of biomarkers using transcriptomic data in non-small-cell lung cancer[J].
PLoS One, 2013, 8(12): 0082241.
DOI: 10.1371/journal.pone.0082241. |
| [13] |
Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/American thoracic society/European respiratory society:international multidisciplinary classification of lung adenocarcinoma:executive summary[J].
Proc Am Thorac Soc, 2011, 8(5): 381-5.
DOI: 10.1513/pats.201107-042ST. |
| [14] |
Imielinski M, Berger AH, Hammerman PS, et al. Mapping the hallmarks of lung adenocarcinoma with massively parallel sequencing[J].
Cell, 2012, 150(6): 1107-20.
DOI: 10.1016/j.cell.2012.08.029. |
| [15] |
Ding L, Getz G, Wheeler DA, et al. Somatic mutations affect key pathways in lung adenocarcinoma[J].
Nature, 2008, 455(7216): 1069-75.
DOI: 10.1038/nature07423. |
| [16] |
Kamachi Y, Kondoh H. Sox proteins:regulators of cell fate specification and differentiation[J].
Development, 2013, 140(20): 4129-44.
DOI: 10.1242/dev.091793. |
| [17] |
Wegner M. All purpose Sox:The many roles of Sox proteins in gene expression[J].
Int J Biochem Cell Biol, 2010, 42(3): 0-390.
|
| [18] |
王钰婷, 薛立辉, 聂刘旺. SOX基因与肿瘤关系的研究进展[J].
癌变·畸变·突变, 2009, 21(1): 77-80.
DOI: 10.3969/j.issn.1004-616X.2009.01.020. |
| [19] |
Dravis C, Chung CY, Lytle NK, et al. Epigenetic and transcriptomic profiling of mammary gland development and tumor models disclose regulators of cell state plasticity[J].
Cancer Cell, 2018, 34(3): 466.
DOI: 10.1016/j.ccell.2018.08.001. |
| [20] |
Duquet A, Melotti A, Mishra S, et al. A novel genome-wide in vivo screen for metastatic suppressors in human colon Cancer identifies the positive WNT-TCF pathway modulators TMED3 and SOX12[J].
EMBO Mol Med, 2014, 6(7): 882-901.
DOI: 10.15252/emmm.201303799. |
| [21] |
Huang W, Chen Z, Shang X, et al. Sox12, a direct target of FoxQ1, promotes hepatocellular carcinoma metastasis through upregulating Twist1 and FGFBP1[J].
Hepatology, 2015, 61(6): 1920-33.
DOI: 10.1002/hep.27756. |
| [22] |
Ding H, Quan H, Yan W, et al. Silencing of SOX12 by shRNA suppresses migration, invasion and proliferation of breast cancer cells[J].
Biosci Rep, 2016, 36(5): e00389-e00389.
DOI: 10.1042/BSR20160053. |
| [23] |
Gu WJ, Wang BH, Wan FN, et al. SOX2 and SOX12 are predictive of prognosis in patients with clear cell renal cell carcinoma[J].
Oncol Lett, 2018, 15(4): 4564-70.
|
| [24] |
Győrffy B, Lánczky A, Szállási Z. Implementing an online tool for genome-wide validation of survival-associated biomarkers in ovarian-cancer using microarray data from 1287 patients[J].
Endocr Relat Cancer, 2012, 19(2): 197-208.
DOI: 10.1530/ERC-11-0329. |
 2019, Vol. 39
2019, Vol. 39

