2. 湖南省乳甲疾病防治临床医学研究中心,湖南 衡阳 421001;
3. 南华大学附属第二医院临床研究所,湖南 衡阳 421001
2. Clinical Research Center For Breast and Thyroid Disease Prevention of Hunan Province, Hengyang 421001, China;
3. Clinical Research Institute, Second Affiliated Hospital, University of South China, Hengyang 421001, China
化疗药物(多西紫杉醇、顺铂和阿霉素等)能够一定程度上起到治疗乳腺癌效果[1],但化疗耐药性已成为临床治疗中的挑战。因此,研究乳腺癌化疗耐药有关机制对于乳腺癌的治疗及预后具有重要的意义。盐霉素属于聚醚类一元羧酸,由白色链霉菌酵产生,具有特殊的环状结构,是典型的离子载体抗生素[2]。在肺癌、前列腺癌、乳腺癌、胃癌和白血病等肿瘤中均有明显的抑制作用,是一种很有开发潜力的抗肿瘤药物[3-5]。自噬是指通过吞噬需要降解的蛋白质和细胞器,实现细胞本身的代谢需要和细胞器更新,以此来帮助肿瘤细胞逃避压力及应激环境[6]。研究表明,阻断自噬可以增强盐霉素对前列腺癌细胞的杀伤作用[7-8],而自噬活性改变与盐霉素诱导乳腺癌细胞凋亡之间的关系目前并无报道。自噬相关基因3(ATG3)是一个自噬调控因子,参与多种肿瘤细胞自噬的调控过程[9]。根据UALCAN数据库(http://ualcan.path.uab.edu/)和Gu等[10]的研究发现,ATG3在乳腺癌组织中的表达要高于正常组织或癌旁组织。在乳腺癌中,ATG3能够调控细胞自噬,并被认为是一种有前途的生物标志和治疗靶点[10]。因此,本研究通过构建携带ATG3慢病毒,感染乳腺癌MCF-7细胞,建立稳定过表达ATG3的MCF-7细胞株,观察自噬水平;同时探讨ATG3过表达影响自噬的作用机制;以及自噬对抗肿瘤药物盐霉素诱导乳腺癌MCF-7细胞凋亡的影响,以期为寻找乳腺癌化疗药物作用的新靶点提供线索。本研究初步揭示了乳腺癌MCF-7细胞对抗肿瘤药物盐霉素耐药的可能机制,为临床乳腺癌化疗药物的选择及其治疗提供了理论实验依据。
1 材料和方法 1.1 材料慢病毒(pCD513B- ATG3)和阴性对照慢病毒(pCD513B-1)、人乳腺癌细胞MCF-7由本实验室保存;蛋白裂解液RIPA、BSA蛋白定量试剂盒均购自天根生化科技有限公司;Lipofectamine 2000及DAPI购于Invitrogen公司;DMEM培养基、胎牛血清及胰蛋白酶购自Gibico公司;盐霉素、无水乙醇、异丙醇、Polybrene及嘌呤霉素等生化试剂购于Sigma公司;SC79、MHY1485及3-MA抑制剂购自Selleck公司;ATG3、LC3、P62、cleaved-caspase 3、Bcl-2、Bax、AKT、mTOR、p-AKT、p-mTOR、β-actin抗体及HRP标记的二抗购自CST公司;ECL-plus化学发光试剂盒购自Millipore公司。
1.2 方法 1.2.1 细胞培养人乳腺癌细胞MCF-7在含10%胎牛血清的DMEM培养液中(青霉素100 U/mL,链霉素100 U/mL),于37 ℃、5% CO2、饱和湿度的细胞培养箱中培养。
1.2.2 ATG3过表达慢病毒感染MCF-7细胞将对数生长期的MCF-7细胞接种于6孔板。培养24 h后,吸去细胞上清,加入慢病毒(pCD513B-ATG3)和阴性对照慢病毒(pCD513B-1)培养基2 mL及5 mg/L的Polybrene,24 h后更换为新鲜培养基培养,72 h后荧光显微镜下观察荧光表达情况,确认目的细胞的感染状况。
1.2.3 稳定细胞株的筛选与建立将上述经慢病毒感染的MCF-7细胞消化传代,接种至100 mm培养皿,继续培养24 h后,更换为含嘌呤霉素培养液进行筛选。10~ 20 d后,pCD513B-ATG3和pCD513B-1慢病毒感染组均可见抗性克隆形成,未感染组细胞全部死亡。以无菌克隆环挑取单细胞阳性克隆,消化传代并扩大培养,2~3周后可获得目标细胞株。
1.2.4 药物处理将稳定过表达ATG3的乳腺癌MCF-7细胞和对照组细胞接种于6孔板12 h后,分别加入含AKT磷酸化激动剂[11](SC79,8 μg/mL)和mTOR激活剂[12](MHY1485,10 μmol/L D MEM完全培养液处理24 h后,收集细胞进行相关检测。
对于抗肿瘤药物盐霉素以及自噬抑制剂[13](3- MA),同样是将ATG3过表达和对照组的MCF-7细胞接种于6孔板12 h后,加入含盐霉素(20 μmol/L)或/和3-MA(10 mmol/L)的DMEM完全培养液处理24 h后,收集细胞进行相关检测。
1.2.5 细胞免疫荧光将上述稳定细胞接种于细胞爬片12 h后。经相应处理后,加入预冷PBS洗涤3次,每次5 min。4%多聚甲醛室温固定30 min后,0.1% Tritonx- 100细胞打孔10 min。经PBS洗涤后,加入5%血清封闭1 h。LC3一抗(1:200稀释)4 ℃孵育过夜,加入红色荧光二抗(1:250稀释)避光室温孵育1 h。DAPI染核10 min,指甲油封片。共聚焦荧光显微镜观察LC3在MCF-7中形成的荧光斑点聚集情况。
1.2.6 透射电子显微镜将上述稳定细胞株接种于100 mm培养皿。培养24 h后,收集细胞。经PBS洗涤后,加入2.5%的戊二醛/0.2 M PBS(pH 7.4)固定。固定后的细胞送往武汉赛维尔生物科技有限公司进行电子显微镜观察。
1.2.7 蛋白免疫印迹将上述稳定经相关处理后,收集细胞,加入RIPA裂解液,提取总蛋白。取20~50 μg蛋白上清经SDS-PAGE电泳、转膜和封闭;Anti-ATG3、AntiGFP tag、Anti-LC3、Anti-P62、Anti-AKT、Anti-mTOR、Anti- p- AKT、Anti- p- mTOR、Anti- cleaved caspase3、Anti-BAX、Anti-Bcl-2、Anti-β-actin一抗(CST,1:1000),分别4 ℃孵育过夜;TBST缓冲液洗膜后,加入HRP标记的二抗(CST,1:1000),室温孵育1 h;洗膜后,用化学发光检测试剂盒(ECL)化学发光自显影。
1.2.8 流式细胞术收集盐霉素处理的ATG3稳定过表达MCF-7细胞,利用PE/Annexin V细胞凋亡检测试剂盒(BD Biosciences),结合流式细胞仪(FACSCalibur flow cytometer,BD Biosciences)分析细胞凋亡比例。
1.3 统计分析采用SPSS 17.0统计软件对各数据进行分析,统计数据以均数±标准差表示,均值比较采用两独立样本t检验。P < 0.05时认为差异有统计学意义。
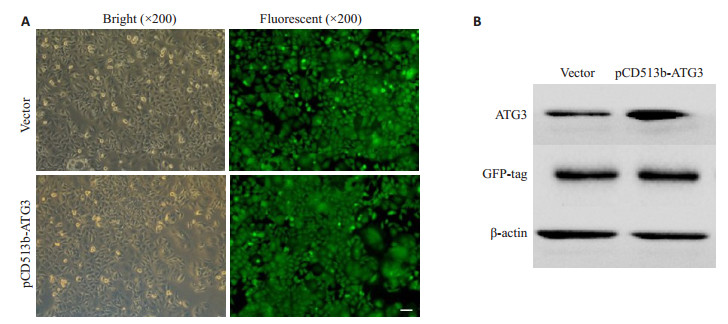
2 结果 2.1 稳定过表达ATG3的MCF-7细胞系建立将成功包装的慢病毒(pCD513B-ATG3)和阴性对照慢病毒(pCD513B-1)感染MCF-7细胞,48 h后加入0.75 mg·L-1的嘌呤霉素进行筛选,阳性细胞克隆在20余次传代后全部稳定存活(图 1A)。Western blot分别检测慢病毒感染后的ATG3表达情况以及GFP标签蛋白和内参蛋白β-actin的表达情况,结果如图 1B。表明稳定过表达ATG3的MCF-7细胞系建立成功。
|
图 1 建立稳定过表达ATG3的MCF-7细胞株 Fig.1 Establishment of MCF-7 cell line stably overexpressing ATG3. A: Lentivirus (ATG3 and empty vector) infected MCF-7 cells (Scale bar=10 μm); B: Expression of ATG3 detected by Western blotting after lentivirus infection |
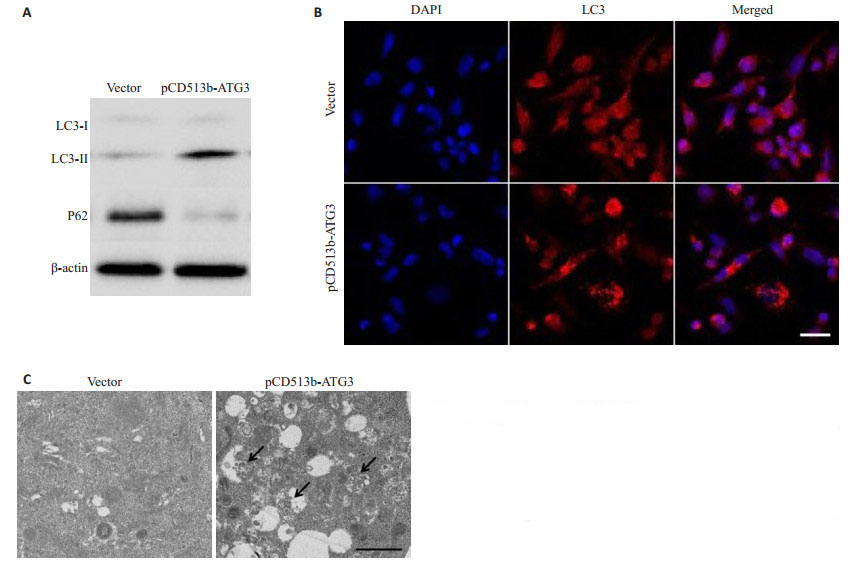
结果显示,ATG3过表达后,LC3-Ⅱ/LC3-I比例明显增加,而自噬底物P62水平明显减少(图 2A)。细胞免疫荧光检测发现,ATG3过表达组LC3斑点形成增多(图 2B)。投射电子显微镜检测发现,ATG3过表达组的自噬小体明显增加(图 2C)。表明ATG3过表达能够促进MCF-7细胞自噬形成。
|
图 2 ATG3促进MCF-7细胞自噬 Fig.2 ATG3 overexpression promotes autophagy in MCF-7 cells. A: Expression of protein markers of autophagy (LC3-Ⅱ/LC3-I and P62) detected by Western blotting; B: LC3 puncta observed using immunofluorescence staining (Scale bar=10 μm); C: Autophagosomes observed under transmission electron microscopy (Scale bar=1 μm) |
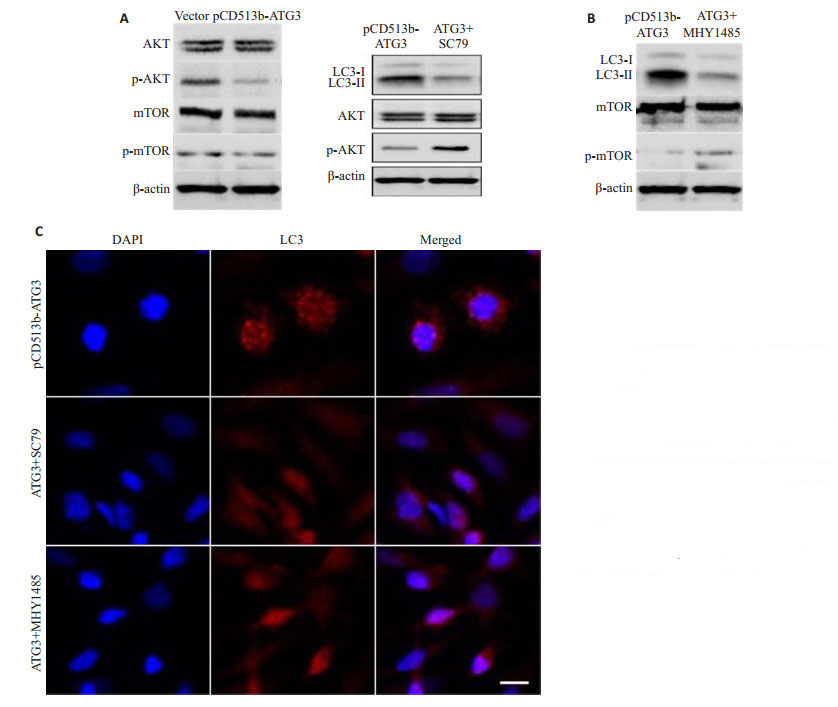
ATG3过表达对AKT和mTOR总蛋白表达水平没有明显影响,但其抑制了AKT和mTOR蛋白的磷酸化水平(图 3A)。上述结果说明ATG3过表达在MCF-7细胞中能够抑制AKT/mTOR信号途径。
|
图 3 ATG3通过抑制AKT/mTOR信号途径促进细胞自噬 Fig.3 ATG3 overexpression promotes autohagy by inhibiting the AKT/mTOR signaling pathway. A: ATG3 overexpression inhibited the AKT/mTOR signaling pathway; B: The activators of AKT/mTOR signaling pathway (SC79 and MHY1485) inhibited LC3 expression induced by ATG3 overexpression; C: The activators (SC79 and MHY1485) inhibited LC3 puncta induced by ATG3 overexpression (Scale bar=10 μm) |
SC79和MHY1485能够抑制ATG3过表达诱导的LC3-Ⅱ的表达(图 3B)。细胞免疫荧光检测发现,SC79和MHY1485能够抑制ATG3过表达诱导的LC3斑点形成(图 3C)。上述结果说明ATG3过表达促进乳腺癌细胞自噬可能是通过抑制AKT/mTOR信号途径引起的。
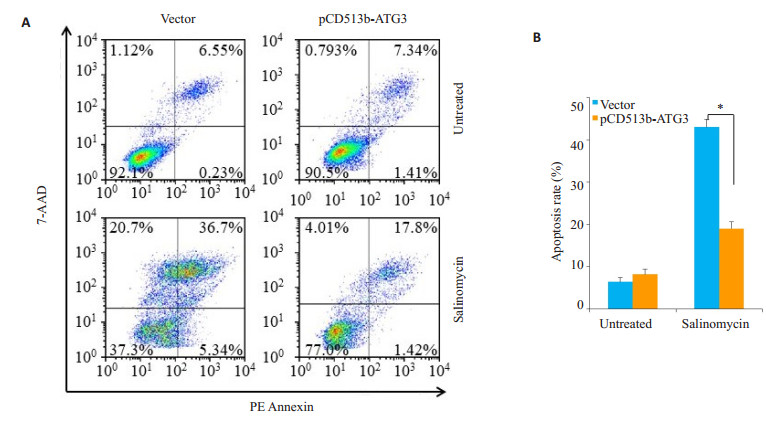
2.4 ATG3对盐霉素处理后MCF-7细胞凋亡率的影响相较于空载体组,ATG3过表达组中,盐霉素(SAL,20 μmol/L)诱导的细胞凋亡率明显降低(P < 0.01,图 4)。表明ATG3过表达能够抑制盐霉素诱导的细胞凋亡。
|
图 4 ATG3对盐霉素处理后MCF-7细胞凋亡率的影响 Fig.4 Effects of ATG3 overexpression on apoptotic rate of MCF-7 cells after salinomycin treatment. A: Apoptotic rate analyzed by flow cytometry; B: A histograms showing the cellular apoptosis rate (%). *P < 0.01 |
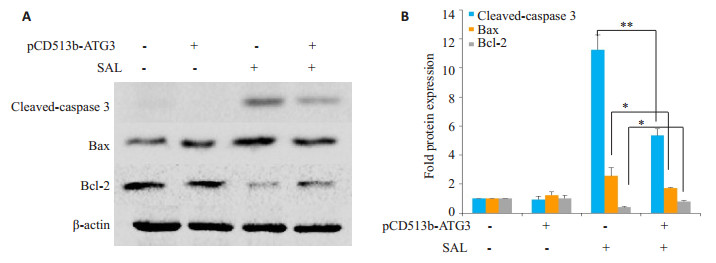
相较于空载体组,ATG3过表达抑制了盐霉素诱导的凋亡标志分子cleaved- caspase 3蛋白的表达(P < 0.01),增加了抗凋亡分子Bcl-2蛋白的表达(P < 0.05),降低了促凋亡分子Bax蛋白的表达(P < 0.05,图 5)。上述结果进一步说明ATG3过表达抑制了盐霉素诱导的细胞凋亡。
|
图 5 ATG3对盐霉素处理后MCF-7细胞中凋亡相关蛋白的影响 Fig.5 Effects of ATG3 on expression of apoptosis-related proteins in MCF-7 cells after salinomycin (SAL) treatment. A: Expression of apoptosis- related proteins detected by Western blotting; B: A histogram showing the fold change in protein expression. *P < 0.05, **P < 0.01 |
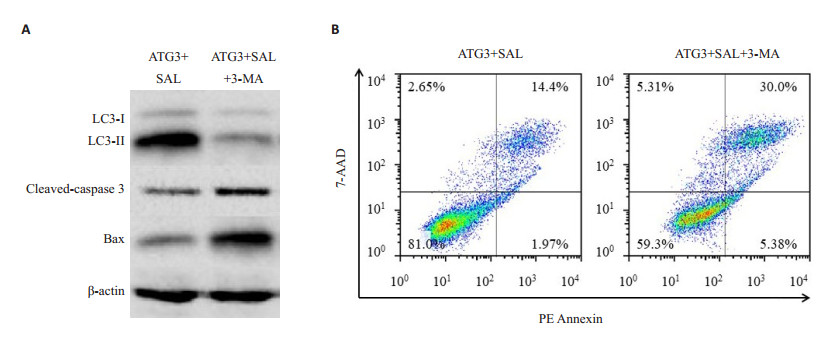
我们利用3-MA(10 mmol/L,一种自噬抑制剂[13])和盐霉素(SAL)共同处理稳定过表达ATG3的MCF-7细胞。结果如图所示(图 6A),3-MA能够明显降低LC3- Ⅱ/LC3-I比例;同时增加凋亡相关蛋白cleaved-caspase 3和Bax的表达。此外,我们还利用流式细胞术分析了细胞凋亡率的变化(图 6B)。相对于SAL单独处理组(3.75%+8.49%),3-MA和SAL共处理组的凋亡率明显增加(11.7%+24.2%)。上述结果提示ATG3过表达可能通过细胞自噬抑制盐霉素诱导的细胞凋亡。
|
图 6 自噬对ATG3过表达抑制盐霉素诱导细胞凋亡的影响 Fig.6 Auotophagy mediates the inhibitory effect of ATG3 overexpression on salinomycin-induced apoptosis. A: Autophagy and apoptosis-related proteins detected by Western blotting; B: Apoptotic rate analyzed by flow cytometry |
细胞自噬在肿瘤发生和肿瘤抑制过程中都发挥着重要的作用,因此它是一把“双刃剑”[14]。在乳腺癌细胞中,自噬能够促进肿瘤细胞的存活和转移复发[15]。自噬相关蛋白ATG3,一个自噬调节因子,有助于LC3与脂质磷脂酰乙醇胺的结合[16]。在前列腺癌中,ATG3被上调后,能够促进细胞自噬[17]。在非小细胞肺癌中,ATG3通过氧化作用抑制了自噬的发生[18-19]。我们前期的研究发现,ATG3过表达能够诱导前列腺癌PC-3细胞自噬的发生[7]。为了研究ATG3对乳腺癌细胞MCF-7自噬的影响,本研究首先利用慢病毒包装技术构建了稳定过表达ATG3的MCF-7细胞株。进一步分析发现,在MCF- 7细胞中,ATG3过表达同样能够诱导细胞自噬的发生,但机制未明。
AKT/mTOR信号途径是自噬调控的关键信号通路之一[20-21],其中mTOR是一个主要的自噬调控因子[22-23]。在SKM-1细胞中,ATG3过表达能够通过AKT/mTOR信号途径诱导细胞自噬的发生[24]。我们在前列腺癌PC- 3细胞中发现ATG3过表达能够抑制AKT/mTOR信号途径[7]。本研究中,我们发现ATG3过表达同样能够抑制AKT/mTOR信号途径。因此,我们推测在乳腺癌MCF-7细胞中,ATG3过表达通过抑制AKT/mTOR信号途径来诱导细胞自噬的。在本研究中,AKT磷酸化激动剂(SC79)[11]和mTOR激活剂(MHY1485)[12]被我们分别使用来激活AKT/mTOR信号途径。随后的研究发现,AKT/mTOR信号途径的激活能够抑制ATG3过表达诱导的细胞自噬。上述结果证实了我们的推测,ATG3过表达是通过抑制AKT/mTOR信号途径来诱导MCF-7细胞自噬的。本研究中自噬的生物学作用有待我们进一步探讨。
为了探究ATG3过表达诱导的自噬对抗肿瘤药物的的敏感性,我们选择了盐霉素作为抗肿瘤药物。据报道,盐霉素在多种恶性肿瘤细胞中发挥抗癌作用[25-26]。此外,盐霉素还具有选择性杀伤乳腺癌肿瘤干细胞的作用[27-28]。我们研究小组最近的研究发现,盐霉素能够上调前列腺癌PC-3细胞ATG3的蛋白表达,并诱导细胞自噬[7]。在本研究中,我们利用盐霉素处理ATG3过表达的MCF-7细胞。进一步分析发现,ATG3过表达能够减少盐霉素诱导的MFC-7细胞凋亡率,同时抑制凋亡相关蛋白的表达。因此,我们推测在乳腺癌MCF-7细胞中,ATG3过表达诱导的自噬能够拮抗盐霉素的抗肿瘤作用。随后的研究中,自噬抑制剂3-MA[13]被我们用来阻滞ATG3诱导的细胞自噬。结果发现,自噬的抑制能够增强盐霉素诱导凋亡蛋白的表达,增加细胞凋亡率。上述结果证实ATG3过表达能够通过细胞自噬抑制盐霉素诱导的MCF-7细胞凋亡。
综上所述,本研究首先利用慢病毒包装技术成功构建了稳定过表达ATG3的MCF-7细胞株;其次,在该稳定细胞株中,我们研究发现,ATG3过表达可能通过抑制AKT/mTOR信号途径,显著提高细胞的自噬水平;最后,我们初步证实了ATG3过表达诱导的细胞自噬,能够拮抗抗肿瘤药物盐霉素对乳腺癌MCF-7细胞的作用效果。由此可见,乳腺癌细胞能够通过自噬增强耐药性、抑制凋亡,但自噬调控乳腺癌细胞凋亡的机制仍需进一步研究。本研究提示诱发细胞自噬可能是乳腺癌细胞耐药的机制之一,对乳腺癌的治疗具有一定的临床意义。
| [1] |
Turki T, Wei Z, Wang JT. A transfer learning approach via procrustes analysis and mean shift for cancer drug sensitivity prediction[J].
J Bioinform Comput Biol, 2018, 16(3): 1840014.
DOI: 10.1142/S0219720018400140. |
| [2] |
Ketola K, Hilvo M, Hyotylainen T, et al. Salinomycin inhibits prostate cancer growth and migration via induction of oxidative stress[J].
Br J Cancer, 2012, 106(1): 99-106.
|
| [3] |
Lu Y, Ma W, Mao J, et al. Salinomycin exerts anticancer effects on human breast carcinoma MCF-7 cancer stem cells via modulation of Hedgehog signaling[J].
Chem Biol Interact, 2015, 228: 100-7.
DOI: 10.1016/j.cbi.2014.12.002. |
| [4] |
Zhang YS, Liu LG, Li F, et al. Salinomycin exerts anticancer effects on PC-3 cells and PC-3-Derived cancer stem cells in vitro and in vivo[J].
Biomed Res Int, 2017: 4101653.
|
| [5] |
Jangamreddy JR, Ghavami S, Grabarek JA, et al. Salinomycin induces activation of autophagy, mitophagy and affects mitochondrial polarity: Differences between primary and cancer cells[J].
Biochim Biophys Acta, 2013, 1833(9): 2057-69.
DOI: 10.1016/j.bbamcr.2013.04.011. |
| [6] |
曾晓刚, 葛明建. ATG5敲低后抑制人肺癌癌细胞H1299自噬并增强南蛇藤素诱导的细胞凋亡[J].
基础医学与临床, 2017, 37(4): 531-6.
DOI: 10.3969/j.issn.1001-6325.2017.04.020. |
| [7] |
Zhang YS, Li F, Liu LG, et al. Salinomycin-induced autophagy blocks apoptosis via the ATG3/AKT/mTOR signaling axis in PC-3 cells[J].
Life Sci, 2018, 207: 451-60.
DOI: 10.1016/j.lfs.2018.06.034. |
| [8] |
Endo S, Nakata K, Sagara A, et al. Autophagy inhibition enhances antiproliferative effect of salinomycin in pancreatic cancer cells[J].
Pancreatology, 2017, 17(6): 990-6.
DOI: 10.1016/j.pan.2017.08.009. |
| [9] |
Frankel LB. EIF5A mediates autophagy via translation of ATG3[J].
Autophagy, 2018, 14(7): 1288-9.
DOI: 10.1080/15548627.2018.1491213. |
| [10] |
Gu J, Wang YE, Wang XE, et al. Effect of the LncRNA GAS5-MiR- 23a-ATG3 axis in regulating autophagy in patients with breast cancer[J].
Cell Physiol Biochem, 2018, 48(1): 194-207.
DOI: 10.1159/000491718. |
| [11] |
Jo H, Mondal S, Tan D, et al. Small molecule-induced cytosolic activation of protein kinase Akt rescues ischemia-elicited neuronal death[J].
Proc Natl Acad Sci USA, 2012, 109(26): 10581-6.
DOI: 10.1073/pnas.1202810109. |
| [12] |
Rakhmanova V, Jin M, Shin J. Inhibition of mast cell function and proliferation by mTOR activator MHY1485[J].
Immune Netw, 2018, 18(3): e18.
DOI: 10.4110/in.2018.18.e18. |
| [13] |
Zhao XF, Luo GS, Cheng Y, et al. Compound C induces protective autophagy in human cholangiocarcinoma cells via Akt/mTORindependent pathway[J].
J Cell Biochem, 2018, 119(7): 5538-50.
DOI: 10.1002/jcb.v119.7. |
| [14] |
Wei HJ, Wei S, Gan BY, et al. Suppression of autophagy by FIP200 deletion inhibits mammary tumorigenesis[J].
Genes Dev, 2011, 25(14): 1510-27.
DOI: 10.1101/gad.2051011. |
| [15] |
Vera-Ramirez L, Vodnala SK, Nini R, et al. Autophagy promotes the survival of dormant breast cancer cells and metastatic tumour recurrence[J].
Nat Commun, 2018, 9: 1944.
DOI: 10.1038/s41467-018-04070-6. |
| [16] |
Yao C, Liu BB, Qian XD, et al. Crocin induces autophagic apoptosis in hepatocellular carcinoma by inhibiting Akt/mTOR activity[J].
Onco Targets Ther, 2018, 11: 2017-28.
DOI: 10.2147/OTT. |
| [17] |
Roy A, Ramalinga M, Kim OJ, et al. Multiple roles of RARRES1 in prostate cancer: Autophagy induction and angiogenesis inhibition[J].
PLoS One, 2017, 12(7): e0180344.
DOI: 10.1371/journal.pone.0180344. |
| [18] |
Burgoyne JR. Oxidative stress impairs autophagy through oxidation of ATG3 and ATG7[J].
Autophagy, 2018, 14(6): 1092-3.
|
| [19] |
Frudd K, Burgoyne T, Burgoyne JR. Oxidation of Atg3 and Atg7 mediates inhibition of autophagy[J].
Nat Commun, 2018, 9(1): 95.
|
| [20] |
Heras-Sandoval D, Pérez-Rojas JM, Hernández-Damián J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J].
Cell Signal, 2014, 26(12): 2694-701.
DOI: 10.1016/j.cellsig.2014.08.019. |
| [21] |
Lin CJ, Chen TL, Tseng YY, et al. Honokiol induces autophagic cell death in malignant glioma through reactive Oxygen speciesmediated regulation of the p53/PI3K/Akt/mTOR signaling pathway[J].
Toxicol Appl Pharmacol, 2016, 304: 59-69.
|
| [22] |
Munson MJ, Ganley IG. MTOR, PIK3C3, and autophagy: Signaling the beginning from the end[J].
Autophagy, 2015, 11(12): 2375-6.
DOI: 10.1080/15548627.2015.1106668. |
| [23] |
Tao Z, Feng C, Mao C, et al. MiR-4465 directly targets PTEN to inhibit AKT/mTOR pathway-mediated autophagy[J]. Cell Stress Chaperones, 2018 Nov 12, doi.org/10.1007/s12192-018-0946-6.
|
| [24] |
Zhuang L, Ma Y, Wang Q, et al. Atg3 overexpression enhances Bortezomib-Induced cell death in SKM-1 cell[J].
PLoS One, 2016, 11(7): e0158761.
DOI: 10.1371/journal.pone.0158761. |
| [25] |
Fuchs D, Heinold A, Opelz G, et al. Salinomycin induces apoptosis and overcomes apoptosis resistance in human cancer cells[J].
Biochem Biophys Res Commun, 2009, 390(3): 743-9.
DOI: 10.1016/j.bbrc.2009.10.042. |
| [26] |
Zhou S, Wang FF, Wong ET, et al. Salinomycin: a novel anti-cancer agent with known anti-coccidial activities[J].
Curr Med Chem, 2013, 20(33): 4095-101.
|
| [27] |
Gupta PB, Onder TT, Jiang G, et al. Identification of selective inhibitors of cancer stem cells by high-throughput screening[J].
Cell, 2009, 138(4): 645-59.
DOI: 10.1016/j.cell.2009.06.034. |
| [28] |
Li J, Xu WQ, Yuan XL, et al. Polymer-lipid hybrid anti-HER2 nanoparticles for targeted salinomycin delivery to HER2-positive breast cancer stem cells and cancer cells[J].
Int J Nanomed, 2017, 12: 6909-21.
DOI: 10.2147/IJN. |
 2019, Vol. 39
2019, Vol. 39

