乙型肝炎病毒(HBV)感染是导致肝硬化、肝衰竭、肝癌的主要原因,据估计,全球共有2.4亿人感染HBV[1],在我国由HBV感染引起的肝硬化和肝癌患者比例分别为60%和80%[2]。而抗病毒治疗是控制慢性乙型肝炎(CHB)进展及其相关性肝硬化最有效的措施。目前,CHB的抗病毒药物包括两大类:核苷(酸)类似物(NAs)及α干扰素(IFN-α),而NAs中使用最多的药物为恩替卡韦(ETV)[3]。我国慢性乙型肝炎防治指南(2015版)[4](下文以《指南》代替)认为:对基线丙氨酸氨基转移酶(ALT)水平≥ 2倍正常值上限(ULN)的CHB患者及乙肝肝硬化患者均应启动抗病毒治疗,对肝硬化患者选用NAs抗病毒治疗已取得共识,但对无肝硬化证据的CHB患者的抗病毒治疗,尤其是对炎症活动较轻的患者选择上述何种抗病毒药物仍存在争议,《指南》中也未明确提及。由于NAs及IFN-α存在各自的优缺点,针对炎症活动不同的患者治疗效果也存在很大差异,故临床上选择何种抗病毒药物仍存在一定困惑[5]。为了对临床医师治疗CHB患者的抗病毒药物选择提供更明确、更简捷的依据,本研究主要分析了基线ALT水平以及不同抗病毒药物(ETV、IFN-α)与CHB抗病毒疗效的关系。
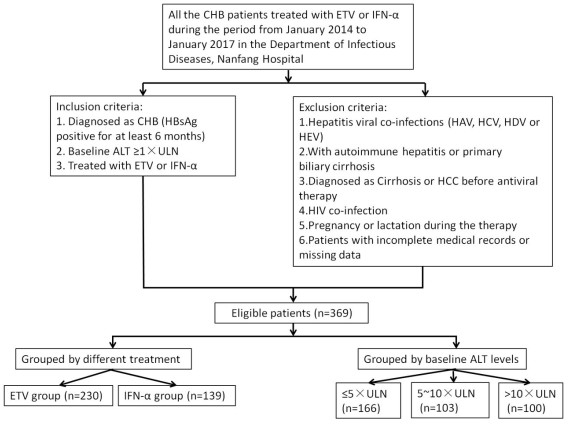
1 资料和方法 1.1 病例选择本研究采用连续入组的方式,纳入的病例为南方医院感染内科在2014年01月~2017年01月使用抗病毒药物治疗的CHB患者。所有患者均符合中华医学会肝病学分会和中华医学会感染病学分会制定的慢性乙型肝炎防治指南(2015版)[4]的诊断标准。纳入标准:(1)明确诊断为CHB患者;(2)治疗基线ALT水平≥ 1×ULN;(3)选择ETV或IFN-α单药治疗。排除标准:(1)合并其他肝炎病毒的感染,如HAV、HCV、HDV、HEV;(2)合并自身免疫性肝病或原发性胆汁淤积性肝硬化;(3)抗病毒治疗前已存在肝硬化、HCC;(4)合并HIV感染的患者;(5)治疗期间处于妊娠期或哺乳期;(6)病历内容不完善或数据资料缺失较多的患者。入组情况如图 1。
|
图 1 患者入选和排除流程 Fig.1 Inclusion and exclusion process of the patients |
将369例患者按照治疗方案不同分组,ETV组共有230例,IFN-α组共有139例患者,其中使用PegIFN-α的患者有116例,使用普通IFN-α治疗的患者有23例。按照不同基线ALT水平进行分组,ALT ≤ 40 U/L被定义为正常值范围,ULN即正常值上限,分为≤ 5×ULN(组1)、5~ 10×ULN(组2)、> 10×ULN(组3)3组,其中组3中使用IFN-α的患者基线ALT > 10×ULN,经过护肝治疗后,待ALT < 10×ULN再予IFN-α治疗。分析HBsAg下降情况时,因HBsAg不作为临床常规检测指标,样本数量较少,因此将组2与组3合并进行分析,即将基线ALT ≤ 5× ULN定义为基线低ALT水平组,> 5×ULN定义为基线高ALT水平组。
1.3 检测指标疗效评价包括病毒学应答(HBV DNA低于检测下限)率、HBeAg转阴率、HBsAg下降情况。ALT等血清学指标由贝克曼库尔特AU生化分析系统(乳酸脱氢酶法)检测,HBsAg、HBeAg用雅培i2000平台定量检测,HBV DNA使用荧光定量PCR(达安,检测下限为100 U/mL)。将治疗48周后HBV DNA < 100 U/mL定义为病毒学应答。
1.4 统计学方法临床数据采用SPSS22.0统计学软件进行分析处理,计量资料以均数±标准差表示,计数资料以率或构成比表示,采用Mann-Whitney U检验或Kruskal Wallis检验。P < 0.05为差异有统计学意义。
2 结果 2.1 患者基线水平纳入分析的患者共369例,其中ETV组230例,IFN-α组139例,按基线ALT分组的组1包含患者166例,组2患者103例,组3患者100例,其中选择IFN-α治疗的患者多是相对年轻的患者,因此在不同方案分组之间的患者年龄存在统计学差异,HBeAg阳性比例在不同治疗方案组之间也存在统计学差异,但此对HBeAg转阴率的结果不会有影响,而性别、治疗前HBV DNA水平、治疗前HBsAg水平在不同治疗方案组或是不同ALT水平组之间均无统计学差异(P > 0.05,表 1、2)。
| 表 1 不同治疗方案的CHB患者基线情况 Tab.1 Baseline characteristics of the CHB patients with different treatments |
| 表 2 不同ALT分组的CHB患者基线情况 Tab.2 Baseline characteristics of the CHB patients in different ALT subgroups |
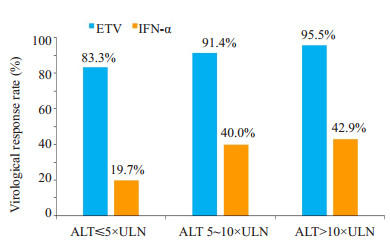
ETV组的患者共230例,包含组1患者101例,组2患者60例,组3患者68例,组1、组2、组3的病毒学应答率分别为83.3%、91.4%、95.5%,各组差异有统计学意义(P=0.010)。IFN-α组患者共139例,包含组1患者65例,组2患者43例,组3患者31例,组1、组2、组3的病毒学应答率分别为19.7%,40%,42.9%,各组差异具有统计学意义(P=0.033)。同一基线ALT水平不同治疗方案之间的病毒学应答率对比各组间差异也有统计学差异(P=0.000,图 2)。
|
图 2 不同ALT水平组及不同治疗方案组的病毒学应答率 Fig.2 Virological response rate of the patients in different ALT subgroups and with different treatments. P=0.000 for comparison within different treatments in the same ALT subgroups; P=0.01 for comparison within different ALT subgroups in ETV group; P=0.033 for comparison within different ALT subgroups in IFN-α group |
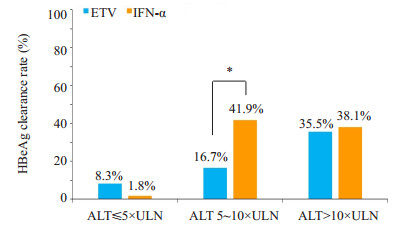
本研究共纳入HBeAg阳性患者263例,ETV组143例,其中组1患者63例,组2患者41例,组3患者39例,组1、组2、组3的HBeAg转阴率分别为8.3%、16.7%、35.5%,各组间的差异具有统计学意义(P=0.010)。IFN-α组患者120例,其中组1患者45例,组2患者43例,组3患者32例,组1、组2、组3的HBeAg转阴率分别为1.8%、41.9%、38.1%,各组间差异具有统计学意义(P=0.000)。对比同一ALT水平分组不同治疗方案的HBeAg转阴率,仅组2两种治疗方案的HBeAg转阴率差异有统计学意义(P=0.046),而在组1和组3,ETV组和IFN-α组的HBeAg转阴率差异均没有统计学意义(P=0.116、0.849,图 3)。
|
图 3 不同ALT水平组及不同治疗方案组的HBeAg转阴率 Fig.3 HBeAg clearance rate in different ALT subgroups and with different treatments. *P < 0.05. P=0.000 for comparison within different treatments in the same ALT subgroups; P=0.01 for comparison within different ALT subgroups in ETV group; P=0.033 for comparison within different ALT subgroups in IFN-α group |
ETV组中基线ALT ≤ 5×ULN组患者共40例,基线ALT > 5×ULN组58例,IFN-α组中基线ALT ≤ 5×ULN组患者36例,基线ALT > 5×ULN组51例。
在ETV组中,治疗48周后在基线ALT ≤ 5×ULN组和基线ALT > 5×ULN组的HBsAg小于200 U/mL率分别为2.5%、13.8%,两者差异无统计学意义(P=0.058),而IFN-α组分别为30.6%、33.3%,差异无统计学意义(P= 0.786)。而同一ALT水平组中两种治疗方案的HBsAg小于200 U/mL率差异均具有统计学意义(P=0.001、0.016)。
另外,ETV组仅有2例患者在治疗48周后达到HBsAg阴转,均出现在基线高ALT水平组,IFN-α组共有5例患者达到HBsAg阴转,基线低ALT水平组2例,基线高ALT水平组3例。
3 讨论治疗CHB的目标是最大限度的长期抑制HBV复制,减轻肝细胞炎性坏死及肝纤维化,延缓和减少肝功能衰竭、肝硬化失代偿、HCC及其他并发症的发生。而治疗最理想的终点,即停药后获得持久的HBsAg消失,基本的终点指抗病毒治疗期间长期维持病毒学应答[4]。
NAs的一线药物包括ETV和替诺福韦酯,临床上使用ETV的患者更多,这两种药物在疗效上无明显差异[6-7],因此本研究主要针对ETV进行分析。IFN-α常用长效干扰素(PegIFN-α)和普通IFN-α,这两种药物具有类似的疗效,但PegIFN-α相较于普通IFN-α有较高的HBeAg血清学转换率、HBV DNA抑制率[8]。IFN-α是一种免疫调节剂,其主要通过增强免疫应答起作用,而NAs是直接抑制病毒复制的口服药物。NAs能获得更高的病毒复制抑制率[9],但其不能完全消除HCC的风险[10-11],且停药后病毒学复发率高。研究表明,对于HBeAg阴性的CHB患者48周内的病毒学复发率高达91.4%,因此需要长期治疗[12]。而IFN-α提供了治疗后实现持续的病毒学和血清学控制的可能性,且相较于NAs更能减少HCC的发生[13-14],但只有一部分患者能实现持续的病毒学应答,且其副作用较多,需要更严密的随访监测[4, 15],另外,因IFN-α需要注射起效,使用IFN-α的患者相对较少。2012年EASL慢乙肝指南[16]指出:HBeAg阳性患者实现HBeAg血清学转换的最佳选择是接受治疗PegIFN治疗,HBeAg阴性患者通过有限疗程实现停药后持久应答可能的唯一选择是接受Peg-IFN治疗。一项台北的队列研究提示,与NAs相比,IFN-α能显著降低HCC的发生率[17]。因此,若能根据基线情况选择出合适的患者,选择IFN-α治疗能获得较高的HBeAg转阴率及HBsAg转阴率[18],获得更好的预后,且可避免长期服药。另有研究表明,在IFN-α基础上加用恩替卡韦并不能提高HBeAg的血清学转换率、停药后持续的病毒学应答率以及HBsAg清除率[19],联合用药治疗的优势还待进一步确定,因此目前仍推荐单药治疗。启动抗病毒治疗的适应征主要根据血清HBV DNA水平、血清ALT和肝脏疾病严重程度来决定。免疫清除期是CHB患者抗病毒治疗的最佳时期[20]。而抗病毒疗效的预测因素包括基线ALT水平、低HBV DNA水平、低HBsAg水平[21-22]。针对血清ALT水平,慢性乙型肝炎防治指南(2015版)建议对ALT持续升高≥ 2×ULN的患者开始启动抗病毒治疗[4],而对于选择IFN-α治疗的患者,基线ALT ≥ 5× ULN的患者可能会获得更好的疗效[20]。
本研究根据不同治疗方案、不同基线ALT水平对患者分组进行分析。结果显示治疗48周后ETV组在基线ALT ≤ 5×ULN(组1)、5~10×ULN(组2)、> 10×ULN(组3)的病毒学应答率分别为83.3%、91.4%、95.5%,IFN-α组则分别为19.7%,40%,42.9%,对比同一ALT组中两种治疗方案的差异,各组均具有统计学差异,证实了ETV在不同基线ALT水平组的病毒学应答率均高于IFN-α组。对同一治疗方案不同ALT组进行分析,不管是ETV组还是IFN-α组,基线ALT > 5×ULN的病毒学应答率均较基线ALT ≤ 5×ULN有较大的提高,差异具有统计学意义,即对ETV和IFN-α而言,基线ALT水平越高,病毒学应答率就越高。
对于HBeAg阳性患者,HBeAg转阴/HBeAg血清学转换是抗病毒治疗重要的终点,可以提高HBsAg转 阴率及改善临床预后[23-24]。本研究结果显示在治疗48周后ETV组的组1、组2、组3的HBeAg转阴率分别为8.3%、16.7%、35.5%,各组差异有统计学意义,而IFN-α组分别为1.8%、41.9%、38.1%,各组差异有统计学意义;而对比不同ALT组中两种治疗方案的HBeAg转阴率,仅在组2中差异有统计学意义。且对于ETV和IFN-α,在基线ALT > 5×ULN时HBeAg转阴率较基线ALT ≤ 5× ULN有明显的提升,这与此前针对IFN-α的研究结果基本类似[25],而一项长期随访研究[26]及Zhang等[27]的前瞻性队列研究均显示对于NAs治疗的患者,基线ALT > 5× ULN有助于提高HBeAg的血清学转换。因此,可以认为不管是选择ETV或IFN-α治疗,基线ALT > 5×ULN的患者在病毒学应答、HBeAg转阴上均有较好的疗效,而在ALT5~10×ULN时,选择IFN-α可能可以获得更高的HBeAg转阴率。
抗病毒治疗的最理想目标是达到HBsAg转阴/ HBsAg血清学转换,HBsAg的清除可实现慢乙肝的缓解及长期预后的改善[28]。一项台湾的研究[29]显示,HBsAg低水平或清除者疾病进展风险小,而Liu等[30]的荟萃分析显示HBsAg转阴率与降低HCC发生风险显著相关。但目前不管是选择ETV还是IFN-α治疗,HBsAg转阴率均处于较低水平,疗效均不理想,IFN-α的HBsAg转阴率约为3%~7%,NAs约为0%~3%(非头对头比较)[4]。本研究中ETV组有2例患者在治疗48周后达到HBsAg阴转,IFN-α组有5例,差异无统计学意义。目前慢性乙型肝炎防治指南(2015版)尚未推荐延长IFN-α的治疗时间,但有研究表明延长IFN-α的治疗时间至96周可以达到更高的病毒学应答率[31],而NEW SWITCH研究中显示在IFN-α治疗24周后HBsAg下降至200 U/mL的NAs经治HBeAg阳性患者,将治疗时间从48周延长至96周可使48.3%的患者达到HBsAg转阴[32]。因此本研究也分析了在治疗48周后HBsAg小于200 U/mL的情况,治疗48周后ETV组在基线低ALT水平组和基线高ALT水平组的HBsAg小于200 U/mL率分别为2.5%、13.8%,两者的差异无统计学意义,而IFN- α组分别为30.6%、33.3%,差异无统计学意义,而同一ALT水平组中两种治疗方案的HBsAg小于200 U/mL率差异均具有统计学意义。可以认为不论在基线低ALT水平还是基线高ALT水平,IFN-α对于HBsAg下降的效果均优于ETV。对比同一治疗方案不同基线ALT水平组,基线ALT > 5×ULN时,治疗48周后的HBsAg小于200 U/mL率均高于ALT ≤ 5×ULN组,但差异并无统计学意义,可能需要更大样本支持。
综上所述,治疗48周后,ETV组在各个ALT组均较IFN-α组有更高的病毒学应答率。在基线ALT5~10× ULN组中,IFN-α组的HBeAg转阴率高于ETV组。对于HBsAg下降情况,IFN-α组在各个ALT组均较ETV组有更好的效果,而同一治疗方案不同ALT组中,基线高ALT水平(ALT > 5×ULN)组的疗效均优于基线低ALT水平(ALT ≤ 5×ULN)组。因此,建议基线ALT水平在5~10×ULN的患者优先选择IFN-α治疗,而基线ALT水平≤ 5×ULN、> 10×ULN的患者选用ETV治疗。
| [1] |
Ott JJ, Stevens GA, Groeger J, et al. Global epidemiology of hepatitis B virus infection: New estimates of age-specific HBsAg seroprevalence and endemicity[J].
Vaccine, 2012, 30(12): 2212-9.
DOI: 10.1016/j.vaccine.2011.12.116. |
| [2] |
Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease: the major impact of China[J].
Hepatology, 2014, 60(6): 2099-108.
DOI: 10.1002/hep.v60.6. |
| [3] |
Sarin SK, Kumar M, Lau GK, et al. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update[J].
Hepatol Int, 2016, 10(1): 1-98.
DOI: 10.1007/s12072-015-9675-4. |
| [4] |
中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年版)[J].
中国肝脏病杂志, 2015, 7(3): 1-18.
|
| [5] |
Lok AS. Personalized treatment of hepatitis B[J].
Clin Mol Hepatol, 2015, 21(1): 1-6.
DOI: 10.3350/cmh.2015.21.1.1. |
| [6] |
时红, 李向永, 朱建芸, 等. 恩替卡韦和替诺福韦酯治疗高病毒载量HBeAg阳性慢性乙型肝炎的对比分析[J].
中华肝脏病杂志, 2017(10): 721-5.
DOI: 10.3760/cma.j.issn.1007-3418.2017.10.001. |
| [7] |
Shi H, Huang MX, Lin GL, et al. Efficacy comparison of tenofovir and entecavir in HBeAg-Positive chronic hepatitis B patients with high HBV DNA[J].
Biomed Res Int, 2016, 2016: 6725073.
|
| [8] |
Zhao H, Kurbanov F, Wan MB, et al. Genotype B and younger patient age associated with better response to low-dose therapy: A trial with pegylated/nonpegylated interferon-alpha-2b for hepatitis B e antigen-positive patients with chronic hepatitis B in China[J].
Clin Infect Dis, 2007, 44(4): 541-8.
DOI: 10.1086/511042. |
| [9] |
Caviglia GP, Abate ML, Pellicano R, et al. Chronic hepatitis B therapy: available drugs and treatment guidelines[J].
Minerva Gastroenterol Dietol, 2015, 61(2): 61-70.
|
| [10] |
Arends P, Sonneveld MJ, Zoutendijk R, et al. Entecavir treatment does not eliminate the risk of hepatocellular carcinoma in chronic hepatitis B: limited role for risk scores in caucasians[J].
Gut, 2015, 64(8): 1289-95.
DOI: 10.1136/gutjnl-2014-307023. |
| [11] |
Cho JY, Paik YH, Sohn W, et al. Patients with chronic hepatitis B treated with oral antiviral therapy retain a higher risk for HCC compared with patients with inactive stage disease[J].
Gut, 2014, 63(12): 1943-50.
DOI: 10.1136/gutjnl-2013-306409. |
| [12] |
Seto WK, Hui AJ, Wong VW, et al. Treatment cessation of entecavir in asian patients with hepatitis B e antigen negative chronic hepatitis B: a multicentre prospective study[J].
Gut, 2015, 64(4): 667-72.
DOI: 10.1136/gutjnl-2014-307237. |
| [13] |
Kusano H, Akiba J, Ogasawara S, et al. Pegylated interferon-alpha 2a inhibits proliferation of human liver cancer cells in vitro and in vivo[J].
PLoS One, 2013, 8(12): e83195.
DOI: 10.1371/journal.pone.0083195. |
| [14] |
Ren PP, Cao ZJ, Mo RD, et al. Interferon-based treatment is superior to nucleos(t)ide analog in reducing HBV-related hepatocellular carcinoma for chronic hepatitis B patients at high risk[J].
Expert Opin Biol Ther, 2018, 18(10): 1085-94.
DOI: 10.1080/14712598.2018.1518423. |
| [15] |
Krishnamoorthy TL, Mutimer D. Hepatitis B: encouraging the use of interferon[J].
Curr Opin Infect Dis, 2015, 28(6): 557-62.
DOI: 10.1097/QCO.0000000000000209. |
| [16] |
Buti M, Cornberg M, Jassen H, et al. EASL clinical practice guidelines: Management of chronic hepatitis B virus infection[J].
J Hepatol, 2012, 57(1): 167-85.
DOI: 10.1016/j.jhep.2012.02.010. |
| [17] |
Liang KH, Hsu CW, Chang ML, et al. Peginterferon is superior to nucleos(t)ide analogues for prevention of hepatocellular carcinoma in chronic hepatitis B[J].
J Infect Dis, 2016, 213(6): 966-74.
DOI: 10.1093/infdis/jiv547. |
| [18] |
Yang YF, Zhao W, Xia HM, et al. Long-term efficacy of interferon alpha therapy on hepatitis B viral replication in patients with chronic hepatitis B: A meta-analysis[J].
Antiviral Res, 2010, 85(2): 361-5.
DOI: 10.1016/j.antiviral.2009.10.023. |
| [19] |
Xie Q, Zhou H, Bai X, et al. A randomized, Open-Label clinical study of combined pegylated interferon alfa-2a(40KD) and entecavir treatment for hepatitis B"e"Antigen-Positive chronic hepatitis B[J].
Clin Infect Dis, 2014, 59(12): 1714-23.
DOI: 10.1093/cid/ciu702. |
| [20] |
张文宏, 张大志, 窦晓光, 等. 聚乙二醇干扰素α治疗慢性乙型肝炎专家共识[J].
中华肝脏病杂志, 2017, 25(9): 678-86.
DOI: 10.3760/cma.j.issn.1007-3418.2017.09.007. |
| [21] |
Buster EH, Hansen BE, Lau GK, et al. Factors that predict response of patients with hepatitis B e antigen-positive chronic hepatitis B to peginterferon-alfa[J].
Gastroenterology, 2009, 137(6): 2002-9.
DOI: 10.1053/j.gastro.2009.08.061. |
| [22] |
Chan H, Messinger D, Papatheodoridis G, et al. A baseline tool for predicting response to peginterferon alfa-2a in HBeAg-positive patients with chronic hepatitis B[J].
Aliment Pharmacol Ther, 2018, 48(5): 547-55.
DOI: 10.1111/apt.14862. |
| [23] |
Liaw Y. HBeAg seroconversion as an important end point in the treatment of chronic hepatitis B[J].
Hepatol Int, 2009, 3(3): 425-33.
DOI: 10.1007/s12072-009-9140-3. |
| [24] |
Zoulim F, Carosi G, Greenbloom S, et al. Quantification of HBsAg in nucleos(t)ide-naive patients treated for chronic hepatitis B with entecavir with or without tenofovir in the BE-LOW study[J].
J Hepatol, 2015, 62(1): 56-63.
DOI: 10.1016/j.jhep.2014.08.031. |
| [25] |
Liaw Y, Jia J, Chan H, et al. Shorter durations and lower doses of peginterferon alfa-2a are associated with inferior hepatitis B e antigen seroconversion rates in hepatitis B virus genotypes B or C[J].
Hepatology, 2011, 54(5): 1591-9.
DOI: 10.1002/hep.24555. |
| [26] |
Wang Q, Li H, Ding D, et al. Upgrade combination response is limited by prolonged nucelos(t)ide analogue therapy in HBeAg-positive chronic hepatitis B:A real-life study[J].
J Clin Transl Hepatol, 2017, 6(1): 1-7.
|
| [27] |
Zhang Y, Hu P, Qi X, et al. A comparison of telbivudine and entecavir in the treatment of hepatitis B e antigen-positive patients: a prospective cohort study in China[J].
Clin Microbiol Infect, 2016, 22(3): 281-7.
|
| [28] |
万谟彬, 翁心华. 干扰素治疗慢性乙型肝炎专家建议的若干补充[J].
中华传染病杂志, 2012, 30(12): 705-10.
DOI: 10.3760/cma.j.issn.1000-6680.2012.12.001. |
| [29] |
Tseng TC, Liu CJ, Yang HC, et al. Serum hepatitis B surface antigen levels help predict disease progression in patients with low hepatitis B virus loads[J].
Hepatology, 2013, 57(2): 441-50.
DOI: 10.1002/hep.26041. |
| [30] |
Liu F, Wang XW, Chen L, et al. Systematic review with meta-analysis: development of hepatocellular carcinoma in chronic hepatitis B patients with hepatitis B surface antigen seroclearance[J].
Aliment Pharmacol Ther, 2016, 43(12): 1253-61.
DOI: 10.1111/apt.2016.43.issue-12. |
| [31] |
Lampertico P, Vigano M, Di Costanzo GG, et al. Randomised study comparing 48 and 96 weeks peginterferon alpha-2a therapy in genotype D HBeAg-negative chronic hepatitis B[J].
Gut, 2013, 62(2): 290-8.
|
| [32] |
Hu P, Shang J, Zhang WH, et al. HBsAg loss with peg-interferon alfa-2a in hepatitis B patients with partial response to nucleos(t)ide analog: new Switch study[J].
J Clin Trans Hep, 2018, 6(1): 25-34.
|
 2019, Vol. 39
2019, Vol. 39

