2. 皖南医学院第一附属医院,安徽 芜湖 241022;
3. 安徽师范大学生命科学学院,安徽 芜湖 241002;
4. 天津市肿瘤医院,天津 300060
2. 2 First Affiliated Hospital of Wangnan Medical College, Wuhu 241022, China;
3. School of Life Sciences, Anhui Normal University, Wuhu 241002, China;
4. Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China
结肠癌是世界范围内最常见的恶性肿瘤之一,其发病率及死亡率都非常高[1]。虽然近年来随着医疗技术的进步,结肠癌患者的生存期有了一定的提高,但是结肠癌的发病率仍然居高不下[2]。多数患者被确诊时已是中晚期,错过了治疗的最佳时期[3]。阐明结肠癌发生和发展的确切分子机制对于诊断及治疗结肠癌至关重要。
Polo样激酶1(PLK1)是一类在真核细胞中广泛存在高度保守的丝氨酸/苏氨酸激酶,其在细胞周期过程中起着非常重要的调控作用[4]。有报道表明,PLK1在多种的癌症(如结肠癌、非小细胞肺癌、乳腺癌、食管癌以及子宫内膜癌等)中出现了高表达,且作为致癌蛋白促进了癌症的发生发展[5-9]。在白血病细胞中,通过小干扰RNA敲除PLK1后能明显抑制白血病细胞的增殖[10]。在结肠癌中,PLK1的高表达可能促进了肿瘤细胞的转移,且PLK1可能作为结肠癌治疗的靶蛋白之一[11]。目前,PLK1在结肠癌中高表达的上游调控机制的研究还未见报道,亟需进一步研究。
microRNA(miRNA)是一类长度为19-22个核苷酸的非编码RNA,其在癌症的发生及发展中起到重要的调控作用[12]。研究表明,miRNAs可能直接与mRNA的编码序列结合或者通过与靶基因mRNA的3′端非翻译区(UTR)结合而起到抑制基因表达的作用[13-14]。miRNAs作为重要的转录后调参与了很多生理和病理进程,如造血细胞分化[15],细胞增殖[16],器官发育[17]和肿瘤的发生[18-19]。miRNAs在肿瘤的发生发展中,可以作为抑癌miRNA或者促癌miRNA发挥功能[20],很多的miRNAs也参与结肠癌的发生发展过程[21-22]。研究表明,miR-593在食道癌中表达量下降,解除了其对PLK1基因表达的抑制,进而促进了肿瘤细胞的增殖[23]。
有关miR-593在结肠癌中的功能及其机制研究尚未见报道。本研究通过体外实验来研究miR-593对结肠癌增殖的影响及其具体的调控机制。
1 材料和方法 1.1 材料 1.1.1 细胞株人结肠癌细胞株SW480、HCT116购自中国科学院上海细胞库。
1.1.2 主要试剂DMEM培养基(Hyclone)、10%胎牛血清(Hyclone)、Lipofectamin 3000(Invitrogen)。TRIzol reagent(Sigama)、双荧光素酶报告基因检测试剂盒(凯基生物)、CCK-8细胞增殖检测试剂盒(日本同仁)、PLK1单克隆抗体(ABclonal)、β-actin(ABclonal)、山羊抗兔二抗(Santacruz)、山羊抗鼠二抗(Santacruz)。
1.2 方法 1.2.1 细胞培养人结肠癌细胞株SW480、HCT116用含抗生素(100 U/mL青霉素和100 mg/L链霉素)和10%胎牛血清DMEM完全培养基,在5%的CO2、37 ℃的环境下培养,待细胞生长到对数生长期后用于后续实验。
1.2.2 miR-593转染miR-593 mimic及miR-593 inhibitor均购于广州锐博生物有限公司。根据lipo3000说明书进行细胞转染实验。
1.2.3 PLK1过表达与抑制PLK1 siRNA购自广州锐博生物有限公司,PLK1过表达质粒(仅包含开放阅读框架)购于上海吉玛生物科技有限公司。根据lipo3000说明书进行细胞转染实验。
1.2.4 Western blot检测PLK1蛋白细胞转染24 h后,收集转染组细胞裂解物。12 000 g,4 ℃离心5 min,吸取上清。加入5×的蛋白上样缓冲液,100 ℃ 5 min。经SDS-PAGE(10%)电泳后,转膜(冰浴,0.3 A,1.5 h),封闭(5%脱脂奶粉,室温1 h)。然后加入按照1:1000稀释的PLK1 I抗,4 ℃孵育过夜。在用TBST清洗5 min 6次。加入稀释好的Ⅱ抗,室温孵育1 h,TBST清洗5 min 6次。清洗好的膜放入暗盒上,正面朝上,加入显影液,暗室曝光。
1.2.5 qRT-PCR检测miR-593及PLK1胰酶消化收集SW480和HCT116细胞,按照Trizol说明书上的方法提取总RNA。采用TaqMan miR-593探针检测并定量miR-593,使用U6作为内参基因。通过oligo dT随机引物将总RNA逆转为cDNA,采用SYBR Green Dye染料法进行qRT-PCR检测PLK1 mRNA的含量,并使用GAPDH作为内参。GAPDH和PLK1引物序列如表 1所示。数据处理采用按2-△△法进行计算。
| 表 1 PLK1和GAPDH引物序列 Tab.1 Sequence of the primers for PLK1 and GAPDH |
采用Cell Counting Kit-8(CCK-8)试剂盒,按照试剂盒说明书上的操作步骤进行操作,检测转染后各组细胞4个时间点(0、24、48、60 h)的细胞数量及活性。细胞相对增殖活性=(实验组A450值N-空白对照组A450值N)/(实验组A450值0-空白对照组A450值0),其中0表示测定的第一个时间点,N表示测定的后面几个时间点。
1.2.7 荧光素酶报告质粒用双荧光素酶报告基因检测miR-593是否直接靶向PLK1基因。PLK1 3'UTR区野生型及突变型荧光素酶报告质粒由上海同科生物科技有限公司合成,将PLK1 3'UTR区序列插入到pmirGLO载体(Promega,E1330)酶切后构成PLK1 3'UTR区野生型荧光素酶报告质粒;将PLK1 3'UTR区域中与miR-593结合的序列由" CAGGAGCC" 突变为" GTCCTCGG" 插入到pmirGLO载体(Promega, E1330)酶切后构成PLK1 3'UTR区突变型荧光素酶报告质粒。用lipo3000转染等量的上述荧光素酶报告质粒和β-半乳糖苷酶(β-gal)表达质粒(Ambion)以及20 pmol的miR-593 mimic、对照组到结肠癌细胞中。用β-gal质粒作为转染效率的对照。24 h后,使用荧光素酶检测试剂盒检测细胞。
1.3 统计学处理采用SPSS19.0软件进行数据处理和统计分析。所有数据以均数±标准差表示。组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 PLK1促进了结肠癌细胞的增殖PLK1过表达质粒及siRNA转染细胞24 h后通过CCK-8试剂盒检测细胞的增殖能力,图 1A-C显示了PLK1过表达及干扰的效率,Western blotting结果表明转染了PLK1过表达质粒后PLK1的表达量比对照组显著提高(P < 0.05),而干扰PLK1后其表达量比对照组明显下降(P < 0.05)。PLK1促进了结肠癌细胞的增殖(P < 0.001,图 1D)。
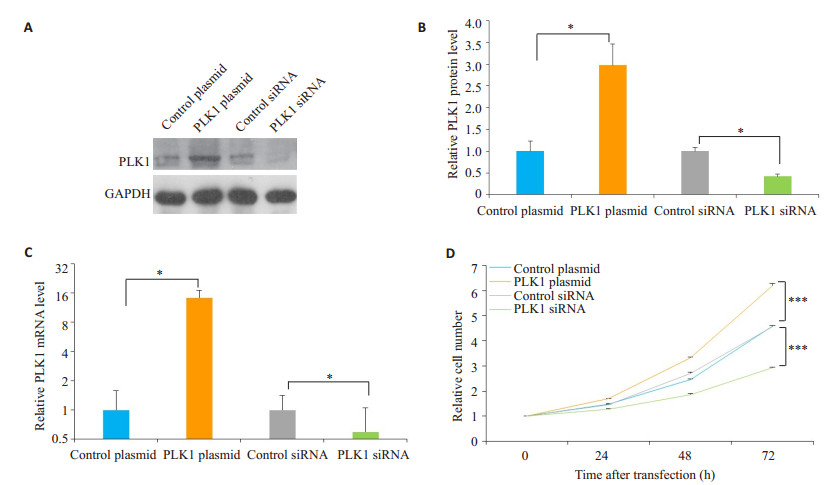
|
图 1 PLK1促进了结肠癌细胞的增殖 Fig.1 PLK1 promotes proliferation of colon cancer cells. A: Western blotting analysis of the PLK1 protein expression levels transfected with control siRNA, PLK1 siRNA, control plasmid or PLK1 plasmid; B: Quantitative analysis of the results of Western blotting; C: Quantitative RT-PCR analysis of PLK1 mRNA expression levels in SW480 cells transfected with control siRNA, PLK1 siRNA, control plasmid or PLK1 plasmid; D: CCK-8 assay of PLK1 protein expression levels in SW480 cells transfected with control siRNA, PLK1 siRNA, control plasmid or PLK1 plasmid. *P < 0.05, ***P < 0.001 |
本研究使用3种不同的生物信息学软件,如TargetScan[24]、miRanda[25]和PicTar[26],来寻找可能结合PLK1的miRNAs。在这些候选miRNs中,miR-593被上述3种软件预测为PLK1结合的miRNA。miR-593与PLK1 3'-UTR区域存在结合位点,且其互补结合的自由能为-29.6 kcal/mol。该自由能处于靶基因与miRNAs互补结合的自由能范围之内(图 2A)。另外,PLK1的3'端非翻译区与miR-593种子序列互补结合的区域在物种之间高度保守。为了更好的验证上述预测结果,本研究进行了双荧光素酶报告基因检测(图 2B)。PLK1基因3'非翻译区野生型组加入miR-593 mimic后,其荧光值比对照组有了明显的下降(P < 0.01);而PLK1 3'非翻译区与miR-593结合序列突变后再转染miR-593 mimic后,其荧光值与对照组相比没有发生变化。
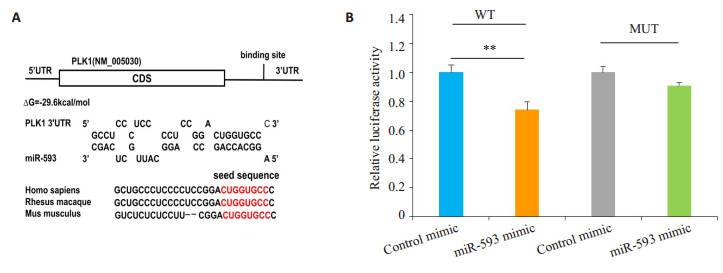
|
图 2 预测及双荧光素酶报告质粒实验验证miR-593与PLK1基因结合 Fig.2 Prediction and dual luciferase reporter plasmid assay to confirm the biding of miR-593 with PLK1 gene. A: Graphical representation of the predicted duplex formed by PLK1 3′-UTR and miR-593; B: Analysis of luciferase reporter assay. Firefly luciferase reporters containing either wild-type (WT) or mutant (MUT) miR-593 binding sites in the PLK1 3′-UTR were co-transfected into SW480 cells with equal doses of the miR-593 mimic and control mimic. **P < 0.01 |
为了进一步证明miR-593对PLK1表达的影响,本研究在2种结肠癌细胞中转染miR-593 mimic和miR-593 inhibitor,24 h后通过Western bolt检测。两种细胞系中过表达miR-593后,其PLK1蛋白的表达水平比对照组有明显的下降;而抑制miR-593的表达后,其PLK1蛋白的表达水平比对照组有明显的上升(P < 0.05,图 3A、B)。转染miR-593后其细胞内的miR-593表达发生变化(P < 0.05,图 3C、D),而PLK1的mRNA水平没有发生变化(P > 0.05)。
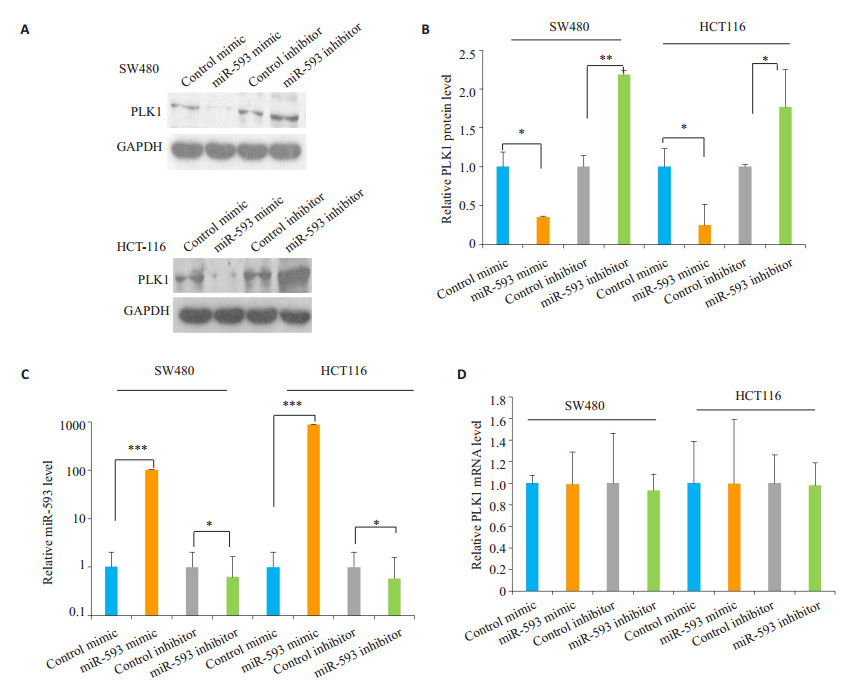
|
图 3 miR-593可在结肠癌细胞中转录后调控PLK1基因的表达 Fig.3 PLK1 is the direct target gene of miR-593. A, B: Western blot analysis of PLK1 protein levels in SW480 cells and HCT-116 cells after transfection with the control mimic, miR-593 mimic, control inhibitor, or miR-593 inhibitor; C: Quantitative RT-PCR analysis of miR-593 level in SW480 cells and HCT-116 cells after transfection; D: Quantitative RT-PCR analysis of PLK1 mRNA level in SW480 cells and HCT-116 cells after transfection. The results were expressed as Mean±SD of 3 independent experiments. *P < 0.05; **P < 0.01, ***P < 0.001 |
miR-593 mimic和miR-593 inhibitor转染结肠癌细胞24 h后,采用CCK-8试剂盒检测细胞的增殖能力。过表达miR-593后,其细胞增殖的能力受到了明显抑制;而抑制miR-593后,其细胞增殖能力比对照组明显提高(P < 0.05,图 4A)。
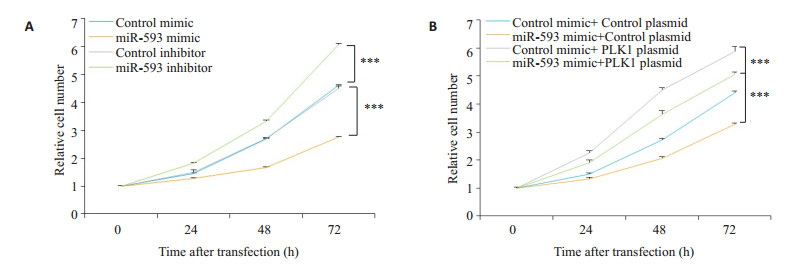
|
图 4 miR-593通过调控PLK1基因表达抑制了结肠癌细胞的增殖 Fig.4 miR-593 inhibits the proliferation of colon cancer cells by down-regulating PLK1. A: Cell proliferation curve of SW480 cells transfected with the control mimic, miR-593 mimic, control inhibitor, or miR-593 inhibitor; B: Cell proliferation curve of SW480 cells transfected with the control mimic plus the control plasmid, the control mimic plus the PLK1 overexpressing plasmid, the miR-593 mimic plus the control plasmid, or the miR-593 mimic plus the PLK1 overexpressing plasmid (n=3; ***P < 0.001 vs control group) |
在前述的结果中,本研究发现miR-593与PLK1对细胞增殖的影响是相反的。为了阐明二者之间的关系,通过共转染miR-593 mimic以及PLK1过表达质粒到结肠癌细胞中,24 h后通过CCK-8试剂盒检测。共转染miR-593过表达和PLK1过表达质粒组对细胞增殖能力的影响介于单独转染miR-593过表达组与单独转染PLK1过表达质粒组之间(图 4B)。
3 讨论miRNAs作为一类重要的转录后调控因子,在肿瘤的发生发展中起到重要作用[27]。现有研究表明,miRNAs在结肠癌的发生发展中,既有抑制作用也有促进作用[28]。有研究表明,miR100通过调控PLK1基因的表达影响了鼻咽癌的进程[29]。研究发现,在食道管癌中miR-593起到一个促癌miRNA的作用,其表达量下降导致了PLK1在食道癌中高表达进而促进了细胞的增殖[24]。PLK1最初在果蝇中被鉴定为参与纺锤体形成的蛋白,进一步的研究表明该激酶在中心体生物学、纺锤体动力学、染色体分离和细胞质分裂中起关键作用[30]。大量研究表明,PLK1癌症发展的早期阶段发挥作用,其过表达与非小细胞肺癌、头颈部癌症和食道癌患者的生存率等呈负相关[31-32]。通过使用PLK1的小分子抑制剂来治疗白血病、非小细胞肺癌等肿瘤是目前正在研究的一种临床治疗策略[33]。但在结肠癌中,PLK1是否存在miRNAs的调控还未见报道。
为了寻找可能调控PLK1基因表达的miRNAs,本研究通过3种生物信息学软件预测可能与PLK1结合的miRNAs,发现miR-593被3种生物信息学软件[26-28]预测为与PLK1结合的miRNA。其次本研究通过CCK-8细胞增殖实验发现,PLK1促进了结肠癌细胞的增殖,这与他人在结肠癌上的结果一致[34],而在结肠癌细胞中干预miR-593的表达后发现miR-593抑制了结肠癌细胞的增殖,因此miR-593与PLK1对结肠癌细胞增殖的影响存在相反的趋势。本结果也提示miR-593在结肠癌细胞中起到抑癌miRNA的作用,这一结果为明确miR- 593在结肠癌中的功能提供了实验依据。
为了验证miR-593与PLK1基因存在结合位点,本研究通过双荧光素酶报告基因实验发现PLK1野生型转染miR-593 mimic后其荧光值下降,而突变型没有发生变化。本结果提示,PLK1基因3′端非翻译区上存在于miR-593结合的位点。为了进一步明确miR-593调控PLK1基因的表达,本研究在结肠癌的二个细胞系中过表达miR-593后发现PLK1基因的表达水平明显下降;而抑制miR-593后PLK1基因的表达水平明显升高,而通过qRT-PCR检测PLK1 mRNA表达水平发现转染miR-593 mimic和miR-593 inhibitor后,PLK1基因的mRNA水平并没有发生变化。本结果提示miR-593在转录后水平调控了结肠癌细胞中PLK1基因的表达。
为了阐明这一调控作用对结肠癌细胞增殖的影响,本研究共转染miR-593 mimic和PLK1过表达质粒进入结肠癌细胞,发现共转染组的细胞增殖能力位于单独转染miR-593 mimic与单独转染PLK1过表达质粒组之间,说明在细胞内过表达miR-593后回复了PLK1基因过表达对结肠癌细胞增殖的影响。
综上所述,本研究通过双荧光素酶报告基因实验、Western blot、qRT-PCR及CCK-8细胞增殖实验发现在体外miR-593通过靶向调控PLK1基因的表达抑制了结肠癌细胞的增殖,在后续的研究中还应该通过免疫细胞化学或免疫荧光的方法进行原位细胞学检测PLK1的表达情况,以期进一步证明miR-593对PLK1的调控作用。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J].
CA Cancer J Clin, 2016, 66(1): 7-30.
DOI: 10.3322/caac.21332. |
| [2] |
Purnak T, Ozaslan E, Efe C. Molecular basis of colorectal cancer[J].
N Engl J Med, 2010, 362(13): 1246-7.
|
| [3] |
Siegel RL, Miller KD, Fedewa SA, et al. Colorectal cancer statistics, 2017[J].
CA Cancer J Clin, 2017, 67(3): 177-93.
DOI: 10.3322/caac.21395. |
| [4] |
Anger M, Kues WA, Klima J, et al. Cell cycle dependent expression of Plk1 in synchronized porcine fetal fibroblasts[J].
Mol Reprod Dev, 2003, 65(3): 245-53.
DOI: 10.1002/(ISSN)1098-2795. |
| [5] |
Xu C, Li S, Chen TF, et al. miR-296-5p suppresses cell viability by directly targeting PLK1 in non-small cell lung cancer[J].
Oncol Rep, 2016, 35(1): 497-503.
DOI: 10.3892/or.2015.4392. |
| [6] |
Wierer M, Verde G, Pisano P, et al. PLK1 signaling in breast cancer cells cooperates with estrogen Receptor-Dependent gene transcription[J].
Cell Rep, 2013, 3(6): 2021-32.
DOI: 10.1016/j.celrep.2013.05.024. |
| [7] |
Zhao CL, Gong L, Li WT, et al. Overexpression of Plk1 promotes malignant progress in human esophageal squamous cell carcinoma[J].
J Cancer Res Clin Oncol, 2010, 136(1): 9-16.
DOI: 10.1007/s00432-009-0630-4. |
| [8] |
Takai N, Miyazaki T, Fujisawa K, et al. Polo-like kinase (PLK) expression in endometrial carcinoma[J].
Cancer Lett, 2001, 169(1): 41-9.
DOI: 10.1016/S0304-3835(01)00522-5. |
| [9] |
Han DP, Zhu QL, Cui JT, et al. Polo-like kinase 1 is overexpressed in colorectal cancer and participates in the migration and invasion of colorectal cancer cells[J].
Med Sci Monit, 2012, 18(6): BR237-46.
|
| [10] |
Uckun FM, Ozer Z, Qazi S, et al. Polo-like-kinase 1 (PLK1) as a molecular target to overcome SYK-mediated resistance of Blineage acute lymphoblastic leukaemia cells to oxidative stress[J].
Br J Haematol, 2010, 148(5): 714-25.
DOI: 10.1111/bjh.2010.148.issue-5. |
| [11] |
Fernandez-Acenero MJ, Cortes D, Gomez del Pulgar T, et al. PLK- 1 expression is associated with histopathological response to neoadjuvant therapy of hepatic metastasis of colorectal carcinoma[J].
Pathol Oncol Res, 2016, 22(2): 377-83.
DOI: 10.1007/s12253-015-0015-8. |
| [12] |
Calin GA, Croce CM. MicroRNA signatures in human cancers[J].
Nat Rev Cancer, 2006, 6(11): 857-66.
DOI: 10.1038/nrc1997. |
| [13] |
Orom UA, Nielsen FC, Lund AH. MicroRNA-10a binds the 5'UTR of ribosomal protein mRNAs and enhances their translation[J].
Mol Cell, 2008, 30(4): 460-71.
DOI: 10.1016/j.molcel.2008.05.001. |
| [14] |
Yan L, Ma JZ, Zhu YP, et al. miR-24-3p promotes cell migration and proliferation in lung cancer by targeting SOX7[J].
J Cell Biochem, 2018, 119(5): 3989-98.
DOI: 10.1002/jcb.v119.5. |
| [15] |
Houshmand M, Hagh MN, Soleimani M, et al. MicroRNA microarray profiling during megakaryocyte differentiation of cord blood CD133+hematopoietic stem cells[J].
Cell J, 2018, 20(2): 195-203.
|
| [16] |
Raghuwanshi S, Gutti U, Kandi R, et al. MicroRNA-9 promotes cell proliferation by regulating RUNX1 expression in human megakaryocyte development[J].
Cell Prolif, 2018, 51(1): e12414.
DOI: 10.1111/cpr.2018.51.issue-1. |
| [17] |
Tu JG, Tian CX, Zhao PQ, et al. Identification and profiling of growth-related microRNAs in Chinese perch (Siniperca chuatsi)[J].
BMC Genomics, 2017, 18(1): 113-20.
|
| [18] |
Chan SH, Wu CW, Li AF, et al. MiR-21 microRNA expression in human gastric carcinomas and its clinical association[J].
Anticancer Res, 2008, 28(2A): 907-11.
|
| [19] |
Hu XY, Zhang M, Miao JY, et al. miRNA-4317 suppresses human gastric cancer cell proliferation by targeting ZNF322[J].
Cell Biol Int, 2018, 42(8): 923-30.
DOI: 10.1002/cbin.v42.8. |
| [20] |
Svoronos AA, Engelman DM, Slack FJ. OncomiR or tumor suppressor? the duplicity of MicroRNAs in cancer[J].
Cancer Res, 2016, 76(13): 3666-70.
DOI: 10.1158/0008-5472.CAN-16-0359. |
| [21] |
Noguchi T, Toiyama Y, Kitajima T, et al. miRNA-503 promotes tumor progression and is associated with early recurrence and poor prognosis in human colorectal cancer[J].
Oncology, 2016, 90(4): 221-31.
DOI: 10.1159/000444493. |
| [22] |
Wang J, Lei ZJ, Guo Y, et al. miRNA-regulated delivery of lincRNA-p21 suppresses beta-catenin signaling and tumorigenicity of colorectal cancer stem cells[J].
Oncotarget, 2015, 6(35): 37852-70.
|
| [23] |
Ito T, Sato F, Kan T, et al. Polo-like kinase 1 regulates cell proliferation and is targeted by miR-593* in esophageal cancer[J].
Int J Cancer, 2011, 129(9): 2134-46.
DOI: 10.1002/ijc.v129.9. |
| [24] |
Maziere P, Enright AJ. Prediction of microRNA targets[J].
Drug Discov Today, 2007, 12(11/12): 452-8.
|
| [25] |
John B, Enright AJ, Aravin A, et al. Human MicroRNA targets[J].
PLoS Biol, 2004, 2(11): e363.
DOI: 10.1371/journal.pbio.0020363. |
| [26] |
Krek A, Grun D, Poy MN, et al. Combinatorial microRNA target predictions[J].
Nat Genet, 2005, 37(5): 495-500.
DOI: 10.1038/ng1536. |
| [27] |
Sandiford OA, Moore CA, Du J, et al. Human aging and cancer: role of miRNA in tumor microenvironment[J].
Adv Exp Med Biol, 2018, 1056(5): 137-52.
|
| [28] |
Liu YQ, Liu R, Yang F, et al. miR-19a promotes colorectal cancer proliferation and migration by targeting TIA1[J].
Mol Cancer, 2017, 16(1): 53-60.
DOI: 10.1186/s12943-017-0625-8. |
| [29] |
Shi W, Alajez NM, Bastianutto C, et al. Significance of Plk1 regulation by miR-100 in human nasopharyngeal cancer[J].
Int J Cancer, 2010, 126(9): 2036-48.
|
| [30] |
Archambault V, Glover DM. Polo-like kinases: conservation and divergence in their functions and regulation[J].
Nat Rev Mol Cell Biol, 2009, 10(4): 265-75.
DOI: 10.1038/nrm2653. |
| [31] |
Yim H, Erikson RL. Plk1-targeted therapies in TP53- or RASmutated cancer[J].
Mutat Res Rev Mutat Res, 2014, 761(9): 31-39.
|
| [32] |
Strebhardt K, Ullrich A. Targeting polo-like kinase 1 for cancer therapy[J].
Nat Rev Cancer, 2006, 6(4): 321-30.
DOI: 10.1038/nrc1841. |
| [33] |
Gutteridge RE, Ndiaye MA, Liu XA. Plk1 inhibitors in cancer therapy: from laboratory to clinics[J].
Mol Cancer Ther, 2016, 15(7): 1427-35.
DOI: 10.1158/1535-7163.MCT-15-0897. |
| [34] |
Francescangeli F, Patrizii M, Signore M, et al. Proliferation state and polo-like kinase1 dependence of tumorigenic colon cancer cells[J].
Stem Cells, 2012, 30(9): 1819-30.
DOI: 10.1002/stem.1163. |
 2019, Vol. 39
2019, Vol. 39

