软骨疾病是对人类健康具有严重影响和危害的一类常见病,其病因、发病机制相当复杂[1-3]。如常见的骨性关节炎,关节软骨和整体的联合结构的渐进退化,伴随着疼痛、关节僵硬甚至残疾,导致生活质量严重下降。目前干预措施仅能缓解疼痛及关节僵硬,无法逆转软骨病变的过程。因此,从分子水平和基因水平研究对软骨细胞增殖的影响因素日益重要[4-5]。
大量的研究证实雌激素在软骨及骨形成中具有十分重要作用[6-8]。ESR1(ERα)是一种配体依赖的转录因子,是雌激素及选择性雌激素受体调节剂生物学效应的主要介导者。就骨骼系统而言,ESR1可表达于成骨细胞、破骨细胞、软骨细胞和骨髓基质细胞以及骨细胞[9-12]。雌激素可直接与核内雌激素受体ESR1结合,活化靶基因的转录,这是经典的雌激素受体信号转导途径。研究发现ESR1还能介导非基因型效应的膜信号途径,比如在乳腺癌中与雌激素结合后,可迅速激活生长因子相关的下游信号转导,如MAPK/ERK和PI3-K/AKT信号通路,从而增强细胞增殖能力[13-14]。已有研究表明雌激素靶向雌激素受体α通过经典途径发挥基因型效应能够促进软骨细胞增殖抑制其凋亡,但雌激素受体α通过胞膜或胞浆中的信号通路来影响软骨细胞增殖的具体机制尚不明确。本研究主要通过构建过表达ESR1基因的腺病毒,并检测在雌二醇(E2)处理下ESR1对软骨细胞凋亡和增殖的影响,探讨其影响过程中可能的分子机制。
1 材料和方法 1.1 材料 1.1.1 细胞和质粒pAd-Track-CMV、pAd-Easy-1质粒、pcDNA3.1(-)、pcDNA3.1(-)-ESR1、C28I2软骨细胞、HEK293细胞,DH5α、BJ5183菌株均来自于本实验室。
1.1.2 主要试剂2×Taq PCR酶、QPCR酶、逆转录试剂盒(vazyme);DNA胶回收试剂盒(Omega);Hindш、Bglп内切酶、Buffer缓冲液、LIC连接酶(Takara);
Pme1、Pac1酶(NAB);lipofectamin2000(Invitrogen);细胞培养基(Gibco);胎牛血清(PΛN);胰酶(碧云天);RNA提取试剂盒(Omega);蛋白裂解液(碧云天);蛋白MARKER(Thermo fisher);脱脂奶粉(完达山);抗ERα抗体、抗Cleaved caspase3抗体、抗P62抗体(Proteintech);抗β-actin抗体(博士德);羊抗兔二抗(博士德);ECL化学发光液(碧云天);显、定影液(成信);胶片(carestream);培养皿(NEST)。
1.2 方法 1.2.1 过表达ESR1重组腺病毒质粒构建根据NCBI中GeneBank提供的ESR1转录本NM_001122740.1的cDNA序列,运用Primer5软件设计对应引物,并加上对应酶切位点序列(Hindш、Bglп),(ESR1正义5'- GTCAGATCCGCTAGAGATCTATGACCATGACCC TCCAC-3',反义5'-GATATCTTATCTAGAAGCTTTC TCAGACCGTGGCAGGG-3)'经过PCR扩增得到的基因片段与线性化pAd-Track-CMV载体LIC连接得到阳性克隆,测序成功后再与pAd-Easy-1电转重组得到pAd-ESR1重组腺病毒质粒。
1.2.2 腺病毒包装、滴度以及MOI值测定将HEK293细胞接种于六孔板,1×105/孔,使用10% FBS、100 g/L青-链霉素的DMEM培养基,置于37 ℃、5% CO2培养箱中培养。待细胞融合度达到60%~70%,根据lipofectamin2000转染说明,用Pac1酶切后的pAd-ESR1质粒转染HEK293细胞,置于培养箱中继续培养。观察细胞均产生绿色荧光,大部分变圆脱落,收集细胞,于-80 ℃和37 ℃反复冻融3次以上,收集病毒原液。将病毒重新感染HEK293细胞,重复以上实验步骤进行病毒扩增,将第三代病毒保存于-80 ℃冰箱,备用;将HEK293细胞以1× 104/孔接种于24孔板,待细胞融合度达到60%~70%时,将对数稀释的病毒液感染HEK293,每组设3个复孔,按照Kaneto等[15]介绍的GFP阳性细胞计数法计算病毒滴度;将C28I2细胞以1×106/孔接种于六孔板,待细胞融合度达到60%~70%时加入不同滴度的病毒,48 h后根据荧光确定最佳感染复数(MOI)。用合适MOI的Ad-ESR1感染C28I2细胞,同时设置NC和Ad-GFP对照组,48 h后检测ESR1的表达情况。
1.2.3 ESR1-siRNA的转染根据前期预实验结果将C28I2细胞按1×106/mL密度接种到六孔板中,置于37 ℃、5% CO2培养箱中培养12 h,待细胞密度达到50% ~70%时更换为DMEM培养基并准备转染稀释液;每孔加入4 μL lipofectamin2000,用50 μL DEME稀释,轻轻混匀后置于室温孵育5 min;取适量siRNA(转染浓度为50 nmol)用50 μL DEME稀释,轻轻混匀后置于室温孵育5 min;将稀释好的lipofectamin2000与稀释好的siRNA轻轻混合,室温静置20 min后缓缓加入细胞培养基中,轻轻摇晃孔板使之混合;将六孔板置于37 ℃、5% CO2培养箱中培养6~8 h后将培养基换为完全培养基。ESR1- siRNA由上海生工公司设计并合成。ESR1- si1RNA:正义5'-GGGCUCUACUUCAUCGC AUTT-3',反义5'-AUGCGAUGAAGUAGAGCCCTT- 3';ESR1- si2RNA:正义5'-GGAUUUGACCCUCCAU GAUTT- 3',反义5'-AUCAUGGAGGGUCAAAUCC TT-3';ESR1-si3RNA:正义5'-GGAGAAUGUUGAAA CACAATT- 3',反义5'-UUGUGUUUCAACAUUCUC CTT-3';阴性对照sicontrol:正义5'-UUCUCCGAACG UGUCACGUTT- 3',反义5'-ACGUGACACGUUCGG AGAATT-3'。
1.2.4 QPCR检测C28I2细胞ESR1、PCNA、CyclinB1和CyclinD1mRNA表达干预48 h后,按照QPCR试剂盒说明提取细胞总RNA。引物:ESR1:正义5'-CCAA CCAGTGCACCATTGAT-3',反义5'-TTTGATCATGA GCGGGCTTG-3';PCNA:正义5'-CCTGCTGGGATAT TAGCTCCA- 3',反义5'- CAGCGGTAGGTGTCGAA GC-3';CyclinB1:正义5'-TTGGGGACATTGGTAACA AAGTC- 3',反义5'-ATAGGCTCAGGCGAAAGTTT TT- 3';CyclinD1:正义5'-GCTGCGAAGTGGAAACC ATC-3',反义5'-CCTCCTTCTGCACACATTTGAA-3'; GAPDH:正义5'-AGGTCGGTGTGAACGGATTTG-3',反义5'-GGGGTCGTTGATGGCAACA-3'。使用GAPDH作为内参基因,使用2-ΔΔCt公式计算目的基因相对表达量。ΔΔCt=(Ct,目标-Ct,GAPDH)干预组(- Ct,目标-Ct,GAPDH)对照组。
1.2.5 蛋白提取以及Western blot检测各处理组细胞分别经PBS冲洗后,加入RIPA蛋白裂解液,用细胞刮缓缓刮下细胞并吹匀,收集至离心管中,放置于冰上使细胞充分裂解5 min,再4 ℃ 12 000×g下离心15 min。取上清液至于新的离心管中,加入SDS上样缓冲液,BCA试剂盒测定蛋白质浓度后,每孔取25 μg的蛋白置于12% SDS-PAGE胶上,电泳分离后的蛋白质经过100 V恒压1 h电转至硝酸纤维素膜上,5%脱脂牛奶封闭膜2 h;分别加入稀释好的一抗,4 ℃孵育过夜;洗膜后,加入相对应的辣根过氧化物酶标记的二抗(1:8000),室温反应2 h;洗膜3次后使用电化学发光试剂,于暗室中胶片曝光。
1.2.6 免疫荧光实验将处于对数生长期的C28I2细胞进行不同的处理组分组,固定并在室温下分别用4% PF和0.1% Triton X-100透化30 min。5% BSA孵育1h以阻断非特异性结合,加入一抗在4 ℃孵育过夜。本研究中使用的抗体为:抗LC3(1:200,CST,兔IgG)和抗LAMP1(1:1000,Novus,小鼠IgG),1×PBS洗3遍,每次5 min,将细胞用相应的抗IgG二抗(1:200,abbkine)在暗盒中染色1 h后洗3遍,再将细胞与DAPI温育15 min,用显微镜观察并拍照。
1.2.7 流式细胞术(FCM)检测处理后C28I2细胞凋亡和周期的影响将处于对数生长期的C28I2细胞进行不同的处理组分组,待病毒感染C28I2细胞48 h后收集细胞,送重庆医科大学生命科学院流式检测平台,检测每组细胞凋亡和周期的情况。
1.2.8 统计学分析实验数据均以均数±标准差表示,Graphpad prism5分析实验结果,统计分析采用单因素方差分析,P < 0.05表示差异具有统计学意义。
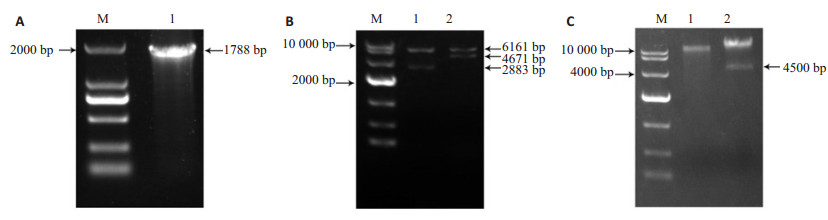
2 结果 2.1 重组腺病毒Ad-ESR1的制备 2.1.1 重组腺病毒pAd-ESR1质粒的构建从HEK293细胞cDNA中PCR得到1788 bp的ESR1基因片段(图 1A)。重组穿梭质粒pAdTrack- ESR1经EcoR Ⅰ和EcoRⅤ双酶切后,琼脂糖凝胶电泳得到分子量大约6000 bp载体片段和4600 bp左右小片段(图 1B),重组质粒送公司测序进一步证明该重组载体构建成功。然后将pAdTrack-ESR1重组载体和腺病毒骨架质粒pAdEasy经过电转重组,得到最终的包装质粒pAd-ESR1,Pac1酶切鉴定,与阴性对照pAd-Easy酶切相比,重组后还有一条约4500 bp的条带(图 1C)。
|
图 1 重组腺病毒pAd-ESR1质粒的鉴定 Fig.1 Identification of the recombinant adenovirus plasmid pAd-ESR1. A: PCR product of ESR1. M: DNA marker 2000; 1: cDNA fragment of ESR1. B: Double restrictionenzyme digestion of pAd-Track-ESR1. M: DNA marker 10 000; 1: pAd-TrackCMV; 2: pAd-Track-ESR1. C: Pac1 digestion identification of pAd-ESR1. M: DNA marker 10000; 1: pAd-Easy; 2: pAd-ESR1 |
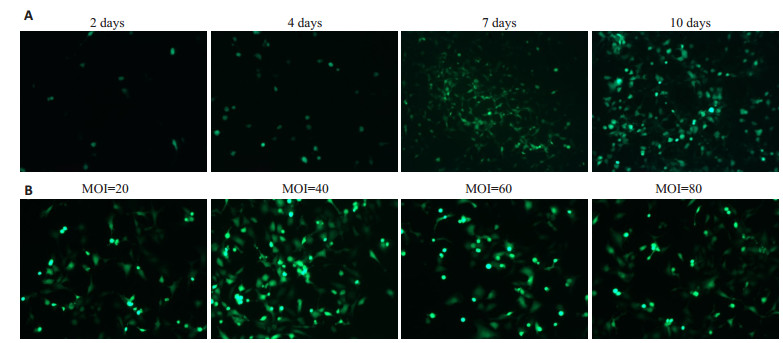
将Pac1线性化的pAd-ESR1通过lipofectamin2000转染入HEK293细胞中包装成功(图 2A)。产生绿色荧光的细胞随着时间的增加而增多,第7天出现彗星状腺病毒病灶,第10天细胞逐渐变圆脱落。测得Ad-ESR1的滴度为2×108 PFU/mL。将病毒分别以MOI为20,40,60,80,感染C28I2细胞,48 h后观察绿色荧光强度,图 2B显示当MOI为40时感染效果最好。
|
图 2 Ad-ESR1腺病毒包装及最佳MOI值测定 Fig.2 Adenoviral packaging of Ad-ESR1 (A) and determination of the optimal MOI value(B) (Original magnification: ×150) |
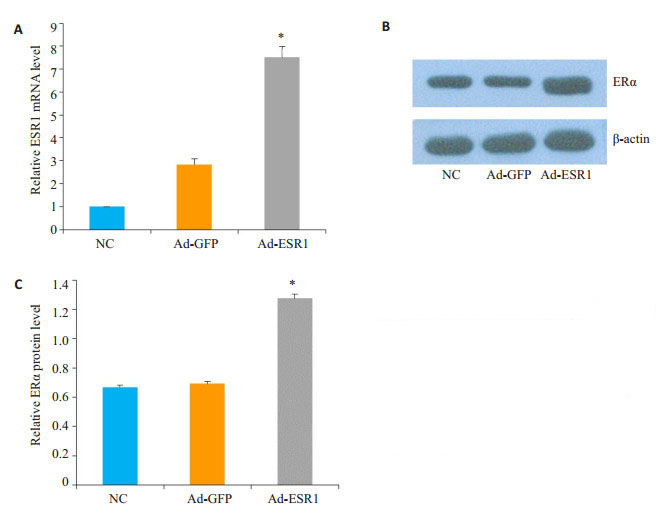
Ad-ESR1感染C28I2细胞48 h后,使用QPCR和Western blot对ESR1的mRNA及蛋白表达进行分析,发现感染Ad-ESR1后细胞ESR1表达水平较对照组明显增加(图 3)。
|
图 3 Ad-ESR1感染C28I2细胞的表达效率鉴定 Fig.3 Assessment of expression efficiency of ESR1 in C28I2 cells infected by Ad-ESR1. A: ESR1 mRNA detected by qPCR; B: Protein level of ERα detected by Western blotting; C: Quantification analysis of the protein level of ERα. *P < 0.05 vs Ad-ESR1 |
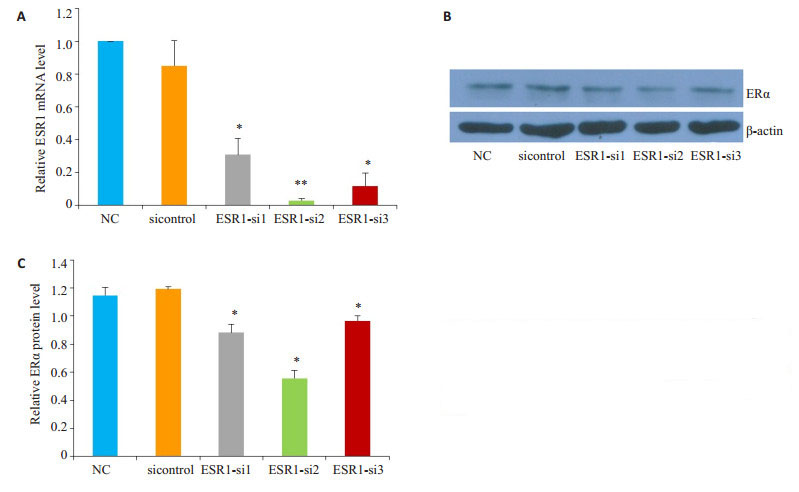
ESR1-siRNA转染C28I2细胞48 h后,QPCR和Western blot结果表明转染ESR1- siRNA后细胞中ESR1的mRNA及蛋白水平相对于sicontrol对照组明显降低(图 4)。
|
图 4 ESR1-siRNA转染C28I2细胞的表达效率鉴定 Fig.4 Identification of the ESR1 expression in C28I2 cells infected by ESR1-siRNA. A: ESR1 detected by qPCR; B: Protein level of ERαdetected by Western blotting; C: Quantification of the protein level of ERα. *P < 0.05, **P < 0.01 vs sicontrol |
分别用0、10-5、10-6、10-7、10-8、10-9mol/L的雌二醇(E2)处理C28I2细胞24 h,发现在E2的浓度为10-9 mol/L时能够明显抑制凋亡蛋白Cleaved caspase12的表达,同时ATG7的表达明显增加(图 5),因此选择10-9 mol/L为后续实验浓度。
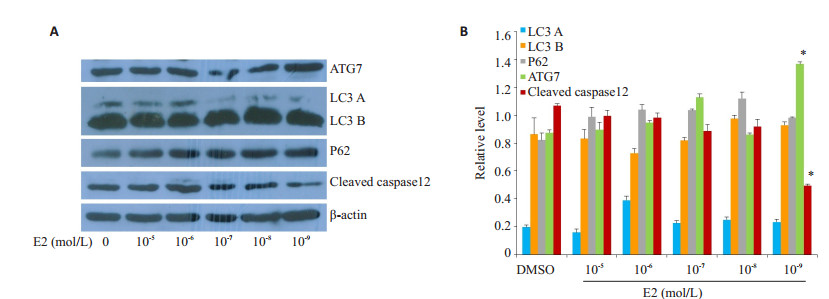
|
图 5 E2对C28I2细胞自噬及凋亡相关蛋白的影响 Fig.5 Effects of E2 on expression of autophagy- and apoptosis-related proteins in C28I2 cells. A: Protein levels detected by Western blotting; B: Quantification of the protein levels. *P < 0.05 vs DMSO |
将C28I2细胞进行DMSO、E2、E2+Ad-GFP、E2+ Ad-ESR1、E2+sicontrol、E2+ESR1-si2、E2+ESR1-si3分组处理48 h后,使用Western blot分析蛋白水平发现E2+Ad-ESR1处理相较于E2+Ad-GFP对照组能够明显的促进自噬相关蛋白ATG7、LC3的表达,且凋亡蛋白cleaved caspase12、cleaved caspase3的表达被抑制。而当转染ESR1-siRNA后,自噬减弱,凋亡增加(图 6)。
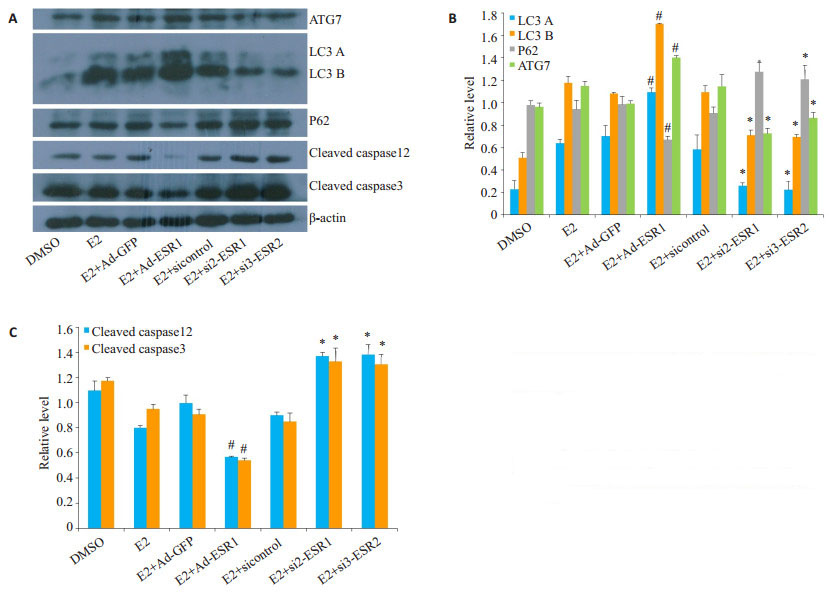
|
图 6 E2+Ad-ESR1、E2+ESR1-siRNA对C28I2细胞自噬及凋亡相关蛋白的影响 Fig.6 Effect of E2+Ad-ESR1 and E2+ESR1-siRNA on autophagy and apoptosis in C28I2 cells. A: Protein levels related with autophagy and apoptosis detected by Western blotting; B, C: Quantification of the protein levels of autophagy (B) and apoptosis (C). #P < 0.05 vs E2+Ad-GFP; *P < 0.05 vs E2+sicontrol |
根据与溶酶体膜蛋白LAMP1共定位LC3,与E2+ pcDNA3.1(-)处理相比,E2+pcDNA3.1(-)-ESR1可以显著增强自噬流,而转染ESR1-siRNA后自噬流强度减弱(图 7)。
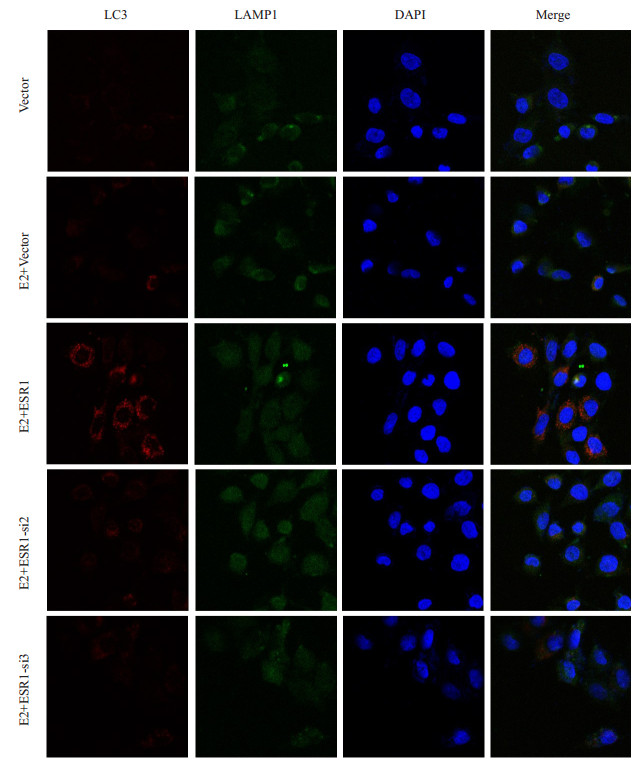
|
图 7 E2+pcDNA(-)-ESR1、E2+ESR1-siRNA对C28I2细胞内自噬流的影响 Fig.7 Effect of E2/pcDNA(-)-ESR1 and E2/ESR1-siRNA transfection on autophagic flow in C28I2 cells (×400) |
E2组和E2+Ad-GFP组凋亡低于DMSO组,实验组E2+Ad-ESR1凋亡率显著低于E2+Ad-GFP组。而E2+ESR1-si2和E2+ESR1-si3的凋亡率均高于E2+ sicontrol组(P < 0.05,图 8)。
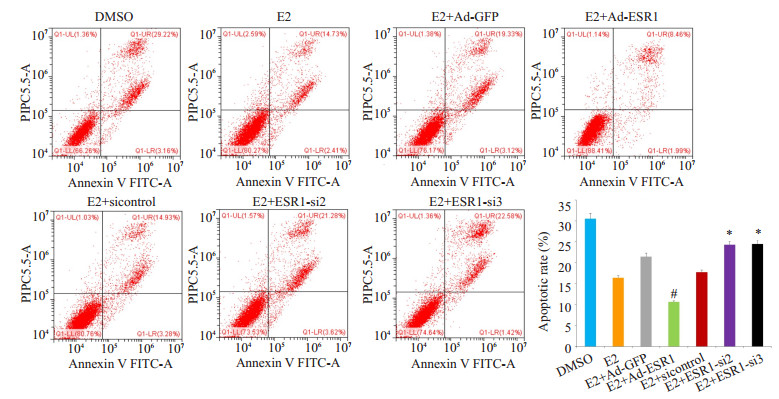
|
图 8 FCM检测各组C28I2细胞凋亡的结果 Fig.8 FCM analysis of apoptosis rate in C28I2 cells. #P < 0.05 vs E2+Ad-GFP; *P < 0.05 vs E2+sicontrol |
使用QPCR分析C28I2细胞内mRNA发现,E2+ AdESR1实验组周期相关Marker基因PCNA、CyclinB1、CyclinD1相较于E2+Ad-GFP对照组均明显增加,差异均有统计学意义(P < 0.05);与E2+sicontrol对照组相比,E2+ESR1-si2、E2+ESR1-si3实验组的PCNA mRNA水平减低(P < 0.05),而CyclinB1、CyclinD1相较于对照组则无明显统计学差异(图 9)。
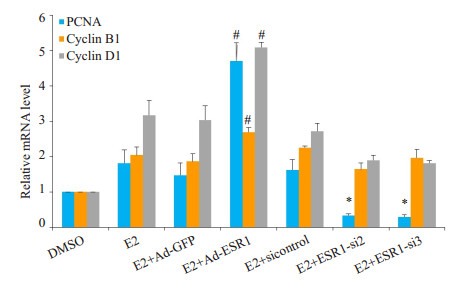
|
图 9 QPCR分析各组C28I2细胞周期相关基因的表达情况 Fig.9 qPCR analysis of mRNA expressions of cell cycle related marker genes in C28I2 cells infected by Ad-ESR1or ESR1-siRNA with E2 treatment, #P < 0.05 vs E2 +Ad-GFP; *P < 0.05 vs E2+sicontrol |
DMSO组、E2组、E2+Ad-GFP组和E2+sicontrol 4组之间细胞周期S期差异无统计学意义,而实验组E2+ Ad-ESR1细胞周期S期与对照组E2+Ad-GFP相比明显增加(P < 0.05),E2+ESR1-si2和E2+ESR1-si3组的细胞周期S期相较于对照组E2+sicontrol有所减少(P < 0.05,图 10)
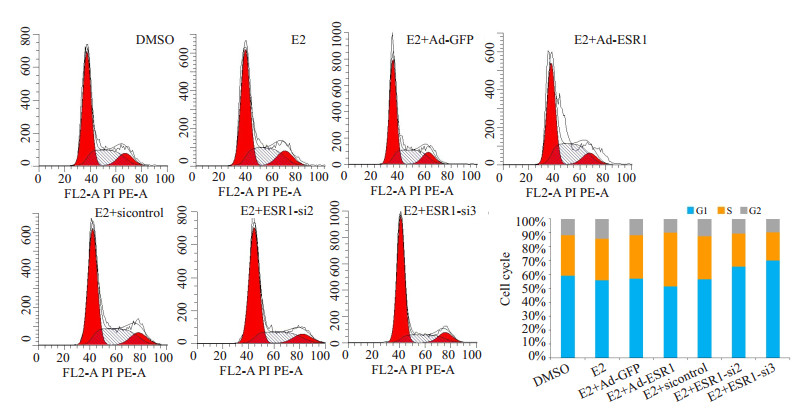
|
图 10 FCM检测在E2处理条件下Ad-ESR1以及ESR1-siRNA对C28I2细胞周期的影响 Fig.10 FCM analysis of cell cycle in C28I2 cells infected by Ad-ESR1or ESR1-siRNA with E2 treatment |
E2+Ad-ESR1处理组与对照组相比,细胞内pERK的相对表达水平明显下降(P < 0.05),而当ESR1表达被抑制,即E2+ESR1-siRNA处理后,pERK的相对表达水平有所增加,差异具有统计学意义(P < 0.05,图 11)。
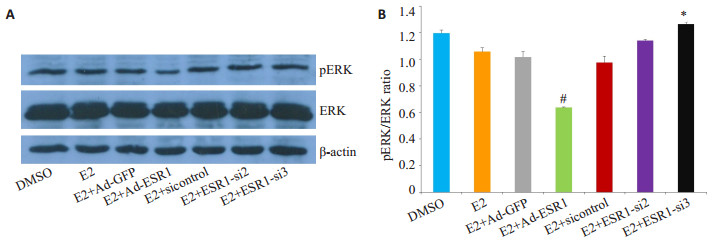
|
图 11 E2+Ad-ESR1、E2+ESR1-siRNA对C28I2细胞内ERK信号通路的影响 Fig.11 Effect of E2+Ad-ESR1, E2+ESR1-siRNA on ERK signaling pathway in C28I2 cells. A: protein level of pERK and ERK was detected by Western blotting; B: Quantification of the protein levels. #P < 0.05 vs E2+Ad-GFP; *P < 0.05 vs E2+sicontrol |
分别用5、10 μmol的特异性抑制剂U0126与E2、Ad-ESR1共同处理C28I2细胞。Western blot检测蛋白水平发现,U0126能够显著抑制E2与ESR1结合诱导的自噬,并且一定程度上促进凋亡蛋白表达。QPCR分析mRNA水平发现,阻断ERK信号通路后,C28I2细胞内PCNA、CyclinB1表达显著降低(图 12)。
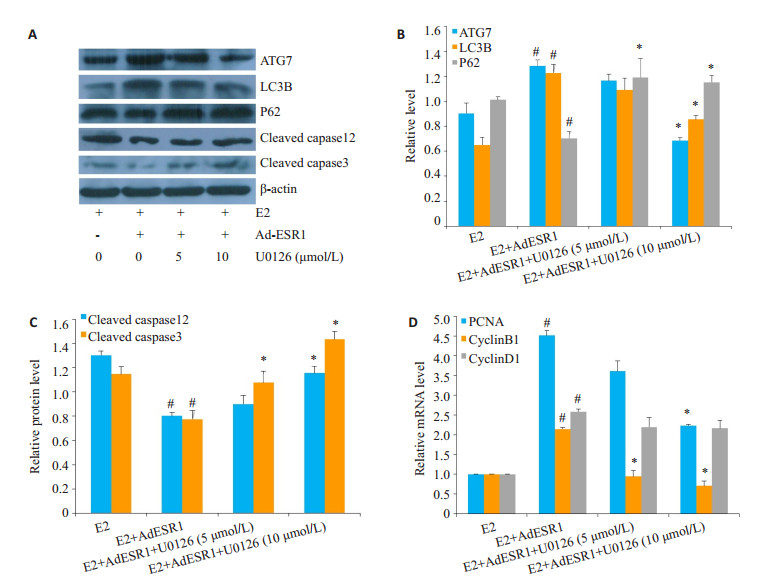
|
图 12 U0126处理对E2+Ad-ESR1诱导的C28I2细胞内自噬、凋亡、增殖的影响 Fig.12 Effect of U0126 on E2 +Ad-ESR1-induced autophagy, apoptosis, and proliferation in C28I2 cells. A: protein level of autophagy and apoptosis detected by Western blotting; B, C: Quantification of the protein levels of autophagy (B) and apoptosis (C); D: qPCR analysis of mRNA expressions of cell cycle-related marker genes in C28I2 cells. #P < 0.05 vs E2; *P < 0.05 vs E2+Ad-ESR1 |
软骨是人和脊椎动物特有的胚胎性骨骼,一种无血管略带弹性的坚韧组织。软骨由软骨细胞、纤维和软骨基质组成。软骨细胞通常存在于健康软骨中,通过产生和维持软骨基质在软骨内骨化和软骨修复中发挥核心作用[16]。软骨细胞骨化过程中软骨细胞的增殖对于细胞外基质的分泌是极其重要的,是骨生长的重要条件之一[17]。研究表明软骨细胞凋亡失调导致骨关节炎(OA)的发生,发生病变的软骨细胞将引起关节软骨退化,由于关节软骨再生能力差,损伤后的关节软骨难以自行修复,最终导致残疾,严重影响人们的正常生活。因此,研究软骨细胞增殖、凋亡的调控机制对软骨功能和软骨修复具有重要意义[18-19]。
Bonnelye等[20]通过IHC发现在体外培养的大鼠软骨细胞中ESR1可诱导早期胚胎发育基因的表达增加,促进软骨细胞增殖从而促进软骨发育。雌激素通过靶向软骨细胞内雌激素受体,能够改变相关酶活性如丝裂原活化蛋白激酶(MAPK)发挥生物学功能。ERK信号作为MAPK信号通路中一员,参与调控细胞凋亡与增殖等过程发挥重要作用。Prasadam等[21]在体外培养的软骨细胞中联合使用ERK抑制剂(U0126)和透明质酸,ERK的磷酸化水平明显降低,同时产生的基质金属蛋白酶MMP-12和RUNX2的数量也大大减少,这可以促进软骨细胞的增殖,推迟软骨细胞肥大化及软骨退化。本研究发现,Ad-ESR1处理后C28I2软骨细胞中ERK磷酸化水平明显抑制,流式细胞术及QPCR结果均表明C28I2细胞凋亡减少,增殖增加;采用特异性抑制剂U0126阻断ERK信号途径活化后,检测显示E2靶向ESR1诱导的自噬被抑制,凋亡蛋白表达上调,细胞增殖显著降低。结果表明,E2靶向活化ESR1调控细胞增殖、自噬与凋亡这一生物学功能依赖于ERK信号途径。
近年来研究发现,ERK信号通路也是自噬的重要调节途径。自噬作为细胞内稳态的主要分解代谢途径,可以清除病原体和细胞内堆积的有害蛋白,通过吞噬细胞质组分并随后与溶酶体融合来降解它们,其在降解和回收长寿命蛋白质和细胞器中作用显著[22-23]。本实验结果发现,E2与Ad-ESR1共同处理C28I2细胞后,自噬相关蛋白LC3B和ATG7表达明显增加,LC3B的表达水平与胞内自噬流形成呈正相关[24-29]。荧光共定位结果进一步证明E2和ESR1共同处理后,促进位于自噬小泡膜表面的LC3与溶酶体的融合,促进自噬性溶酶体的形成。自噬是一种细胞内保护性机制,可以保护蛋白质和细胞器功能的正常执行,保护细胞免受各类应激因素的影响,维持细胞正常的新陈代谢[30]。我们研究发现软骨细胞中雌二醇E2靶向和活化ESR1,通过抑制ERK磷酸化激活,抑制ERK信号通路,促进自噬流的形成,激活自噬,减少凋亡,进而引起软骨细胞的增殖。但由于细胞内自噬的复杂调控机制,该效应具体通过何种自噬及分子发挥作用将会是我们后续研究的重点。
本研究在正常人软骨细胞C28I2中发现,E2能够靶向结合ESR1通过抑制ERK信号通路的磷酸化诱导自噬和凋亡,多靶点调控细胞增殖。综上,整个实验中,我们发现在E2处理下,ESR1活化能够抑制ERK的磷酸化,进一步促进自噬、抑制凋亡,从而促进细胞增殖。为后续研究ESR1的生物学功能、探讨自噬与软骨相关疾病的作用机制奠定了基础。
| [1] |
Anthony S, Munk R, Skakun W, et al. Multiple epiphyseal dysplasia[J].
J Am Acad Orthop Surg, 2015, 23(3): 164-72.
DOI: 10.5435/JAAOS-D-13-00173. |
| [2] |
Cohen J. Biology of RUNX2 and cleidocranial dysplasia[J].
J Craniofac Surg, 2013, 24(1): 130-3.
DOI: 10.1097/SCS.0b013e3182636b7e. |
| [3] |
Tsang KY, Tsang SW, Chan D, et al. The chondrocytic journey in endochondral bone growth and skeletal dysplasia[J].
Birth Defects Res C Embryo Today, 2014, 102(1): 52-73.
DOI: 10.1002/bdrc.21060. |
| [4] |
Wuelling M, Vortkamp A. Chondrocyte proliferation and differentiation[J].
Endocr Dev, 2011, 21(21): 1-11.
|
| [5] |
Zhu L, Skoultchi AI. Coordinating cell proliferation and differentiation[J].
Curr Opin Genet Dev, 2001, 11(1): 91-7.
DOI: 10.1016/S0959-437X(00)00162-3. |
| [6] |
Fan DX, Yang XH, Li YN, et al. 17 beta-Estradiol on the expression of G-Protein coupled estrogen receptor (GPER/GPR30) mitophagy, and the PI3K/Akt signaling pathway in ATDC5 chondrocytes in vitro[J].
Med Sci Monit, 2018, 24: 1936-47.
DOI: 10.12659/MSM.909365. |
| [7] |
Liang YJ, Duan L, Xiong JY, et al. E2 regulates MMP-13 via targeting miR-140 in IL-1 beta-induced extracellular matrix degradation in human chondrocytes[J].
Arthritis Res Ther, 2016, 18(1): 105.
DOI: 10.1186/s13075-016-0997-y. |
| [8] |
Tao YL, Sun HB, Sun HY, et al. 17 beta-estradiol activates mTOR in chondrocytes by AKT-dependent and AKT-independent signaling pathways[J].
Int J Clin Exp Pathol, 2015, 8(12): 15911-8.
|
| [9] |
Dall GV, Britt KL. Estrogen effects on the mammary gland in early and late Life and breast cancer risk[J].
Front Oncol, 2017, 7: 110.
DOI: 10.3389/fonc.2017.00110. |
| [10] |
Hilborn E, Stal O, Jansson A. Estrogen and androgen-converting enzymes 17β-hydroxysteroid dehydrogenase and their involvement in cancer: with a special focus on 17β-hydroxysteroid dehydrogenase type 1. 2, and breast cancer[J].
Oncotarget, 2017, 8(18): 30552-62.
|
| [11] |
Lu CL, Herndon C. New roles for neuronal estrogen receptors[J].
Neurogastroenterol Motil, 2017, 29(7): e13121.
DOI: 10.1111/nmo.2017.29.issue-7. |
| [12] |
Yang X, Guo YJ, He JL, et al. Estrogen and estrogen receptors in the modulation of gastrointestinal epithelial secretion[J].
Oncotarget, 2017, 8(57): 97683-92.
|
| [13] |
Chaudhri RA, Schwartz N, Elbaradie KA, et al. Role of ER alpha 36 in membrane-associated signaling by estrogen[J].
Steroids, 2014, 81(SI): 74-80.
|
| [14] |
Yin L, Zhang XT, Bian XW, et al. Disruption of the ER-alpha 36- EGFR/HER2 Positive Regulatory Loops Restores Tamoxifen Sensitivity in Tamoxifen Resistance Breast Cancer Cells[J].
PLoS One, 2014, 9(9): e107369.
DOI: 10.1371/journal.pone.0107369. |
| [15] |
Kaneto H, Xu G, Song KH, et al. Activation of the hexosamine pathway leads to deterioration of p ancreatic beta-cell function through the induction of oxidative stress[J].
J Biol Chem, 2001, 276(33): 31099.
DOI: 10.1074/jbc.M104115200. |
| [16] |
Kronenberg HM. Developmental regulation of the growth plate[J].
Nature, 2003, 423(6937): 332-6.
DOI: 10.1038/nature01657. |
| [17] |
Mackie EJ, Ahmed YA, Tatarczuch L, et al. Endochondral ossification: How cartilage is converted into bone in the developing skeleton[J].
Int J Biochem Cell Biol, 2008, 40(1): 46-62.
DOI: 10.1016/j.biocel.2007.06.009. |
| [18] |
Duan L, Liang YJ, Ma B, et al. Epigenetic regulation in chondrocyte phenotype maintenance for cell-based cartilage repair[J].
Am J Transl Res, 2015, 7(11): 2127-40.
|
| [19] |
Hwang HS, Kim HA. Chondrocyte apoptosis in the pathogenesis of osteoarthritis[J].
Int J Mol Sci, 2015, 16(11): 26035-54.
DOI: 10.3390/ijms161125943. |
| [20] |
Bonnelye E, Zirngibl RA, Jurdic P, et al. The orphan nuclear estrogen receptor-related receptor-alpha regulates cartilage formation in vitro: Implication of Sox9[J].
Endocrinology, 2007, 148(3): 1195-205.
DOI: 10.1210/en.2006-0962. |
| [21] |
Prasadam I, Mao XZ, Shi W, et al. Combination of MEK-ERK inhibitor and hyaluronic acid has a synergistic effect on antihypertrophic and pro-chondrogenic activities in osteoarthritis treatment[J].
J Mol Med, 2013, 91(3): 369-80.
DOI: 10.1007/s00109-012-0953-5. |
| [22] |
Sonali, Joshi, Leonidas, et al. Mnk kinase pathway: Cellular functions and biological outcomes[J].
World J Biol Chem, 2014, 5(3): 321-33.
DOI: 10.4331/wjbc.v5.i3.321. |
| [23] |
Długońska H. Autophagy as a Universal intracellular process. A comment on the 2016 nobel prize in physiology or medicine[J].
Ann Parasitol, 2017, 63(3): 153-7.
|
| [24] |
Huang R, Xu Y, Wan W, et al. Deacetylation of nuclear LC3 drives autophagy initiation under starvation[J].
Mol Cell, 2015, 57(3): 456-66.
DOI: 10.1016/j.molcel.2014.12.013. |
| [25] |
Wu B, Yu L, Wang YS, et al. Aldehyde dehydrogenase 2 activation in aged heart improves the autophagy by reducing the carbonyl modification on SIRT1[J].
Oncotarget, 2016, 7(3): 2175-88.
|
| [26] |
Zheng S, Han F, Shi YX, et al. Single-Prolonged-Stress-Induced changes in Autophagy-Related proteins beclin-1, LC3, and p62 in the medial prefrontal cortex of rats with post-traumatic stress disorder[J].
J Mol Neurosci, 2017, 62(1): 43-54.
|
| [27] |
Berezowska S, Galván JA. Immunohistochemical detection of the autophagy markers LC3 and p62/SQSTM1 in formalin-fixed and paraffin-embedded tissue[J].
Methods Mol Biol, 2017, 1560: 189-94.
DOI: 10.1007/978-1-4939-6788-9. |
| [28] |
Tanida I, Ueno T, Kominami E. LC3 conjugation system in mammalian autophagy[J].
Int J Biochem Cell Biol, 2004, 36(12): 2503-18.
DOI: 10.1016/j.biocel.2004.05.009. |
| [29] |
Sil P, Muse G, Martinez J. A ravenous defense: canonical and noncanonical autophagy in immunity[J].
Curr Opin Immunol, 2018, 50(1): 21-31.
|
| [30] |
Choi AK, Ryter SW, Levine B. Autophagy in human health and disease[J].
N Engl J Med, 2013, 368(7): 651-62.
DOI: 10.1056/NEJMra1205406. |
 2019, Vol. 39
2019, Vol. 39

