2. 联勤保障部队第九四 O医院泌尿外科,甘肃 兰州 730050;
3. 空军军医大学基础医学院学员四大队,陕西 西安 710032
2. Department of Urology, The 940th Hospital of Joint Logistics Support Force of Chinese People's Liberation Army, Lanzhou 730050, China;
3. Fourth Group of Students, College of Basic Medical Sciences, Fourth Military Medical University, Xi'an 710032, China
随着泌尿系腔道微创治疗的进展,尿源性脓毒血症已成为泌尿外科较为常见的危急重症,该类疾病起病急骤、进展迅速、病情凶险,部分患者院前就已经出现全身炎症反应综合征(SIRS),若得不到及时的治疗,会进一步发展为脓毒性休克,甚至多器官功能障碍,病情会迅速失控、恶化、死亡[1-2];因此,早期诊治极为关键。近年来,对脓毒症的早期诊断的标志物的相关研究中,降钙素原、中性粒细胞百分比、血小板等炎性指标在尿源性脓毒血症的诊断及判断严重程度方面具有明确的临床诊断价值[3-4],而脓毒血症严重程度的相关因素的研究报道中多个炎性标志物联合研究结果不一,需要进一步研究探索;针对我院2013.1~2018.4收治尿源性脓毒血症的患者中的炎性指标,进行回顾性研究,对脓毒血症严重程度的相关因素采用单因素分析、事后比较及有序logistic回归等统计方法分析哪些炎性指标与尿源性脓毒血症患者的病情严重程度相关,为脓毒血症早期诊断治疗提供客观依据。
1 资料和方法 1.1 研究对象回顾2013年1月~2018年4月于本院收治的脓毒血症患者的临床资料。入选标准:符合感染性休克和脓毒血症的临床诊断标准(p428-429)[5]且病例资料完整。排除标准:(1)年龄 < 18岁;(2)孕妇或哺乳期妇女;(3)基础疾病为血液系统疾病;(4)免疫系统疾病或者应用免疫调节治疗者;(5)肺癌或其他部位肿瘤患者。剔除标准:(1)住院时间 < 24 h;(2)临床资料不完整;(3)放弃治疗者。本研究符合医学伦理学标准,并经医院伦理委员会批准实施,所有治疗和检查均获得过患者或家属的知情同意。根据以上标准共筛选病例70例。
1.2 病例分组根据2014版中国泌尿外科疾病诊断治疗指南的感染性休克和脓毒血症的临床诊断标准(p428-429)[5]将所有入选的患者进行分组:A组(脓毒症组)22例;B组(低血压+严重脓毒血症组)12例;C组(感染性休克组)17例;D组(难治性感染性休克组)19例。
1.3 研究方法本研究为回顾性研究,所有入选患者在入院24 h内根据标准操作规程抽血,收集患者的白细胞、中性粒细胞百分比、血小板、纤维蛋白原、D-二聚体、白细胞介素- 6、C-反应蛋白、降钙素原等结果;根据患者入院24 h内情况进行序贯器官衰竭评分(SOFA);应用德国BRAHMS全自动免疫分析仪检测降钙素原,应用IMMAGE免疫分析仪(速率散射比浊法)检测C-反应蛋白;若同一患者在1周内重复送检,只记录首次24 h内外周血检测结果及血培养结果,根据2014版感染性休克和脓毒血症的临床诊断标准分组后,比较患者的白细胞、中性粒细胞百分比、血小板、纤维蛋白原、D-二聚体、白细胞介素-6、C-反应蛋白、降钙素原的差异,并进行logistic回归分析炎性指标与脓毒血症的相关性,评价炎性指标对病情严重程度的相关影响。
1.4 使用SPSS 22.0软件处理数据计量资料先行正态检验,符合正态分布者以均数±标准差表示,两组间比较采用t检验,方差齐者多组间比较采用单因素方差分析,不符合正态分布者以中位数(四分位数间距)[M(QR)]表示,两组间比较用MannWhitney U检验,多组间比较用Kruskal-Wallis H检验,计数资料采用χ2检验,对于P < 0.05的因素再行有序Logistic回归分析,评估对脓毒症严重程度的相关价值,P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况本研究纳入70例患者,年龄62.05±18.04岁。男性33例占47.1%,女性37例占52.9%。根据2014版中国泌尿系疾病诊治指南感染性休克和脓毒血症的临床诊断标准(p428-429)[5]分为A脓毒症组,B低血压+严重脓毒血症组,C感染性休克组,D难治性感染性休克组。患者的一般情况及分组如表 1。
| 表 1 一般情况及分组 Tab.1 Characteristics of the patients |
采用偏度及峰度对炎性指标进行正态性检测,纤维蛋白原、C反应蛋白服从正态分布,而白细胞、中性粒细胞百分比、血小板、D-二聚体、白细胞介素-6、降钙素原呈非正态分布(表 2)。
| 表 2 脓毒血症的炎性指标正态性检验表 Tab.2 Inflammatory indicators of inflammatory normality test table |
中性粒细胞百分比、血小板、D-二聚体、降钙素原的Kruskal-Wallis检验P值< 0.05,差异有统计学意义;纤维蛋白原、C反应蛋白方差分析后提示P>0.05,差异无统计学意义(表 3)。
| 表 3 脓毒血症的炎性指标的单因素分析 Tab.3 Univariate analysis of inflammatory markers in the patients with sepsis |
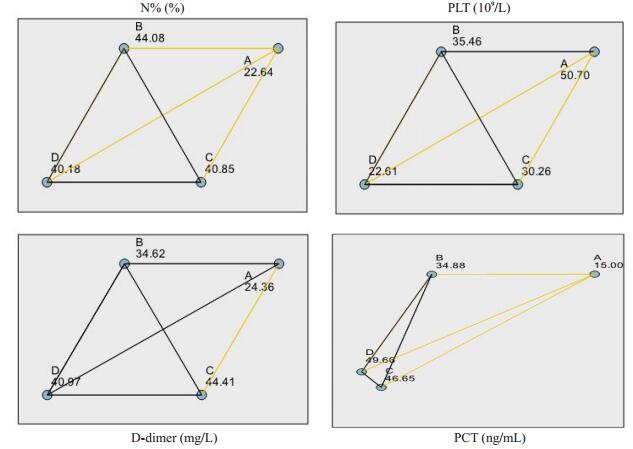
对有显著性差异的不同脓毒血症组别的炎性指标进行事后两两比较可见中性粒细胞百分比在脓毒症组与低血压+严重脓毒血症组、脓毒症组与感染性休克组、脓毒症组与难治性感染性休克组之间存在显著差异;血小板在脓毒症组与感染性休克组、脓毒症组与难治性感染性休克组之间存在显著差异;D-二聚体在脓毒症组与感染性休克组之间存在显著差异;降钙素原在脓毒症组与低血压+严重脓毒血症组、脓毒症组与感染性休克组、脓毒症组与难治性感染性休克组之间存在显著差异(表 4,图 1)。
| 表 4 不同脓毒血症组别的炎性指标的事后比较 Tab.4 Pairwise comparisons of inflammatory markers in different sepsis groups (P value) |
|
图 1 不同脓毒血症组别的炎性指标的事后比较图 Fig.1 Pairwise comparisons of inflammatory markers in different sepsis groups. A: Sepsis group; B: Hypotension+severe sepsis group; C: Septic shock group; D: Critically septic shock group. |
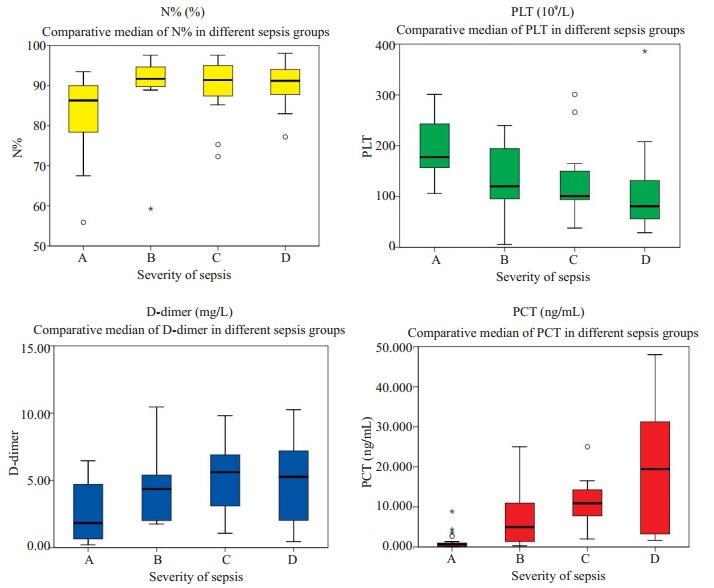
对有显著差异的不同脓毒血症组别的炎性指标的中位数(四分位距)[M(QR)]分析:血小板数量随脓毒血症严重程度加重而减少;降钙素原随脓毒血症严重程度升高而上升;而中性粒细胞百分比及D-二聚体在脓毒血症各组别上的中位数也随脓毒血症严重程度升高而上升(表 5,图 2)。
| 表 5 不同脓毒血症组别的炎性指标的中位数(四分位数间距)比较 Tab.5 Comparison of the median (interquartile range) levels of inflammatory markers among different sepsis groups [M(QR)] |
|
图 2 不同脓毒血症组别的炎性指标的中位数比较图 Fig.2 Comparison of median levels of inflammatory markers among the 4 sepsis groups. A: Sepsis group; B: Hypotension+severe sepsis group; C: Septic shock group; D: Critically septic shock group. |
模型拟合信息(P < 0.05),平行线检验P=0.208,P> 0.05;降钙素原的P值为0.000,回归系数为0.186;中性粒细胞百分比的P值为0.035,回归系数为0.047;血小板的P值为0.003,回归系数为-0.012,差异有统计学意义;而白细胞、纤维蛋白原、D-二聚体、白细胞介素-6、C反应蛋白炎性指标的P>0.05,差异无统计学意义(表 6)。
| 表 6 脓毒血症相关因素的有序Logistic回归分析 Tab.6 Ordered logistic regression analysis of factors related with sepsis |
脓毒血症被认为是一个复杂的、多阶段的、动态的综合征症状;其发病机制涉及复杂的全身炎症网络效应、免疫功能障碍、凝血功能异常、基因多态性、组织损伤及宿主对感染的反应等多个方面[6-7];脓毒症-3.0对其认识达到新的高度,取得的大量进展,但机制仍然未明确,脓毒症严重程度的判断需联合血中多个炎性因子动态监测,尤其是早期监测对把握尿源性脓毒血症的严重程度有重要的临床应用价值[8],为及时诊断及治疗提供客观依据。
降钙素原是相对分子量约为13×103的糖蛋白,由116个氨基酸组成,其编码基因位于11号染色体的降钙素基因-Ⅰ(CALC-Ⅰ)上;机体在正常情况下,血清降钙素原水平极低(< 0.1 ng/mL),但在脓毒血症患者体内,在炎症因子诱导下,全身组织器官如肝、肾、脂肪组织和肌肉组织将产生大量的降钙素原并释放入血,导致血清降钙素原水平大幅度升高且与病情变化呈正相关[2, 9-10]。血清降钙素原用于诊断全身细菌感染具有高度的敏感度和特异度,且优于白细胞、C反应蛋白、白细胞介素-6等指标[11-12]。另有研究提示[13-14]:动态血清降钙素原监测值与病情程度变化趋势相关,血清降钙素原水平随病情的加重而升高,血清降钙素原水平随病情的好转而降低。保勇等[15]研究认为,严重脓毒症组血清降钙素原水平早期即明显升高,且显著高于非脓毒症组,降钙素原对脓毒症的诊断敏感度为86.7%,特异度为81.8%。尹承芬等[16]Meta分析脓毒症、严重脓毒症和脓毒性休克患者的相关研究的结果显示,降钙素原诊断成人脓毒症的受试者工作特征曲线下面积(AUC)为0.83(95%CI=0.79~0.87),表明降钙素原对脓毒症具有中等诊断价值。
本研究中,降钙素原的不同脓毒症组别进行Kruskal-Wallis检验并事后比较显示:脓毒症组与低血压+严重脓毒血症组的显著性P值为0.039,脓毒症组与感染性休克组的显著性P值为0.000,脓毒症组与难治性感染性休克组的显著性P值为0.000,表明降钙素原在脓毒症组与其他不同脓毒症组别间存在显著差异;其中位数(四分位距)分别为:0.64(0.9)、4.96(10.16)、10.9(7.24)、19.41(34.59),提示降钙素原水平与脓毒血症病情严重程度变化趋势一致,降钙素原值越高,尿源性脓毒血症越严重;有序logistic回归降钙素原的P值为0.000,回归系数为0.186,表明降钙素原与尿源性脓毒血症呈正相关;降钙素原可用于评估严重程度和病情变化,与国内外研究一致[17]。血清降钙素原变化水平与脓毒血症严重程度分级及病情发展趋势密切相关,可用于脓毒血症患者的病情监测,指导抗生素的使用和评价治疗效果[18]。降钙素原可以作为脓毒血症严重程度分级的生物学标志物[19]。
血小板减少在脓毒血症中被认为是一个非常重要的、与其发病率和死亡率相关的指标;多项研究显示,在ICU病人中血小板减少与多器官功能衰竭及死亡率之间存在密切的关系;在这些患者中,血小板减少提示存在严重的脓毒症且预后较差[20-21]。本研究中,血小板的不同组别进行Kruskal-Wallis检验并事后比较显示:脓毒症组与感染性休克组的显著性P值为0.011,脓毒症组与难治性感染性休克组的显著性P值为0.000,表明血小板在脓毒症组与其他不同脓毒症组别间存在显著差异;其中位数(四分位距)分别为:177.5(90)、120(108)、101(64)、81(97),表明脓毒血症患者体内的血小板的数量变化与脓毒血症严重程度具有密切的关系,患者的病情越重,血小板的数量下降越快,提示患者的脏器功能受到的损害越严重。脓毒症有序logistic回归血小板的P值为0.003,回归系数为-0.012,表明了血小板与尿源性脓毒血症的严重程度呈负相关;血小板可用于评估病情的严重程度;血小板的数值越低,脓毒症的严重程度越重,血小板与脓毒血症病情严重程度变化趋势呈反比,我们的研究结果与多数学者的研究结果一致。因此,脓毒血症患者外周血中血小板计数变化,反应病情严重程度,可以作为预判病情严重程度的参考指标。
中性粒细胞百分比是指血液中中性粒细胞所占的百分比,其外周血杆状核和未成熟粒细胞比例的升高可以作为细菌感染的指征,中性粒细胞是防御微生物病原体入侵的第一道防线,中性粒细胞具有良好的吞噬、灭菌、免疫功能[22]。本研究中,中性粒细胞百分比进行Kruskal-Wallis检验并事后比较显示:脓毒症组与低血压+严重脓毒血症组的显著性P值0.020,脓毒症组与感染性休克组的显著性P值为0.033,脓毒症组与难治性感染性休克组的显著性P值为0.035,表明中性粒细胞百分比在脓毒症组与其他不同脓毒症组别间存在显著差异;其中位数(四分位距)分别为:86.3(12.02)、91.7(5.34)、91.4(8.9)、91.2(6.5),随着中性粒细胞百分比的升高,脓毒血症严重程度逐渐加重,中性粒细胞百分比增加与脓毒血症严重程度分级及病情发展趋势密切相关;其有序logistic回归中性粒细胞百分比的P值为0.035,回归系数为0.047,表明了中性粒细胞百分比与尿源性脓毒血症的严重程度正相关;中性粒细胞百分比可用于危重患者的病情监测,指导脓毒血症的治疗。
在本研究中,降钙素原、血小板及中性粒细胞百分比在脓毒血症不同组别对比存在显著差异,特别是脓毒症组与低血压+严重脓毒血症组、感染性休克组、难治性感染性休克组的差异显著高于后者各组之间的差异,这可能是临床中脓毒血症强调6 h内治疗是最重要的治疗措施的理论依据,脓毒症组可能在6 h内开始触发加速器官功能紊乱;而低血压+严重脓毒血症组、感染性休克组、难治性感染性休克组出现了多个器官及其功能衰竭可能已经超过6 h,其变化趋势也相对变缓,本研究中降钙素原及中性粒细胞百分比变化趋势也相应变小;这可能表明6 h内的脓毒血症病情变化趋势大于6 h后的变化趋势;因此,早期诊断、早期干预是决定尿脓毒血症的预后的关键,脓毒血症的治疗指南也强调6 h内血流动力学的支持是抗休克治疗中最重要的措施,低血压出现的6 h内,每延迟1 h,患者生存率降低8% [23-24],这可能与本研究的多炎性指标的变化趋势显著有关。
综上,降钙素原血清波动水平与尿源性脓毒血症病情严重程度呈正相关,血中降钙素原水平越高,脓毒症患者病情越重;血小板与尿源性脓毒血症的波动呈负相关,血小板随脓毒血症严重程度的加重而减低;中性粒细胞百分比也随脓毒血症严重程度的加重而变化,联合检测更有助于病情严重程度判断,为临床早期病情判断及治疗提供临床指导[25-27]。
本研究存在不足:样本量偏小,可能会影响到炎性指标反应尿源性脓毒血症严重程度变化的真实水平。本研究结果需多中心、大样本临床资料进一步验证。
| [1] |
Auriti C, Fiscarelli E, Ronchetti MP, et al. Procalcitonin in detecting neonatal nosocomial sepsis[J].
Arch Dis Child Fetal Neonatal Ed, 2012, 97(5): F368-70.
|
| [2] |
Kaukonen KM, Bailey M, Pilcher D, et al. The systemic inflammatory response syndrome criteria and their differential association with mortality[J].
J Crit Care, 2018, 46: 29-36.
|
| [3] |
Zhao R, Dong S. Clinical value of serum endocan and procalcitonin in early diagnosis and prognosis evaluation of sepsis[J].
Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2017, 29(4): 321.
|
| [4] |
Keshary A, Badgett RG. Reassessment of a meta-analysis of procalcitonin-guided antibiotic therapy for lower respiratory tract infections[J].
Lancet Infect Dis, 2018, 18(2): 140.
DOI: 10.1016/S1473-3099(18)30014-8. |
| [5] |
陈山, 魏金星, 陈斌, 等.
泌尿系感染诊断治疗指南[M]. 北京: 人民卫生出版社, 2013: 424-34.
|
| [6] |
Uzzan B, Cohen R, Nicolas P, et al. Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma: a systematic review and meta-analysis[J].
Crit Care Med, 2006, 34(7): 1996-2003.
|
| [7] |
Becker KL, Snider R, Nylen ES. Procalcitonin assay in systemic inflammation, infection, and sepsis: clinical utility and limitations[J].
Crit Care Med, 2008, 36(3): 941-52.
DOI: 10.1097/CCM.0B013E318165BABB. |
| [8] |
Napolitano LM. Sepsis 2018: definitions and guideline changes[J].
Surg Infect (Larchmt), 2018, 19(2): 117-25.
|
| [9] |
Giamarellos-Bourboulis EJ, Mega A, Grecka P, et al. Procalcitonin: a marker to clearly differentiate systemic inflammatory response syndrome and sepsis in the critically ill patient[J].
Intensive Care Med, 2002, 28(9): 1351-6.
|
| [10] |
Meisner M, Tschaikowsky K, Palmaers T, et al. Comparison of procalcitonin (PCT) and C-reactive protein (CRP) plasma concentrations at different SOFA scores during the course of sepsis and MODS[J].
Crit Care, 1999, 3(1): 45-50.
DOI: 10.1186/cc306. |
| [11] |
Lin KH, Wang FL, Wu MS, et al. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection in patients with liver cirrhosis: a systematic review and meta-analysis[J].
Diagn Microbiol Infect Dis, 2014, 80(1): 72-8.
|
| [12] |
Ghorbani G. Procalcitonin role in differential diagnosis of infection stages and non infection inflammation[J].
Pak J Biol Sci, 2009, 12(4): 393-6.
|
| [13] |
赵磊, 臧学峰, 陈炜. 血中炎性指标水平与细菌性血流感染所致脓毒症患者病情严重程度的相关性分析[J].
中华危重病急救医学, 2015, 27(6): 448-53.
DOI: 10.3760/cma.j.issn.2095-4352.2015.06.007. |
| [14] |
刘阳桦, 吴敏. 细菌性血流感染所致脓毒症患者凝血-炎症生物标志物水平变化的临床意义[J].
中国病原生物学杂志, 2017, 12(3): 270-3.
|
| [15] |
保勇, 史梦, 喻华, 等. 检测血清降钙素原对感染性疾病及脓毒症的诊断价值[J].
实用医院临床杂志, 2012, 9(1): 94-6.
DOI: 10.3969/j.issn.1672-6170.2012.01.032. |
| [16] |
尹承芬, 李彤, 高心晶, 等. 降钙素原对成人脓毒症诊断准确性的Meta分析[J].
中华危重病急救医学, 2015, 27(9): 743-9.
DOI: 10.3760/cma.j.issn.2095-4352.2015.09.009. |
| [17] |
Schroeder S, Hochreiter M, Koehler T, et al. Procalcitonin (PCT)- guided algorithm reduces length of antibiotic treatment in surgical intensive care patients with severe sepsis: results of a prospective randomized study[J].
Langenbeck Arch Surg, 2009, 394(2): 221-6.
|
| [18] |
Liew YX, Chlebicki MP, Lee W, et al. Use of procalcitonin (PCT) to guide discontinuation of antibiotic use in an unspecified sepsis is an antimicrobial stewardship program (ASP)[J].
Eur J Clin Microbiol Infect Dis, 2011, 30(7): 853-5.
|
| [19] |
Schultz MJ, Determann RM. PCT and sTREM-1: the markers of infection in critically ill patients[J].
Med Sci Monit, 2008, 14(12): RA241-7.
|
| [20] |
Li M F, Li X L, Fan K L, et al. Platelet desialylation is a novel mechanism and a therapeutic target in thrombocytopenia during sepsis: an open- label, multicenter, randomized controlled trial[J].
Journal of Hematology & Oncology, 2017, 10(1): 104.
|
| [21] |
Greco E, Lupia E, Bosco O, et al. Platelets and Multi-Organ failure in sepsis[J].
Int J Mol Sci, 2017, 18(10): 2200.
DOI: 10.3390/ijms18102200. |
| [22] |
Jaillon S, Galdiero MR, Del Prete DA, et al. Neutrophils in innate and adaptive immunity[J].
Semin Immunopathol, 2013, 35(4): 377-94.
DOI: 10.1007/s00281-013-0374-8. |
| [23] |
Cheval C, Timsit JF, Garrouste-Orgeas M, et al. Procalcitonin (PCT) is useful in predicting the bacterial origin of an acute circulatory failure in critically ill patients[J].
Intensive Care Med, 2000, 26(Suppl 2): S153-8.
|
| [24] |
Liu B, Ding X, Yang J. Effect of early goal directed therapy in the treatment of severe sepsis and/or septic shock[J].
Curr Med Res Opin, 2016, 32(11): 1773-82.
DOI: 10.1080/03007995.2016.1206872. |
| [25] |
Suárez-Santamaría M, Santolaria F, Pérez-Ramírez A, et al. Prognostic value of inflammatory markers (notably cytokines and procalcitonin), nutritional assessment, and organ function in patients with sepsis[J].
Eur Cytokine Netw, 2010, 21(1): 19-26.
|
| [26] |
Castelli GP, Pognani C, Meisner M, et al. Procalcitonin and Creactive protein during systemic inflammatory response syndrome, sepsis and organ dysfunction[J].
Crit Care, 2004, 8(4): R234-42.
|
| [27] |
Oliveira CF, Botoni FA, Oliveira CR, et al. Procalcitonin versus Creactive protein for guiding antibiotic therapy in sepsis: a randomized trial[J].
Crit Care Med, 2013, 41(10): 2336-43.
DOI: 10.1097/CCM.0b013e31828e969f. |
 2019, Vol. 39
2019, Vol. 39

