腓骨肌萎缩症(CMT)又称遗传性运动感觉神经病,是人类最常见的具有高度临床和遗传异质性的周围神经病[1],群体发病率为10~28/10万[2]。CMT最先于1886年由Charcot和Marie描述,主要表现为进行性对称性远端感觉减退、肌无力和萎缩、腱反射减弱或消失以及足部畸形等[3]。根据正中神经运动传导速度(MNCV)可分为CMT1型(MNCV < 38 m/s)、CMT2型(MNCV>38 m/s)以及中间型CMT(I-CMT)(MNC 25~45 m/s)[4]。CMT的遗传方式可分为常染色体显性遗传(AD)、常染色体隐性遗传(AR)以及X-连锁遗传[5]。CMT有多种致病基因,包括PMP22、GJB1、MPZ、MFN2、GDAP1基因等[6],其中神经节苷脂诱导分化相关蛋白1(GDAP1)基因是为数不多既可导致AD-CMT、又可导致AR-CMT的致病基因,其导致的AD-CMT包括AD-CMT2K(OMIM 607831),AR-CMT包括ARCMT2K(OMIM 607831)、RI-CMT(OMIM 608340)以及CMT4A (OMIM 214400)等[7-8]。迄今为止,已经有超过80个GDAP1基因突变参与CMT的发病(http://www.hgmd.cf.ac.uk/ac/dipx.php),其中导致AD-CMT2K的GDAP1基因突变报道较少,目前文献报道了10余个突变类型[7, 9-18],其发病机制尚未明确。本研究对1个ADCMT2K家系进行基因筛查,探讨该家系的分子遗传学发病机制。本研究在该家系中发现了GDAP1基因存在1个从未报道过的杂合错义突变,这拓宽了对ADCMT2K致病基因的认识。
1 资料和方法 1.1 研究资料该汉族家系来自中国安徽省滁州市,共3代10人(图 1)。先证者(III1)女,21岁,因“左足跟部疼痛伴背伸受限5年余”入院。5年余(16岁)前无明显诱因出现左足跟部疼痛、背屈受限,行走后加重,休息后可缓解,深蹲时无法全脚掌着地,上述症状逐渐加重。查体示肢体肌肉无萎缩,双足高足弓,四肢肌张力正常,四肢腱反射减弱,双上肢肌力正常,双下肢髂腰肌、股四头肌、股二头肌肌力正常,双踝关节背屈不能,病理征未引出。右手掌及双下肢足背触痛觉减退。肌电图提示周围神经脱髓鞘损害合并轴索损害,运动纤维及感觉纤维均受累,其中双胫神经、双腓总神经运动传导速度减慢,而双上肢运动神经传导速度正常。患者在外院行腓肠神经活检,送检组织形态符合脱髓鞘为主混合性周围神经病变病理改变。先证者外公、母亲及弟弟有类似症状,其外公69岁,有轻微高足弓;其母亲45岁,有轻微高足弓;其弟弟16岁,出现手掌及小腿肌肉萎缩、背伸受限、高足弓,四肢无麻木疼痛感。先证者其他家系成员无相关症状。先证者签署知情同意书后行相关基因检测,并对先证者父母、弟弟进行验证。

|
图 1 家系图 Fig.1 Family structure of the pedigree. |
抽取家系成员的乙二胺四乙酸(EDTA)抗凝外周血2~3 mL,参照《盐析法血液DNA提取试剂盒》操作要求制备基因组DNA,用Sim-100超微量分光光度计测定DNA的OD值。
1.2.2 目标外显子捕获及测序分析对与CMT相关的65个基因的编码区使用基于目标区域捕获的方法进行扩增,并用二代测序平台测序。
1.2.3 生物信息学分析采用多序列比对分析基因序列的保守性。利用PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)、PROVEAN(http://provean.jcvi.org/)和SIFT(http://sift.jcvi.org/www/SIFT_BLink_submit.html)三种软件方法对突变基因进行功能预测。采用PyMOL-1软件模拟出突变蛋白三维结构蛋白结构图。
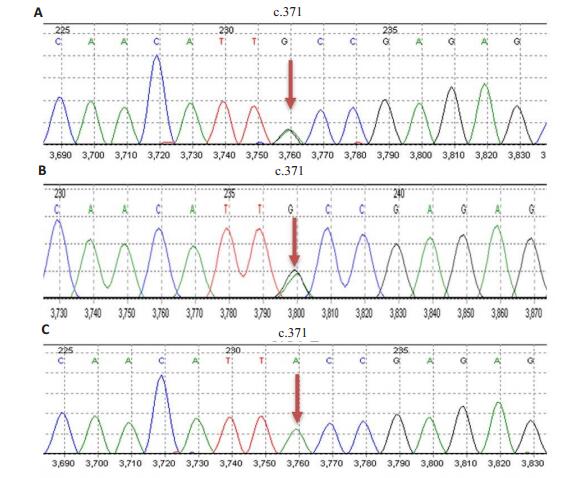
2 结果 2.1 DNA序列分析通过对先证者的外显子捕获发现GDAP1基因(MIM 606598)第3外显子存在1个c.371A>G杂合错义突变,该突变导致编码第124位的酪氨酸突变为半胱氨酸(p.Y124C)(图 2)。先证者母亲及弟弟均携带c.371A>G杂合突变,而其父亲未检测到该突变(图 2)。检索ExAC(The Exome Aggregation Consortium, http://exac.broadinstitute.org)、1000 Genome(http://browser.1000genomes.org)、gnomAD(Genome Aggregation Database, http://gnomad.broadinstitute.org)等正常人群数据库,在正常人群中未发现该突变。因此,c.371A>G为是1个未见报道的新突变。
|
图 2 先证者母亲(A)、弟弟(B)及父亲(C)的GDAP1基因第3外显子测序结果 Fig.2 Sequencing results of the third exon of GDAP1 gene of the proband's mother (A), younger brother (B) and father (C). |
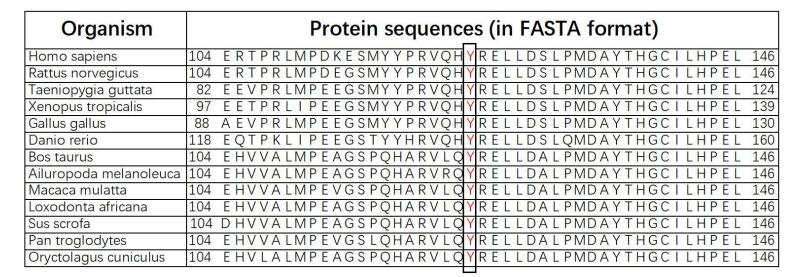
如图 3所示,GDAP1基因由6个外显子(E1~E6)组成编码区,编码的GDAP1蛋白由358个氨基酸组成。其主要结构包括谷胱甘肽硫转移酶(GST)结构域(包括GST-N和GST-C两个模体)、α4-α 5环、疏水结构域(HD)以及跨膜结构域(TMD)等。对黑猩猩、大熊猫、猪种、家牛、家兔等12个物种的GDAP1基因作多序列比对分析,结果显示位于GDAP1基因第124位的酪氨酸具有高度保守性(图 4黑框、红字部分)。
|
图 4 GDAP1基因的保守性分析 Fig.4 Results of multiple sequence alignments of GDAP1 gene. |
通过PolyPhen-2、PROVEAN、SIFT 3种软件预测分析该突变对GDAP1基因功能的影响,结果显示,3种软件均预测该突变为有害突变。其中,PolyPhen-2预测结果显示,HumDiv和HumVar法预测该突变均为“很可能有害(Probably damaging)”,预测值分别为0.999(敏感性:0.14,特异性:0.99)和0.940(敏感性:0.66,特异性:0.91)。PROVEAN预测分值为-5.09,为“有害(Deleterious)”突变。SIFT预测分值为0.001,为“有害(Damaging)”突变。
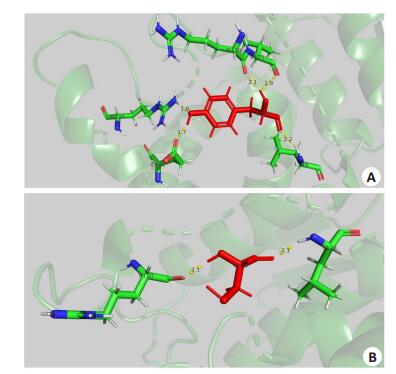
2.2.3 GDAP1蛋白的分子结构模拟结果采用PyMOL-1软件进行GDAP1的三维蛋白结构模拟,该蛋白通过同源建模为一个同源二聚体(图 5)。图 6A展示了野生型蛋白第124位氨基酸(p.Y124)与周围氨基酸残基相互作用。由图 6A可知,p.Y124(红色)与周围氨基酸残基共形成了5条氢键(黄色虚线表示,上面标识的数字代表p.Y124与周围残基形成的氢键的距离,单位为A,下同),这些氨基酸残基分别是p.R120(2.1A)、p.V121(2.9A)、p.L128(2.2A)、p.E222(1.7A)、p.R226(1.9A)。从图 6B可以看出,突变体p.Y124C(红色)与周围氨基酸残基共形成了2条氢键,这两个氨基酸残基分别是p.R120(2.1A)和p.L128(2.1A)。相比于未突变前,p.Y124C比突变前少了3个氢键,即第124位氨基酸的残基少了与p.V121、p.E222、p.R226这3个残基的相互作用,导致突变体在第124位氨基酸残基与周围氨基酸残基的相互作用力减弱,从而可能影响到蛋白整体的稳定性。
|
图 5 构建的GDAP1蛋白模型 Fig.5 Athree-dimensional model of GDAP1 protein. |
|
图 6 突变氨基酸突变前(A)后(B)与周围氨基酸残基相互作用示意图 Fig.6 Diagram showing the interaction among the amino acid residues before (A) and after (B) the mutation at codon 124. |
迄今为止,已经有超过80个GDAP1基因突变参与CMT的发病(http://www.hgmd.cf.ac.uk/ac/dipx.php)。这些突变包括错义突变、无义突变、移码突变、碱基缺失、产生截短和非功能蛋白的突变以及改变GDAP1转录本中的剪接位点的突变等[19-20]。本研究应用目标外显子组捕获技术发现先证者的GDAP1基因第3外显子存在1个c.371A>G杂合错义突变,导致编码第124位的酪氨酸变为半胱氨酸(p.Y124C)。鉴于该突变是1个未见报道的新突变,进一步证实了先证者母亲及弟弟均存在该杂合突变,而其父亲未检测到该突变(图 2)。因此,本例CMT家系的遗传方式考虑为常染色体显性遗传(AD-CMT)。
GDAP1基因突变可导致AR-CMT和AD-CMT,研究发现GDAP1基因的显性和隐性突变在临床表现的严重程度上截然不同。GDAP1基因突变常常导致ARCMT4A,但也可导致AR-CMT2K和AD-CMT2K。AR-CMT2K的特点为发病年龄小,常于婴幼儿期及儿童早期发病,以肢体远端无力及感觉障碍为主要临床表现,可伴有声带和呼吸机麻痹,病理表现为有髓神经纤维脱髓鞘改变或轴索损害[21-22];与AR-CMT2K相比,AD-CMT2K发病时间相对较晚,并具有相对轻微的临床症状[23-24],病理表现为有髓神经纤维出现髓鞘和轴索的联合损害[23]。因此,结合本例家系成员的临床资料,本例家系符合AD-CMT2K型。然而也有研究表明ADCMT2K表型变异性可能很大,体现在发病年龄从儿童早期到成人,以及严重程度可从轻度到中度等[9, 25]。
常染色体显性遗传的GDAP1基因突变报道较少,目前报道的突变位点有p.G10EfsX14(c.23delAG)[10]、p.S34C(c.101C>G)[10]、p.Q38R(c.113A>G)[7]、p.R120W(c.358C>T)[9, 11-12]、p.H123R(c.368A>G)[13-14]、p.E126K(c.376G>A)[14]、p.A156G(c.467C>G)[15]、p.Q218E(c.C652G)[16]、p.E222K(c.664G>A)[17]、p.R226S(c.678A>T)[10]、p.C240Y(c.719G>A)[18]、p.P274L[15]等。如图 3所示,突变最常发生于外显子6,其次为外显子3;突变多位于GST结构域或位于接近GST结构域的α-螺旋中[26];而最常见的突变类型是错义突变,其次是移码突变,无义突变和剪接位点突变[7]。尽管目前研究尚未发现GDAP1蛋白具有GST的活性功能,但大多数显性遗传的GDAP1基因突变位于或接近GST结构域,而隐性遗传的GDAP1基因突变可出现在整个蛋白质序列中,表明GST结构域在蛋白质功能以及AD-CMT表型的分子机制中起重要作用[15]。此外,有些突变位于GST结构域的α-螺旋,表明α-螺旋的完整性也是GDAP1蛋白发挥活性作用的必要条件[15]。本例先证者GDAP1基因的杂合错义突变位于第3外显子,突变位点位于α-螺旋结构,接近GST结构域,这与上述GDAP1基因突变发生的特点基本相符。
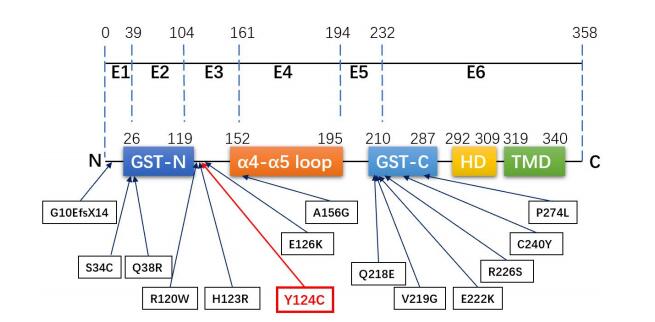
|
图 3 GDAP1基因结构示意图以及本家系(p.Y124C)和文献报道的常染色体显性遗传突变位点 Fig.3 Structure of GDAP1 gene and the autosomal dominant mutation sites of this family (p.Y124C) and in previous reports. E: Exon; GST: Glutathione-S transferase; HD: Hydrophobic domain; TMD: Trans-membrane domain. |
GDAP1蛋白主要位于神经元和雪旺细胞的线粒体外膜上,通过调控线粒体分裂和融合的动态平衡参与周围神经系统的发育和髓鞘化过程,其对线粒体动力学的精确调控在有髓周围神经生理功能的发挥中至关重要[21, 23]。研究发现,GDAP1蛋白的过表达可诱导线粒体碎裂而非细胞凋亡影响线粒体整体活性或干扰线粒体融合,而通过RNA干扰技术特异性敲除GDAP1基因则导致管状线粒体形态的异常[21]。GDAP1基因突变可能的致病机制包括:(1)GDAP1基因的不同遗传方式对线粒体动力学的干扰存在不同的机制。GDAP1是线粒体裂变因子之一,隐性遗传方式通过功能丧失机制降低线粒体裂变活性,导致线粒体的碎裂和管状线粒体的扩大;而显性遗传则干扰线粒体融合、增加活性氧簇的产生,造成线粒体跨膜电位不均匀,导致线粒体损伤,增强细胞对凋亡刺激的敏感性,这被证实为p.R120W、p.A156G、p.Q218E等突变的致病机制[12, 15];(2)研究表明p.C240Y突变的AD-CMT2K患者成纤维细胞线粒体呼吸链复合体I活性较对照组下降,而管状线粒体直径扩大、线粒体体积增加,提示GDAP1蛋白除在线粒体网络动力学中起调节作用外,还可能参与能量生产和调控线粒体体积[18];(3)另有研究报道了一个包含GDAP1基因的8q21.11缺失的CMT2K女性患者存在单倍体不足[27],进一步研究表明GDAP1表达的中断会造成一系列线粒体依赖的功能紊乱,包括对谷胱甘肽水平、氧化应激或钙缓冲均可产生影响,导致内环境紊乱[28-29];(4)GDAP1蛋白还可以与微管蛋白结合,这种相互作用在α-螺旋环突变中显著增强,提示这类突变可以干扰线粒体-细胞骨架的相互作用[30]。p.H123位于GST-N和GST-C结构域之间的α-螺旋环结构域[26],p.H123R的致病机制可能为线粒体动力学及细胞呼吸障碍,或线粒体与抑制线粒体移动的微管细胞骨架的结合异常[13]。
本例家系为p.R120、p.H123附近的p.Y124突变,三者均为相同遗传方式、相同结构域中的突变位点,提示它们可能存在相似的发病机制[12]。GDAP1蛋白的分子结构模拟结果显示突变体在124位置处的氨基酸残基与周围氨基酸残基的相互作用力减弱,这可能影响蛋白整体稳定性。有趣的是,与p.Y124形成氢键的氨基酸中,p.R120、p.E222、p.R226位点的常染色体显性突变均已有报道,而p.V121和p.L128则均具有高度保守性,提示这些位点氨基酸的相互作用的改变可能导致GDAP1蛋白功能异常,从而导致疾病的发生。
本研究在一个AD-CMT2K家系中发现了GDAP1基因第3外显子存在1个新的杂合错义突变[c.371A>G(p.Y124C)],拓宽了对AD-CMT2K致病基因的认识。但本研究仍存在以下不足,需要进一步研究:(1)本研究只检测了先证者父母及弟弟相应位点基因的突变情况,但由于知情同意等原因未能检测到存在临床症状的先证者外公以及其他家系成员相应位点基因的突变情况;(2)该突变可能影响了蛋白整体稳定性,但其与线粒体功能相关的致病机制仍需进一步研究。
致谢: 特别感谢南方医科大学南方医院神经内科蒋海山教授提供病理资料!| [1] |
Kenis-Coskun O, Matthews DJ. Rehabilitation issues in Charcot-Marie-Tooth disease[J].
J Pediatr Rehabil Med, 2016, 9(1): 31-4.
DOI: 10.3233/PRM-160359. |
| [2] |
Corrado B, Ciardi G, Bargigli C. Rehabilitation management of the Charcot-Marie-Tooth syndrome a systematic review of the literature[J].
Medicine (Baltimore), 2016, 95(17): e3278.
DOI: 10.1097/MD.0000000000003278. |
| [3] |
Ramchandren S. Charcot-Marie-Tooth disease and other genetic polyneuropathies[J].
Continuum (Minneap Minn), 2017, 23(5): 1360-77.
|
| [4] |
Barreto LC, Oliveira FS, Nunes PS, et al. Epidemiologic study of Charcot-Marie-Tooth disease: a systematic review[J].
Neuroepidemiology, 2016, 46(3): 157-65.
DOI: 10.1159/000443706. |
| [5] |
Mccorquodale D, Pucillo EM, Johnson NE. Management of Charcot-Marie-Tooth disease: improving long-term care with a multidisciplinary approach[J].
J Multidiscip Healthc, 2016, 9(4): 7-19.
|
| [6] |
Azevedo H, Pupe C, Pereira R, et al. Pain in Charcot- Marie-Tooth disease: an update[J].
Arq Neuropsiquiatr, 2018, 76(4): 273-6.
DOI: 10.1590/0004-282x20180021. |
| [7] |
Pakhrin PS, Xie YZ, Hu ZM, et al. Genotype-phenotype correlation and frequency of distribution in a cohort of Chinese Charcot-MarieTooth patients associated with GDAP1 mutations[J].
J Neurol, 2018, 265(3): 637-46.
|
| [8] |
戴昰旭, 付俊, 王朝霞, 等. 常染色体隐性遗传性腓骨肌萎缩症2K型临床特征[J].
中华神经科杂志, 2017, 50(4): 292-6.
DOI: 10.3760/cma.j.issn.1006-7876.2017.04.012. |
| [9] |
Sivera R, Espinos C, Vilchez JJ, et al. Phenotypical features of the p. R120W mutation in the GDAP1 gene causing autosomal dominant Charcot-Marie-Tooth disease[J].
J Peripher Nerv Syst, 2010, 15(4): 334-44.
|
| [10] |
Crimella C, Tonelli A, Airoldi G, et al. The GST domain of GDAP1 is a frequent target of mutations in the dominant form of axonal Charcot Marie Tooth type 2K[J].
J Med Genet, 2010, 47(10): 712-6.
DOI: 10.1136/jmg.2010.077909. |
| [11] |
Claramunt R, Pedrola L, Sevilla T, et al. Genetics of Charcot-MarieTooth disease type 4a: mutations, inheritance, phenotypic variability, and founder effect[J].
J Med Genet, 2005, 42(4): 358-65.
DOI: 10.1136/jmg.2004.022178. |
| [12] |
Niemann A, Wagner KM, Ruegg M, et al. GDAP1 mutations differ in their effects on mitochondrial dynamics and apoptosis depending on the mode of inheritance[J].
Neurobiol Dis, 2009, 36(3): 509-20.
|
| [13] |
Auranen M, Ylikallio E, Toppila J, et al. Dominant GDAP1 founder mutation is a common cause of axonal Charcot-Marie-Tooth disease in Finland[J].
Neurogenetics, 2013, 14(2): 123-32.
DOI: 10.1007/s10048-013-0358-9. |
| [14] |
Yoshimura A, Yuan JH, Hashiguchi A, et al. Clinical and mutational spectrum of Japanese patients with Charcot-Marie-Tooth disease caused by GDAP1 variants[J].
Clin Genet, 2017, 92(3): 274-80.
DOI: 10.1111/cge.2017.92.issue-3. |
| [15] |
Zimon M, Baets J, Fabrizi GM, et al. Dominant GDAP1 mutations cause predominantly mild CMT phenotypes[J].
Neurology, 2011, 77(6): 540-8.
|
| [16] |
Chung KW, Kim SM, Sunwoo IN, et al. A novel GDAP1 Q218E mutation in autosomal dominant Charcot-Marie-Tooth disease[J].
J Hum Genet, 2008, 53(4): 360-4.
|
| [17] |
Kabzinska D, Kotruchow K, Cegielska J, et al. A severe recessive and a mild dominant form of Charcot-Marie-Tooth disease associated with a newly identified Glu222Lys GDAP1 gene mutation[J].
Acta Biochim Pol, 2014, 61(4): 739-44.
|
| [18] |
Cassereau J, Chevrollier A, Gueguen N, et al. Mitochondrial complex I deficiency in GDAP1-related autosomal dominant Charcot-MarieTooth disease (CMT2K)[J].
Neurogenetics, 2009, 10(2): 145-50.
DOI: 10.1007/s10048-008-0166-9. |
| [19] |
Cassereau J, Chevrollier A, Bonneau DA, et al. A locus- specific database for mutations in GDAP1 allows analysis of genotypephenotype correlations in Charcot- Marie-Tooth diseases type 4A and 2K[J].
Orphanet J Rare Dis, 2011, 6(2): 87.
|
| [20] |
Cassereau J, Chevrollier A, Gueguen NA, et al. Mitochondrial dysfunction and pathophysiology of Charcot-Marie-Tooth disease involving GDAP1 mutations[J].
Exp Neurol, 2011, 227(1): 31-41.
|
| [21] |
Niemann A, Ruegg M, La Padula V, et al. Ganglioside-induced differentiation associated protein 1 is a regulator of the mitochondrial network: new implications for Charcot-Marie-Tooth disease[J].
J Cell Biol, 2005, 170(7): 1067-78.
DOI: 10.1083/jcb.200507087. |
| [22] |
Baxter RV, Ben Othmane K, Rochelle JM, et al. Ganglioside-induced differentiation-associated protein-1 is mutant in Charcot-MarieTooth disease type 4A/8q21[J].
Nat Genet, 2002, 30(1): 21-2.
|
| [23] |
Pedrola L, Espert A, Wu X, et al. GDAP1, the protein causing Charcot-Marie-Tooth disease type 4A, is expressed in neurons and is associated with mitochondria[J].
Hum Mol Genet, 2005, 14(8): 1087-94.
DOI: 10.1093/hmg/ddi121. |
| [24] |
Niemann A, Huber N, Wagner KM, et al. The Gdap1 knockout mouse mechanistically links redox control to Charcot-Marie-Tooth disease[J].
Brain, 2014, 137(Pt 3): 668-82.
|
| [25] |
Fu J, Dai S, Lu Y, et al. Similar clinical, pathological, and genetic features in Chinese patients with autosomal recessive and dominant Charcot-Marie-Tooth disease type 2K[J].
Neuromuscul Disord, 2017, 27(8): 760-5.
DOI: 10.1016/j.nmd.2017.04.001. |
| [26] |
Marco A, Cuesta A, Pedrola L, et al. Evolutionary and structural analyses of GDAP1, involved in Charcot-Marie-Tooth disease, characterize a novel class of glutathione transferase-related genes[J].
Mol Biol Evol, 2004, 21(1): 176-87.
|
| [27] |
Niyazov D, Africk D. Mitochondrial dysfunction in a patient with 8q21.11 deletion and Charcot- Marie-Tooth disease type 2K due to GDAP1 haploinsufficiency[J].
Mol Syndromol, 2015, 6(4): 204-6.
DOI: 10.1159/000440660. |
| [28] |
Noack R, Frede S, Albrecht P, et al. Charcot- Marie-Tooth disease CMT4A: GDAP1 increases cellular glutathione and the mitochondrial membrane potential[J].
Hum Mol Genet, 2012, 21(1): 150-62.
|
| [29] |
Barneo-Munoz M, Juarez P, Civera-Tregon A, et al. Lack of GDAP1 induces neuronal calcium and mitochondrial defects in a knockout mouse model of Charcot-Marie-Tooth neuropathy[J].
PLoS Genet, 2015, 11(4): e1005115.
DOI: 10.1371/journal.pgen.1005115. |
| [30] |
Estela A, Pla-Martin D, Sanchez-Piris MA, et al. Charcot-MarieTooth-related gene GDAP1 complements cell cycle delay at G(2)/M phase in saccharomyces cerevisiae fis1 gene-defective cells[J].
J Biol Chem, 2011, 286(42): 36777-86.
DOI: 10.1074/jbc.M111.260042. |
 2019, Vol. 39
2019, Vol. 39

