2. 天津市第三中心医院检验科//天津市人工细胞重点实验室//卫生部人工细胞工程技术研究中心,天津 300170
2. Clinical Laboratory Department of Tianjin Third Central Hospital, Tianjin Key Laboratory of Artificial Cell, Artificial Cell Engineering Technology Research Center of Public Health Ministry, Tianjin 300170 China
肝癌在我国恶性肿瘤发病率排前3位,其死亡率系继肺癌后排第2位[1]。由于我国是乙肝相关性HCC的重灾区,我国因此肝癌的发病率和死亡率无论男女均高于发达国家[2]。全球范围内,肝细胞癌HCC占所有肝癌的75%左右,而我国HCC占所有肝癌的90%,>70%的HCC患者为乙肝相关性HCC [3]。全球范围每年HCC新增病例约有78.2万,其中50%发生在中国[3]。每年HCC死亡人数占亚洲总死亡患者的近55% [4-5]。除了疾病本身的恶性程度高以外,HCC发病隐匿,大部分的患者在确诊时已经是晚期,错失了最佳治疗机会。HCC的死亡率高、发病机制复杂,至今尚未被阐明。尽管CT、超声检查、生物标记物AFP广泛应用于临床HCC的筛选与诊断,但敏感度不够、效果仍不不理想[6]。深入了解HCC的发病机制,寻找HCC特定的治疗的新靶点,更加及时准确的诊断HCC仍是目前刻不容缓的需求。
近年来,随着代谢组学技术的发展,越来越多应用到包括对于HCC等疾病的研究中。代谢组学技术的发展为研究HCC提供了新思路,也越来越多的研究通过分析血清、血浆、尿液和粪便等样本,在HCC患者代谢标志物鉴定方面取得了一定的研究成果,证实了代谢组学研究的有效性[6-10]。一项多中心研究表明,由Phe-Trp和GCA组成的生物标志物组对早前诊断HCC具有很高的诊断价值[7]。对50对肝组织样本分析发现乙酰肉碱是肝细胞癌的候选诊断和预后生物标志物[8]。也有不同检测的方法分析血清代谢普探索HCC生物标记物的报道[9-10]。研究201例血清样本的代谢轮廓,发现15种代谢物与正常人-肝炎-肝硬化-HCC发展过程中存在密切的联系[11]。利用气质联用发现氨基戊二酸、柠檬酸、乳酸、支链氨基酸、α-生育酚、胆固醇以及山梨糖在HCC患者和肝硬化患者中表达存在差异[12]。有研究乙肝和丙肝血清代谢轮廓的变化[13]。尽管上述研究对血清代谢物作为潜在生物标记物进行了报道,但目前某些潜在生物标记物特异性不高,循证医学证据仍不足,进一步探索更多有效的生物潜在标记物尤为必要。接受不同手术方式的患者一般处于不同的疾病阶段,然而关于不同手术方式下不同分期HCC患者血清代谢轮廓的研究却无报道。
基于液质联用LC/MS平台,本研究在探索乙肝相关性HCC发生发展整个过程不同疾病状态患者血清代谢物的变化的同时,进一步分析了不同手术方式HCC患者血清代谢物的变化趋势。通过分析这些特征代谢物对于乙肝相关性HCC诊断及分期效能,以其找到更多有效的乙肝相关性肝细胞癌潜在生物标记物,为精确诊断HCC和进一步探究HCC发病机制提供支持。
1 资料和方法 1.1 研究资料选取于2014年6月~2015年12月就诊于天津市第三中心医院肝内科及肝胆外科住院患者126例为乙肝组,包括27例乙肝DNA阴性(DNA-N)的乙肝肝炎患者、24例乙肝DNA阳性(DNA-P)的乙肝肝炎患者、24例乙肝肝硬化(LC)患者、27例乙肝相关性HCC行手术/射频治疗(T1)患者和24例乙肝相关性HCC行介入治疗(T2)患者及同期25例健康体检者为正常对照(Normal)组。纳入标准:(1)乙肝性肝病患者均为HBsAg阳性,排除丙肝抗体同时阳性的患者,排除同时患有自身免疫性肝病和/或酒精性肝病患者,排除梅毒快速血浆反应素试验(RPR)、艾滋病(HIV)抗体阳性的患者;(2)HCC患者均有影像学诊断证据,巴萨罗那分期均为A和B期,排除合并其它部位原发性肿瘤患者以及明确HCC远处转移患者;(3)HCC行手术/射频治疗的患者均有明确的病理学诊断依据,排除不典型增生、胆管细胞癌以及混合细胞癌患者;(4)HCC行介入治疗的患者均为首次行经导管动脉化学栓塞(TACE)的患者;(5)乙肝肝炎患者均无肝脏纤维化的表现,尚未发展为肝硬化;(6)肝硬化均为Child-Puge A级的患者,在研究期间尚未发展为HCC。所有纳入对象均不患有糖尿病等内分泌疾病、肺结核等呼吸系统疾病、肾衰等肾脏疾病以及白血病等造血系统疾病,年龄控制在40~65岁之间。本研究已受到天津市第三中心医院伦理委员会的批准,遵守赫尔辛基宣言的原则,所有研究对象在采血前均取得本人或家属的知情同意。
1.2 研究方法 1.2.1 样本收集及指标检测收集患者基本资料,并分别清晨采集受试者空腹静脉血,离心留取血清待用。所有HCC患者均在行手术切除、射频治疗或介入治疗之前采血。罗氏全自动生化分析仪P800白蛋白(ALB)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转移酶(GGT)、总胆红素(TBIL)含量,罗氏combas 6000生化分析仪测定甲胎蛋白(AFP)含量。
1.2.2 特征代谢物的筛选与鉴定将收集血清标本同时进行去蛋白、烘干、溶解、上样。分别取5 µL待测样品,充分混匀,即为质控品。在样品分析前连续检测12个质控品,之后每检测6个样品检测1次质控品,每次质控品检测之后加测一次空白,以防止交叉污染。基于高效液相色谱和质谱(UPLC-MS)平台,提取总离子流图:(1)色谱仪检测条件:以反相C18柱(2.1 mm ×150 mm. 1.9 μm)为色谱柱,以0.1%甲酸水溶液为流动相A,以0.1%甲酸乙腈溶液为流动相B。流动相时间和浓度设置为:起始为95%流动相A和5%流动相B,维持2.5 min;之后的4 min,流动相B线性增加到95%;维持5%流动相A和95%流动相B 3 min;之后的4 min,流动相B线性降低到5%;最后95%流动相A和5%流动相B,维持2.5 min。其它参数设置为:进样量为10 μL、自动进样器温度为4 ℃、流速为200 μL/min以及柱温为20 ℃;(2)质谱仪检测条件:以电喷雾离子源(ESI)为离子源,全峰宽半峰高分辨率(FWHM)能够达到100 000。参数设置为:正离子模式下进行检测、数据采集范围为质荷比(m/z)50~1000、毛细管电压为7 V、离子源电压为4.8 kV、锥孔电压为50 V。
将获取的数据利用MZmine2.0软件进行预处理[14],导入SIMCA P+(Umetrics,瑞典)软件构建正交偏最小二乘判别分析模型(OPLS-DA);再根据变量投影重要性(VIP)值及VIP置信区间对所测离子进行初步筛选。筛选标准为:VIP>1且置信区间不包含0的离子。某些特征代谢物可以通过与标准品的色谱峰和质谱峰进行对比加以鉴定。对于其它的特征代谢物则实行以下鉴定方法:(1)根据特征离子的m/z精确值查询HMDB数据库[15];(2)利用MS/MS扫描特征离子,将获取的二级质谱图与Mass Frontier 6.0软件自带数据库进行对比和鉴定。
1.3 统计分析应用SPSS 17.0软件进行统计分析,对于符合正态分布计量资料采用t检验或方差分析比较,对于不符合正态分布的连续性资料采用Kruskal-Wallis H检验或Mann-Whitney U检验进行比较,对于计数资料比较采用χ2检验。绘制受试者工作特征曲线(ROC)以及计算各个曲线所对应的曲线下面积(AUC)。以P < 0.05表示差异有统计学意义。
2 结果 2.1 临床基本资料分析乙肝组患者的临床基本资料,如表 1。各组的年龄(χ2=2.265,P=0.811)和性别(F=1.040,P=0.397)均差异无统计学意义。HBV-HCC组患者GGT和AFP含量均较Normal组显著升高(P < 0.05)。
| 表 1 正常对照组和乙肝组的一般临床资料 Tab.1 General clinical data of the normal control group and hepatitis B group |
本研究共检测了37个质控品,对数据分析后建立了主成分分析(PCA)模型图(图 1)。本批样品分析结果可靠,图中只有一个主成分,检测完12个质控品之后,仪器基本处于稳定状态,之后的25个都在均数±标准差的在控范围内。
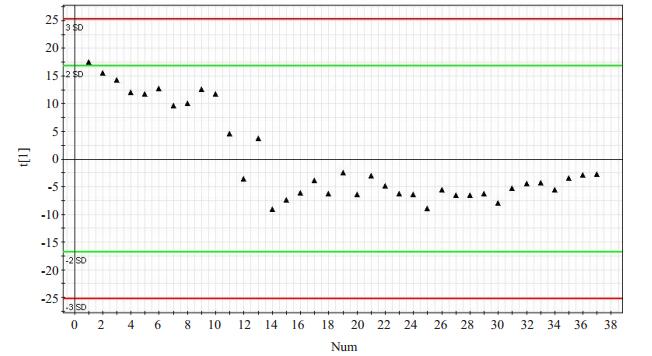
|
图 1 质控物的PCA模型图 Fig.1 PCA model diagram of the quality control. |
各样品所对应的总离子流图(TIC),横坐标表示的是保留时间(RT),纵坐标表示总离子流强度。从总体而言,各样品所对应的TIC大致相似,但在保留时间为7.05 min左右时,各组所检测到的代谢离子在种类或是含量上存在差异(图 2)。
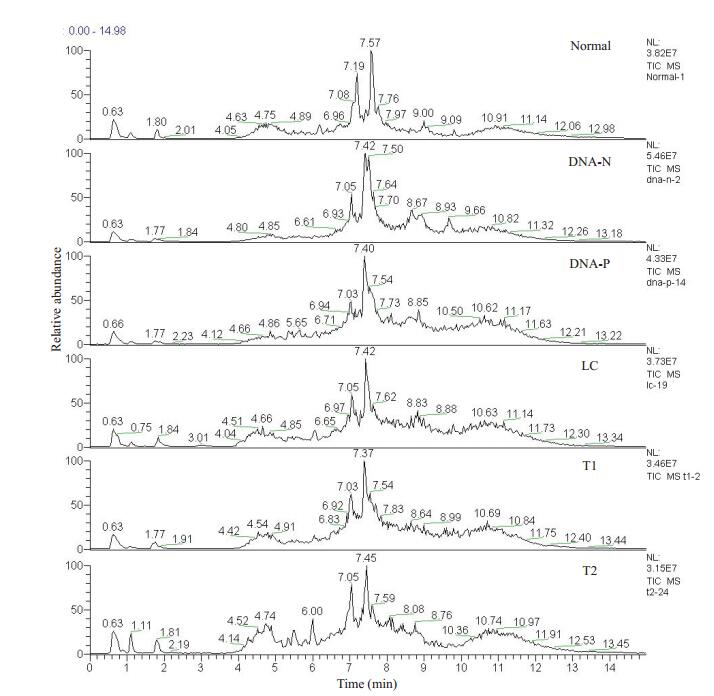
|
图 2 各组血清样品的总离子流图 Fig.2 Total ion chromatogram of serum samples in each group. DNA negative (DNA-N), DNA-positive (DNA-P), Liver cirrhosis (LC), T1 (Surgical removal or radiofrequency), T2 (Intervention). |
将所得到的数据进行前处理后,进行主成分分析(PCA),构建OPLS-DA模型,具有较好的模型解释率和预测率:R2X=70.6%,R2Y=71.1%,Q2=53.9%(图 3)。乙肝肝硬化和乙肝相关性HCC行手术/射频治疗组分布在图的右侧;乙肝相关性HCC行介入治疗组分布在左下角;乙肝肝炎组都分布在图的上方。
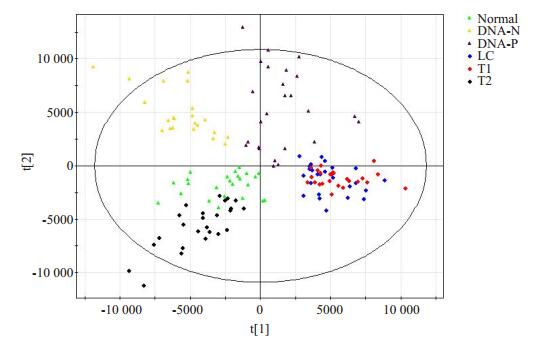
|
图 3 基于乙肝组和正常对照组的OPLS-DA模型 Fig.3 OPLS-DA model based on HBV group and normal group. DNA negative (DNA-N), DNA-positive (DNA-P), Liver cirrhosis (LC), T1 (Surgical removal or radiofrequency), T2 (Intervention). |
根据所构建OPLS-DA区分模型,共筛选出41种代谢离子,比较这些离子的色谱峰积分面积值在各组间的差异,最终鉴定出25种特征代谢物(表 2)。为了探索这些特征代谢物对于乙肝相关性HCC的诊断效能,将正常对照组、肝炎等各组进行比较。
| 表 2 各组代谢物表达比较分析 Tab.2 Comparison of the expression of metabolites among the groups |
与健康对照组比较,乙肝相关性HCC患者共有7种代谢物表达升高,15种代谢物表达降低(表 2,图 4A、B)。表达升高的7种代谢物均有较好的区分效能,其AUC结果Adlupone为0.735;PA[P-16:0e/ 18:2(9Z, 12Z)]为0.848;Hericenone D为0.796;5, 6- Dihydroxyprostaglandin F1a为0.877;L-天门冬氨酰-4-磷酸为0.930;甘氨胆酸为0.893;LPA(P-16:0e/0:0)为0.861。15种表达降低的代谢物有9种代谢物均有较好的区分效能,LysoPC[18:2(9Z, 12Z)]、LysoPC[18:1(9Z)]、Phytanic acid、Behenic acid、17a-Estradiol、LysoPC(17:0)、LysoPC(P-16:0)、LysoPC[20:4(5Z, 8Z, 11Z, 14Z)]、5-Methylcytidine的AUC均大于0.700。
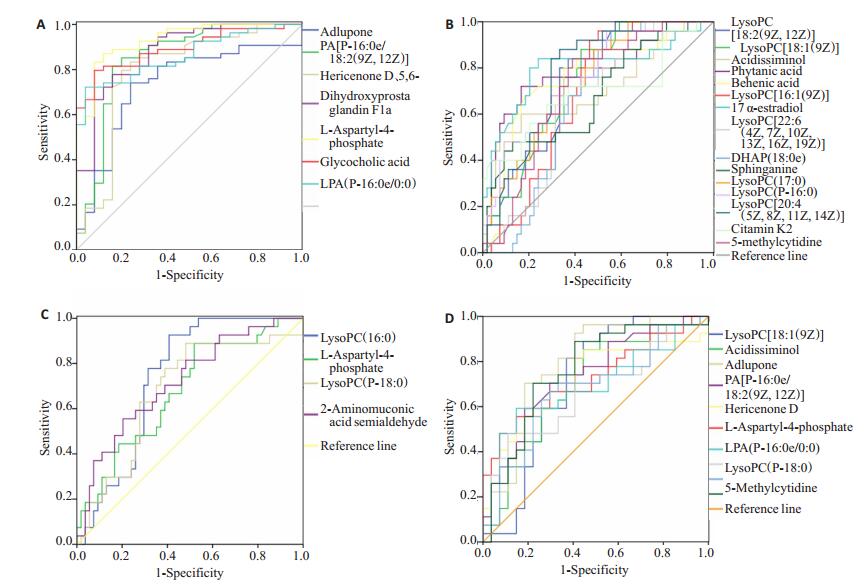
|
图 4 差异代谢物对于乙肝相关性HCC诊断和分期的ROC曲线 Fig.4 ROC curves of the differential metabolites for diagnosis and staging of HBV- HCC. A: Metabolites with increased expression in HBV-HCC group compared with normal control group; B: Metabolites with decreased expression in HBV-HCC group compared with normal control group; C: Metabolites with differential expressions in HBV-HCC group compared with LC group; D: Metabolites with differential expression in T2 group compared with T1 group. HBV: Hepatitis B virus; LC: Liver cirrhosis; HCC: Hepatocellular carcinoma; T1: Surgical removal or radiofrequency; T2: Interventional therapy. |
鉴于HCC大部分都有肝硬化的基础,对乙肝肝硬化组与乙肝相关性HCC组进行比较,发现4种代谢物在两组间存在差异(表 2,图 4C)。其中LysoPC(16:0)和2-Aminomuconic acid semialdehyde的AUC分别为0.738和0.719(P < 0.05),对于乙肝肝硬化和乙肝相关性HCC具有较好鉴别诊断的效能。
2.5.3 代谢物在乙肝相关性HCC行手术/射频治疗和行介入治疗患者间诊断效能评估通过比较乙肝相关性HCC组行手术/射频治疗和行介入治疗患者,发现10种代谢物存在差异,其中6种包括LysoPC[18:1(9Z)]、Adlupone、PA[P-16:0e/18:2(9Z, 12Z)]、Hericenone D、L-Aspartyl-4-phosphate、5-Methylcytidine具有较好的HCC分期效能,AUC均大于0.700(表 2,图 4D)。
3 讨论作为体内重要的新陈代谢器官,肝脏肩负着人体解毒排毒的重任。研究表明,HCC是通过调整细胞代谢,增加合成代谢来维持癌细胞的增殖和生长的[16-17]。尽管对于HCC的代谢组学研究不断增加,然而对于乙肝相关性HCC发生发展的整个过程的研究鲜有报道。因此,本研究利用代谢组学平台,以健康对照组及乙肝相关性HCC的发生发展的各阶段患者为研究对象,探索血清小分子特征代谢物与乙肝相关性HCC的关系,为揭示其发病机制提供靶向代谢信息。
本研究首先通过比较各组的性别和年龄,排除了性别和年龄对检测结果的影响。为了保证LC-MS平台结果的可靠性,本研究在检测样品前和检测样品时加入质控品以检测仪器的精密度。为了避免交叉污染,检测质控品后均加入一个空白检测。从质控图中可以看出,所有质控物数值都处在均数±标准差的在控范围内,说明仪器的精密度高,结果可靠。通过比较各组的TIC图可以发现,各组间的代谢离子的种类或是代谢离子的含量存在着差异,各个TIC图的虽总体形状相似,但各组峰的位置或高度不尽相同,为后续区分模型构建提供依据。目前,OPLS-DA已经被广泛地应用于代谢组学中,分析研究对象差异,其应用价值也被不断的被认可[18-19]。
本研究以乙肝组和正常对照组构建的OPLS-DA模型,进行特征代谢物筛选和鉴定,最终鉴定出包括9种LysoPC、2种脂肪酸、α-雌二醇、二氢神经鞘氨醇、5-甲基胞苷、维生素K2、甘氨胆酸、溶血磷脂酸以及报道较少的Acidissiminol、L-天门冬氨酰-4-磷酸等25种特征代谢物。本研究发现的25种特征代谢物中有9种是属于LysoPC类,可见LysoPC在乙肝相关性HCC中发挥着重要作用。然而,血清LysoPC含量在HCC患者的变化却存在着争议。研究表明LysoPC有助于慢性炎症的维持以及肝脏恶性肿瘤的进展,无论是肝硬化患者还是乙肝相关性HCC患者,饱和或不饱和脂肪酸酰基链的LysoPC比例均下降[13]。基于LC-MS分析研究78例HCC患者和184例肝硬化患者,发现血清LysoPC(17:0)等血清代谢物参与鞘脂代谢和磷脂分解代谢在HCC中高表达[20]。不同的是,本研究乙肝相关性HCC患者包含血清LysoPC(17:0)在内的7种LysoPC与肝硬化患者均无差别,而LysoPC(16:0)及LysoPC(P-18:0)水平却显著下降。与正常对照组比较,这7种LysoPC血清含量在乙肝相关性HCC中却显示下降。另外,接受手术与射频的HCC患者LysoPC[18:1(9Z)]却明显高于接受介入治疗的患者。综合考虑上述现象,导致差异原因可能与样本选择差异有关。总之,LysoPC对于病理的刺激很敏感,在膜的重塑[21]、炎性合成和抵抗炎症等过程中发挥着重要作用[22-23]。
另外,乙肝相关性HCC患者中植烷酸、17α-雌二醇、二氢神经鞘氨醇、5-甲基胞苷、维生素K等表达均低于正常对照组。本结果提示应该高度重视这些代谢物表达的降低,有可能是发展为乙肝相关性HCC的征兆。此外,L-天冬氨酰基-4-磷酸属于α-氨基酸,由L-天门冬氨酸和ATP合成,参与赖氨酸生物合成I途径和高丝氨酸生物合成。Xiaoning Wang等发现无论是肝肾阴虚还是湿热内阴的乙肝肝炎后肝硬化患者尿液L-天冬氨酰基-4-磷酸均低于正常[24]。而本文所有癌症患者的血清L-天冬氨酰基-4-磷酸均高于正常对照组,而且随着疾病严重程度其血清含量也一直升高。分析导致这种现象的原因,可能是疾病进展促进了L-天冬氨酰基-4-磷酸的合成,却降低了L-天冬氨酰基-4-磷酸的排泄,从而导致血液中L-天冬氨酰基-4-磷酸增高,而尿液降低。
为了探讨这些代谢物对于乙肝相关性HCC的诊断价值,分别将各组进行比较,绘制ROC曲线。结果表明,与正常对照组相比,乙肝相关性HCC血清共22种代谢物存在差异表达(7种表达升高,15种表达降低),其中16种AUC均大于0.700。AFP作为临床诊断HCC最为常见的血清生物标记物,然而大量研究表明其敏感度和特异性不够。研究表明AFP对于HCC的诊断敏感性为65%,临床预测的敏感度就更低 < 40% [25-26]。更有研究表明,几乎三分之一的早期HCC患者表现出与健康受试者相同水平的AFP [27],其对于直径小于3 cm的HCC诊断特异性极低[28]。以本研究7种表达升高的血清代谢物为例,Adlupone、PA[P-16:0e/18:2(9Z, 12Z)]、Hericenone D、5, 6-Dihydroxyprostaglandin F1a、甘氨胆酸、PA(P- 16:0e/0:0)及L-天门冬氨酰-4-磷酸的AUC分别为0.735、0.848、0.796、0.877、0.893、0.861及0.930,均显著高于AFP的0.65 [25-26]。以上种种证据表明,这些差异性代谢物对诊断HCC具有较高的临床诊断价值,尤其是L-天门冬氨酰-4-磷酸。
为了寻找具有HCC筛查功能的指标,比较分析了乙肝肝硬化组与乙肝相关性HCC血清代谢物水平变化。两组间4种代谢物存在差异,其中LysoPC(16:0)和2-Aminomuconic acid semialdehyde水平HCC患者均较肝硬化患者低,分析其水平下降的主要原因可能是由于肝损伤或恶性再生期间膜卵磷脂的快速转换[29]。分析ROC结果表明LysoPC(16:0)和2-Aminomuconic acid semialdehy的AUC均大于0.70,对区分乙肝肝硬化组与乙肝相关性HCC具有较高的诊断价值。
为了寻找具有早期诊断及分期效能的标志物,首先,我们对比分析了乙肝肝硬化组与乙肝相关性HCC组行手术/射频治疗组血清代谢物变化。根据巴萨罗那分期,只有极早期(0期)和早期(A期)的HCC患者适用于手术或射频治疗[30]。对HCC患者进行分期,选择最合适的治疗方案进行早期诊断也是至关重要的,许多单位和研究学者支持巴萨罗那的分期和治疗策略是最好的分期系统[31-32]。本研究纳入行手术/射频治疗的乙肝相关性HCC患者27例,共发现4种代谢物与乙肝肝硬化组患者存在差异,其中Adlupone、LysoPC(P-18:0)和2-Aminomuconic acid semialdehyde的AUC均大于0.700,具有早期诊断价值。进一步,本研究对比分析了行手术/射频治疗和行介入治疗乙肝相关性HCC患者血清变化。结果表明不同治疗方式下患者共10种代谢物存在差异,其中LysoPC[18:1(9Z)]、Adlupone、PA[P-16: 0e/18:2(9Z, 12Z)]、Hericenone D、L-Aspartyl-4-phosphate、5-Methylcytidine的AUC均大于0.700。结果提示,这些代谢物水平在不同分期患者血清中差异显著,可对诊断和治疗方案提供重要参考。然而,关于HCC诊断生物标记物不同研究、不同组织样本的得出的结论也不尽相同[6-12],仍需要更多的研究进行更加深入地验证。
综上所述,运用代谢组学的方法研究乙肝相关性HCC是行之有效的方法。本研究成功地构建了基于乙肝组和正常对照组的OPLS-DA疾病区分模型,通过代谢物初筛,最终鉴定出25种特征代谢物,这些物质对于乙肝相关性HCC具有一定的诊断和分期的效能。在乙肝相关性HCC的发生发展过程,有些特征代谢物呈连续性的变化可能就预示着癌变的可能;有些代谢物对手术方式的选择具有指导意义。这些代谢物与HCC的关系,仍需要更多的研究去验证。
| [1] |
陈万青, 郑荣寿, 曾红梅, 等. 2011年中国恶性肿瘤发病和死亡分析[J].
中国肿瘤, 2015, 24(1): 1-10.
|
| [2] |
陈建国, 陈万青, 张思维, 等. 中国2003-2007年肝癌发病率与死亡率分析[J].
中华流行病学杂志, 2012, 33(6): 547-53.
DOI: 10.3760/cma.j.issn.0254-6450.2012.06.001. |
| [3] |
Goh GB, Chang PE, Tan CK. Changing epidemiology of hepatocellular carcinoma in Asia[J].
Best Pract Res Clin Gastroenterol, 2015, 29(6): 919-28.
DOI: 10.1016/j.bpg.2015.09.007. |
| [4] |
Parkin DM. The global health burden of infection-associated cancers in the year 2002[J].
Int J Cancer, 2006, 118(12): 3030-44.
DOI: 10.1002/(ISSN)1097-0215. |
| [5] |
Farrell GC, Chan HL, Yuen M, et al. Prevention of hepatocellular carcinoma in the asia-pacific region: consensus statements[J].
J Gastroenterol Hepatol, 2010, 25(4): 657-63.
DOI: 10.1111/jgh.2010.25.issue-4. |
| [6] |
Soper R, Himmelreich U, Painter D, et al. Pathology of hepatocellular carcinoma and its precursors using proton magnetic resonance spectroscopy and a statistical classification strategy[J].
Pathology, 2002, 34(5): 417-22.
DOI: 10.1080/0031302021000009324. |
| [7] |
Luo P, Yin PY, Hua R, et al. A large-scale, multicenter serum metabolite biomarker identification study for the early detection of hepatocellular carcinoma[J].
Hepatology, 2018, 67(2): 662-75.
DOI: 10.1002/hep.v67.2. |
| [8] |
Lu YH, Li N, Gao L, et al. Acetylcarnitine is a candidate diagnostic and prognostic biomarker of hepatocellular carcinoma[J].
Cancer Res, 2016, 76(10): 2912-20.
DOI: 10.1158/0008-5472.CAN-15-3199. |
| [9] |
Xiao R, Zhang XH, Rong Z, et al. Non-invasive detection of hepatocellular carcinoma serum metabolic profile through surfaceenhanced Raman spectroscopy[J].
Nanomedicine, 2016, 12(8): 2475-84.
DOI: 10.1016/j.nano.2016.07.014. |
| [10] |
Liu YE, Hong ZY, Tan GG, et al. NMR and LC/MS-based global metabolomics to identify serum biomarkers differentiating hepatocellular carcinoma from liver cirrhosis[J].
Int J Cancer, 2014, 135(3): 658-68.
DOI: 10.1002/ijc.v135.3. |
| [11] |
Gao R, Cheng JH, Fan CL, et al. Serum metabolomics to identify the liver disease-specific biomarkers for the progression of hepatitis to hepatocellular carcinoma[J].
Sci Rep, 2015, 10(5): 18175.
|
| [12] |
Ranjbar MR, Luo YE, Di Poto CA, et al. GC-MS based plasma metabolomics for identification of candidate biomarkers for hepatocellular carcinoma in Egyptian cohort[J].
PLoS One, 2015, 10(6).
|
| [13] |
Zhou LA, Ding LL, Yin PY, et al. Serum metabolic profiling study of hepatocellular carcinoma infected with hepatitis B or hepatitis C virus by using liquid chromatography-mass spectrometry[J].
J Proteome Res, 2012, 11(11): 5433-42.
DOI: 10.1021/pr300683a. |
| [14] |
Steinfath DG M, Lisec EA J. Metabolite profile analysis: from raw data to regression and classification[J].
Physiol Plant, 2008, 132(2): 150-61.
|
| [15] |
Chen J, Zhao XJ, Fritsche J, et al. Practical approach for the identification and isomer elucidation of biomarkers detected in a metabonomic study for the discovery of individuals at risk for diabetes by integrating the chromatographic and mass spectrometric information[J].
Anal Chem, 2008, 80(4): 1280-9.
DOI: 10.1021/ac702089h. |
| [16] |
Ward PS, Thompson CB. Metabolic reprogramming: a cancer hallmark even warburg did not anticipate[J].
Cancer Cell, 2012, 21(3): 297-308.
|
| [17] |
Kroemer G, Pouyssegur J. Tumor cell metabolism: cancer's achilles' heel[J].
Cancer Cell, 2008, 13(6): 472-82.
|
| [18] |
Mun JH, Lee H, Yoon D, et al. Discrimination of basal cell carcinoma from normal skin tissue using high-resolution magic angle spinning H-1 NMR spectroscopy[J].
PLoS One, 2016, 11(3): e0150328.
DOI: 10.1371/journal.pone.0150328. |
| [19] |
Liu TH, Li JX, Xu FC, et al. Comprehensive analysis of serum metabolites in gestational diabetes mellitus by UPLC/Q-TOF-MS[J].
Anal Bioanal Chem, 2016, 408(4): 1125-35.
DOI: 10.1007/s00216-015-9211-3. |
| [20] |
Ressom HW, Xiao JF, Tuli L, et al. Utilization of metabolomics to identify serum biomarkers for hepatocellular carcinoma in patients with liver cirrhosis[J].
Anal ChimActa, 2012, 19(12): 90-100.
|
| [21] |
Nguyen DH, Sok DE, Kim MR. Prevention of 1-palmitoyl lysophosphatidylcholine-induced inflammation by polyunsaturated acyl lysophosphatidylcholine[J].
Inflamm Res, 2012, 61(5): 473-83.
DOI: 10.1007/s00011-012-0434-x. |
| [22] |
Hung ND, Kim MR, Sok DE. Anti-inflammatory action of arachidonoyl lysophosphatidylcholine or 15-hydroperoxy derivative in zymosan A-induced peritonitis[J].
Prostaglandins Other Lipid Mediat, 2009, 90(3/4): 105-11.
|
| [23] |
Mehta D. Lysophosphatidylcholine: an enigmatic lysolipid[J].
Am J Physiol Lung Cell Mol Physiol, 2005, 289(2): L174-5.
DOI: 10.1152/ajplung.00165.2005. |
| [24] |
Wang XN, Xie GX, Wang XY, et al. Urinary metabolite profiling offers potential for differentiation of liver-kidney yin deficiency and dampness-heat internal smoldering syndromes in posthepatitis B cirrhosis patients[J].
Evid Based Complement Alternat Med, 2015, 18(7): 464969.
|
| [25] |
Soper R, Himmelreich U, Painter D, et al. Pathology of hepatocellular carcinoma and its precursors using proton magnetic resonance spectroscopy and a statistical classification strategy[J].
Pathology, 2002, 34(5): 417-22.
DOI: 10.1080/0031302021000009324. |
| [26] |
Marrero JA, Lok AS. Newer markers for hepatocellular carcinoma[J].
Gastroenterology, 2004, 127(5): S113-9.
DOI: 10.1053/j.gastro.2004.09.024. |
| [27] |
Bertino G, Ardiri A, Malaguarnera MA, et al. Hepatocellualar carcinoma serum markers[J].
Semin Oncol, 2012, 39(4): 410-33.
DOI: 10.1053/j.seminoncol.2012.05.001. |
| [28] |
Chen L, Ho DW, Lee NP, et al. Enhanced detection of early hepatocellular carcinoma by serum SELDI-TOF proteomic signature combined with alpha-fetoprotein marker[J].
Ann Surg Oncol, 2010, 17(9): 2518-25.
DOI: 10.1245/s10434-010-1038-8. |
| [29] |
Taylor LA, Arends J, Hodina AK, et al. Plasma lyso-phosphatidylcholine concentration is decreased in cancer patients with weight loss and activated inflammatory status[J].
Lipids Health Dis, 2007, 6(1): 17.
DOI: 10.1186/1476-511X-6-17. |
| [30] |
张玉盼, 侯建存, 淮明生, 等. 手术切除与射频消融治疗早期肝癌疗效Meta分析[J].
中国实用外科杂志, 2015, 35(11): 1232-7.
|
| [31] |
Bruix J, Sherman M. Management of hepatocellular carcinoma[J].
Hepatology, 2005, 42(7): 1208-36.
|
| [32] |
Llovet JM, Di Bisceglie AM, Bruix JA, et al. Design and endpoints of clinical trials in hepatocellular carcinoma[J].
J Natl Cancer Inst, 2008, 100(10): 698-711.
DOI: 10.1093/jnci/djn134. |
 2019, Vol. 39
2019, Vol. 39

