结肠癌(CRC)是一种较为常见的肿瘤,发生率及致死率一直很高[1-2]。近几年,随着科学技术的发展和手术水平的提高,虽然患者生存时间有所加长,但仍有不少患者饱受预后不良和远端转移的折磨,严重影响生活质量。研究表明,癌细胞的侵袭和转移是包括结肠癌在内的所有高致死率癌症的主要原因[3]。虽国内外有大量关于结肠癌的研究的报道,但结肠癌发生发展机制较为复杂,具体调控机制仍不清楚。细胞因子信号抑制子3(SOCS3)是一种重要的诱导性抗肿瘤分子,可诱导表达于多种组织细胞中[4]。有研究表明,SOCS3可作为反映结直肠癌发生、发展的潜在分子标记物和早期诊断指标,而甲基化作用会降低SOCS3在肿瘤部位中的表达,从而促进肿瘤的发生、发展[5-6]。Rigby等[7-8]研究表明SOCS3可以限制损伤诱导的隐窝过度增殖和结肠肿瘤形成。Singh等[9]研究表明抵抗素可通过上调SOCS3导致结肠癌细胞G1停滞。目前国外有少量关于SOCS3与结肠癌细胞增殖相关研究的报道,然而关于SOCS3对结肠癌增殖与侵袭能力的调控机制国内尚未研究报道。因而,本研究通过检测SOCS3在结肠癌组织和结肠癌细胞系中的表达,分析其对于细胞增殖和侵袭能力的影响,以期为结肠癌的靶向治疗提供一定的理论依据。
1 材料和方法 1.1 临床资料收集我院2014年7月~2017年5月经确诊并进行结肠癌根治术的80例结肠癌患者的癌组织(n=80),同时收集距癌组织边缘>10 cm在癌旁组织标本(n=80)作为对照。80个病例其中男43例,女37例,年龄32~70岁,平均年龄52岁。组织样本依据国际抗癌联盟制定的第七版TNM分期系统[10]进行病理学诊。所有组织离体后均立即浸入液氮,-80 ℃保存,用于后续分析。所有入组病例均由两名病理医师进行组织病理学检查,明确诊断为结肠癌且临床分期为Ⅱ/Ⅲ期,肿瘤下缘在腹膜反折以下,盆腔侧方淋巴结无肿大[11]。所有入组病例均无心脏病、糖尿病、高血压等其他疾病,术前未采取均未行放、化疗等任何辅助治疗,血清学检测HBsAg、HIV、HCV均呈阴性。
1.2 主要仪器与试剂鼠抗人SOCS3抗体及二抗(Abcam),CCK-8试剂盒(索莱宝),Trizol RNA提取试剂(Gibco),反转录试剂盒(TaKaRa),5-AZA和IL-6(sigma)。Applied Biosystems-7500实时荧光PCR仪(Thermo-Fisher),化学发光成像仪(赛欧斯),多功能酶标仪(Berthold),多功能水平电泳仪(Bio-Rad)。结肠癌细胞系SW480(丰晖生物)。
1.3 Western blot法检测SOCS3的表达分别取结肠癌组织和癌旁组织,BCA法进行蛋白定量并收集保存。从保存的样本中取少量蛋白,分别经过电泳分离及转膜后,将其置于室温条件下摇床封闭1 h;然后将膜剪开放在两个器皿中,分别向其中加入抗SOCS3(1: 5000),随后将其置于4 ℃条件下进行过夜处理,再用TBS洗液进行洗膜,洗涤3次,洗膜完毕后分别向各组中滴加经过辣根过氧化物酶处理的二抗,二抗(1: 2000)添置完毕置于室温条件下进行孵育,1 h后再次用TBS进行洗膜,以上所有操作均完成后,在膜上加发光工作液A液和B液,在成像仪分析,以β-actin为内参,对各组图像进行分析。
1.4 SW480细胞复苏及细胞培养先将培养细胞的完全DMEM培养液从冰箱取出,常温下平衡30 min后,取1 mL加进无菌的离心15 mL管内待用。37 ℃水浴快速解冻后1200 r/min离心5 min,弃液,再加1 mL完全DMEM培养基入管中混匀。移入细胞培养皿中并补加6 mL完全培养液,轻晃动培养皿使分散均匀细胞,镜下查看其状态,后放入CO2细胞箱中孵养。次日,显微镜下查看新复苏细胞是否多数贴壁,长势和形态是否正常,然后使用新的完全培基代替旧培基,以去除DMSO残余和死细胞。传代2次后,方可作为其他试验的原材料。
1.5 SW480细胞转染提前1 d铺板,取出结肠癌细胞系SW480细胞加胰蛋白酶消化,用含血清的培养基终止消化,重悬细胞,室温下1000 r/min离心5 min。内加适量的完全培基入离心管内,细胞数按照2×105/孔,计算好每个孔应加的细胞液体积,放入CO2细胞箱中孵养,用于后续细胞转染。
取2个1.5 mL无酶EP管,分别吸取opti-MEM 50 µL加入两管。50 µL opti-MEM加2 µg质粒DNA用于过表达SOCS3或2 µg的siRNA用于敲减SOCS3,6 µL的p3000;50 µL opti-MEM加3 µL的lipo3000,轻轻混匀。将管放于37 ℃环境中孵育5 min,再将两管加到一管放于37 ℃环境中孵育5 min。之后,取出已经铺好板的细胞,弃液加进混好的转染液。转染操作完毕6 h后,扔掉孔内液体,更换为2 mL含有胎牛血清的完全培基,48 h后收样。为保证转染的可靠性,每次转染须做2组重复,一组用RT-PCR来证明转染的可靠性,另一组用于后续的其他试验。
1.6 CCK-8试验检测细胞增殖转染后的SW480细胞培养次日,用胰酶消化SW480成单细胞,计数后按照每组检测4次,每次5个复孔,每孔初始4000个细胞计算各组的总加细胞液量。96孔板置于培养箱中孵育,分别于0、24、48、72 h,向对应孔加10 µL的CCK8,立即放回孵箱,避光,反应1.5 h。结束后,用锡箔纸包住板子,450 nm下用酶标仪检测每孔中液体的吸光度(A)。
1.7 Transwell侵袭试验用50 mg/L matrigel 1/8稀释加到Transwell小室底上表面,置于4 ℃干燥。然后吸尽残余液体,每孔加50 µL不含血清培养基,37 ℃培养30 min。先把SW480细胞饥饿处理,去除血清的影响,胰酶消化细胞,弃消化液用PBS洗细胞,无血清培养基重悬细胞,密度为105。取200 µL悬液加到Transwell小室,下室加500 µL含有FBS的培养基,注意小室底部与下层培养基之间避免产生气泡。细胞培养12~48 h,统计穿过的细胞数目。
1.8 采用5-AZA和IL-6处理SW480SW480细胞提前1d铺板,按照每个6孔板的孔初始为1~5×105细胞,分别使用5-AZA、IL-6(100 ng/mL)及同时加入两种试剂处理细胞,因5-AZA和IL-6试剂是由DMSO溶解,加入同量的DMSO作为对照。一组24 h后收细胞检测SOCS3的表达情况,另一组采用CCK-8检测SW480增殖能力。
1.9 统计学处理数据均以SPSS 20.0统计软件进行分析。计量资料采用采用均数±标准差表示,至少3次独立实验重复。两组间SOCS3的表达、细胞增殖、细胞侵袭的差异比较采用t检验进行分析。以P < 0.05认为差异具有统计学意义。
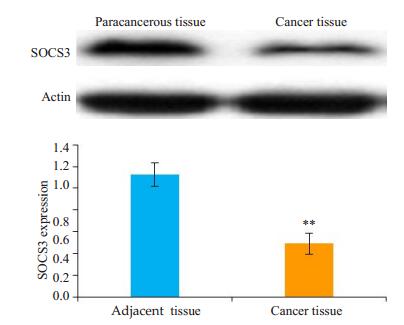
2 结果 2.1 Western blot法检测结肠癌组织及癌旁组织SOCS3的表达结肠癌组织中SOCS3的蛋白表达均低于癌旁组织(图 1)。
|
图 1 SOCS3在结肠癌组织及癌旁组织蛋白水平的表达 Fig.1 Expression of SOCS3 protein detected by Western blotting in colon cancer tissues and paired adjacent tissues. **P < 0.01 vs adjacent tissues. |
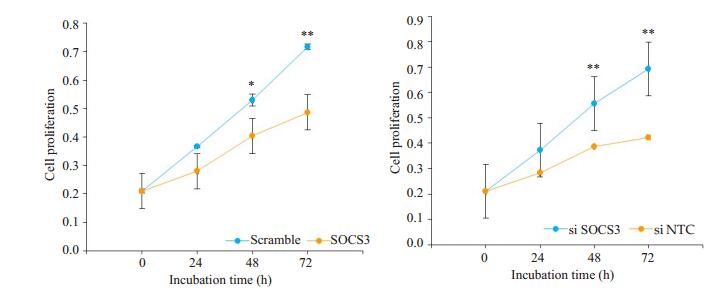
当在SW480细胞中过表达和敲减SOCS3的表达后,于24、48、72 h通过CCK-8试验检测细胞增殖情况。与对照组相较,过表达SOCS3明显抑制了SW480细胞细胞增殖;而敲减SOCS3促进了细胞增殖(图 2)。
|
图 2 过表达(左)和敲减(右)SOCS3对结肠癌细胞增殖的影响 Fig.2 Effect of SOCS3 overexpression (left) and knockdown (right) on proliferation of SW480 colon cancer cells. *P < 0.05 vs SOCS3; **P < 0.01 vs SOCS3 or siNTC. |
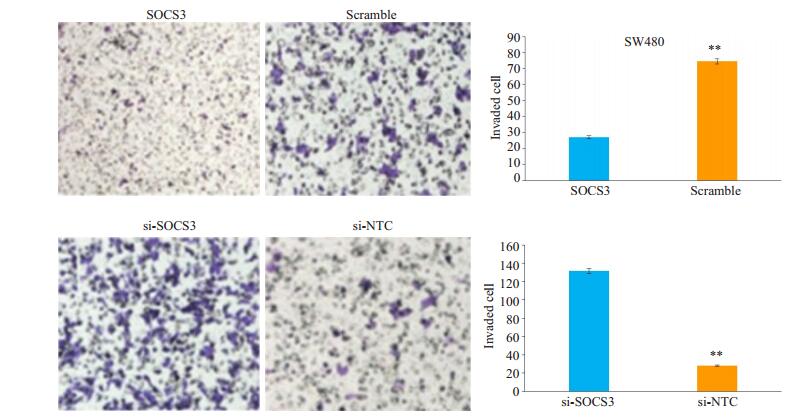
当SW480中SOCS3表达升高之后,细胞侵袭能力减弱,穿过小室的细胞数目明显减少。而使用si-SOCS3及对照si-NTC对SW480进行转染,Tranwell试验检测敲减SOCS3之后的细胞侵袭能力(图 3)。
|
图 3 SW480中过表达SOCS3(上)和敲减SOCS3(下)对结肠癌细胞侵袭的影响 Fig.3 Effect of SOCS3 overexpression o (upper panel) and knockdown (lower panel) on invasion capacity of SW480 cells in vitro. **P < 0.01 vs SOCS3 or siSOCS3. |
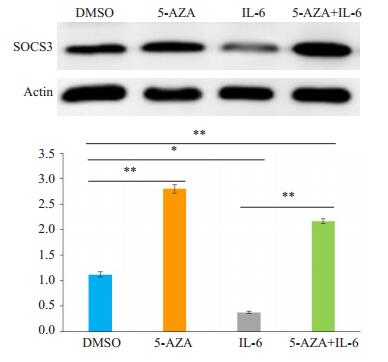
RT-PCR及Western blot检测SOCS3的mRNA及蛋白水平表明,5-AZA显著促进了SOCS3在SW480细胞的表达,而IL-6处理明显降低SOCS3的表达(图 4)。
|
图 4 甲基化和IL-6处理SW480后对于SOCS3表达的影响 Fig.4 Effect of demethylation and IL-6 treatment on SOCS3 expression in SW480 cells. *P < 0.05, **P < 0.01. |
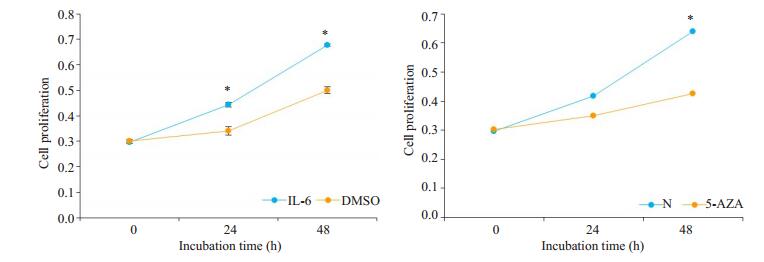
与SOCS3表达结果一致,5-AZA去甲基化抑制SW480细胞增殖,而IL-6处理促进了细胞增殖(图 5)。
|
图 5 去甲基化和IL-6处理对SW480结肠癌细胞增殖的影响 Fig.5 Effect of demethylation and IL-6 treatment on proliferation of SW480 cells. *P < 0.05 vs DMSO or 5-AZA treatment. |
结肠癌(CRC)作为一种较为常见的肿瘤,具有较高的发生率及致死率。结肠癌的诱发不仅与人们的生活、饮食习惯有关,与生存状态的变化、初期确诊率以及医治疗效等均有关。放化疗和手术治疗是治疗结肠癌重要的治疗方式,结肠癌手术疗法目前仍是结肠癌治疗最主要和最显效的医治手段。结肠癌的发生发展是多步骤、多基因变化的过程,其一大特点就是癌细胞增强的增殖及侵袭能力。研究表明,癌细胞的侵袭和转移是包括结肠癌在内的所有高致死率癌症的主要原因[3]。细胞因子信号抑制子3(SOCS3)是SOCS家族的主要成员之一,对多种炎症因子及生长因子信号通路起抑制性调控的影响[12]。在通常情况下,细胞中SOCS3表达极低或无表达,但在某些炎症细胞因子和激素能够刺激下,SOCS3的表达水平显著升高,而SOCS3的表达升高又能够抑制炎症细胞因子及激素介导的信号通路。目前资料显示,在某些外界刺激因素的作用下,SOCS3的表达出现缺陷或失调,促进肿瘤细胞过度生长、迁移、侵袭及血管生成等[13]。本研究通过观察SOCS3在结肠癌组织中的表达,并进一步探讨其对结肠癌细胞增殖与侵袭能力的调控机制。本研究结果表明结肠癌组织中SOCS3蛋白水平还是mRNA表达量均显著低于癌旁组织。
遗传信息的改变是细胞癌变的先决基础,基因异常正常表达往往在癌症发生发展过程中发挥关键作用。肿瘤发生过程中常常会伴有炎性因子的生成,这些炎性因子也会通过影响不同的通路及旁路影响基因的表达[14-15]。研究表明,SOCS3基因转染可上调小鼠CD4+Th细胞SOCS3基因表达,下调STAT4活化和磷酸化,抑制Th1细胞分化,并下调炎症细胞因子基因和蛋白表达,同时间接促进Th2细胞分化,并上调相应炎症细胞因子基因和蛋白表达[16]。正常生理条件下,细胞的生长是受一系列因子的严格限制,调节周期的蛋白表达如果上调会使细胞增殖失调,如CyclinD1在G1期向S期转化过程中发挥作用[17-18]。肿瘤的持续生长是肿瘤细胞无节制增殖和凋亡减弱的结果。细胞凋亡在肿瘤的发生发展中有重要的意义,许多的化学疗法及分子靶向疗法都是通过利用凋亡途径抑制肿瘤的生长来发挥功效的[19]。有研究表明,在甲状腺癌中SOCS家族的SOCS1,SOCS3,SOCS5表达水平下降,使得对于AKT和STAT3的抑制减弱,活化了AKT,降低凋亡促进细胞的生长[20]。也有研究报道,SOCS3不止抑制癌细胞生长,也抑制细胞的其侵袭能力。在肝癌细胞中,SOCS3通过下调FAK激酶活性抑制了肝癌细胞的迁移和侵袭[21]。本研究首先分析了SOCS3在结肠癌组织及癌旁组织中的表达,结果表明SOCS3在结肠癌组织的表达与其在其他癌症如乳腺癌[22]、肾细胞癌[23-24]中表达一样,癌组织中SOCS3的蛋白表达均低于癌旁组织。杨意等人通过构建大鼠模型,分析SOCS3表达肝郁脾虚型溃疡性结肠炎结肠组织的表达,结果表明结肠组织中SOCS3的表达在结肠炎大鼠也明显低于对照组[25],也有力的支持了我们的结论。
在此基础上之上,本研究通过转染SW480细胞,从过表达SOCS3及敲减SOCS3两方面分析对结肠癌细胞增殖及侵袭的影响。我们发现在结肠癌细胞中,当SOCS3的表达升高时,会抑制细胞的增殖和侵袭;而当SOCS3的表达降低时会促进细胞的增殖和侵袭能力。Rigby等人研究表明SOCS3可限制结肠肿瘤形成[7-8]。Singh等人研究表明SOCS3上调可导致结肠癌细胞G1停滞[9]。Ishibashi等人研究表明,肾细胞癌细胞中SOCS3表达水平与IL-6产生水平相关,可调节肾细胞癌细胞的细胞增殖[26]。SOCS3可以调节挫伤性脊髓损伤后NG2细胞的增殖和分化[27]。淋巴瘤中,miR-155的下调通过上调SOCS3表达抑制JAK-STAT3信号通路,抑制DLBCL细胞增殖,促进细胞凋亡[28]。更有研究表明,可以通过SOCS-3调节胰腺β细胞的质量和增殖,介导胰腺β细胞中的细胞因子信号传导,可能成为开发糖尿病新治疗策略的候选靶标[29]。以上证据也有力地支持了我们的结果。总之,本研究结果更具深入地分析了SOCS3表达在结肠癌发展的影响,结肠癌发生发展可通过影响SOCS3的表达进而调控细胞的增殖和侵袭能力来发挥作用的。
最近研究表明SOCS3的甲基化修饰与多种实体肿瘤发病机制密切相关,在肺癌及肝癌等多种肿瘤中发现SOCS3启动子区异常甲基化修饰导致SOCS3转录抑制而造成表达水平下降,进一步影响细胞凋亡[4, 30]。为了分析SOCS3表达在结肠癌发生发展过程中是否受到甲基化的影响,本研究使用5-AZA及IL-6对SW480细胞进行了处理。结果表明,5-AZA处理显著促进了SOCS3在结肠癌SW480细胞的表达,而IL-6处理明显降低SOCS3的表达。结肠癌中SOCS3的表达降低明显受到5-AZA及IL-6调控的影响。进一步细胞增殖结果表明,5-AZA去甲基化抑制了SW480细胞增殖,而IL-6处理促进了细胞增殖。大量研究表明某些炎性因子可以激活SOCS3的表达[31-33],而SOCS3也可以负反馈抑制炎性因子的表达,从而抑制细胞向恶性方向转化,促进癌细胞的凋亡[34]。反之,当细胞内SOCS3表达降低,结肠癌细胞增殖及侵袭能力得以促进,进而促进了结肠癌的发生发展。本结果提示SOCS3的甲基化修饰不仅可以影响结肠癌细胞增殖,对细胞侵袭能力及结肠癌发生发展也具有关键性作用。但仍需要更多的研究去研究SOCS3的甲基化对结肠癌发生发展机制的影响。
总之,SOCS3参与结肠癌的发生发展。在结肠癌患者中,SOCS3低表达可能与甲基化有关,影响了结肠癌细胞的增殖和侵袭能力。鉴于SOCS3在肿瘤中的抑癌作用,SOCS3有望成为结肠癌新的治疗靶点。
| [1] |
尹慧, 王伟, 张强, 等. MicroRNA-381的表达下降促进结肠癌的增殖与侵袭[J].
西南国防医药, 2016, 26(7): 697-700.
DOI: 10.3969/j.issn.1004-0188.2016.07.001. |
| [2] |
Rui Q, Xu ZP, Yang P, et al. Long noncoding RNA expression patterns in lymph node metastasis in colorectal cancer by microarray[J].
Biomed Pharmacother, 2015, 75: 12-8.
DOI: 10.1016/j.biopha.2015.08.003. |
| [3] |
Ji Q, Zhang L, Liu X, et al. Long non-coding RNA MALAT1 promotes tumour growth and metastasis in colorectal cancer through binding to SFPQ and releasing oncogene PTBP2 from SFPQ/PTBP2 complex[J].
Br J Cancer, 2014, 111(4): 736-48.
DOI: 10.1038/bjc.2014.383. |
| [4] |
何靖炀, 刘秋英, 魏玲, 等. BORIS通过表观修饰对人肝癌细胞SOCS3表达的调控[J].
四川大学学报:医学版, 2018, 49(1): 1-7.
|
| [5] |
农晰婷, 杨光, 张昱. siRNA靶向抑制MACC_1对结直肠癌细胞增殖和侵袭能力的影响[J].
陕西医学杂志, 2016, 45(1): 9-11.
DOI: 10.3969/j.issn.1000-7377.2016.01.003. |
| [6] |
陈文彬, 钟文洲. GPX1在结直肠癌组织中的表达及其对癌细胞增殖、侵袭及迁移的影响[J].
中国肿瘤生物治疗杂志, 2017, 24(9): 995-1001.
|
| [7] |
Rigby RJ, Simmons JG, Greenhalgh CJ, et al. Suppressor of cytokine signaling 3 (SOCS3) limits damage-induced crypt hyper-proliferation and inflammation-associated tumorigenesis in the colon[J].
Oncogene, 2007, 26(33): 4833-41.
DOI: 10.1038/sj.onc.1210286. |
| [8] |
Rigby, J R, Greenhalgh, et al. Suppressor of cytokine signaling 3 (SOCS3) limits damage-induced crypt hyperproliferation and tumor formation in the colon[J].
Inflamm Bowel Dis, 2006, 12(38): 387-98.
|
| [9] |
Singh S, Chouhan S, Mohammad N, et al. Resistin causes G1 arrest in colon cancer cells through upregulation of SOCS3[J].
FEBS Lett, 2017, 591(10): 1371-82.
DOI: 10.1002/feb2.2017.591.issue-10. |
| [10] |
权继传, 解亦斌, 田艳涛. 国际抗癌联盟胃癌TN M分期系统第七版解读[J].
中华诊断学电子杂志, 2014, 2(1): 72-4.
DOI: 10.3877/cma.j.issn.2095-655X.2014.01.017. |
| [11] |
梁鸿, 张辉, 田鹏, 等. 艾迪联合FOLFOX4方案治疗Ⅲ期结肠癌患者术后效果观察[J].
中华实用诊断与治疗杂志, 2016, 30(2): 196-8.
|
| [12] |
Drebert Z, De Vlieghere E, Bridelance J, et al. Glucocorticoids indirectly decrease colon cancer cell proliferation and invasion via effects on cancer-associated fibroblasts[J].
Exp Cell Res, 2018, 362(2): 332-42.
DOI: 10.1016/j.yexcr.2017.11.034. |
| [13] |
李永福, 熊亮发, 杨昆宪. SOCS3过表达对乳腺癌细胞侵袭能力的影响及作用机制[J].
山东医药, 2017, 57(24): 48-50.
DOI: 10.3969/j.issn.1002-266X.2017.24.015. |
| [14] |
Tang X, Zha L, Li H, et al. Upregulation of GNL3 expression promotes colon cancer cell proliferation, migration, invasion and epithelial-mesenchymal transition via the Wnt/beta-catenin signaling pathway[J].
Oncol Rep, 2017, 38(4): 2023-32.
DOI: 10.3892/or.2017.5923. |
| [15] |
王玉琼, 丁佳寅, 诸娴, 等. 炎性因子对人胰腺癌PaTu8988细胞NF- κB及Hedgehog通路成员表达的影响[J].
中华胰腺病杂志, 2015, 15(1): 18-21.
DOI: 10.3760/cma.j.issn.1674-1935.2015.01.005. |
| [16] |
张沛, 董念国, 刘金平. SOCS3基因转染对小鼠CD4~+Th细胞分化及炎症细胞因子表达的影响及机制研究[J].
重庆医学, 2016, 45(36): 5049-51, 5055.
DOI: 10.3969/j.issn.1671-8348.2016.36.003. |
| [17] |
陈志华, 林素勇, 韩宏景, 等. 慢病毒转染KISS1基因对人结直肠癌HCT116细胞增殖、侵袭和迁移能力的影响[J].
吉林大学学报:医学版, 2017, 43(3): 577-81, 670.
|
| [18] |
Vakil L, Najafipour R, Rakhshani N, et al. Investigation of FIH-1 and SOCS3 expression in KRAS mutant and wild-type patients with colorectal cancer[J].
Tumor Biol, 2016, 37(7): 8841-8.
DOI: 10.1007/s13277-015-4723-1. |
| [19] |
张天明, 蔡成, 杜金林, 等. 沉默缺氧诱导因子-1α对结肠癌SW480细胞生长增殖、侵袭迁移能力的影响[J].
中华实验外科杂志, 2017, 34(6): 1063.
DOI: 10.3760/cma.j.issn.1001-9030.2017.06.052. |
| [20] |
Zhang B, Fang L, Wu HM, et al. Mer receptor tyrosine kinase negatively regulates lipoteichoic acid-induced inflammatory response via PI3K/Akt and SOCS3[J].
Mol Immunol, 2016, 76: 98-107.
DOI: 10.1016/j.molimm.2016.06.016. |
| [21] |
Caldow MK, Ham DJ, Chee A, et al. Muscle-specific deletion of SOCS3 does not reduce the anabolic response to leucine in a mouse model of acute inflammation[J].
Cytokine, 2017, 96: 274-8.
DOI: 10.1016/j.cyto.2017.05.016. |
| [22] |
Lv YE, Song G, Li P. Correlation of SOCS-1 gene with onset and prognosis of breast cancer[J].
Oncol Lett, 2018, 16(1): 383-7.
|
| [23] |
Urbschat A, Stumpf S, Haenze J, et al. Expression of the antiinflammatory suppressor of cytokine signaling 3 (SOCS3) in human clear cell renal cell carcinoma[J].
Tumor Biol, 2016, 37(7): 9649-56.
DOI: 10.1007/s13277-016-4857-9. |
| [24] |
Shang AQ, Wu J, Bi F, et al. Relationship between HER2 and JAK/ STAT- SOCS3 signaling pathway and clinicopathological features and prognosis of ovarian cancer[J].
Cancer Biol Ther, 2017, 18(5): 314-22.
DOI: 10.1080/15384047.2017.1310343. |
| [25] |
杨意, 朱向东, 翟艳会, 等. 痛泻要方对肝郁脾虚型溃疡性结肠炎大鼠结肠组织中gp130, SOCS3表达的影响[J].
山东医药, 2017, 57(34): 20-3.
DOI: 10.3969/j.issn.1002-266X.2017.34.006. |
| [26] |
Ishibashi K, Oguro T, Kumagai S, et al. 299IL-6 and SOCS3 regulates cell proliferation in renal cell carcinoma cells[J].
J Urol, 2013, 189(4): e121-2.
|
| [27] |
Hackett AR, Lee DH, Dawood A, et al. STAT3 and SOCS3 regulate NG2 cell proliferation and differentiation after contusive spinal cord injury[J].
Neurobiol Dis, 2016, 89: 10-22.
DOI: 10.1016/j.nbd.2016.01.017. |
| [28] |
Li XD, Li XM, Gu JW, et al. MiR-155 regulates lymphoma cell proliferation and apoptosis through targeting SOCS3/JAK-STAT3 signaling pathway[J].
Eur Rev Med Pharmacol Sci, 2017, 21(22): 5153-9.
|
| [29] |
Lindberg K, Ronn SG, Tornehave D, et al. Regulation of pancreatic beta-cell mass and proliferation by SOCS-3[J].
J Mol Endocrinol, 2005, 35(2): 231-43.
DOI: 10.1677/jme.1.01840. |
| [30] |
刘春来, 李永文, 董云龙, 等. H2228细胞和EML4-ALK阳性肺癌组织中SOCS3基因启动子区甲基化状态的研究[J].
中国肺癌杂志, 2016, 19(9): 565-70.
|
| [31] |
Chu QJ, Shen D, He L, et al. Prognostic significance of SOCS3 and its biological function in colorectal cancer[J].
Gene, 2017, 627: 114-22.
DOI: 10.1016/j.gene.2017.06.013. |
| [32] |
Li T, Wu SY, Li S, et al. SOCS3 participates in cholinergic pathway regulation of synovitis in rheumatoid arthritis[J].
Connect Tissue Res, 2018, 59(3): 287-94.
|
| [33] |
Jiang YD, Pagadala J, Miller D, et al. Reduced insulin receptor signaling in retinal Muller cells cultured in high glucose[J].
Mol Vis, 2013, 19: 804-11.
|
| [34] |
Handle F, Erb HH, Luef B, et al. SOCS3 modulates the response to enzalutamide and is regulated by androgen receptor signaling and CpG methylation in prostate cancer cells[J].
Mol Cancer Res, 2016, 14(6): 574-85.
DOI: 10.1158/1541-7786.MCR-15-0495. |
 2019, Vol. 39
2019, Vol. 39

