2. 西安交通大学医学院医学中心生物化学和分子生物学系,陕西 西安 710004
2. Department of Biochemistry and Molecular Biology, Xi'an Jiaotong University Health Science Center, Xi'an 710004, China
过氧化物酶体增殖物激活受体(PPARγ)是一类由配体激活的核转录因子,是核受体超家族中的成员之一。活化的PPARγ与过氧化物酶体反应原件E(PPREs)结合启动靶基因转录,发挥其生物学作用[1-4]。目前研究表明PPARγ通路的激活对中枢神经系统各种急、慢损伤具有显著的保护作用,可能是缺血性脑血管疾病、AD、PD等多种疾病治疗的新靶点[5-7],其机制涉及到调节氧化应激反应、抑制炎症反应以及减少细胞凋亡等方面[8-12]。但PPARγ通路在神经系统自然衰老进程中发挥何种作用尚不清楚。基于此,本研究拟应用长程培养原代神经细胞建立自然衰老神经细胞模型,通过观察干预PPARγ通路后长程培养原代神经细胞内抗氧化能力及细胞凋亡的变化,以确定PPARγ通路是否具有保护长程培养原代神经细胞的作用,并探讨其机制,为神经系统抗衰老提供新的思路。
1 材料和方法 1.1 实验动物SD大乳鼠(1 d),雌雄不限,购自武汉巴菲尔生物技术有限公司动物实验中心(NO.42000600012249)。饲养条件[室内温度22±2 ℃;湿度:(55±5)%;光照:12 h]。
1.2 主要试剂和仪器GW9662(Selleckchem),吡格列酮(Selleckchem),Neurobasal培养基(Gibco),B27添加剂(Gibco),MAP-2(兔抗大鼠,武汉三鹰生物),GFAP(小鼠抗大鼠,Santa Cruz),荧光(Cy3)标记羊抗兔IgG(武汉博士德),荧光(FITC)标记羊抗小鼠IgG(武汉博士德),MTT(Sigma),细胞凋亡检测试剂盒(南京凯基生物),细胞衰老检测试剂盒(南京凯基生物),超氧化物歧化酶测定试剂盒(南京建成生物),RIPA裂解液(碧云天),BCA蛋白浓度测定试剂盒(碧云天),还原型谷胱甘肽检测试剂盒(南京建成生物),丙二醛测定试剂盒(南京建成生物),倒置显微镜(Olympus),荧光显微镜(Olympus),体视显微镜(Olympus)。
1.3 长程培养原代神经细胞建立衰老神经细胞模型[13-14]新生1 d的SD大乳鼠脱颈处死,取下双侧大脑皮层,体视显微镜的协助下剔除大脑皮层周围的血管膜及软脑膜。将取出的组织快速剪碎,移向15 mL离心管中并加入浓度为0.125%的胰蛋白酶2 mL,混均后置于37 ℃摇床中消化10 min。离心管内加入2 mL的含胎牛血清的培养基终止消化,并用1 mL枪头反复吹打,制备成为单细胞悬液,进行过滤去除未被消化完全的细胞团块。将滤液进行800 r/min离心5 min,弃上清,得到的细胞制成细胞悬液,用Neurobasal培养基调整细胞密度。分离的细胞接种,37 ℃ 5% CO2饱和湿度条件下培养过夜。每隔两天半量换入新鲜培养基。在培养板中将已爬好细胞的玻片用PBS浸洗3次,3 min/次。倒置显微镜下观察拍照不同培养时间点细胞形态。
1.4 实验分组及干预方法衰老对照组(C组):总共培养22 d,2 d换半培养液。GW9662干预组(G组):第11天加入含GW9662的培养液[15],根据GW9662终浓度分为4个亚组:G(0.1):0.1 μmol/L,G(1):1 μmol/L,G(5):5 μmol/L,G(10):10 μmol/L,2 d换半液体,共培养22 d。吡格列酮干预组(P组):第11天加入含吡格列酮的培养液[16],根据吡格列酮终浓度分为4个亚组:P(0.1):0.1 μmol/L,P(1):1 μmol/L,P(5):5 μmol/L,P(10):10 μmol/L,2 d换半液体,共培养22 d。
1.5 MTT测定细胞活力将分离的神经元细胞以5×104/孔密度接种于96孔板,每孔200 μL细胞悬液,同时设空白组,37 ℃ 5%CO2饱和湿度条件下培养,每隔两天半量换入新鲜培养基;每孔加入20 μL MTT,37 ℃培养4 h;吸出培养基,加入150 μL DMSO震荡10 min;酶标仪测定各孔吸光值A568 nm;以C组值作为参照,设定为100%。
1.6 免疫荧光双标染色计数神经细胞个数分离的细胞以1.0×106/mL密度接种于多聚赖氨酸处理好的12孔板内,每孔加入1 mL细胞悬液,37 ℃,5% CO2饱和湿度条件下培养过夜。每隔2 d半量换入新鲜培养基。已爬好细胞的玻片用PBS浸洗,4%的多聚甲醛固定,0.5%Triton X-100室温通透20 min,血清封闭30 min,加第1种一抗MAP-2(1:100,种属:兔,中国,武汉三鹰),放入湿盒孵育(4 ℃,24 h)。加第1种二抗荧光(Cy3)标记羊抗兔IgG(1:200,中国,武汉博士德),湿盒中20~37 ℃孵育1 h。加荧光二抗后均在较暗处操作。再次血清封闭30 min,加第2种一抗GFAP(1:100,种属:小鼠,Santa Cruz),之后于湿盒中避光孵育(4 ℃,24 h)。加第2种二抗荧光(FITC)标记羊抗小鼠IgG(1:200,中国,武汉博士德),湿盒中20~37 ℃孵育1 h。最后加用DAPI进行核复染,含抗荧光淬灭剂的封片液封片。在荧光显微镜下观察采集图像。其中CY3为红色荧光,激发波长550 nm,发射波长570 nm,FITC绿色荧光,激发波长是494 nm,发射波长是518 nm。DAPI蓝色荧光,激发波长为340 nm,发射波长为488 nm。
1.7 流式细胞仪测定凋亡细胞比率将新分离的神经元细胞以2×105/mL密度接种于T25方瓶中,每瓶5 mL细胞悬液,37 ℃ 5%CO2饱和湿度条件下培养,每隔两天半量换入新鲜培养基。用不含EDTA的0.25%胰酶消化细胞,1500 r/min离心5 min,去上清,加PBS重悬;用PBS将细胞润洗2次,1500 r/min 5 min。使用AnnexinV-FITC/PI细胞凋亡检测试剂盒进行检测。流式细胞仪上机检测凋亡细胞比率。其中左上象限:(AnnexinV-FITC)-/PI+,此区域的细胞为坏死细胞;右上象限:(AnnexinV+FITC)+/PI+,此区域的细胞为晚期凋亡细胞;左下象限:(AnnexinV-FITC)-/PI-,此区域的细胞为活细胞;右下象限:(AnnexinV-FITC)+/ PI-,此区域的细胞为早期凋亡细胞。早期凋亡细胞与晚期凋亡细胞之和为凋亡细胞计数。
1.8 SOD活性、GSH含量及MDA含量测定洗涤细胞后,每瓶细胞加400 μL裂解液,于冰上裂解30 min,于4 ℃下12 000 r/min离心5 min。将离心后的上清分装转移倒离心管中放于-20 ℃保存。BCA试剂盒测定蛋白浓度。采用超氧化物歧化酶测定试剂盒测定SOD活性,微量还原型谷胱甘肽检测试剂盒测定GSH含量。丙二醛测定试剂盒测定MDA含量。
1.9 统计学方法所有数据应用SPSS(ver. 20.0)软件统计,所有实验重复3次,计量结果以均数±标准差表示。多组间比较应用单因素方差分析,两两比较采用t检验,P < 0.05为差异有统计学意义。
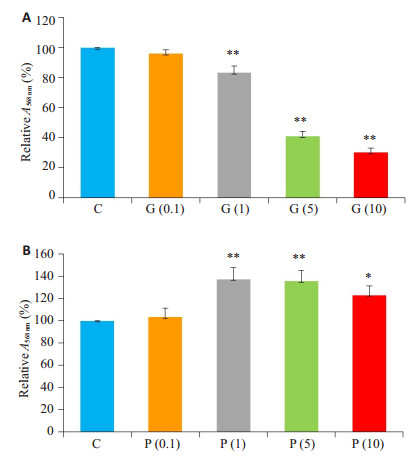
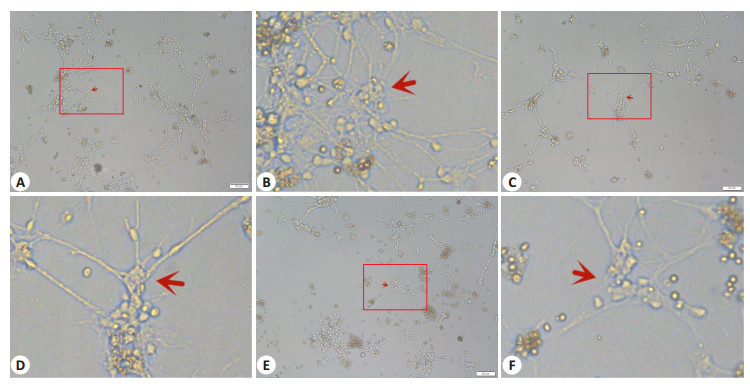
2 结果 2.1 PPARγ通路阻滞剂及激动剂干预浓度的确定本实验应用MTT法测定不同浓度GW9662干预后长程培养原代神经细胞活力。结果显示:随着干预浓度的增加,细胞活力进行性下降,其中G(1)、G(5)和G(10)组细胞活力较C组均显著降低(P < 0.05,图 1A)。应用倒置显微镜观察不同浓度梯度干预后长程培养原代神经细胞形态变化。结果发现G(1)组神经细胞形态完整,部分突触交织成网。G(5)和G(10)组神经细胞聚集,仅少部分细胞存在极少突触,神经网络基本消失(图 2)。最终确定后续实验G组的GW9662干预浓度为1 μmol/L。
|
图 1 各组细胞活力统计分析图 Fig.1 Changes of cell viability after intervention with different concentrations of GW9662 (A) and pioglitazone (B). The absorbance values relative to that of the control group are shown. *P < 0.05 vs C Group; **P < 0.005 vs C Group |
|
图 2 不同浓度GW9662干预后神经细胞形态变化 Fig.2 Morphology of the nerve cells after intervention with different concentrations of GW9662 (Inverted microscopy). A: Morphology of nerve cells treated with 1 μmol/L GW9662 (Original magnification: ×100); B: Enlarged view of the red box in A (×400); C: Morphology of nerve cells treated with 5 μmol/L GW9662 (×100); D: Enlarged view of the red box in C (×400); E: Morphology of nerve cells treated with 10 μmol/LGW9662 (×100); F: Enlarged view of the red box in E (×400) |
本实验应用MTT法测定不同浓度吡格列酮干预后衰老长程培养原代神经细胞活力。结果显示:加用吡格列酮干预后细胞活力较C组提高,其中P(1)、P(5)和P(10)组细胞活力较C组提高具有统计学意义(P < 0.05,图 1B)。但P(1)、P(5)、P(10)组3组之间比较无明显差异(P > 0.05)。最终确定后续实验P组的吡格列酮干预浓度为1 μmol/L。
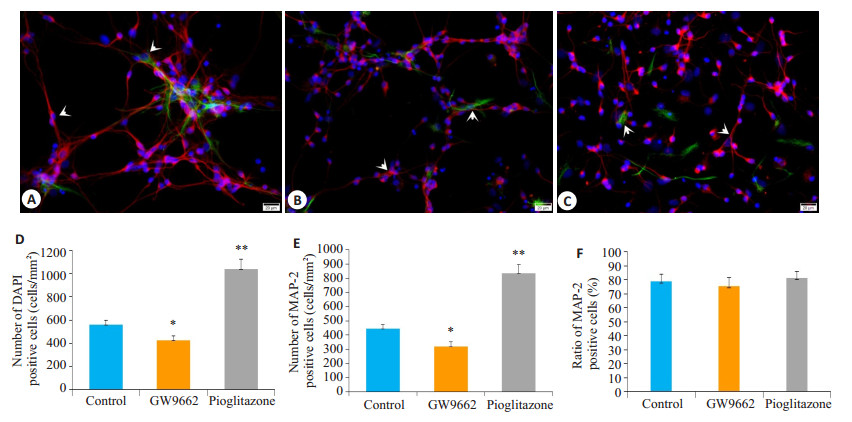
2.2 PPARγ通路激活增加长程培养原代神经细胞计数本实验应用免疫荧光双标染色计数吡格列酮及GW9662干预后各组细胞总数和神经细胞数量(图 3)。结果显示:G组细胞总数及神经细胞计数均较C组显著下降(P < 0.05),而P组细胞总数及神经细胞计数均显著高于C组(P < 0.05)。各组神经细胞比率均维持在80%左右,差异无统计学意义(P > 0.05,图 3)。
|
图 3 各组神经细胞形态及细胞计数统计分析图 Fig.3 Morphological and cell count changes of the nerve cells after GW9662 and pioglitazone treatment. Red: MAP-2 staining positive cells; Green: GFAP staining positive cells; Blue: DAPI staining positive cells. A, B, and C: Nerve cell morphology in control, GW9662, and pioglitazone groups, respectively (Double immunofluorescence labeling, × 400); D-F: Statistical analysis of DAPI- positive and MAP-2-positive cell counts and MAP-2 positive cell ratio, respectively. *P < 0.05, **P < 0.005 vs control group |
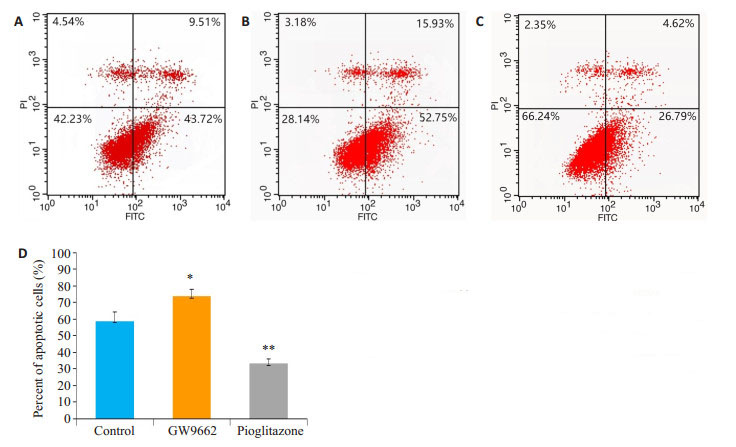
应用AnnexinV- FITC/PI双标流式细胞仪检测GW9662及吡格列酮干预后细胞凋亡率。结果显示:G组细胞凋亡率显著高于C组(P < 0.05),而P组细胞凋亡率显著低于C组(P < 0.05,图 4)。
|
图 4 各组凋亡细胞散点图和统计分析图(AnnexinVFITC/PI双标流式细胞仪检测) Fig.4 Flow cytometry of apoptotic cells in each group (Annexin V-FITC/PI double-labeling flow cytometry). A: Control group; B: GW9662 group; C: Pioglitazone group; D: Comparison of apoptotic cell ratio among the 3 groups. *P < 0.05, **P < 0.005 vs control group |
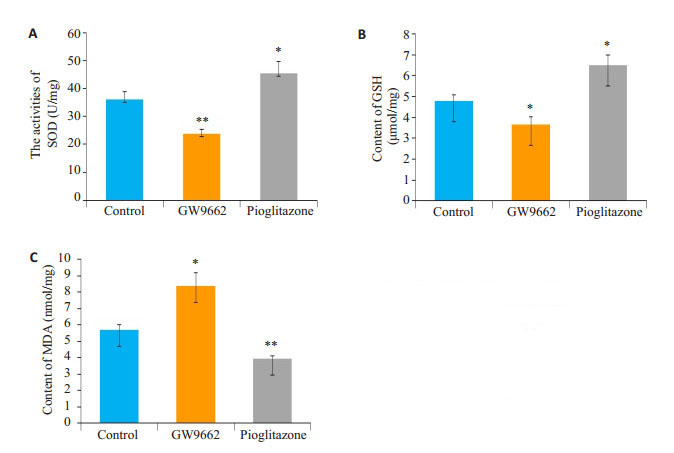
本实验应用免疫化学方法测定GW9662和吡格列酮干预后细胞抗氧化酶SOD活性、GSH含量和MDA含量的变化。结果显示:G组SOD活性及GSH含量均较C组显著降低(P < 0.05),而MDA含量较C组显著增加(P < 0.05);P组SOD活性及GSH含量均较C组显著升高(P < 0.05),而MDA含量较C组显著减少(P < 0.05,图 5)。
|
图 5 各组间细胞内SOD活性、GSH及MDA含量统计分析图(免疫化学法) Fig.5 Statistical analysis of SOD activity (A), GSH (B) and MDA (C) contents in the cells in each group (Immunochemistry method). *P < 0.05, **P < 0.005 vs control group |
既往研究显示长程培养原代神经细胞制备的自然衰老神经细胞模型能反映生理条件下神经细胞的衰老进程[13-14, 17-18]。我们既往应用新生1 d大鼠皮层神经细胞进行长程培养,通过观察神经细胞形态、神经纤维网络、细胞总数、细胞活力、凋亡细胞率及衰老细胞比率的变化,发现DIV22时长程培养的原代神经细胞表现出典型的衰老相关表现,成功模拟了神经细胞的自然衰老过程[14]。鉴于此,本实验仍采用长程培养原代神经细胞建立自然衰老损伤模型。神经细胞在长程培养过程中经历发育、成熟稳定、衰老退化3个阶段。伴随衰老的进行,原代神经细胞活力下降,线粒体膜电位下降,抗氧化能力下降,蛋白羰基及Aβ沉积,凋亡相关蛋白表达变化,最终神经元对各种应激所致细胞死亡的敏感性增加[17-18]。虽然在体神经系统内衰老相关性神经细胞的减少是否存在尚有争议[19-21],但离体原代神经细胞培养体系中,随着培养时间的延长,死亡神经细胞增加,因得不到新生神经细胞的补充,最终可以导致神经细胞总数的减少。因而,残存细胞数量是长程培养原代神经细胞衰老的重要标志。既往对长程培养体系中神经元数量的研究发现,神经元数量在发育期及成熟期维持相对稳定,进入衰老期后逐渐下降,而神经细胞凋亡的增加是长程培养神经细胞计数减少的重要原因[14]。本研究中我们应用细胞核DAPI染色进行总细胞计数,以神经细胞树突标志物MAP-2染色进行神经细胞计数,应用流式细胞仪检测凋亡细胞比率。结果显示培养22 d的C组细胞总数仅500 cells/mm2左右,但凋亡细胞比率超过50%,这与我们前面的研究一致[14]。因而寻找到一种阻止长程培养神经细胞凋亡,降低细胞凋亡率的途径可能是保护神经细胞衰老损伤的有效方法。
PPARγ是配体活化的Ⅱ型核受体超家族成员之一,是具有调控代谢过程相关基因转录作用的核转录因子[22-23]。非活化状态下,细胞内PPARγ与视黄醛酸受体(RXRs)形异物二聚体PPAR-RXRs与阻遏蛋白结合抑制靶基因转录[3];激活状态下,阻遏蛋白分离释放,PPARγ蛋白活化,进入细胞核内,结合共激活因子,启动靶基因转录[22],发挥生理作用。以下3条是其主要生理机制:(1)PPARγ活化途径:PPARγ直接结合配体,通过调节PPARγ磷酸化修饰参与MARK和PI3K及细胞凋亡等的调控[6];(2)PPARγ激活调控靶基因转录途径:配体激活PPARγ,活化的PPARγ进入细胞核内结合PPRE,通过影响基因转录水平调控氧化应激、细胞增殖、分化和凋亡等环节[7];(3)PPARγ与其他转录因子及信号交叉途径:PPARγ通过非DNA结合方式作用竞争性抑制NF-κB、JAK-STAT等途径,对抗炎性损伤[24]。现有研究显示PPARγ通路参与AD、PD等神经退行性疾病的保护作用[25-27]。PPARγ激动剂能够显著改善AD大鼠模型的认知能力,并与大鼠海马区ERK通路的激活有关[28-29],而PPARγ激动剂可以通过修复AD模型齿状回神经细胞功能改善其认知功能[30]。除此之外,有研究显示PPARγ激活参与保护神经细胞的各种损伤[31-34]。如吡格列酮能够通过增加NF-κB亚基c-Rel调控的抗凋亡因子Bcl-xLmRNA表达,保护大鼠皮质神经细胞[31];PPARγ激活能够上调Bcl-2表达量保护小鼠皮质神经元的缺氧、缺糖损伤[32];而PPARγ激活可以通过减少不同损伤导致的细胞凋亡保护SH-SY5Y细胞[33-34]。这些研究均显示PPARγ的神经细胞保护作用与减少细胞凋亡密切相关。但是PPARγ激活是否能够保护长程培养原代神经细胞及其保护机制是否涉及细胞凋亡尚不清楚。基于此,本研究首先应用MTT及免疫荧光双标染色法检测发现应用PPARγ阻滞剂GW9662干预后长程培养原代神经细胞活力进行性下降,细胞计数减少;而给予PPARγ激动剂吡格列酮干预后长程培养神经细胞活力显著提高,同时细胞计数明显升高。这从正反两方面证实PPARγ通路激活对长程培养原代神经细胞具有保护作用,提示PPARγ通路可能是神经衰老损伤的保护作用靶点。为进一步探讨PPARγ通路激活保护长程培养原代神经细胞的机制,本研究应用流式细胞仪测定了长程培养原代神经细胞凋亡情况。结果显示PPARγ通路阻滞后长程培养原代神经细胞凋亡比率显著升高,而PPARγ通路激活后细胞凋亡比率显著降低。该结果提示与其他神经细胞损伤模型相似[33-34],PPARγ通路激活可以通过影响神经细胞凋亡保护长程培养原代神经细胞,但其具体机制尚不清楚。
目前认为大部分神经细胞的老化死亡都属于凋亡一类[35-36]。而这种细胞凋亡可能与自由基的潴积[37-38],神经生长因子的减少[39]及神经递质的改变[40]密切相关。既往研究证实氧自由基的潴积是神经系统及神经细胞损伤的关键因素之一[41-42],它影响着神经细胞的凋亡[14],因而提高抗氧化能力是机体减少细胞凋亡对抗衰老的关键因素之一。研究显示PPARγ通路与细胞的抗氧化能力密切相关[43]。研究认为PPARγ激活通过抑制氧化应激损伤保护神经干细胞[44],PPARγ参与的抗氧化应激损伤保护了AD细胞模型[45]。由此我们推测PPARγ激活减少细胞凋亡保护长程培养原代神经细胞可能也涉及到细胞抗氧化能力的提高。为证实该假设,本研究应用免疫化学法观察了PPARγ通路干预后长程培养原代神经细胞氧化应激相关指标的变化。结果发现PPARγ通路激活显著提高了长程培养原代神经细胞的抗氧化能力,减少了MDA的潴积,而PPARγ通路阻滞后细胞抗氧化能力显著下降,MDA明显升高。由此推测细胞抗氧化能力的变化是PPARγ通路激活减少细胞凋亡,保护长程培养原代神经细胞的途径之一。但是,PPARγ通路影响细胞凋亡的途径除了减少氧化应激反应之外尚存在PPARγ磷酸化修饰途径及竞争性影响NF-κB、JAK-STAT等途径[6, 24],在长程培养神经细胞上是否也存在着这两种途径有待后期进一步研究。
综上所述,本研究从正反两方面证实了PPARγ通路激活可以通过增强细胞抗氧化能力,减少细胞凋亡,增加细胞计数,提高细胞活力,最终保护衰老长程培养原代神经细胞,提示针对PPARγ通路进行的药物干预可能是临床减少神经细胞凋亡抗神经系统衰老治疗的有效途径之一。但是本研究仅初步揭示了其机制,其详细的复杂机制仍有待进一步研究。同时本研究也只是细胞层面的基础研究,需要进一步的在体研究验证。
| [1] |
Lehrke M, Lazar MA. The many faces of PPARgamma[J].
Cell, 2005, 123(6): 993-9.
DOI: 10.1016/j.cell.2005.11.026. |
| [2] |
Harada S, Hiromori Y, Nakamura S, et al. Structural basis for PPAR gamma transactivation by endocrine-disrupting organotin compounds[J].
Sci Rep, 2015, 5.
DOI: 10.1038/srep08520. |
| [3] |
Plutzky J. The PPAR-RXR transcriptional complex in the vasculature energy in the balance[J].
Circ Res, 2011, 108(8): 1002-16.
DOI: 10.1161/CIRCRESAHA.110.226860. |
| [4] |
Álvarez-Almazán S, Bello M, Tamaycach F, et al. Study of new interactions of glitazone's stereoisomers and the endogenous ligand 15d-PGJ2 on six different PPAR gamma proteins[J].
Biochem Pharmacol, 2017, 142(2017): 168-93.
|
| [5] |
Agarwal S, Yadav A, Chaturvedi RK. Peroxisome proliferatoractivated receptors(PPARs)as therapeutic target in neurodegenerative disorders[J].
Biochem Biophys Res Commun, 2017, 483(4): 1166-77.
DOI: 10.1016/j.bbrc.2016.08.043. |
| [6] |
Pang T, Sun LX, Wang T, et al. Telmisartan protects central neurons against nutrient deprivation-induced apoptosis in vitro through activation of PPARy and the Akt/GSK-beta pathway[J].
Acta Pharmacol Sin, 2014, 35(6): 727-37.
DOI: 10.1038/aps.2013.199. |
| [7] |
Taheri M, Salamian A, Ghaedi K, et al. A ground state of PPAR gamma activity and expression is required for appropriate neural differentiation of hESCs[J].
Pharmacol Rep, 2015, 67(6): 1103-14.
DOI: 10.1016/j.pharep.2015.04.011. |
| [8] |
董燕, 丁奇, 金英, 等. 吡格列酮对Aβ_(25-35)引起的皮层神经元损伤保护作用部分机制的研究[J].
中国药理学通报, 2010, 26(12): 1652-7.
|
| [9] |
Landreth G, Jiang Q, Mandrekar S, et al. PPARgamma agonists as therapeutics for the treatment of Alzheimer's disease[J].
Neurotherapeutics, 2008, 5(3): 481-9.
DOI: 10.1016/j.nurt.2008.05.003. |
| [10] |
Swanson CR, Joers V, Bondarenko VA, et al. The PPAR-gamma agonist pioglitazone modulates inflammation and induces neuroprotection in parkinsonian monkeys[J].
J Neuroinflammation, 2011, 8(1): 1-14.
DOI: 10.1186/1742-2094-8-1. |
| [11] |
Huot P, Johnston TH, Fox SH, et al. Pioglitazone May impair LDOPA anti-parkinsonian efficacy in the MPTP-lesioned macaque: results of a pilot study[J].
Synapse, 2015, 69(3): 99-102.
DOI: 10.1002/syn.v69.3. |
| [12] |
Pilipovic K, Zupan Z, Dolenec PA, et al. A single dose of PPAR gamma agonist pioglitazone reduces cortical oxidative damage and microglial reaction following lateral fluid percussion brain injury in rats[J].
Prog Neuropsychopharmacol Biol Psychiatry, 2015, 59(2015): 8-20.
|
| [13] |
Lesuisse C, Martin LJ. Long-term culture of mouse cortical neurons as a model for neuronal development, aging, and death[J].
J Neurobiol, 2002, 51(1): 9-23.
|
| [14] |
Wang HQ, Fan JX, Chen MY, et al. rhEPO enhances cellular antioxidant capacity to protect long-term cultured aging primary nerve cells[J].
J Mol Neurosci, 2017, 62(3/4): 291-303.
|
| [15] |
Zeng Y, Xie K, Dong H, et al. Hyperbaric Oxygen preconditioning protects cortical neurons against oxygen-glucose deprivation injury: role of peroxisome proliferator-activated receptor-gamma[J].
Brain Res, 2012, 1452(13): 140-50.
|
| [16] |
Gray E, Ginty M, Kemp K, et al. The PPAR-γ agonist pioglitazone protects cortical neurons from inflammatory mediators via improvement in peroxisomal function[J].
J Neuroinflammation, 2012, 9(1): 63.
|
| [17] |
Dong WG, Cheng SW, Huang F, et al. Mitochondrial dysfunction in long-term neuronal cultures mimics changes with aging[J].
Med Sci Monit, 2011, 17(4): BR91-6.
|
| [18] |
Bertrand SJ, Aksenova MV, Aksenov MY, et al. Endogenous amyloidogenesis in long-term rat hippocampal cell cultures[J].
BMC Neurosci, 2011, 12(1): 38.
DOI: 10.1186/1471-2202-12-38. |
| [19] |
Brody H. Organization of the cerebral cortex. Ⅲ. A study of aging in the human cerebral cortex[J].
J Comp Neurol, 1995, 102(2): 511-6.
|
| [20] |
Roberts DE, Killiany RJ, Rosene DL. Neuron numbers in the hypothalamus of the normal aging rhesus monkey: stability across the adult lifespan and between the sexes[J].
J Comp Neurol, 2012, 520(6): 1181-97.
DOI: 10.1002/cne.v520.6. |
| [21] |
Uylings HB, de Brabander JM. Neuronal changes in normal human aging andAlzheimer's disease[J].
Brain Cogn, 2002, 49(3): 268-76.
DOI: 10.1006/brcg.2001.1500. |
| [22] |
Berger J, Moller D. The mechanisms of action of PPARs[J].
Annu Rev Med, 2002, 53(1): 409-35.
DOI: 10.1146/annurev.med.53.082901.104018. |
| [23] |
章红妍, 蒙思颖, 林利芳, 等. PPARγ在神经系统中能够促进IRS-4基因表达[J].
南方医科大学学报, 2013, 33(10): 1463-6.
|
| [24] |
Huang T, Gao DK, Hei YE, et al. D-allose protects the blood brain barrier through PPAR gamma-mediated anti-inflammatory pathway in the mice model of ischemia reperfusion injury[J].
Brain Res, 2016, 1642(2016): 478-86.
|
| [25] |
Liu J, Wang LN, Jia JP. Peroxisome proliferator-activated receptorgamma agonists for alzheimer's disease and amnestic mild cognitive impairment: a systematic review and meta-analysis[J].
Drugs Aging, 2015, 32(1): 57-65.
DOI: 10.1007/s40266-014-0228-7. |
| [26] |
Vallée A, Lecarpentier Y. Alzheimer disease: crosstalk between the canonical wnt/beta-catenin pathway and PPARs alpha and gamma[J].
Front Neurosci, 2016, 10(429): 459.
|
| [27] |
郭鹏, 王晓民, 王德生. 过氧化物酶体增殖物激活受体γ在神经系统退行性疾病中的作用研究进展[J].
生理科学进展, 2015, 27(5): 379-82.
|
| [28] |
Denner LA, Rodriguez-Rivera J, Haidacher SJ, et al. Cognitive enhancement with rosiglitazone links the hippocampal PPARγ and ERK MAPK signaling pathways[J].
J Neurosci, 2012, 32(47): 1635a-725.
|
| [29] |
Dineley KT, Jahrling J, Hernandez CA, et al. Ppara recruitment to active ERK during memory consolidation is required for alzheimer's disease-related cognitive enhancement[J].
J Neurosci, 2014, 35(3, S): 4054-63.
|
| [30] |
Nenov MN, Tempia F, Denner L, et al. Impaired firing properties of dentate granule neurons in an Alzheimer's disease animal model are rescued by PPAR gamma agonism[J].
J Neurophysiol, 2015, 113(6): 1712-26.
DOI: 10.1152/jn.00419.2014. |
| [31] |
何兰英, 张蓓, 罗勇. 吡格列酮对培养大鼠大脑皮质神经元氧-葡萄糖剥夺/复氧后PPARγ, NF-κB c-Rel和Bcl-xL表达的影响[J].
国际脑血管病杂志, 2013, 21(5): 357-62.
DOI: 10.3760/cma.j.issn.1673-4165.2013.05.005. |
| [32] |
李键, 冯江, 段宇, 等. 15d-PGJ_2对神经元氧糖剥夺/复氧损伤的影响[J].
中风与神经疾病杂志, 2016, 33(10): 873-7.
|
| [33] |
Lee JE, Park JH, Jang SJ, et al. Rosiglitazone inhibits chlorpyrifosinduced apoptosis via modulation of the oxidative stress and inflammatory response in SH-SY5Y cells[J].
Toxicol Appl Pharmacol, 2014, 278(2): 159-71.
DOI: 10.1016/j.taap.2014.04.021. |
| [34] |
Ko J, Park JH, Park YS, et al. PPAR- gamma activation attenuates deltamethrin-induced apoptosis by regulating cytosolic PINK1 and inhibiting mitochondrial dysfunction[J].
Toxicol Lett, 2016, 260(2016): 8-17.
|
| [35] |
Ermini F, Jucker M. Nerve cell loss and neurogenesis in the aging brain[J].
Praxis, 2000, 89(40): 1605-8.
|
| [36] |
Aging AY. Disease and nerve cell death[J].
Bull Acad Natl Med, 1995, 179(6): 1193-203.
|
| [37] |
刘师兵, 徐冶, 于洋, 等. 人胎盘组织液对自然衰老大鼠海马区细胞凋亡和氧化应激的影响[J].
中国老年学杂志, 2016, 36(2): 282-4.
DOI: 10.3969/j.issn.1005-9202.2016.02.012. |
| [38] |
Wood KA, Youle RJ. The role of free radicals and p53 in neuron apoptosis in vivo[J].
J Neurosci, 1995, 15(8): 5851-7.
DOI: 10.1523/JNEUROSCI.15-08-05851.1995. |
| [39] |
Wang ZM, Qiu ZW, Gao CX, et al. 2, 5-hexanedione downregulates nerve growth factor and induces neuron apoptosis in the spinal cord of rats via inhibition of the PI3K/Akt signaling pathway[J].
PLoS One, 2017, 12(6): e0179388.
DOI: 10.1371/journal.pone.0179388. |
| [40] |
Tian K, Wang YX, Li LX, et al. Neuronal death/apoptosis induced by intracellular Zinc deficiency associated with changes in amino-acid neurotransmitters and glutamate receptor subtypes[J].
J Inorg Biochem, 2018, 179(2018): 54-9.
|
| [41] |
Samson FE, Nelson SR. The aging brain, metals and Oxygen free radicals[J].
Cell Mol Biol (Noisy-le-grand), 2000, 46(4): 699-707.
|
| [42] |
Sims-Robinson C, Hur J, Hayes JM, et al. The role of oxidative stress in nervous system aging[J].
PLoS One, 2013, 8(7): e68011.
DOI: 10.1371/journal.pone.0068011. |
| [43] |
Feng X, Yu W, Li X, et al. Apigenin, a modulator of PPAR 款, attenuates HFD-induced NAFLD by regulating hepatocyte lipid metabolism and oxidative stress via Nrf2 activation[J].
Biochem Pharmacol, 2017, 136(2017): 136-49.
|
| [44] |
Chiang MC, Nicol CJ, Yc C, et al. Rosiglitazone activation of PPARγ- dependent pathways is neuroprotective in human neural stem cells against amyloid-beta-induced mitochondrial dysfunction and oxidative stress[J].
NeurobiolAging, 2016, 40(2016): 181-90.
|
| [45] |
Zhang ZX, Li YB, Zhao RP. Epigallocatechin gallate attenuates β- Amyloid Generation and oxidative stress involvement of PPARγ in N2a/APP695 cells[J].
Neurochem Res, 2017, 42(2): 468-80.
DOI: 10.1007/s11064-016-2093-8. |
 2019, Vol. 39
2019, Vol. 39

