2. 南方医科大学南方医院器官移植科,广东 广州 510515
2. Department of Organ Transplantation, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
BK病毒(BKV)属乳多空病毒科多瘤病毒,在正常人群中普遍存在潜伏感染,但BKV感染对健康人群并不致病[1]。病毒可以大量存在于肾小管及尿路上皮细胞中,当宿主免疫功能低下时,可导致BKV被激活。肾移植术后BKV再激活导致的BK多瘤病毒相关性肾病(BKVAN)比例达10%,是造成移植物失功的重要原因[2-3]。目前,国内外研究显示BKV感染与免疫抑制强度有关[4-5],降低免疫抑制剂使用量,能减少BKV载量[6-7]。但BKV感染与尿隐血的相关性、BKV载量变化速率与免疫抑制剂谷值血药浓度变化速率的关系未见文献报道。因此,探讨BKV载量与血药浓度变化的关系、BKV感染对移植肾功能影响,对肾移植受者BKV再激活的临床症状早期发现、早期诊断和早期治疗具有重要意义。
1 资料和方法 1.1 研究对象选择2013年1月~2018年1月在南方医科大学南方医院行BKV载量规律监测且检测结果为阳性的157例肾移植受者作为研究组,其中排除了泌尿系感染、泌尿系结石、小儿供肾及多囊肾患者。研究对象包括:尿BKV阳性(连续2次尿液BKV载量为1.0×104~1.0×107 copy/mL)、BKV尿症(连续2次尿液BKV载量>1.0× 107 copy/mL)和BKV血症(连续2次血浆BKV载量≥1.0×104 copy/mL)[8]。收集上述受者的人口统计学资料、临床资料及随访资料。同时,选择同期接受移植、年龄相近(△≤5岁)且尿液BKV载量始终< 1.0×104copy/mL的69例肾移植受者,作为BKV阴性对照组。尿BKV阳性、BKV尿症、BKV血症和阴性对照组的随访时间分别为15.0(0.3~76.0)月、22.2(2.8~85.0)月、38.0(16.0~ 98.2)月和15.5(0.5~80.1)月。
1.2 BKV感染的监测对研究对象的尿液和外周血标本进行实时荧光定量聚合酶链反应(qRT-PCR)检测。采用BKV核酸检测试剂盒(PCR-荧光探针法)检测尿液和血标本中BKV载量。
1.3 免疫抑制方案肾移植受者免疫诱导方案:所有受者在术后第1~3天应用抗胸腺免疫球蛋白,术前评估为高风险的受者(群体反应性抗体阳性,女性多次妊娠史,再次移植,心脏死亡供者肾移植等)在术前2 h及术后第4天加用抗CD25单克隆抗体2剂诱导。甲基强的松龙术后3 d连续以0.5、0.25、0.25 g静脉给药,后改为甲泼尼龙20 mg/d口服给药,1月内逐渐减量至8 mg/d维持。术后均给予钙调磷酸酶抑制剂(CNI)类药物为主的三联免疫抑制方案:[他克莫司(Tacrolimus)或环孢素(CsA)]+霉酚酸酯(MPA)或麦考酚钠肠溶片(EC-MPS)+强的松(Pred),FK506以0.15~0.3 mg/kg、2次/d,CsA以4~5 mg/kg、2次/d起始给药,根据血药浓度调整药物剂量。术后前3个月,Tacrolimus和CsA的血药靶浓度分别为8~9 ng/mL、280~300 ng/mL。MPA以0.5 g、2次/d,EC-MPS以0.36 g、2次/d剂量给药并维持。
1.4 移植肾功能检测eGFR由简化的改良肾小球滤过率估算公式计算[9]:eGFR=175×血肌酐-1.234×年龄-0.179×0.79(若女性)。eGFR≥60 mL/(min·1.73 m2),视为eGFR基线水平;eGFR < 60 mL/(min·1.73 m2),视为eGFR减退;eGFR < 15 mL/(min·1.73 m2),视为肾功能丢失[10]。
急性排斥反应的诊断标准:临床表现为体温升高、排尿量减少、移植肾肿大压痛以及血压升高等;实验室检查血肌酐升高30 μmol/L以上;彩色多普勒超声检查移植肾各级动脉血管阻力指数升高(RI>0.75),并排除其他原因如梗阻等引起的肾功能损害[11-12];移植肾细针穿刺活检病理检查符合急性排斥反应的Banff病理分类标准[13]。
1.5 统计分析采用SPSS 22.0软件,正态分布计量资料用均数±标准差表示;非正态分布的计量资料以中位数(最小值-最大值)表示;计数资料以率表示。构成比的比较用χ2检验,BKV载量变化率与Tacrolimus、MPA血药浓度变化率的关系采用线性回归分析,非正态分布独立样本间比较用秩和检验。统计检验均采用双侧检验,P < 0.05认为差异有统计学意义。
2 结果 2.1 一般情况回顾临床资料,最终纳入本研究的BKV阳性肾移植受者157例,男104例(66.2%), 女53例,年龄(41±11)岁。其中,尿BKV阳性60例(38.2%)、BKV尿症66例(42.0%)以及BKV血症31例(19.7%)。BKV尿症患者有26例从尿BKV阳性进展而来,BKV血症患者有13例直接从尿BKV阳性进展而来,18例从BKV尿症进展而来。阴性对照组69例,男41例,女28例,年龄(40±7)岁。研究组和对照组的年龄、性别差异均无统计学意义(P>0.05)。
2.2 尿BKV阳性、BKV尿症和BKV血症首次出现的时间157例肾移植受者中在移植术前检测出尿BKV阳性2例,移植术后发展为BKV尿症。移植术后首次出现尿BKV阳性、BKV尿症、BKV血症的时间分布(图 1),提示:移植术后出现尿BKV阳性60例(38.2%),BKV尿症64例(40.8%),BKV血症31例(19.7%),中位数时间分别是移植术后3.4(0~171.3)月、5.6(0~180.9)月和10.5(0.1~115.8)月;肾移植受者出现BKV尿症后出现BKV血症18例(11.7%),中位数时间2.8(0.2~34.6)月。
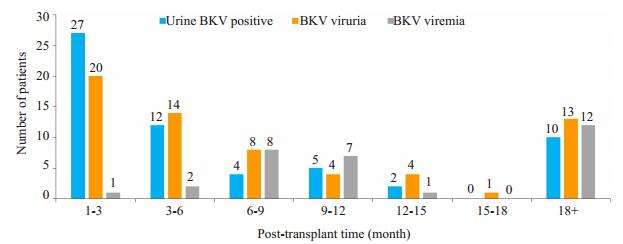
|
图 1 BKV复制程度-时间分布图 Fig.1 Time interval from transplant to occurrence of urine BKV positivity, BKV viruria and BKV viremia. |
同时检测移植受者BKV载量和尿隐血情况,发现BKV阳性患者尿隐血阳性率为62.4%(n=98),其中尿BKV阳性组、BKV尿症组、BKV血症组分别为49.5%、68.2%、75.8%;而BKV阴性患者尿隐血阳性率为44.9%(n=31)。BKV阳性患者与BKV阴性患者相比,尿隐血阳性率更高,差异有统计学意义(χ2=5.987,P=0.019)。
2.4 免疫抑制剂对BKV载量的影响在移植术后1年内,每间隔1个月检测移植受者尿液BKV载量,取其以10为底的对数值,并比较Tacrolimus和MPA的谷值血药浓度水平(表 1,图 2)。尿液BKV载量对数值、Tacrolimus和MPA谷值血药浓度在移植后3个月时间点的平均值分别为7.1 copy/mL、9.5 ng/mL和2.1 μg/mL,在10个月的时间点为5.5 copy/mL、8.0 ng/mL和2.3 μg/L。肾移植手术3个月后,患者尿液BKV载量的变化与Tacrolimus谷值血药浓度变化趋势基本一致。
| 表 1 尿液BKV载量对数值、Tacrolimus和MPA的谷值血药浓度 Tab.1 Urine BKV load and trough blood levels of Tacrolimus and MPA |
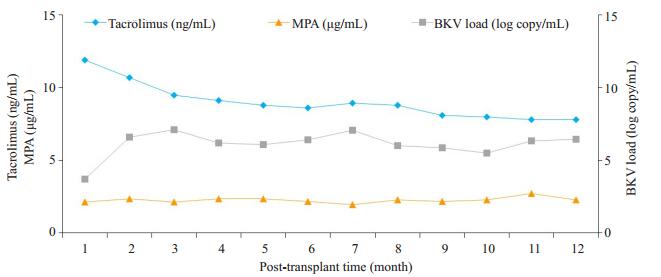
|
图 2 移植术后1年内尿液BKV载量、Tacrolimus和MPA谷值血药浓度水平变化 Fig.2 Changes of urine BKV load, Tacrolimus and MPAtrough blood levels in one year after transplantation. |
比较尿液BKV载量对数值变化率与同时期Tacrolimus和MPA谷值血药浓度变化率。相关性分析结果显示,移植术后受者尿液BKV载量变化率与Tacrolimus谷值血药浓度变化率呈正相关(r2=0.351,P=0.000),而与MPA谷值血药浓度变化的相关性无统计学意义(r2=0.006,P=0.088,图 3)。
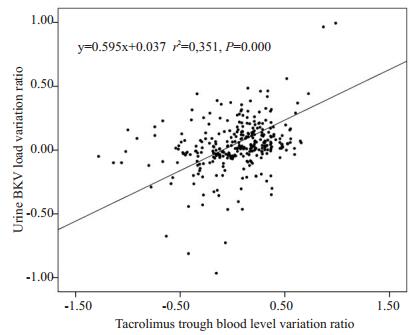
|
图 3 尿液BKV载量对数值变化率与Tacrolimus谷值血药浓度变化率的线性相关图 Fig.3 Linear correlation between urine BKV load variation ratio and Tacrolimus trough blood level variation ratio. |
所有肾移植受者规律随访,排除7例(尿BKV阳性组4例,BKV尿症组3例)因出现急性排斥反应导致eGFR降低。在首次发现BKV再激活时,尿BKV阳性组、BKV尿症组和BKV血症组的平均eGFR均低于对照组,差异有统计学意义(P=0.008, 0.002, 0.000)。截止至末次随访BKV血症组的平均eGFR明显低于尿BKV阳性组和BKV尿症组(P=0.006, 0.062)。各组的eGFR变化趋势如图 4所示,免疫抑制剂减量后,尿BKV阳性组的平均eGFR恢复至基线水平以上[eGFR≥60 mL/(min·1.73 m2)],而BKV尿症组和BKV血症组的平均eGFR虽有所改善,但仍然低于基线水平。
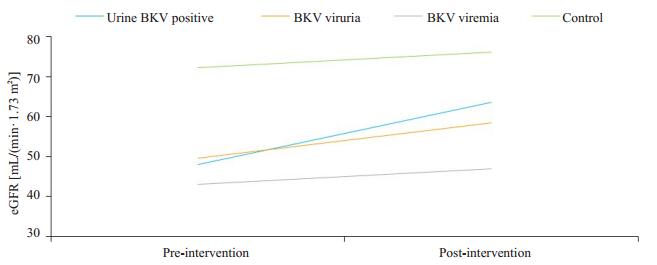
|
图 4 各组干预前后eGFR变化趋势图 Fig.4 Changes of eGFR after intervention in the 4 groups. |
BKV在成人中的感染率高达82%,初次感染多发于儿童期,但健康人不会出现明显的BKV感染症状[14]。对于免疫力低下或服用免疫抑制剂的人群,潜伏在泌尿系统上皮细胞中的病毒可以被激活,再次引发机体感染[15]。文献报道肾移植术后BKV尿症、BKV血症和BKVAN的发生率分别为30%~60%、10%~25%和0~ 10% [16]。本中心肾移植术后BKV尿症和BKV血症的发生率分别为29.2%和13.7%。
肾移植术后BKV感染早期无明显临床症状[17],本研究发现在排除泌尿系感染等影响因素后,BKV阴性组中尿隐血阳性率达44.9%,BKV阳性组62.4%,提示移植术后尿隐血可能存在某些共同的因素,而BKV感染则加重了这一损伤作用。由于肾移植受者免疫力低下,潜伏在尿路上皮细胞的BKV增殖性感染,导致宿主细胞破碎溶解、细胞器损伤,肾小管上皮细胞内的过氧化物酶体释放过氧化氢,氧化各种细胞器碎片,使得对机体有害的物质变成无毒性的物质, 同时也引起尿隐血。也有可能是病毒扩散到管间和管周毛细血管,直接损伤红细胞,导致其内的血红素释放。因此,对于移植术后患者,不明原因的尿隐血阳性可能BKV增殖性感染相关,其可作为BKV激活早期筛查的警示信号。
3.2 BKV复制的早期筛查本研究中,肾移植受者发生尿BKV阳性、BKV尿症和BKV血症的中位时间分别为移植术后3.4月、6.5月和10.5月。移植术后半年内是发生BKV尿症的高峰期,这可能是由于早期免疫抑制剂浓度保持在较高的水平上,受者容易发生BKV感染、再激活。因此肾移植受者术后BKV载量的监测,对早期发现BKV增殖性感染、BKV尿症及BKV血症并及时采取干预措施具有重要意义[18]。
3.3 免疫抑制剂浓度对BKV载量的影响移植术后免疫抑制剂的使用是BKV再激活的高危因素。国内外研究显示,第3代免疫抑制剂Tacrolimus和MPA的使用,使BKV相关肾病发病率逐年上升[19-21]。Mengel等的研究提示,大剂量Tacrolimus或MPA使BKV相关肾病的发病率增加13倍[22]。由于目前没有特效的抗病毒的药物,对于已经确诊为BKVAN的患者,减少免疫抑制剂用量是公认的首选干预措施。
本研究显示,对于肾移植术后出现BKV增殖性感染的患者,其尿液BKV载量变化与Tacrolimus谷值血药浓度变化趋势基本一致,随着Tacrolimus使用量的降低,BKV载量也显著降低。
并且病毒载量变化速率同Tacrolimus血药浓度变化速率呈正相关,说明BKV对免疫抑制剂浓度的变化非常敏感。对于高病毒载量的患者,大幅减少免疫抑制剂用量能够有效控制BKV复制,但可能存在诱发排斥反应的风险。因此肾移植术后早期监测BKV载量,在病毒负荷并不过重的情况下及时予以适当的免疫抑制剂减量,避免大幅度地调整,就能有效保护移植肾功能,预防BKVAN的发生,也避免急性排斥反应的发生。
3.4 BKV复制的早期干预2009年版《KDIGO临床实践指南》指出:当患者血浆BKV载量持续≥1.0×107 copy/mL时,建议建少免疫抑制剂的用量[23]。2016年版《中国实体器官移植受者BK病毒感染临床诊疗指南》指出:若出现血浆BKV载量持续≥1.0×104 copy/mL或尿液BKV载量持续升高时,建议降低免疫抑制剂强度[24]。而我们认为应当在患者出现尿BKV阳性时,就进行早期干预。本中心的经验为:当移植受者尿中BKV载量达1.0×104~1.0×105 copy/mL时,应密切关注病毒载量变化和血药浓度,超过1.0×106 copy/mL时就应适当缓慢减少免疫抑制剂剂量。
研究发现患者诊断为尿BKV阳性时,其肾小球滤过率(eGFR)已降至正常值2/3以下,提示其肾功能可能因BKV感染已经受到损伤。但早期干预后,改善效果明显,肾功能可恢复至正常范围。而对于BKV尿症和BKV血症患者干预后,eGFR有所改善,但大多数仍低于正常值,移植肾出现功能下降。因此,在患者出现尿BKV阳性即进行早期干预,治疗效果较出现BKV尿症和BKV血症时进行干预更为敏感[25]。
综上所述,对于肾移植受者,术后应重视监测其尿隐血情况、尿液和血浆BKV载量,有利于发现BKV的早期复制。当患者尿液BKV阳性时及时给予必要的临床干预措施,进行适度的免疫抑制剂减量。BKV再激活的早期发现、早期诊断、早期治疗能够最大限度地维持移植肾功能。
| [1] |
Teutsch K, Schweitzer F, Knops E, et al. Early identification of renal transplant recipients with high risk of polyomavirus-associated nephropathy[J].
Med Microbiol Immunol, 2015, 204(6): 657-64.
DOI: 10.1007/s00430-015-0398-x. |
| [2] |
Dao M, Pecriaux A, Bessede T, et al. BK virus-associated collecting duct carcinoma of the renal allograft in a kidney-pancreas allograft recipient[J].
Oncotarget, 2018, 9(19): 15157-63.
|
| [3] |
Huang G, Zhang L, Liang X, et al. Risk factors for BK virus infection and BK virus-associated nephropathy under the impact of intensive monitoring and pre-emptive immunosuppression reduction[J].
Transplant Proc, 2014, 46(10): 3448-54.
DOI: 10.1016/j.transproceed.2014.08.036. |
| [4] |
Hocker B, Schneble L, Murer L, et al. Epidemiology of and risk factors for BK polyomavirus replication and nephropathy in pediatric renal transplant recipients: an international ERTAIN registry study[J].
Transplant Int, 2018, 31(5, SI): 23.
|
| [5] |
Elfadawy N, Flechner SM, Liu X, et al. The impact of surveillance and rapid reduction in immunosuppression to control BK virusrelated graft injury in kidney transplantation[J].
Transplant Int, 2013, 26(8): 822-32.
DOI: 10.1111/tri.2013.26.issue-8. |
| [6] |
Egli A, Koehli S, Dickenmann M, et al. Inhibition of polyomavirus BK-specific T-cell responses by immunosuppressive drugs[J].
Transplantation, 2009, 88(10): 1161-8.
DOI: 10.1097/TP.0b013e3181bca422. |
| [7] |
Pham P, Reddy UG. TRANSPLANTATION immunosuppression and risk of polyomavirus BK replication[J].
Nat Rev Nephrol, 2013, 9(3): 135-6.
DOI: 10.1038/nrneph.2013.17. |
| [8] |
Hirsch HH, Randhawa P, AST Infect Dis Community Practice. BK polyomavirus in solid organ transplantation[J].
Am J Transplant, 2013, 13(4, SI): 179-88.
|
| [9] |
Ma YC, Zuo L, Chen JH, et al. Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].
JAm Soc Nephrol, 2006, 17(10): 2937-44.
DOI: 10.1681/ASN.2006040368. |
| [10] |
Stevens PE, Levin A, Kidney Disease: Improving global outcomes chronic kidney disease guideline development work group members. evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline[J].
Ann Intern Med, 2013, 158(11): 825-30.
DOI: 10.7326/0003-4819-158-11-201306040-00007. |
| [11] |
Perico N, Cattaneo D, Sayegh MH, et al. Delayed graft function in kidney transplantation[J].
Lancet, 2004, 364(9447): 1814-27.
DOI: 10.1016/S0140-6736(04)17406-0. |
| [12] |
Sola R, Alarcon A, Jimenez C, et al. The influence of delayed graft function[J].
Nephrol Dial Transplantat, 2004, 19(3): 32-7.
|
| [13] |
Racusen LC, Solez K, Colvin RB, et al. The Banff 97 working classification of renal allograft pathology[J].
Kidney Int, 1999, 55(2): 713-23.
DOI: 10.1046/j.1523-1755.1999.00299.x. |
| [14] |
Jacob W R, Scadden, et al. Polyoma virus nephropathy in kidney transplantation[J].
World J Transplant, 2017, 7(6): 329-38.
DOI: 10.5500/wjt.v7.i6.329. |
| [15] |
Krejci K, Tichy T, Bednarikova J, et al. BK virus-induced renal allograft nephropathy[J].
Biomed Papers-Olomouc, 2018, 162(3): 165-77.
DOI: 10.5507/bp.2018.018. |
| [16] |
Sawinski D, Goral S. BK virus infection: an update on diagnosis and treatment[J].
Nephrol Dial Transplant, 2015, 30(2): 209-17.
DOI: 10.1093/ndt/gfu023. |
| [17] |
Castroa T, Domingues Fink MC, Figueiredo M, et al. Polyomavirus BK and JC in individuals with chronic kidney failure, kidney transplantation, and healthy controls[J].
J Clin Virol, 2017, 89: 5-9.
DOI: 10.1016/j.jcv.2017.02.003. |
| [18] |
Elfadawy N, Yamada M, Sarabu N. Management of BK polyomavirus infection in kidney and kidney-pancreas transplant recipients a review article[J].
Infect Dis Clin NorthAm, 2018, 32(3): 599.
|
| [19] |
Hasegawa M, Ito T, Saigo K, et al. Association of DNA amplification with progress of BK polyomavirus infection and nephropathy in renal transplant recipients[J].
Transplant Proc, 2014, 46(2): 556-9.
DOI: 10.1016/j.transproceed.2013.11.114. |
| [20] |
Lee HM, Jang IA, Lee D, et al. Risk factors in the progression of BK virus-associated nephropathy in renal transplant recipients[J].
Korean J Intern Med, 2015, 30(6): 865-72.
DOI: 10.3904/kjim.2015.30.6.865. |
| [21] |
Chadban S, Morris R, Hirsch HH, et al. Immunosuppression in renal transplantation: some aspects for the modern era[J].
Transplant Rev (Orlando), 2008, 22(4): 241-51.
DOI: 10.1016/j.trre.2008.05.003. |
| [22] |
Mengel M, Marwedel M, Radermacher J, et al. Incidence of polyomavirus-nephropathy in renal allografts: influence of modern immunosuppressive drugs[J].
Nephrol Dial Transplant, 2003, 18(6): 1190-6.
DOI: 10.1093/ndt/gfg072. |
| [23] |
KDIGO clinical practice guideline for the care of kidney transplant recipients [J].Am J Transplant, 2009, 9 Suppl 3: S1-155.
https://www.sciencedirect.com/science/article/pii/S0085253815542439
|
| [24] |
石炳毅, 范宇. 中国实体器官移植受者BK病毒感染临床诊疗指南(2016版)[J].
中华移植杂志:电子版, 2017, 11(2): 65-9.
|
| [25] |
Brochot E, Descamps V, Handala L, et al. BK polyomavirus in the urine for follow-up of kidney transplant recipients[J].
Clin Microbiol Infect, 2019, 25(1): 111-2.
|
 2019, Vol. 39
2019, Vol. 39

