在尿毒症患者中,心血管并发症防治是临床中一大难题[1]。临床研究表明,左室肥厚既是尿毒症心肌病最显著的特征,亦是该类患者生存率降低的一个独立危险因素[2]。也有相关研究发现26%的慢性肾病(CKD)患者已存在左室肥厚,而透析患者中该比例高达74% [3]。
尿毒症心肌病发病机制较为复杂,而尿毒素在该疾病发展中起到重要作用[4-5]。硫酸吲哚酚(IS)一疏水的有机阴离子且与白蛋白非共价结合后,不能有效通过透析去除的尿毒素分子[6]。尿毒症患者由于肾功能减退,不能有效的将其排除体外,加以多种尿毒素相互竞争排泄途径,易导致IS蓄积[7-8]。研究发现血浆中IS可诱导CKD患者体内活性氧(ROS)的增加,加速肾功能恶化[9-10],且可诱导在血管平滑肌细胞的成骨样改变,从而加速冠状动脉钙化[11]。Lin等[12]在细胞实验中发现IS亦可通过AKT信号通路诱导大部分肾脏切除小鼠心肌肥厚及纤维化。也有相关文献报道,IS可通过ERK1/2、P38信号通路诱导心肌细胞肥厚,促使左室重构,加速心功能的恶化[13-14]。故IS在尿毒症心肌病左室肥厚的进展中扮演着重要角色。
真武汤源自于《伤寒论》,具有温阳利水的功效,适用于脾肾阳虚,水气内停之证的各类疾病[15]。目前真武汤在心肾疾病治疗及研究中获益颇多[16-17]。我们的前期临床研究发现,心肾综合征患者加用真武汤治疗后,患者心肾功能均较前改善且血浆IS水平有所降低[18]。故本研究通过建立尿毒症心肌病大鼠模型,探讨真武汤对IS致尿毒症大鼠心肌肥厚的作用,并探讨其相关作用机制,以期为中医及中医药结合治疗尿毒症心肌患者改善心功能提供新的基础理论依据及发展方向。
1 材料和方法 1.1 材料 1.1.1 实验动物及饲养本实验中采用清洁级雄性SD大鼠50只,体质量200±20 g,6周龄,由南方医科大学实验动物中心提供[许可证号SCXK(粵)2011-0015]。饲养大鼠一周适应环境后再进行实验,饲养条件为恒温(20±2)℃及湿度(50±5)%,24 h自由摄水,人工照明各12 h。
1.1.2 药物药物真武汤由中药配方颗粒(一方制药)按生药量为淡附片9 g,茯苓9 g,生姜9 g,白芍9 g,白术6 g混合溶解于21 m L温蒸馏水制成。
1.1.3 实验仪器及试剂酶标仪(Thermo,型号Varioskan LUX),倒置显微镜(Leica,型号DMI1),冷光源动物手术灯(瑞沃德生命科技,型号76301),微量离心机(Thermo,型号LEGEND Micro21R),心脏超声仪(Vevo 2100 Imaging System),水合氯醛、氨苄青霉素钠(Sigma-Aldrich);肌酐测定试剂盒(AAPR369-2)、尿素氮测试盒(AAPR276-2)、尿蛋白定量测试盒(C035-2)(行知生物科技);BNP抗体(wl02126,wanleibio,AntiPhospho-P38、Anti-P38、Anti-Phospho-ERK1/2、AntiERK1/2、Anti-Phospho-JNK、Anti-JNK(CST)。
1.2 方法 1.2.1 动物分组、造模及给药将大鼠随机分成假手术组(n=8)、模型组(n=8)、真武汤低剂量组(生药量4.5 g/kg,n=7),高剂量组(生药量13.5 g/kg,n=7)。待大鼠适应环境一周后,手术前1 d禁食水。予5%水合氯醛(300 mg/kg)腹腔注射大鼠,待大鼠全身肌肉松弛后,腹部备皮,酒精消毒后铺巾,沿腹部中线切开皮肤,切口约2 cm,钝性分离皮下组织,暴露腹部肌肉,分离脏器。找到肾动脉后用尖镊尝试夹闭该肾动脉分支,观察到左侧肾脏组织约2/3明显缺血性改变后,结扎该肾动脉分支。假手术组则仅对大鼠进行开腹,为行肾切处理。逐层间断缝合腹部肌肉、皮肤,对皮后酒精消毒腹部伤口。上述手术操作过程均在严格无菌条件下进行。术后大鼠予氨苄青霉素钠(20万U/只)腹腔注射预防感染,且连续注射3 d。造模手术4周后开始给药,低剂量和高剂量分别以4.5 g/kg、13.5 g/kg剂量的真武汤汤剂灌胃,对照组剂及模型组给予同等量蒸馏水灌胃。
1.2.2 心肌细胞原代培、分组及处理心肌细胞提取采用胰酶消化、差速贴壁法[19]。取出生1~3 d SD大鼠乳鼠,无菌条件下取出心脏,通过胰酶消化法将心肌组织逐步分离成单细胞悬液,后者经离心后收集沉淀;用含Brdu培养混匀沉淀,并接种培养皿中。经孵箱中培养90~120 min后,差速贴壁去除成纤维细胞。将纯化后的心肌细胞调整浓度,分为对照组及IS组,分别接种至6孔板及24孔板(蛋白质合成速率检测),孵箱中培养;48 h后心肌细胞贴壁,更换培养基饥饿24 h,6孔板IS组给与IS(10 μm)刺激15 min [14],提取各组细胞蛋白。24孔板的两组中除IS组给与IS(10 μm)外,均加入[3H]亮氨酸1 μCi/孔(每孔1 mL培养液)继续培养24 h后,PBS冲洗两遍,用胰蛋白酶消化收集细胞于玻璃纤维素膜上,然后以三氯乙酸固定、滤膜烘干,加入闪烁液在闪烁瓶中测定强度。
1.2.3 生化指标检测给药4周后时称大鼠体质量(BW),腹腔注射5%水合氯醛(300 mg/kg)将大鼠镇静,采用心尖取血法收集大鼠血液标本,放入肝素化2.0 mL EP管充分混匀,离心(4 ℃,8000 r/min,6 min)后,取上清液-80 ℃保存。采用肌氨酸氧化酶法检测不同实验组血肌酐(Scr),脲酶法检测血尿素氮(BUN)水平,尿蛋白定量试剂盒(CCB)法检测24 h尿蛋白,高效液相色谱法检测血浆硫酸吲哚酚(IS)水平;上述相关生化指标严格按照对应试剂盒说明书具体操作步骤和注意事项进行,并用酶标仪分析计算吸光度,根据生化指标对应的计算公式或标准曲线回归方程计算样本浓度。
1.2.4 全心质量指数和左心室质量指数待心尖取血后,开胸将大鼠心脏取出,修剪去除心脏包膜、心耳,生理盐水泡洗,无菌纱布吸干心脏表面水分及血迹,用电子天平(Sartorius)分别称取全心质量(HW)及左室质量(LVM),并计算全心质量指数(HMI)(全心质量×100%/体质量)、左室质量指数(LVMI)(左室质量×100%/体质量)。
1.2.5 心脏彩超检测在大鼠取材前1 d,经异氟烷气体吸入麻醉下,用超声仪(Vevo 2100 Imaging System)行心脏超声检查,检测项目包括左室前壁厚度(收缩期、舒张期)(LVAWD、LVAWS)、左室后壁厚度(收缩期、舒张期)(LVPWs、LVPWd),左室内径(收缩期、舒张期)(LVESD、LVEDD)。
1.2.6 心脏HE染色将开胸取出的心脏组织称取完后,置于4%甲醛溶液中固定24 h后进行脱水、包埋、切片处理。按标准步骤进行用苏木素-伊红(HE)染色染色。HE染色样本于Leica光学显微镜观察心肌细胞核排列及心肌细胞大小等情况。用Image J 6.0图像分析软件对HE染色图片进行心肌肥大细胞所占面积(Cardiac myocyte cross-sectional area(CSA)分析对比。
1.2.7 Western blot提取样品蛋白,根据BCA蛋白定量试剂盒测定蛋白浓度;(1)电泳:根据所测的总蛋白浓度,每例标本取总蛋白30 μg,5% SDS-PAGE 80V电泳30 min;12% SDS-PAGE 110伏电泳80 min,然后100V 1 h电转印于硝酸纤维素膜(NC膜)上;(2)封闭:用封闭液(1 ×TBS,5%脱脂奶粉)室温振摇封闭2 h;(3)孵一抗:将Anti-P38、Anti-ERK1/2、Anti-JNK以1:1000用1×TBST稀释,Anti-BNP(1: 500)用1×TBST稀释,AntiPhospho-P38、Anti-Phospho-ERK1/2、Anti-PhosphoJNK则以1:1000用5×BSA稀释。与经封闭液处理过的NC膜置孵育盒内4 ℃孵育过夜。1×TBST液洗膜3次,每次10 min;(4)孵二抗:同样方法,1:8000稀释二抗,37 ℃孵育2 h,1 ×TBST液洗膜3次,每次10 min。(5)曝光:加ECL发光剂,曝光。并登记记录。
1.2.8 统计学方法用SPSS22.0统计软件进行统计分析,所得结果以均数±标准差的形式进行描述,两组之间使用独立样本t检验,多组间的比较采用单因素方差分析,非正态分布均釆用秩和检验法。P < 0.05为差异有统计意义。
2 结果 2.1 IS对心肌细胞蛋白质合成速率及其BNP、p38、ERK1/2、JNK蛋白表达情况在细胞实验中发现,与对照组相,IS组的心肌细胞蛋白质合成速率明显增加,且BNP蛋白表达亦显著上调。由此说明,IS可诱导心肌细胞肥大。同时进一步发现IS组心肌细胞的p-ERK1/2、p-p38表达均较对照组升高(均P < 0.01),而P-JNK蛋白则与对照组相比未见明显差异(图 1)。
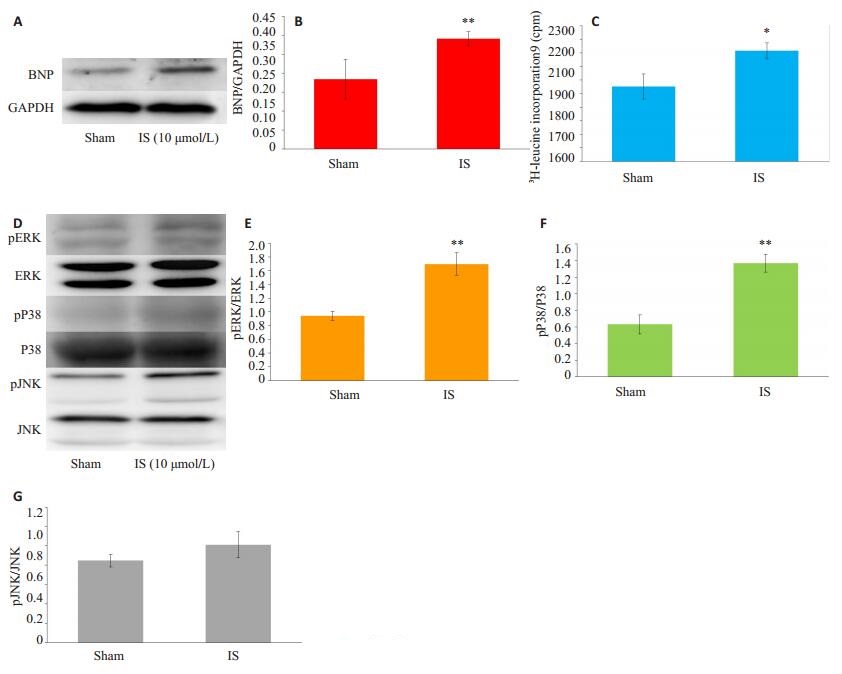
|
图 1 心肌细胞蛋白质合成速率及蛋白表达情况 Fig.1 Protein synthesis rate and protein expressions in the cardiomyocytes. A: Western blotting showing BNP and GAPDH expressions; B: Densitometric analysis of the results of Western blotting; C: Synthetic rate of proteins; E, F, G: Densitometric analysis of the results of Western blotting. *P < 0.05, **P < 0.01 vs Sham group. |
与假手术组相比,模型组大鼠的Scr、BUN、24 h Upro明显升高,其中模型组大鼠的血肌酐值为假手术组的2倍有余,故成功构建尿毒症大鼠模型。同时模型组血浆IS水平较假手术组亦是显著升高(P < 0.01,表 1)。
| 表 1 各组大鼠生化结果比较 Tab.1 Comparison of biochemical outcomes in different groups |
模型组的HMI、LVMI较假手术组均显著增加(均P < 0.01),体质量则也明显减轻,表明模型组大鼠心脏整体形态发生改变,已经出现显著左心室肥厚(表 2)。在心超结果中,模型组大鼠的LVESD、LVEDD较假手术组有缩短(均P < 0.05),LVAWS、LVAWD、LVPWs、LVPWd则明显增厚,差异存在统计学意义(均P < 0.05)(表 3,图 2)。较假手术组相比,模型组大鼠心肌细胞肥大且细胞所占面积(CSA)增大、排列紊乱,细胞核增大,形态不规则,核仁浓染,胞浆染色加深,心肌纤维增粗(图 3)。
| 表 2 各组大鼠心脏质量结果 Tab.2 Comparison of HW, LVM, BW, HMI and LVMI among the groups |
| 表 3 各组大鼠心脏超声结果比较 Tab.3 Comparison of echocardiography parametersat different groups of rats |
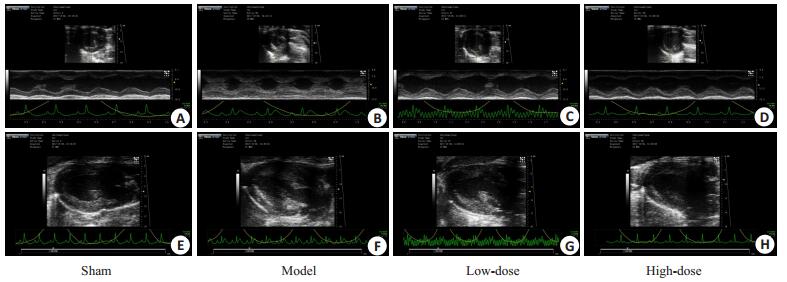
|
图 2 各组大鼠心脏超声图像 Fig.2 Echocardiographic presentation in different groups. A, E: Sham group; B, F: Model group; C, G: Low-dose group; D, H: High-dose group. |
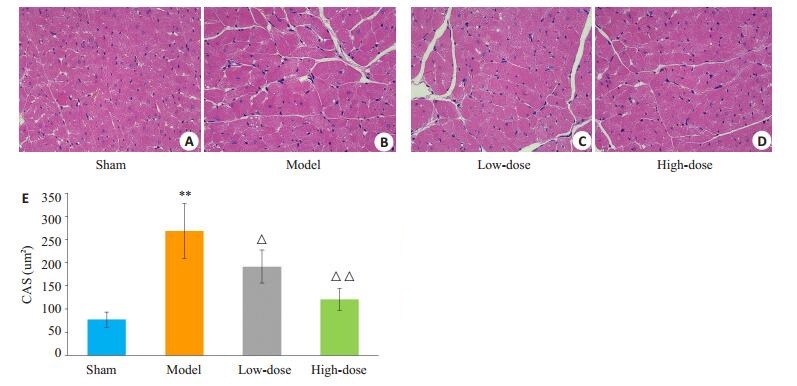
|
图 3 各组大鼠心脏HE染色 Fig.3 Pathological changes of the heart tissues in different groups (HE staining, original magnification: ×400). A-D: HE staining in sham group, model group, low-dose group, and high-dose group, respectively. **P < 0.01 vs Sham group; △ P < 0.05, △△P < 0.01 vs model group. |
与假手术组相比,模型组大鼠心脏组织BNP蛋白的表达均升高(均P < 0.01),进一步检测了ERK1/2、P38及JNK蛋白表达情况,结果显示模型组大鼠心肌组织p-ERK1/2、p-p38及P-JNK蛋白的表达均升高(均P < 0.01,图 4)。
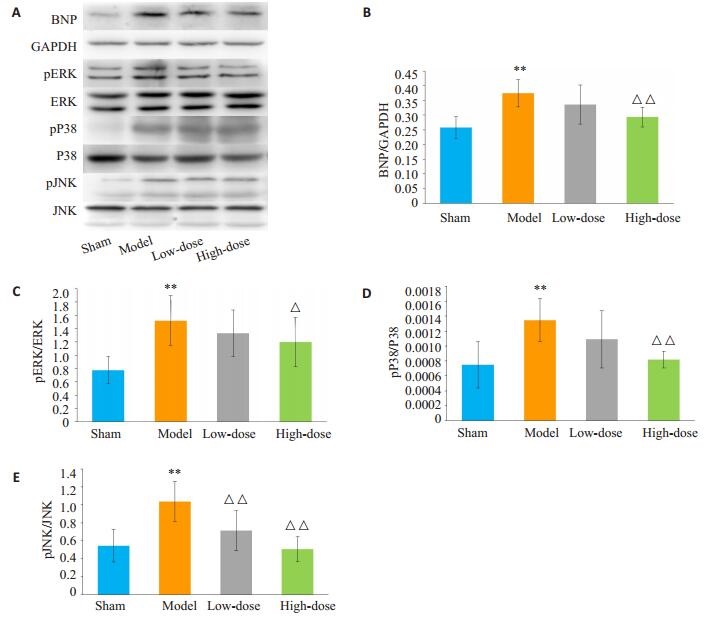
|
图 4 各组大鼠心脏组织蛋白表达情况 Fig.4 Myocardial protein expressions in different groups. A: Western blotting showing BNP, pERK, ERK, pP38, P38, pJNK, JNK and GAPDH expressions; B-E: Densitometric analysis of Western results. **P < 0.01 vs Sham group; △P < 0.05, △△P < 0.01 vs model group. |
结果显示,真武汤低剂量及高剂量组的Scr、BUN、24 hUpro均较模型组降低。可见,真武汤可改善肾脏功能。血浆IS在真武汤低、高剂量组均有所降低,而高剂量组的效果较为显著(P < 0.01,表 1)。
2.3.2 真武汤剂量组大鼠全心质量指数、左室质量指数、心脏彩超结果和HE染色和模型组相比,低、高剂量组大鼠HMI、LVMI均降低,而体质量增加,其中高剂量组较模型组具有统计学差异(表 2)。在心脏超声结果中,LVESD、LVEDD、LVAWS、LVAWD、LVPWs、LVPWd在低剂量及高剂量组中均有改善,其中仅LVAWd在低剂量组与模型组间的差异存在统计学意义(P < 0.05,表 3)。HE染色显示低剂量及高剂量组大鼠心肌细胞心肌纤维排列较为整齐,小范围的心肌细胞肥大,横纹较清晰,细胞核较为居中,且高剂量组改善效果较为显著(图 3)。2.3.3真武汤剂量组大鼠心肌组织BNP、ERK1/2、P38及JNK蛋白表达情况与模型组相比,低、高剂量组心脏组织BNP均有所下调。其次,高剂量组心肌组织pERK1/2、p-p38及P-JNK蛋白表达下调幅度明显优于低剂量组(图 4)。
3 讨论尿毒症心肌病是由高压力、高容量负荷及尿毒素等因素的作用下发生的心脏病变, 包括形态和功能的改变,主要表现为心肌肥大,心肌间质纤维化及心室重塑,最终导致左室肥厚,心室舒张、收缩功能失调,心律失常和心力衰竭[20-21]。延缓、停止或逆转CKD的进展,抑制尿毒症患者左室肥厚,改善其心脏功能是控制尿毒症心肌病疾病进展的重要手段。
近年来,尿毒症毒素对心脏的直接毒性作用得到了越来越多的证实[22-23]。IS是一种疏水的有机阴离子尿毒症毒素。色氨酸经肠道微生物群转化为吲哚,吸收入血并经门静脉入肝,经羟化、硫酸化作用产生IS [24-25]。研究表明,在肾功能正常的患者血浆中几乎不含IS,而随着肾功能下降,血清IS水平则逐渐升高,可对体内多器官造成毒害作用[26]。Lekawanvijit [27]首次在体外实验得到证实发现IS对心脏的直接毒性作用影响,而后又验证了IS通过与其受体特异性地结合,激活心肌细胞及成纤维细胞P38、ERK1/2等信号通路,进而激活一系列的级联反应,分别促进肥大相关蛋白及纤维化相关蛋白表达。研究表明ERK、p38 MAPK、JNK3条MAPK信号通路,经细胞受到外界刺激后,三者并行的信号通路可单独或同时激活,既可独立亦可交联协同发挥作用[28]。Sun等[29]发现经主动脉缩窄致心肌肥厚的小鼠中磷酸化ERK1/2表达水平增高,降低该水平后可有效改善小鼠心室肥厚。本研究细胞实验结果提示,IS在诱导心肌细胞后P38、ERK1/2信号明显激活,促使心肌蛋白质合成速率及BNP的表达增加。该结果与Lekawanvijit [27]研究的结果一致,IS可经P38、ERK1/2信号通路,诱导心肌细胞肥大。
在体内实验中,我们通过对大鼠行5/6肾切术诱导尿毒症,且随着大鼠血肌酐的异常,渐进的发生了心肌肥厚,符合尿毒症心肌病病理学生理改变。生化及心脏超声等结果显示,尿毒症心肌病大鼠血浆IS水平异常升高,同时伴有心肌明显肥厚。Yang等[30]研究发现,小鼠在腹腔注射IS后,其血浆IS水平升高,小鼠心室也明显肥厚。目前研究证实,AST-120,一种口服炭吸附剂,可以减少吲哚的吸收从而降低血清IS水平来减轻氧化应激等作用,防止CKD中心肌肥厚的进展[31-32]。因此,降低CKD的IS水平可能成为在临床预治尿毒症心肌病心室重构的重要突破口。
真武汤作为经典的中药复方,具有温阳利水的功效,适用于脾肾阳虚[33]。有研究发现真武汤可能通过炎症因子途径逆转大鼠慢性压力负荷性心肌肥厚[34]。陈琪等[35]发现真武汤可改善5/6肾切致尿毒症心肌病小鼠的心功能,并可能抑制AMPK-mTOR信号通路而延缓尿毒症心肌病小鼠的心肌肥厚。李峥等[36]发现真武汤可通过调节心肌细胞中线粒体通路,影响凋亡相关蛋白的表达,抑制心肌细胞的凋亡,从而延缓充血性心衰的发展。本实验通过真武汤对尿毒症心肌病大鼠进行干预,结果显示真武汤干预后不仅改善尿毒症心肌病大鼠的肾脏功能,同时也抑制了尿毒症心肌病大鼠心室肥厚,且高剂量组结果优于低剂量组。正如我们前期临床研究中发现,真武汤可降低心肾综合征患者血浆IS水平,改善其心肾功能。本研究首次发现经真武汤可明显降低尿毒症心肌病大鼠血浆IS水平,随着真武汤剂量越高,血浆IS水平则越低,而大鼠心室肥厚改善越明显。由于IS水平下降,使得其作用心肌组织的作用减弱,ERK、p38 MAPK、JNK3条信号通路的传导部分受到抑制,心肌组织的肥大相关蛋白表达下调。
我们首次发现,真武汤可降低血浆IS水平,减少其对脏器的毒性作用。在真武汤整方的药理研究中发现,其作用位点广泛,因此真武汤可能调节肠道菌群减少吲哚的产生;或其效用成分对血液中的吲哚进行了去除,从而降低IS水平,具体相关机制有待进一步探究。本研究中不足之处在于未设置西药治疗组,且未能体现真武汤与西药治疗的效果差异,有待在后续研究中进一步完善和改进。
| [1] |
Prommer HU, Maurer J, Von Websky KA, et al. Chronic kidney disease induces a systemic microangiopathy, tissue hypoxia and dysfunctional angiogenesis[J].
Sci Rep, 2018, 8(1): 5317.
DOI: 10.1038/s41598-018-23663-1. |
| [2] |
Zolty R, Hynes PJ, Vittorio TJ. Severe left ventricular systolic dysfunction May reverse with renal transplantation: Uremic cardiomyopathy and cardiorenal syndrome[J].
Am J Transplant, 2008, 8(11): 2219-24.
DOI: 10.1111/ajt.2008.8.issue-11. |
| [3] |
Peterson GE, De Backer T, Contreras G, et al. Relationship of left ventricular hypertrophy and diastolic function with cardiovascular and renal outcomes in African americans with hypertensive chronic kidney disease[J].
Hypertension, 2013, 62(3): 518-25.
|
| [4] |
Wolley MJ, Hutchison CA. Large uremic toxins: an unsolved problem in end-stage kidney disease[J].
Nephrol Dial Transplant, 2018, 33(suppl_3): i6-i11.
DOI: 10.1093/ndt/gfy179. |
| [5] |
Fujii H, Goto S, Fukagawa M. Role of uremic toxins for kidney, cardiovascular, and bone dysfunction[J].
Toxins (Basel), 2018, 10(5): E202.
DOI: 10.3390/toxins10050202. |
| [6] |
Liu WC, Tomino Y, Lu KC. Impacts of indoxyl sulfate and p-Cresol sulfate on chronic kidney disease and mitigating effects of AST-120[J].
Toxins (Basel), 2018, 10(9): E367.
DOI: 10.3390/toxins10090367. |
| [7] |
Lai J, Akindavyi G, Fu Q, et al. Research progress on the relationship between coronary artery calcification and chronic renal failure[J].
Chin Med J (Engl), 2018, 131(5): 608-14.
DOI: 10.4103/0366-6999.226066. |
| [8] |
Lekawanvijit S. Cardiotoxicity of uremic toxins: a driver of cardiorenal syndrome[J].
Toxins (Basel), 2018, 10(9): E352.
DOI: 10.3390/toxins10090352. |
| [9] |
Niwa T, Shimizu H. Indoxyl sulfate induces nephrovascular senescence[J].
J Ren Nutr, 2012, 22(1): 102-6.
DOI: 10.1053/j.jrn.2011.10.032. |
| [10] |
Pieniazek A, Gwozdzinski L, Hikisz PA. Indoxyl sulfate generates free radicals, decreases antioxidant defense, and leads to damage to mononuclear blood cells[J].
Chem Res Toxicol, 2018, 31(9): 869-75.
DOI: 10.1021/acs.chemrestox.8b00065. |
| [11] |
Chen J, Zhang XY, Zhang H, et al. Indoxyl sulfate enhance the hypermethylation of klotho and promote the process of vascular calcification in chronic kidney disease[J].
Int J Biol Sci, 2016, 12(10): 1236-46.
DOI: 10.7150/ijbs.15195. |
| [12] |
Lin CY, Hsu YJ, Hsu SC, et al. CB1 cannabinoid receptor antagonist attenuates left ventricular hypertrophy and Akt-mediated cardiac fibrosis in experimental uremia[J].
J Mol Cell Cardiol, 2015, 85: 249-61.
DOI: 10.1016/j.yjmcc.2015.06.010. |
| [13] |
Liu S, Kompa AR, Kumfu S, et al. Subtotal nephrectomy accelerates pathological cardiac remodeling post-myocardial infarction: Implications for cardiorenal syndrome[J].
Int J Cardiol, 2013, 168(3): 1866-80.
DOI: 10.1016/j.ijcard.2012.12.065. |
| [14] |
Savira F, Cao LX, Wang I, et al. Apoptosis signal-regulating kinase 1 inhibition attenuates cardiac hypertrophy and cardiorenal fibrosis induced by uremic toxins: Implications for cardiorenal syndrome[J].
PLoS One, 2017, 12(11): e187459.
|
| [15] |
鲁美君, 张婷. 真武汤证近代临床应用[J].
辽宁中医杂志, 2015, 42(5): 1145-6.
|
| [16] |
黄丽芳, 陈明. 《伤寒论》真武汤证理论探讨[J].
中华中医药学刊, 2016, 34(1): 30-2.
|
| [17] |
林思炜, 梁北南, 陈丽霞. 真武汤加减治疗心肾阳虚型慢性心力衰竭50例[J].
实用医学杂志, 2016, 32(1): 140-2.
DOI: 10.3969/j.issn.1006-5725.2016.01.045. |
| [18] |
王慧敏, 吴英智, 韦震鸣, 等. 真武汤治疗Ⅱ型及Ⅳ型心肾综合征的临床研究[J].
实用医学杂志, 2018, 34(13): 2255-9.
DOI: 10.3969/j.issn.1006-5725.2018.13.038. |
| [19] |
陈雪, 沈楠, 安英, 等. 丹酚酸B对氧化应激损伤乳鼠心肌细胞的保护作用及其机制[J].
吉林大学学报:医学版, 2018(05): 974-8.
|
| [20] |
马欣, 王丽, 芶芳芳, 等. 伊马替尼对尿毒症心肌病大鼠心肌纤维化的保护作用[J].
重庆医学, 2016, 45(3): 313-6.
DOI: 10.3969/j.issn.1671-8348.2016.03.008. |
| [21] |
Gross ML, Ritz E. Hypertrophy and fibrosis in the cardiomyopathy of uremia--beyond coronary heart disease[J].
Semin Dial, 2008, 21(4): 308-18.
DOI: 10.1111/j.1525-139X.2008.00454.x. |
| [22] |
Lin CJ, Liu HL, Pan CF, et al. Indoxyl sulfate predicts cardiovascular disease and renal function deterioration in advanced chronic kidney disease[J].
Arch Med Res, 2012, 43(6): 451-6.
DOI: 10.1016/j.arcmed.2012.08.002. |
| [23] |
Liabeuf S, Drueeke TB, Massy ZA. Protein-Bound uremic toxins: new insight from clinical studies[J].
Toxins (Basel), 2011, 3(7): 911-9.
DOI: 10.3390/toxins3070911. |
| [24] |
Vaziri ND, Zhao YY, Pahl MV. Altered intestinal microbial flora and impaired epithelial barrier structure and function in CKD: the Nature, mechanisms, Consequences and potential treatment[J].
Nephrol Dial Transplant, 2016, 31(5): 737-46.
DOI: 10.1093/ndt/gfv095. |
| [25] |
Leong SC, Sirich TL. Indoxyl Sulfate-Review of toxicity and therapeutic strategies[J].
Toxins (Basel), 2016, 8(12): E358.
DOI: 10.3390/toxins8120358. |
| [26] |
Pretorius CJ, Mcwhinney BC, Sipinkoski BA, et al. Reference ranges and biological variation of free and total serum indoxyl- and p-cresyl sulphate measured with a rapid UPLC fluorescence detection method[J].
Clinica Chimica Acta, 2013, 419: 122-6.
DOI: 10.1016/j.cca.2013.02.008. |
| [27] |
Lekawanvijit S, Adrahtas A, Kelly DJ, et al. Does indoxyl sulfate, a uraemic toxin, have direct effects on cardiac fibroblasts and myocytes?[J].
Eur Heart J, 2010, 31(14): 1771-9.
DOI: 10.1093/eurheartj/ehp574. |
| [28] |
黄宏超, 李阳, 魏文峰, 等. 瑞舒伐他汀联合厄贝沙坦对心肌肥厚大鼠MAPK/ERK和JNK通路的影响[J].
临床和实验医学杂志, 2018, 17(16): 1703-8.
DOI: 10.3969/j.issn.1671-4695.2018.16.007. |
| [29] |
Sun SM, Kee HJ, Jin L, et al. Gentisic acid attenuates pressure overload-induced cardiac hypertrophy and fibrosis in mice through inhibition of the ERK1/2 pathway[J].
J Cell Mol Med, 2018, 22(12): 5964-77.
DOI: 10.1111/jcmm.2018.22.issue-12. |
| [30] |
Yang K, Wang C, Nie L, et al. Klotho protects against indoxyl sulphate-induced myocardial hypertrophy[J].
J Am Soc Nephrol, 2015, 26(10): 2434-46.
DOI: 10.1681/ASN.2014060543. |
| [31] |
Fujii H, Nakai K, Fukagawa M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease[J].
Ther Apher Dial, 2011, 15(2): 125-8.
DOI: 10.1111/tap.2011.15.issue-2. |
| [32] |
Lekawanvijit S, Kompa AR, Manabe M, et al. Chronic kidney disease-induced cardiac fibrosis is ameliorated by reducing circulating levels of a non- dialysable uremic toxin, indoxyl sulfate[J].
PLoS One, 2012, 7(7): e41281.
DOI: 10.1371/journal.pone.0041281. |
| [33] |
鞠静, 杜武勋. 真武汤药效物质基础及温阳利水机制研究[J].
吉林中医药, 2016, 36(7): 719-23.
|
| [34] |
谢志翔, 陈科, 梁智敏, 等. 炎症介质在真武汤逆转心肌肥厚中的作用研究[J].
新中医, 2011, 43(12): 120-2.
|
| [35] |
陈琪, 李志樑, 刘北, 等. 真武汤对大部分肾切除所致尿毒症心肌病小鼠心脏的保护作用[J].
南方医科大学学报, 2015, 35(12): 1725-8.
|
| [36] |
李峥, 李文杰, 尚雪莹, 等. 真武汤通过SIRT1信号通路减轻心力衰竭大鼠心肌细胞线粒体损伤及心肌细胞凋亡[J].
中华中医药学刊, 2018, 36(5): 1062-7.
|
 2019, Vol. 39
2019, Vol. 39

