2. 南方医科大学口腔 医院,广东 广州 510000;
3. 广州市妇女儿童医疗中心,广东 广州 510623;
4. 桂林医学院附属医院,广西壮族自 治区 桂林 541000
2. Stomatological Hospital, Southern Medical University, Guangzhou 510000, China;
3. Guangzhou Women and Children's Medical Center, Guangzhou 510623, China;
4. Affiliated Hospital of Guilin Medical University, Guilin 541000, China
目前临床上患牙髓或根尖周疾病的年轻恒牙,通过牙髓再生治疗可实现根管内组织的再生,促使牙根的继续发育及根尖封闭[1]。随着对根管内新生组织的深入研究,提示从根尖区域募集的根尖乳头干细胞(SCAPs)发挥重要作用[2]。SCAPs最早是由Sonoyama等[3]从根尖孔未发育完成的年轻恒牙中分离出来的,具有分化形成不同细胞类型的潜能,比牙髓干细胞(DPSCs)具有更高的分化率和矿化潜能[4],提示由SCAPs介导的组织再生是实现牙根再生的理想方法[5]。
自噬是一种细胞分解代谢过程,受损或衰老的细胞器将被自噬体吞噬,自噬体进而与溶酶体融合形成自噬溶酶体以对底物进一步进行降解[6]。细胞基础水平的自噬具有保护功能,可维持细胞稳态,并在饥饿或压力环境下提高细胞存活率[6]。然而,自噬也通过独立诱导caspase依赖性细胞凋亡或诱发caspase非依赖性细胞凋亡而参与细胞死亡过程[7-8]。自噬过程对干细胞的自我更新能力、分化进程以及在长期静止期阶段保持其分化潜能具有至关重要的作用[9]。自噬已被证实存在于牙齿发育过程的根尖乳头组织中[10],并参与根尖孔未闭合的牙髓切断术后犬牙的牙髓再血管化过程中[11],通过细胞器和蛋白质的更新以维持成牙本质细胞的寿命[12]。然而,自噬的功能障碍可能会降低成牙本质细胞的适应性,并削弱其成牙本质能力[12]。这些发现提示自噬在牙髓再生过程中具有重要作用。
患牙髓或根尖周组织感染的年轻恒牙的干细胞,暴露在由受损组织所释放的促炎细胞因子诱导的不利环境中[4]。其中,肿瘤坏死因子-α(TNF-α)在炎症的起始和调节过程中起着重要作用[13]。研究表明TNF-α在体外和体内试验中均可激活自噬,诱导破骨细胞分化,从而刺激破骨细胞介导的骨吸收[14]。抑制人牙髓间充质干细胞中的自噬水平,将进一步抑制其成骨向的分化[15]。本课题组的前期研究表明,TNF-α可以促进SCAPs的增殖,并参与成骨分化的调节[16]。然而,目前尚未有关于TNF-α作用下自噬对SCAPs生物学特性影响的研究。因此,本研究将探讨不同浓度TNF-α作用下对SCAPs的自噬水平的影响以及自噬抑制剂3-MA作用下,自噬对SCAPs的生物学特性及成骨分化的影响。
1 材料和方法 1.1 实验材料胎牛血清(GIBCO);青链霉素混合液(Solarbio);α- MEM培养基(GIBCO);重组人源性TNF-α(Peprotech);3-甲基腺嘌呤、地塞米松、β-甘油磷酸钠、维生素C(Sigma);CCK-8试剂盒(BestBio);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(BestBio);0.25%胰酶(TRYPSIN)(GIBCO),兔抗人LC3抗体、β-actin抗体、辣根过氧化物酶标记山羊抗兔二抗(Cell Signaling Technology);一抗稀释液、二抗稀释液、30%丙稀酰胺、1.5 mol/L Tris-HCl(pH 8.8)、1.0 mol/L Tris-HCl(pH 6.8)、10%SDS、TEMED(碧云天生物技术公司,中国);GFP-LC3质粒(莱德尔联康物科技有限公司,中国);Lipofectamine® 3000(Life Technologies)
1.2 方法 1.2.1 SCAPs的分离、培养在广州市妇女儿童医疗中心口腔医学中心就诊患者(年龄16~18岁)的知情同意下,收集多生牙或因正畸需拔除的牙根尚未发育完全的健康年轻恒牙。在无菌条件下分离根尖乳头组织并反复剪切成约1 mm×1 mm×1 mm大小接种于细胞培养瓶中,将瓶底向上倒置于细胞培养箱中。24 h后小心翻转培养瓶,并加入4 mL完全培养基没过组织块,继续培养,倒置显微镜下观察细胞生长情况,每3 d换液。待细胞融合约80%时常规传代培养,取第3~5代细胞用于后续实验。
1.2.2 CCK-8检测取生长状态良好的第3代SCAPs,消化、离心收集细胞,调整细胞密度为6×103/孔接种到96孔培养板中继续培养24 h,实验组分别加入TNF-α(5 ng/mL),TNF-α(5 ng/mL)+3-MA(5 mmol/L),每组设6个复孔,并设阴性对照组和空白调零组。培养24 h后弃原培养液,避光下加入CCK-8溶液,细胞培养箱中孵育2 h后,酶标仪测定A450 nm,计算细胞活力。细胞活力=(实验组A450 nm-空白组A450 nm)/(阴性对照组A450 nm-空白组A450 nm)×100%
1.2.3 流式细胞仪检测细胞凋亡取生长状态良好的第3代SCAPs均匀接种于6孔培养板中,待细胞融合约70%时,实验组分别加入TNF-α(5 ng/mL),TNF-α(5 ng/mL)+ 3-MA(5 mmol/L),对照组不做处理,每组3个复孔。在加药处理24 h后,消化收集各组细胞,按Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明操作,立即用流式细胞仪检测。
1.2.4 自噬水平检测 1.2.4.1 吖啶橙染色取生长状态良好的第3代SCAPs均匀接种于24孔板中,分别加入TNF-α(0 ng/mL),TNF-α(5 ng/mL),TNF-α(10 ng/mL),TNF-α(5 ng/mL)+ 3-MA(5 mmol/L),每组3个复孔。继续培养24 h后终止反应,加入终浓度为10 µmol/L的吖啶橙,细胞培养箱中孵育15 min,PBS漂洗,立即在荧光显微镜下观察、拍照。
1.2.4.2 GFP-LC3质粒转染及检测取生长状态良好的第3代SCAPs均匀接种于放置了无菌细胞爬片的24孔板中,待细胞融合70%~80%时,更换为无血清培养液。根据Lipofectamine® 3000转染试剂盒说明,于24孔板中加入制备的Lipofectamine® 3000与质粒预混液,继续培养2 d后按如下分组进行处理:分别加入TNF-α(0 ng/mL),TNF-α(5 ng/mL),TNF-α(10 ng/mL),TNF-α(5 ng/mL)+3-MA(5 mmol/L),每组3个复孔,继续培养24 h后终止反应。4%多聚甲醛固定15 min,0.1% Triton-X100通透细胞15 min,DAPI细胞核染色10 min,甘油封片,置于激光共聚焦显微镜下观察、拍照记录。
1.2.5 qRT-PCR检测SCAPs成骨向分化相关基因取生长状态良好的第3代SCAPs,消化、离心收集细胞,调整细胞密度为1×105/mL接种到6孔培养板中。24 h后按如下分组进行处理,TNF-α+3-MA组:加入含TNF-α(5 ng/mL)+ 3-MA(5 mmol/L)的成骨分化诱导液(100 nmol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 µg/mL维生素C);TNF-α组:加入含TNF-α(5 ng/mL)的成骨分化诱导液;对照组:仅加入成骨分化诱导液。各组细胞分别于成骨向分化诱导的第3、7、14天时终止反应。采用Trizol试剂盒提取各组细胞总RNA,并根据Takara公司逆转录试剂盒说明书,完成逆转录反应合成各组cDNA。以各组cDNA为模板,GAPDH为内参,采用Takara荧光定量PCR试剂盒检测各组细胞成骨相关基因碱性磷酸酶(ALP)、骨涎蛋白(BSP)、骨钙素(OCN)的表达水平。本实验相关PCR引物序列由广州瑞真生物技术公司设计合成(表 1)。实验重复3次。
| 表 1 引物序列 Tab.1 Primer sequences |
取生长状态良好的第3代SCAPs均匀接种于6孔板中,待细胞融合约80%时,实验组分别加入TNF-α(5 ng/mL),TNF-α(10 ng/mL),TNF-α(5 ng/mL)+ 3-MA(5 mmol/L),对照组不做处理,每组3个复孔,继续培养24 h后终止反应。用含PMSF的裂解液RIPA裂解各组细胞,4 ℃下高速离心取上清液,采用BCA蛋白测定试剂盒测定各样品蛋白浓度后蛋白变性。采用SDS-PAGE进行蛋白质电泳分离蛋白,湿法转膜转印至PVDF膜上,室温封闭1 h,一抗4 ℃孵育过夜,TBST洗膜,二抗室温孵育1 h,TBST洗膜,ECL发光试剂显色,于暗室中压片,洗片,晾干,扫描仪扫描图像,于计算机中作灰度分析,检测各组细胞LC3-Ⅱ/β- actin水平。
1.2.7 统计学方法采用SPSS 13.0统计软件对检测结果进行统计学分析,实验数据以均数±标准差表示,3组间差异采用方差分析,各组间差异选用Bonferroni法分析,P < 0.05认为差异有统计学意义。
2 结果 2.1 TNF-α诱导SCAPs自噬发生TNF-α处理组LC3-Ⅱ/β-actin水平较对照组升高。10 ng/mL TNF-α处理组LC3-Ⅱ/β-actin水平较5 ng/mL TNF-α处理组高,差异具有统计学意义(P < 0.05,图 1A、B)。GFP-LC3质粒位于自噬小泡中,自噬激活的细胞可表现出更多的荧光斑点,10 ng/mL TNF-α处理组较5 ng/mLTNF-α处理组细胞内GFP-LC3数目多,差异有统计学意义(P < 0.05)。吖啶橙染色结果细胞核呈绿色荧光,胞浆内酸性囊泡呈橙色荧光,TNF-α处理组相比对照组观察到更多的酸性囊泡,与GFP-LC3结果分析一致(图 1E)。
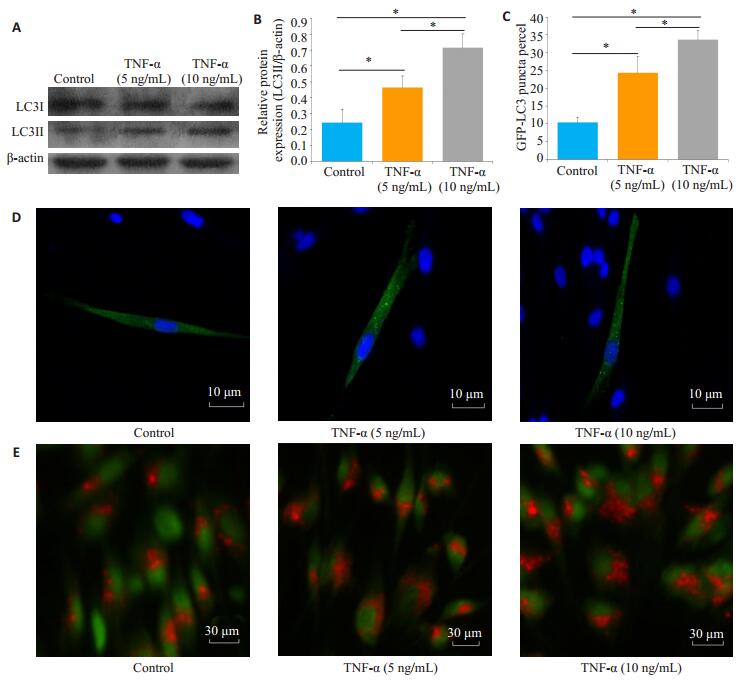
|
图 1 TNF-α作用下SCAPs自噬活化水平 Fig.1 TNF-α induced autophagy in SCAPs. A, B: LC3-Ⅱ expression levels examined by Western blotting with β-actin as the loading control; C, D: Formation of GFP- LC3 puncta in the SCAPs observed under a confocal microscope; E: Formation of AVOs visualized by fluorescence microscopy (acridine orange staining). Scale bars: 10 µm (D) and 30 µm (E). The data are presented as Mean±SD (*P < 0.05). |
TNF-α和TNF-α + 3-MA处理SCAPs 24 h后,Western blot检测结果:TNF-α+3-MA处理组的LC3-Ⅱ/β-actin水平较TNF-α处理组显著降低(P < 0.05,图 2A、B)。3-MA对自噬的抑制情况进一步通过GFP-LC3转染验证,TNF-α+3-MA处理组细胞内GFP-LC3荧光斑点数目较TNF-α处理组显著降低(P < 0.05,图 1C、D)。为研究TNF-α和3-MA对SCAPs细胞活力的影响,TNF-α和TNF-α+3-MA处理SCAPs 24 h后,CCK-8检测TNF-α处理组细胞活力与对照组无明显差异(P> 0.05,图 3A),TNF-α+3-MA处理组细胞活力较TNF-α处理组下降(P < 0.05)。流式细胞仪检测细胞凋亡检测结果如图 3B,C所示,TNF-α和TNF-α+3-MA处理SCAPs后,TNF-α处理组与对照组无明显差异(P>0.05),TNF-α+3-MA处理组较TNF-α处理组显著上升,差异具有统计学意义(P < 0.05)。
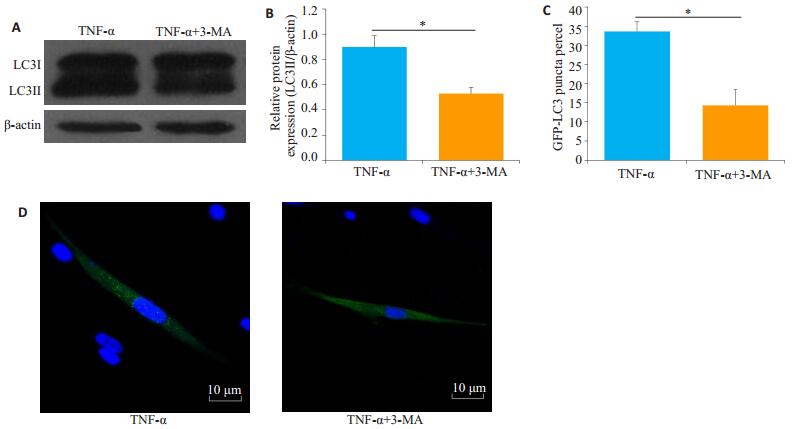
|
图 2 自噬抑制剂3MA对TNF-α作用下SCAPs自噬水平的抑制情况 Fig.2 3-MA attenuated TNF-α-induced autophagy in the SCAPs. A, B: Expression of LC3-Ⅱ analyzed by Western blotting with β-actin as the loading control; C, D: Formation of GFP-LC3 puncta in the SCAPs observed under a confocal microscope. Scale bars: 10 µm (C). The data are presented as Mean±SD (*P < 0.05). |
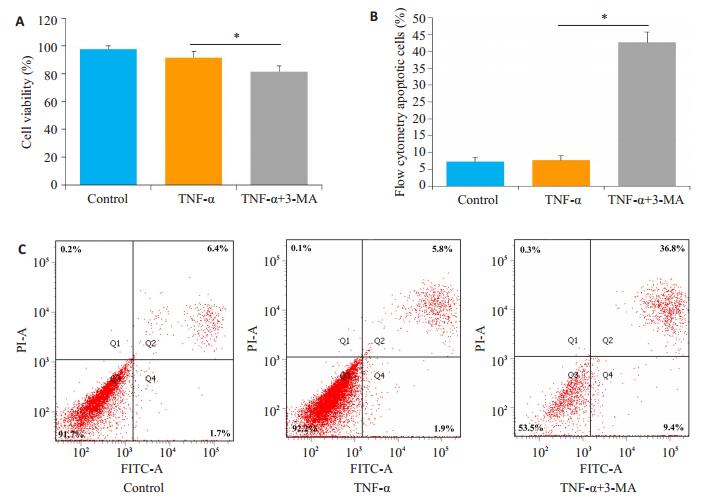
|
图 3 TNF-α/TNF-α+3-MA作用下SCAPs细胞活力及凋亡水平 Fig.3 Cell viability (A) and apoptosis (B) of SCAPs in the presence of TNF-α with/without 3-MA stimulation. The data are presented as Mean±SD (*P < 0.05). |
qRT-PCR结果如图 4所示,TNF-α处理组的成骨相关基因ALP、OCN、BSP表达在第3、7、14天较对照组明显增加,差异具有统计学意义(P < 0.05)。TNF-α+3-MA处理组的ALP、BSP表达量在第3、7、14天较TNF-α处理组均下降(P < 0.05),OCN的表达量在第3、7天较TNF-α处理组降低(P < 0.05),第14天时差异无统计学意义(P>0.05)。
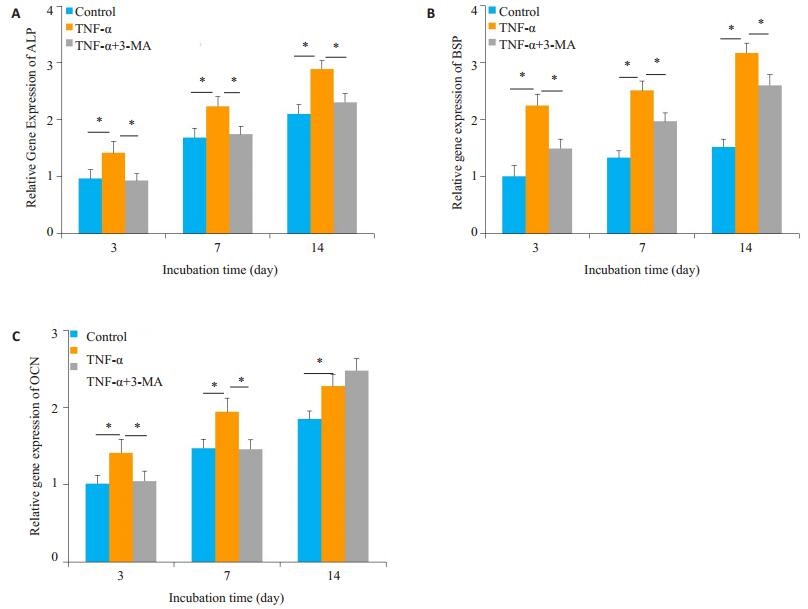
|
图 4 qRT-PCR检测TNF-α/TNF-α+3-MA作用下SCAPs成骨分化相关基因的表达 Fig.4 Effects of TNF-α with and without 3-MA on the expression of osteogenic genes. A: ALP; B: BSP; C: OCN. The data are presented as Mean±SD (*P < 0.05). |
自噬是一种普遍存在的细胞分解代谢过程,在维持细胞稳态和功能方面发挥重要作用[6]。在自噬相关基因中,Beclin1、Atg5、Atg12和LC3对自噬的诱导阶段十分重要。其中,LC3蛋白在自噬的诱导过程中,从胞膜形式的LC3-Ⅰ转化为自噬体膜形式的LC3-Ⅱ,提示自噬小体的形成,因此被广泛用作自噬体形成的标志[17]。自噬可通过不同的细胞外刺激因素激活,如细胞因子或营养缺乏等[18]。炎症状态的牙髓和根尖周组织较正常组织高表达TNF-α [19],TNF-α作为炎症过程中的关键诱发因子和调节因子,已被证实参与细胞的增殖、凋亡和分化过程[13]。研究表明TNF-α可在多种细胞类型中诱导自噬的发生,如巨噬细胞[18]、破骨细胞[20]等,且TNF-α的作用浓度越高,诱导细胞自噬的能力越强[21]。本研究采用不同浓度TNF-α分别处理SCAPs,证实TNF-α可诱导SCAPs自噬水平的活化,且TNF-α浓度越高,SCAPs自噬水平越强,表现为更高的LC3II蛋白水平、GFP-LC3及AVO数目,与Wang等[21]的研究结果一致。多种复杂的信号通路被证实参与调控TNF-α诱导的自噬发生,如ERK / JNK、p38信号传导通路[22]等,而TNF-α诱导SCAPs自噬活化的相关机制有待进一步研究。
为进一步探讨自噬对TNF-α作用下SCAPs生物学特性的影响,本研究采用自噬抑制剂3-MA处理细胞。3-MA作为Ⅲ类磷脂酰肌醇3-激酶(PI3K)的抑制剂,被证实在自噬体形成的早期阶段对自噬进行抑制[23]。本研究发现,5 mmol/L 3-MA能显著抑制TNF-α作用下SCAPs的LC3蛋白从LC3 Ⅰ型向LC3 Ⅱ型的转化,下调GFP-LC3表达量,提示3-MA可有效抑制TNF-α诱导的SCAPs自噬发生。研究表明,凋亡和自噬两者并不是相互独立或排斥的通路,由于具有共同的调节分子,因此两者起着相互协同或者相互拮抗的作用[8]。目前,自噬的抑制已被证明可在多种细胞类型中诱导细胞凋亡发生。氯喹或3-MA预处理抑制自噬后,可显着增强H2O2诱导的小鼠间充质干细胞的细胞死亡[24]。在人口腔鳞状细胞癌细胞中,3-MA抑制自噬可显著增加IL-24诱导的细胞凋亡[25]。在本研究,我们发现通过药物抑制TNF-α诱导的自噬,可下调细胞活力,显著上调SCAPs的细胞凋亡水平,与Li等[25]人的研究结果一致。这些结果提示自噬参与炎症环境下SCAPs的生物学过程,自噬可能对SCAPs起细胞保护作用,对抗细胞凋亡,提高细胞生存率。
近年来研究表明,在多种细胞的分化进程中自噬均被不同程度的激活[9],参与血管生成[26]、成骨分化[15, 27]、脂肪生成[27]、神经发生[28]等过程。在人DPSCs中,自噬的抑制通过AMPK/Akt/mTOR信号传导通路抑制成骨分化[15]。通过对FIP200敲除对自噬进行抑制,导致成骨细胞分化缺陷[29]。自噬的抑制仅对成脂分化过程的早期阶段起抑制作用,在分化的后期阶段存在极小或没有影响[30],提示自噬在分化的不同阶段所起的作用不同。然而,目前尚未有关于自噬对TNF-α作用下SCAPs分化影响的报道。本研究所选用的ALP、OCN及BSP是目前公认的成骨分化相关标志物,被研究者广泛应用于成骨分化水平的检测。在本研究中,药物抑制自噬在第3天到第7天显着降低了ALP、BSP及OCN的表达量,第14天时ALP、BSP的表达量下降,OCN的表达量无明显变化。成骨分化过程是由多基因共同调控的复杂过程,因此,我们推测自噬的抑制对TNF-α作用下SCAPs成骨分化的前期起抑制作用,在分化的后期阶段自噬的抑制对OCN的调控作用逐渐减弱。本研究结果表明在TNF-α作用下SCAPs的成骨分化过程中,自噬可能对SCAP起保护作用,参与成骨分化的进程,自噬的抑制将导致成骨分化水平的抑制。在后续研究中,我们将采用siRNA介导的自噬相关基因沉默(ATG5或beclin1)抑制自噬[31],以进一步证实我们的结果。
综上所述,TNF-α作用下可诱导SCAPs自噬的发生,自噬的抑制将导致SCAPs细胞凋亡水平上调,并抑制TNF-α作用下SCAPs的成骨向分化水平,提示自噬可能对炎症环境下的SCAPs起保护作用,参与维持其成骨分化进程。研究结果提示在经受牙髓或根尖周组织感染的年轻恒牙的再生牙髓治疗过程中,自噬可能发挥重要的作用。
| [1] |
Simon SR, Tomson PL, Berdal A. Regenerative endodontics: regeneration or repair[J].
J Endod, 2014, 40(4 Suppl): S70-5.
|
| [2] |
Lovelace TW, Henry MA, Hargreaves KM, et al. Evaluation of the delivery of mesenchymal stem cells into the root canal space of necrotic immol/Lature teeth after clinical regenerative endodontic procedure[J].
J Endod, 2011, 37(2): 133-8.
|
| [3] |
Sonoyama W, Liu Y, Fang D, et al. Mesenchymal stem cell-mediated functional tooth regeneration in swine[J].
PLoS One, 2006, 8(1): e79.
|
| [4] |
Feitosa Henriques LC, Neves de Brito LC, Vieira LQ, et al. Cytokine analysis in lesions refractory to endodontic treatment[J].
J Endod, 2011, 37(12): 1659-62.
|
| [5] |
Chueh LH, Huang GT. Immature teeth with periradicular periodontitis or abscess undergoing apexogenesis: a paradigm shift[J].
J Endod, 2006, 32(12): 1205-13.
|
| [6] |
Rabinowitz JD, White E. Autophagy and metabolism[J].
Science, 2010, 330(6009): 1344-8.
DOI: 10.1126/science.1193497. |
| [7] |
Hedrick SM, Ch'En IL, alves BN. Intertwined pathways of programmol/led cell death in immol/lunity[J].
Immol/Lunol Rev, 2010, 236(3): 41-53.
|
| [8] |
Eisenberg-Lerner A, Bialik S, Simon HU, et al. Life and death partners: apoptosis, autophagy and the cross-talk between them[J].
Cell Death Differ, 2009, 16(7): 966-75.
|
| [9] |
Guan JL, Simon AK, Prescott M, et al. Autophagy in stem cells[J].
Autophagy, 2013, 9(6): 830-49.
|
| [10] |
Yang JW, Zhu LX, Yuan GH, et al. Autophagy appears during the development of the mouse lower first molar[J].
Histochem Cell Biol, 2013, 139(1): 109-18.
|
| [11] |
Yang JW, Zhang YF, Wan CY, et al. Autophagy in SDF-1 alphamediated DPSC migration and pulp regeneration[J].
Biomaterials, 2015, 44(5): 11-23.
|
| [12] |
Couve E, Osorio R, Schmachtenberg O. The amazing odontoblast: activity, autophagy, and aging[J].
J Dent Res, 2013, 92(9): 765-72.
DOI: 10.1177/0022034513495874. |
| [13] |
Zelova H, Hosek J. TNF-alpha signalling and inflammol/Lation: interactions between old acquaintances[J].
Inflam Res, 2013, 62(7): 641-51.
DOI: 10.1007/s00011-013-0633-0. |
| [14] |
Lin NY, Stefanica A, Distler JH. Autophagy: a key pathway of TNFinduced inflammol/Latory bone loss[J].
Autophagy, 2013, 9(8): 1253-5.
|
| [15] |
Pantovic A, Krstic A, Janjetovic KA, et al. Coordinated timedependent modulation of AMPK/Akt/mTOR signaling and autophagy controls osteogenic differentiation of human mesenchymal stem cells[J].
Bone, 2013, 52(1): 524-31.
|
| [16] |
Liu C, Xiong H, Chen K, et al. Long-term exposure to pro-inflammol/ Latory cytokines inhibits the osteogenic/dentinogenic differentiation of stem cells from the apical papilla[J].
Int Endod J, 2015(2): 25.
|
| [17] |
Shi YM, Yang L, Geng YD, et al. Polyphyllin I induced-apoptosis is enhanced by inhibition of autophagy in human hepatocellular carcinoma cells[J].
Phytomedicine, 2015, 22(13): 1139-49.
|
| [18] |
Harris J. Autophagy and cytokines[J].
Cytokine, 2011, 56(2): 140-4.
|
| [19] |
Pezelj-Ribaric S, Anic I, Brekalo I, et al. Detection of tumor necrosis factor alpha in normal and inflamed human dental pulps[J].
Arch Med Res, 2002, 33(5): 482-4.
DOI: 10.1016/S0188-4409(02)00396-X. |
| [20] |
Lin NY, Beyer C, Giessl A, et al. Autophagy regulates TNFalphamediated joint destruction in experimental arthritis[J].
Ann Rheum Dis, 2013, 72(5): 761-8.
DOI: 10.1136/annrheumdis-2012-201671. |
| [21] |
Sivaprasad U, Basu A. Inhibition of ERK attenuates autophagy and potentiates tumour necrosis factor-alpha-induced cell death in MCF- 7 cells[J].
J Cell Mol Med, 2008, 12(4): 1265-71.
|
| [22] |
Cheng Y, Qiu F, Tashiro SI, et al. ERK and JNK mediate TNF alphainduced p53 activation in apoptotic and autophagic L929 cell death[J].
Biochem Biophys Res Commun, 2008, 376(3): 483-8.
DOI: 10.1016/j.bbrc.2008.09.018. |
| [23] |
Seglen PO, Gordon PB. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes[J].
Proc Natl Acad Sci USA, 1982, 79(6): 1889-92.
DOI: 10.1073/pnas.79.6.1889. |
| [24] |
Liu GY, Jiang XX, Zhu X, et al. ROS activates JNK-mediated autophagy to counteract apoptosis in mouse mesenchymal stem cells in vitro[J].
Acta Pharmacol Sin, 2015, 36(12): 1473-9.
DOI: 10.1038/aps.2015.101. |
| [25] |
Li J, Yang D, Wang W, et al. Inhibition of autophagy by 3-MA enhances IL-24-induced apoptosis in human oral squamous cell carcinoma cells[J].
J Exp Clin Cancer Res, 2015, 34(8): 97.
|
| [26] |
Torisu T, Torisu K, Lee IH, et al. Autophagy regulates endothelial cell processing, maturation and secretion of von Willebrand factor[J].
Nat Med, 2013, 19(10): 1281-7.
|
| [27] |
Nuschke A, Rodrigues M, Stolz DB, et al. Human mesenchymal stem cells/multipotent stromal cells consume accumulated autophagosomes early in differentiation[J].
Stem Cell Res Ther, 2014, 5(6): 140.
|
| [28] |
Vazquez P, Arroba AI, Cecconi F, et al. Atg5 and ambra1 differentially modulate neurogenesis in neural stem cells[J].
Autophagy, 2012, 8(2): 187-99.
DOI: 10.4161/auto.8.2.18535. |
| [29] |
Liu F, Fang F, Yuan H, et al. Suppression of autophagy by FIP200 deletion leads to osteopenia in mice through the inhibition of osteoblast terminal differentiation[J].
J Bone Miner Res, 2013, 28(11): 2414-30.
|
| [30] |
Skop V, Cahova M, Dankova H, et al. Autophagy inhibition in early but not in later stages prevents 3T3-L1 differentiation: Effect on mitochondrial remodeling[J].
Differentiation, 2014, 87(5): 220-9.
DOI: 10.1016/j.diff.2014.06.002. |
| [31] |
Barth S, Glick D, Macleod KF. Autophagy: assays and artifacts[J].
J Pathol, 2010, 221(2): 117-24.
|
 2019, Vol. 39
2019, Vol. 39

