原发性肝癌(HCC)的病变隐匿,确诊时往往已进入中、晚期,因而病死率高,预后较差[1]。研究表明,肿瘤微环境与肿瘤的病程进展关系密切,其中存在着的炎性细胞和免疫调节分子影响着肿瘤的生长、浸润和转移[2-3]。
HCC是一种典型的炎症相关性肿瘤[4],炎症反应组成部分中的细胞因子在其病变进程中发挥着重要作用。资料表明干扰素-γ(IFN-γ)可以通过抑制细胞增殖及诱导细胞凋亡等多种途径发挥抗肿瘤作用[5-6],且它与HCC的肿瘤生长间也存在着密切的关系[7]。而新近发现的白介素-17(IL-17)是Th17细胞的标志性细胞因子,它也可能是调控肿瘤发生、进展的一种重要因子[8]。HCC、乳腺癌以及非小细胞肺癌组织局部均存在着高水平表达的IL-17[9-10];HCC肿瘤组织中存在IL-17+细胞,且组织中IL-17+细胞数及血清IL-17水平的增高往往提示患者预后较差[9, 11]。然而,以上资料还远不能阐明IL- 17在HCC病程进展中的作用,而对其研究的不断深入必将会为HCC的防治带来新的希望。
已知细胞因子间常常存在着复杂的网络式交互作用。那么IL-17是否会通过与其它细胞因子间的相互作用而影响HCC肿瘤的发展进程呢?我们将关注重点首先放在了机体抑制肿瘤生长的重要因子之一的干扰素家族。我们发现,IL-17与IFN-γ间存在着显著的拮抗关系。我们的研究对深入理解Th17/IL-17系统促进HCC发生、发展的途径及分子机制进行了有益的探索,并有望为HCC的临床防治提供新的思路。
1 材料和方法 1.1 主要试剂Hepa1-6肝癌细胞购自中国科学院上海细胞库,小鼠IFN-γ和IL-17(Peprotech),DMEM培养基(Hyclone),胎牛血清(Gibco),PCNA及Cyclin D1抗体(Abcam),p21抗体(Santa Cruz),p16抗体(ABGENT),p-p38MAPK、p-ERK1/2以及p-Stat1(Tyr701)以及β-actin抗体均来自(Cell Signaling),其它试剂均为国产分析纯。
1.2 方法 1.2.1 细胞培养及干预小鼠肝癌细胞系Hepa1-6常规培养于10%胎牛血清的DMEM基本培养基中,5% CO2、37 ℃孵箱培养。2~3 d换液1次,待细胞长满后采用胰酶进行消化、传代,干预之前使用无血清培养基饥饿细胞18~24 h。根据前期预实验结果,在2%胎牛血清存在的情况下,本实验均采用20 ng/mL的IFN-γ和/或同样浓度的IL-17处理细胞。细胞生长情况测定、细胞增殖检测、细胞周期的流式分析以及细胞周期相关蛋白的Western blot测定均于干预因素处理24 h后进行。而细胞信号分子p38MAPK/ERK1/2以及Stat1的活化程度分析则于干预因素处理30 min后进行。
1.2.2 细胞生长情况分析实验结束后,胰酶消化、将种植于6孔板中的各组细胞收集、离心,调整细胞浓度,并用等量无血清培养基稀释。而后采用台盼蓝排斥实验计算各组细胞浓度,进行统计。
1.2.3 细胞增殖检测Hepa1-6细胞以每孔5000个接种于96孔培养板中,培养过夜后进行干预,每组设6个复孔,以添加完全培养液的无细胞孔作为空白对照。细胞干预完成后,每孔加入5 mg/mL的MTT液20 μL,继续孵育4 h后,弃上清,再加入100 μL的DMSO,室温充分振荡,使紫色结晶充分溶解,测定各孔A490 nm值计算细胞增殖情况。
1.2.4 细胞周期分析实验结束后,胰酶消化、收集各组细胞经1000 r/min离心5 min后并用PBS洗涤,4 ℃条件下75%冰乙醇固定过夜。细胞重悬于含有碘化丙锭(PI)的PBS中,室温避光孵育30 min。细胞周期分布通过FACSCalibur检测,并采用Flow Jo7.6.1软件进行分析。
1.2.5 蛋白印迹实验吸尽培养基预冷PBS漂洗2次,加入含有磷酸酶抑制剂及蛋白酶抑制剂的蛋白裂解混合液(RIPA)裂解细胞,提取蛋白并进行蛋白定量。采用聚丙烯酰胺凝胶电泳分离等量蛋白,将其转移到PVDF膜上,5%脱脂牛奶封闭后一抗孵育、4 ℃过夜,孵育二抗后化学发光法显色,β-actin作为内参对照。
1.3 统计学处理统计软件采用SPSS 18.0,数据以均数±标准误表示,数据统计以单因素ANOVA分析检验方法进行比较,P < 0.05认为差异有统计学意义。
2 结果 2.1 小鼠Hepa1-6肝癌细胞系的基本情况Hepa1-6细胞株源自C57/L小鼠中引发的BW7756肝癌,可表达AFP、α1抗胰蛋白酶、淀粉酶等。Hepa1-6细胞附壁生长,细胞生长较为缓慢,生长一段时间后会变为不规则的多形性或细长条形状。细胞可重叠堆积生长,镜下观察可见有明显的细胞集落形成(图 1A)。

|
图 1 IL-17单独或联合IFN-γ干预对小鼠Hepa1-6细胞生长的影响 Fig.1 Effects of IL-17 and IFN-γ alone or in combination on the growth of Hepa1-6 cells (Original magnification: × 40). A: Microscopic observation of the Hepa1-6 cells treated with IL-17 and IFN-γ alone or in combination; B: Cell density of Hepa1-6 cells in different groups. **P < 0.01 vs control group; ##P < 0.01 vs IFN-γ group |
根据前期预实验结果,我们选择在血清浓度2%的条件下分别给予20 ng/mL的IL-17和/或IFN-γ处理细胞。结果显示,IL-17单独应用对细胞的生长影响不大,而IFN-γ干预24h可以显著抑制小鼠Hepa1-6细胞的生长,IL-17与IFN-γ联合应用却可明显改善细胞的生长。以上结果表明,IFN-γ可以显著抑制Hepa1-6细胞的生长,但IL-17可以逆转这一作用(图 1B)。
2.3 IL-17可显著改善IFN-γ对Hepa1-6细胞增殖的抑制20 ng/mL的IL-17对细胞增殖影响不大,而IFN-γ干预24 h可显著抑制细胞的增殖(MTT值仅为对照组的45.2%,差异显著)。与IL-17联用,与IFN-γ干预组相比,细胞的增殖情况大幅度地改善至对照组的92.5%,差异十分显著(图 2)。

|
图 2 IL-17单独或联合IFN-γ对小鼠Hepa1-6细胞增殖的影响 Fig.2 Proliferation of mouse Hepa1-6 cells treated with IL-17 and/or IFN-γ for 24 h. **P < 0.01 vs control group; ##P < 0.01 vs IFN-γ group |
20 ng/mL的IFN- γ干预24 h可使约75.42%的Hepa1-6细胞停滞于G0/G1期,IL-17单独干预(43.74%)处于G0/G1期的细胞数与对照组(49.768%)相比差异不明显。然而,IL-17与IFN-γ联用可使G0/G1期的细胞数显著降低至57.92%,与IFN-γ组相比差异十分显著(图 3)。

|
图 3 IL-17单独或联合IFN-γ干预对小鼠Hepa1-6细胞周期分布的影响 Fig.3 Effects of IL-17 and IFN-γ alone or in combination on cell cycle of Hepa1-6 cells. A: Cell cycle of mouse Hepa1-6 cells with different treatments for 24 h; B: Percentage of cell population in G0/G1, S and G2/M phases.*P < 0.05 |
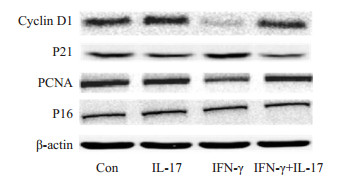
与对照组相比,20 ng/mL的IL-17对Hepa1-6细胞PCNA、Cyclin D1、P21及P16蛋白表达的影响均不显著,说明IL-17基本不影响Hepa1-6细胞的生长。IFN-γ干预24 h可以显著降低PCNA及Cyclin D1的表达水平,同时明显增加P21,但不影响P16的蛋白表达水平。与IL-17联用,PCNA及Cyclin D1的表达较之IFN-γ单独处理组显著增加,而P21的表达则显著降低。这些结果表明,IFN-γ可显著抑制细胞增殖促进蛋白PCNA及Cyclin D1的表达,而增加细胞增殖抑制蛋白P21的表达,从而阻抑细胞的增殖。但与IL-17联用,上述影响均可被显著改善(图 4)。
|
图 4 IFN-γ单独或联合IL-17对小鼠Hepa1-6细胞Cyclin D1、PCNA、P21及P16蛋白表达的影响 Fig.4 Effects of IL-17 and/or IFN-γ on protein expression of cyclin D1, PCNA, P21 and P16 in mouse Hepa1-6 cells |
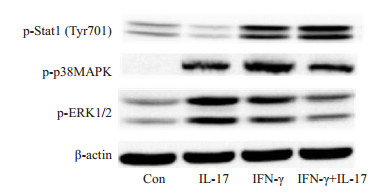
IL- 17干预30 min可以显著激活p38MAPK及ERK1/2,但对Stat1的活化作用较弱。而30 min的IFN-γ干预可以同时激活以上三种信号分子,特别是Stat1。值得注意的是,与IFN-γ单独处理组相比,IL-17的参与虽不影响Stat1的磷酸化水平,但却可以显著降低p38MAPK及ERK1/2的磷酸化水平,说明IL-17与IFN-γ的胞内信息传递过程存在着一定的拮抗作用(图 5)。
|
图 5 IFN-γ单独或联合IL-17对小鼠Hepa1-6细胞信号分子p38MAPK、ERK1/2及Stat1磷酸化的影响 Fig.5 Effects of IL-17 and/or IFN-γ on the phosphorylation of p38MAPK, ERK1/2 and Stat1 in mouse Hepa1-6 cells |
被视为肿瘤“第七大标记性特征”的肿瘤微环境是指实体瘤所处的局部生物环境,大量研究已证明,肿瘤微环境调节着肿瘤的生长、浸润和转移,肿瘤的发展依赖于这个复杂的动态的微环境[2]。
IFN-γ与HCC的肿瘤生长具有显著的负相关关系:血浆IFN-γ与HCC患者肿瘤临床分期以及瘤体大小显著负相关,且经历临床治疗以后的血浆低IFN-γ水平(< 50 pg/mL)患者,肿瘤复发几率高[13];肝组织中NK细胞CD160的表达常常伴随着NK细胞介导的免疫功能的活化及IFN-γ的高表达,且该类患者HCC病变程度较轻、复发率低[14]。IFN-γ的抗肝癌效应可能与以下机制相关:上调主要组织相容性(MHC) Ⅰ类抗原处理和提呈相关通路,增强肿瘤细胞的免疫原性,促进淋巴细胞对其的认知和清除;诱导自噬和细胞增殖抑制以及生长停滞[15]。我们的结果则表明20 ng/mL的IFN-γ确可显著抑制小鼠Hepa1-6细胞的生长、阻遏其增殖,这一作用与其降低PCNA及Cyclin D1蛋白的表达,增加P21蛋白的表达有关。PCNA是标志细胞增殖状态的重要基因[16];Cyclin D1[17]主要是通过加速细胞周期G1/S期的进程从而促进细胞的增殖;而P21是公认的细胞增殖负性调节基因[18]。P16也可负调节细胞周期[19],但本实验结果则显示IFN-γ对Hepa1-6细胞生长和增殖的调控不是通过P16途径实现的。
近几年,人们发现了一种不同于Th1和Th2细胞的、可以分泌IL-17的新的效应性T细胞亚群--Th17细胞。IL-17是Th17细胞的标志性细胞因子。已证实Th17细胞及IL-17在慢性炎症和牛皮癣、类风湿性关节炎等自身免疫性疾病的发生中发挥着重要作用[20-21]。最新研究显示,IL-17与肿瘤的发生及进展关系密切[22],它可以上调瘤体局部组织内血管内皮细胞生长因子(VEGF)的表达而促进血管发生,同时提高肿瘤对VEGF治疗的抵抗力[23];增强肿瘤微环境中的炎症反应,促进包括IL-6、IL-8、转化生长因子-β(TGF-β)、VEGF在内的促侵袭因子的释放[24]。IL-17还可通过TRAF4/ERK5通路直接促进肿瘤细胞的增殖[25]。IL-17与HCC的病程进展关系也很密切,它可以通过IL-6/Jak2/Stat3通路或与FoxP3+ Tregs细胞相互作用促进肝癌的进展及转移[26-27]。我们最新的结果则表明,IL-17还可与IFN-γ的抗肿瘤作用相拮抗,减轻因IFN-γ所引起的Hepa1-6细胞生长抑制并促进其增殖。IFN-γ可以降低PCNA及Cyclin D1蛋白的表达,同时增加P21的蛋白表达,而与IL-17联合应用可以逆转这一过程,从而改善细胞的生长。
IL-17的生物学效应与MAPK通路密切相关[28-30],而IFN-γ的作用与Stat1的活化有关[31-32]。我们的结果显示,IL-17虽不影响IFN-γ对Stat1的磷酸化,但与IFN-γ联用细胞p38MAPK及ERK1/2的磷酸化水平却因而显著降低,说明IL-17与IFN-γ在MAPK通路的信息传递过程中存在着拮抗作用。而这种拮抗作用是否可以解释为IL-17对IFN-γ信号分子的负反馈调节,还需进一步的实验予以证实。
总之,我们的结果显示HCC患者肿瘤组织局部含有IL-17及IFN-γ在内的多种细胞因子,它们之间存在复杂的交互调控。IL-17自身虽不影响小鼠肝癌细胞Hepa1-6的生长,但却可以显著拮抗IFN-γ对其生长的抑制从而促进瘤细胞的生长。这一发现对进一步揭示IL-17促肿瘤作用及其分子机制开辟了新的视野。
| [1] |
侯帅, 樊琳琳, 戴光荣. 非手术治疗原发性肝癌研究进展[J].
实用肝脏病杂志, 2016, 19(2): 249-52.
DOI: 10.3969/j.issn.1672-5069.2016.02.037. |
| [2] |
Zhang S, Yang X, Wang L, et al. Interplay between inflammatorytumor microenvironmentand cancer stem cells[J].
Oncol Lett, 2018, 16(1): 679-86.
|
| [3] |
Najafi M, Goradel NH, Farhood B, et al. Tumor microenvironment: Interactions and therapy, 2018 Oct 30. doi: 10.1002/jcp.27425.
|
| [4] |
Ponziani FR, Bhoori S, Castelli C, et al. Hepatocellular carcinoma is associated with gut microbiota profile andinflammationin nonalcoholic fatty liver disease[J]. Hepatology, 2018 Apr 17. doi: 10.1002/hep.30036.
|
| [5] |
Castro F, Cardoso AP, Gonçalves RM, et al. Interferon-gamma at the crossroads of tumor immune surveillance or evasion[J].
Front Immunol, 2018, 9: 847.
DOI: 10.3389/fimmu.2018.00847. |
| [6] |
Aqbi HF, Wallace M, Sappal S, et al. IFN-gamma orchestrates tumor elimination, tumor dormancy, tumor escape, and progression[J].
J Leukoc Biol, 2018, 103(6): 1219-23.
DOI: 10.1002/jlb.2018.103.issue-6. |
| [7] |
Garnelo M, Tan A, Her Z, et al. Interaction between tumourinfiltrating B cells and T cells controls the progression of hepatocellular carcinoma[J].
Gut, 2017, 66(2): 342-51.
DOI: 10.1136/gutjnl-2015-310814. |
| [8] |
Diller ML, Kudchadkar RR, Delman KA, et al. Balancing inflammation: the Link between Th17 and regulatory T cells[J].
Mediators Inflamm, 2016(3): 6309219.
|
| [9] |
Hatting M, Tacke F. From NAFLD toHCC: IsIL-17the crucial Link[J].
Hepatology, 2017, 65(2): 739-41.
DOI: 10.1002/hep.v65.2. |
| [10] |
Coffelt SB, Kersten K, Doornebal CW, et al. IL-17-producing γδ T cells and neutrophils conspire to promote breastcancermetastasis[J].
Nature, 2015, 522(7556): 345-8.
DOI: 10.1038/nature14282. |
| [11] |
Hammad LN, Abdelraouf SM, Hassanein FS, et al. Circulating IL-6, IL-17 and vitamin D in hepatocellular carcinoma: potential biomarkers for a more favorable prognosis[J].
J Immunotoxicol, 2013, 10(4): 380-6.
DOI: 10.3109/1547691X.2012.758198. |
| [12] |
Asadzadeh Z, Mohammadi H, Safarzadeh EA, et al. The paradox of Th17 cell functions in tumor immunity[J].
Cell Immunol, 2017, 322: 15-25.
DOI: 10.1016/j.cellimm.2017.10.015. |
| [13] |
Lee IC, Huang YH, Chau GY, et al. Serum interferon gamma level predicts recurrence in hepatocellular carcinoma patients after curative treatments[J].
Int J Cancer, 2013, 133(12): 2895-902.
|
| [14] |
Sun H, Xu J, Huang Q, et al. Reduced CD160 expression contributes to impaired NK cell function and poor clinical outcomes inpatientswithHCC[J].
Cancer Res, 2018, 78(23): 6581-93.
DOI: 10.1158/0008-5472.CAN-18-1049. |
| [15] |
Li P, Du Q, Cao Z, et al. Interferon-γ induces autophagy with growth inhibition and cell death in human hepatocellular carcinoma (HCC) cells through interferon-regulatory factor-1 (IRF-1)[J].
Cancer Lett, 2012, 314(2): 213-22.
DOI: 10.1016/j.canlet.2011.09.031. |
| [16] |
Park SY, Jeong MS, Han CW, et al. Structural and functional insight intoproliferating cell nuclear antigen[J].
J Microbiol Biotechnol, 2016, 26(4): 637-47.
DOI: 10.4014/jmb.1509.09051. |
| [17] |
Qie S, Diehl JA. Cyclin D1, cancer progression, and opportunities in cancer treatment[J].
J Mol Med (Berl), 2016, 94(12): 1313-26.
DOI: 10.1007/s00109-016-1475-3. |
| [18] |
El-Deiry WS. p21(WAF1) mediates cell-cycle inhibition, relevant to cancer suppression and therapy[J].
Cancer Res, 2016, 76(18): 5189-91.
DOI: 10.1158/0008-5472.CAN-16-2055. |
| [19] |
Serra S, Chetty R. p16[J].
J Clin Pathol, 2018, 71(10): 853-8.
DOI: 10.1136/jclinpath-2018-205216. |
| [20] |
Tamehiro N, Nishida K, Sugita Y, et al. RhoH deficiency inducespsoriasis-like chronic dermatitis by promoting TH17 cell polarization[J]. JAllergy Clin Immunol, 2018 Oct 17. doi: 10.1016/j.jaci.2018.09.032.
|
| [21] |
Beringer A, Miossec P. IL-17andIL-17-producing cells and liver diseases, with focus on autoimmune liver diseases[J].
Autoimmun Rev, 2018, 17(12): 1176-85.
DOI: 10.1016/j.autrev.2018.06.008. |
| [22] |
Song Y, Yang JM. Role of interleukin (IL)-17 and T- helper (Th)17 cells in cancer[J].
Biochem Biophys Res Commun, 2017, 493(1): 1-8.
DOI: 10.1016/j.bbrc.2017.08.109. |
| [23] |
Chung AS, Wu X, Zhuang G, et al. An interleukin-17-mediated paracrine network promotes tumor resistance to anti-angiogenic therapy[J].
Nat Med, 2013, 19(9): 1114-23.
DOI: 10.1038/nm.3291. |
| [24] |
He D, Li H, Yusuf N, et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin[J].
PLoS One, 2012, 7(2): e32126.
DOI: 10.1371/journal.pone.0032126. |
| [25] |
Wu L, Chen X, Zhao J, et al. A novel IL-17 signaling pathway controlling keratinocyte proliferation and tumorigenesis via the TRAF4-ERK5 axis[J].
J Exp Med, 2015, 212(10): 1571-87.
DOI: 10.1084/jem.20150204. |
| [26] |
Hu Z, Luo D, Wang D, et al. IL-17activates the IL-6/STAT3 signal pathway in the proliferation of hepatitis B virus-related hepatocellular carcinoma[J].
Cell Physiol Biochem, 2017, 43(6): 2379-90.
DOI: 10.1159/000484390. |
| [27] |
Huang Y, Wang F, Wang Y, et al. Intrahepatic interleukin-17+T cells and FoxP3 + regulatory T cells cooperate to promote development and affect the prognosis of hepatocellular carcinoma[J].
J Gastroenterol Hepatol, 2014, 29(4): 851-9.
DOI: 10.1111/jgh.2014.29.issue-4. |
| [28] |
Wei L, Liu M, Xiong H, et al. Up-regulation of IL-23 expression in human dental pulp fibroblasts byIL-17 via activation of the NF-κB andMAPKpathways[J].
Int Endod J, 2018, 51(6): 622-31.
DOI: 10.1111/iej.2018.51.issue-6. |
| [29] |
Li JK, Nie L, Zhao YP, et al. IL-17mediates inflammatory reactions via p38/c-Fos and JNK/c-Jun activation in an AP-1-dependent manner in human nucleus pulposus cells[J].
J Transl Med, 2016, 14: 77.
DOI: 10.1186/s12967-016-0833-9. |
| [30] |
Gaffen SL, Mcgeachy MJ. Integratingp38α MAPKimmunesignalsin nonimmune cells[J].
Sci Signal, 2015, 8(366): fs5.
DOI: 10.1126/scisignal.aaa8398. |
| [31] |
Dufour A, Bellac CL, Eckhard U, et al. C-terminal truncation of IFNgamma inhibits proinflammatory macrophage responses and is deficient in autoimmune disease[J].
Nat Commun, 2018, 9(1): 2416.
|
| [32] |
Zhang Y, Chen Y, Liu Z, et al. ERK is a negative feedback regulator for IFN-γ/STAT1signaling by promotingSTAT1ubiquitination[J].
BMC Cancer, 2018, 18(1): 613.
DOI: 10.1186/s12885-018-4539-7. |
 2019, Vol. 39
2019, Vol. 39

